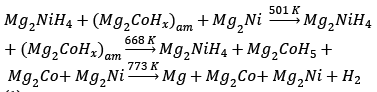1. Introducción
El magnesio es un elemento muy atractivo como almacenador de hidrógeno debido a su alta capacidad de almacenamiento (teóricamente de 7.6 % en peso de H), gran abundancia en la corteza terrestre, baja densidad y bajo costo en relación con otros materiales utilizados para este propósito [1,2]. La mayor desventaja que presenta la utilización del Mg es la lenta cinética de absorción-desorción de hidrógeno [3,4]. Considerando que un material para aplicaciones tecnológicas debe absorber-desorber hidrógeno a temperatura entre 323-373 K [5] se ha estudiado la incorporación de un segundo elemento al Mg que incremente la cinética de absorción-desorción, especialmente metales de transición (Ni, Pd, Fe, Co, V, Cu, etc.) facilitando la disociación de la molécula de hidrógeno [6]. En este contexto, el intermetálico Mg2Ni que presenta una capacidad de almacenamiento teórica de 3.6 % en peso de H, a temperaturas sobre las requeridas para aplicaciones tecnológica [7]. D. Guzmán [8] reporta que el Mg2Ni es capaz de absorber un 2.0 % en peso de H a 363 K y a una presión de hidrógeno de 2 MPa. Esta alta capacidad de almacenamiento alcanzada lo atribuye a la presencia de Ni(nc) (nc: nanocristalino) y una fase amorfa residual rica en Mg. Por otro lado, existen otros hidruros con una mayor capacidad de almacenamiento como es el caso del Mg2CoH5 que presenta un capacidad de almacenamiento teórica de 4.5 % en peso de H [9].
Por lo tanto, un material compuesto por Mg2Ni0.5Co0.5 en estado amorfo o nanocristalino mejoraría la cinética de hidruración y la capacidad de almacenamiento del material base Magnesio. Por lo anterior, en este trabajo se presenta el estudio del proceso de obtención y las propiedades de hidruración es del compuesto Mg2Ni0.5Co0.5 en estado amorfo y nanocristalino.
2. Materiales y métodos
Las granallas de Mg (99 % de pureza), polvos de Ni (99 % de pureza) y Co (98 % de pureza) se alearon mecánicamente en un molino de alta energía Spex 8000D equipado con viales y bolas de acero endurecido bajo atmósfera de argón. La carga de los viales consistió en una relación atómica de Mg:Ni:Co de 2:0.5:0.5 y con una relación bolas-polvos (RBP) de 10:1. Los ciclos de trabajo de los polvos constaron de 1 h de molienda efectiva por 0.5 h de descanso, realizándose remoción mecánica en el transcurso de la molienda para obtener un producto más homogéneo con tiempos de molienda total de 12, 18, 24, 30 y 36 h.
La evolución de las fases durante la molienda fue estudiada por difracción de rayos-X (DRX) en un difractómetro Shimadzu XDR-6000 usando radiación Cu-Kα. El tamaño de los cristalitos se determinó mediante la ecuación de Scherrer [10]. El tamaño del polvo, la morfología y homogeneidad química se estudiaron utilizando un microscopio electrónico de barrido (SEM) Zeiss Evo/MA 10. La estabilidad térmica de los polvos se estudió por medio de calorimetría diferencial de barrido (DSC) en un DSC 2929 TA Instrument. El barrido de temperatura para todas las muestras fue de 300 a 773 K, usando una velocidad de calentamiento de 10 K/min bajo un flujo de nitrógeno de 80 ml/min.
La obtención de la aleación en estado nanocristalina fue mediante aleado mecánico de 36 h y un posterior tratamiento térmico por 15 min a una temperatura en función de la estabilidad térmica del sistema.
La absorción de hidrógeno de los compuestos fue investigada en un aparato tipo Sievert a 363 K y una presión de 2 MPa, mientras que el procesos de desorción se realizó mediante calorimetría diferencial de barrido (DSC) bajo flujo de N2, utilizando una velocidad de calentamiento de 10 K/min en un equipo DSC 2929 TA Instrument.
3. Resultados y discusión
3.1 Obtención del compuesto Mg2Ni0.5Co0.5
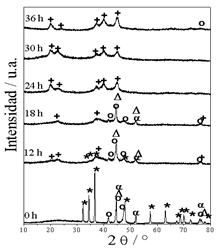
Con el fin de entender el comportamiento del sistema Mg-Ni-Co en el proceso de molienda, en la Fig. 1 se muestra la evolución de las fases tras el proceso de aleado mecánico. Los tamaños de cristalitos se determinaron a partir de los difractogramas de cada elemento por separado evitando así las superposiones de los picos de difracción. En la muestra con 0 h de molienda (inicial) se aprecia que el cobalto elemental presenta la coexistencia de las fases alotrópicas, fase cúbica centrada en las caras (f.c.c.) y fase hexagonal (h.c.p.). Los tamaños de los cristalitos del cobalto son de alrededor de 25 nm para la fase h.c.p., (plano (101)) y de 12 nm para la fase f.c.c., (plano (111)), para el Mg el tamaño de cristalitos es de 36 nm, (plano (101)) y para el Ni de 34 nm, determinado en el plano (111).
Al incrementar el tiempo de molienda a 12 h se observa la presencia de Mg2Ni formado en el proceso de aleado mecánico en coexistencia con Mg, Ni y Co elemental. Al continuar con la molienda, las reflexiones asociadas al Mg desaparecen y sólo se observan las reflexiones asociadas a Mg2Ni, Ni y Co. A partir de las 24 h desaparecen las reflexiones asociadas a los polvos elementales de Ni y Co y solo se observa la presencia del intermetálico Mg2Ni, aunque a las 36 h aparece nuevamente las reflexiones de Co(cub), ya que es una fase metaestable [12]. Estos resultados manifiestan que la presencia de Co retarda la formación del intermetálico Mg2Ni, en comparación con los resultados de P. Rojas et al. [13] quienes reportaron que se requieren 10 h de molienda para obtener este intermetálico sin presencia de Ni residual. En este estudio lo señalado anteriormente ocurre posterior a las 18 h de molienda en las mismas condiciones experimentales.
Generalmente, la presencia de más elementos hace que sea difícil la disposición de los átomos constituyentes en una estructura ordenada, retardando el tiempo de obtención en este caso del intermetálico Mg2Ni [11].
En la Fig. 2 se muestra las micrografías del compuesto Mg2Ni0.5Co0.5 con 12, 18, 24, 30 y 36 h de molienda. En general, a medida que aumenta el tiempo de molienda la fracción de distribución bimodal de partículas aumenta, compuesta de grandes aglomerados de ~ 80 µm y pequeños partículas de ~ 20 µm deformadas.
Fuente: Autoría propia
Figura 1 Patrones de difracción del sistema Mg-Ni-Co en función del tiempo de molienda (* Mg; o Co(Hex); α Co(cub); Δ Ni; + Mg2Ni).
De hecho, los grandes aglomerados están formados por varias partículas pequeñas deformadas y soldadas entre sí, producto de continuos ciclos de deformación plástica, soldadura y fractura [11]. Estas diferencias podrían deberse a lo siguiente, i) la diferencia en estructuras cristalinas, ya que, parte del Co es h.c.p. como se mencionó anteriormente, y Ni es f.c.c, y ii) la distinta microdureza de cada elemento, ya que el Ni posee una microdureza de 130 HV y el Co de 106 HV, por ende el proceso de molienda de ambos elementos se llevará a cabo de una manera distinta.
El cambio en la morfología de los polvos debido a la molienda se presenta en la Fig. 2, observándose que el tamaño de partícula va disminuyendo al aumentar el tiempo de molienda hasta las 30 h, pero a las 36 h se aprecia un incremento en los aglomerados. Además, la Fig. 2 muestra imágenes obtenidas con electrones retrodispersados por ello, se puede hacer una evaluación de la homogeneidad química de los polvos. A las 12 h existen puntos brillantes bien distribuidos que desaparecen a las 36 h de molienda, lo que significa que no existe segregación de los elementos o fases en las partículas de los polvos. No obstante, los patrones de difracción de rayos X muestran la presencia de distintas fases en ambos sistemas (ver Fig. 1), por lo cual se puede concluir que todas las fases presentes en ambos sistemas se encuentran homogéneamente distribuidas. La excelente distribución de ambos elementos se atribuye a la alta energía suministrada por el proceso de molienda conjuntamente con el proceso remoción.
En la Fig. 3 se presentan las curvas calorimétricas del Mg2Ni0.5Co0.5 con 36 h de molienda. En la gráfica se aprecian cuatro eventos exotérmicos: i) 419 K: que corresponde a procesos de cristalización del precursor amorfo de Mg2Ni reportado por P. Rojas et al. [13], ii) 614 K: correspondiente al crecimiento de grano de los nanocristales de Mg que no fueron detectados por DRX, iii) el evento exotérmico a 640 K se asocia a la cristalización del Mg2Co [14] y iv) el evento a 704 K atribuido al crecimiento de Mg2Co.

Fuente: Autoría propia
Figura 2 Imágenes de microscopia electrónica de barrido mediante electrones retrodispersados del Mg2Ni0.5Co0.5 con distintos tiempos de molienda a) 12 h, b) 18 h, c) 24 h, d) 30 h y e) 36 h.
En vista de los resultados obtenidos del análisis térmico, la aleación nanocristalina se sintetizó mediante molienda de 36 h más un tratamiento térmico a 673 K por 15 min. La Fig. 4 muestra los difractogramas del Mg2Ni0.5Co0.5 con 36 h de molienda antes y después del tratamiento térmico. Como se mencionó anteriormente, posterior al aleado mecánico se observa la presencia de Mg2Ni como fase principal y como fase remanente Co. Posterior al tratamiento térmico, aparece la fase Mg2Co que se encuentra en coexistencia con las fases de Mg2Ni, Mg y Co, concordando con la curva calorimétrica que presenta las diversas transformaciones térmicas. Debido al solapamiento de las reflexiones de ambos intermetálicos es más complejo determinar el tamaño de cristalito del Mg2Ni, solamente es posible obtener el tamaño de cristalito del intermetálico Mg2Co utilizando el plano (111) (2θ=13º) que se encuentra a bajo ángulo, siendo este valor de ~13 nm.
3.2. Hidruración de los compuestos Mg2Ni0.5Co0.5
El proceso de hidruración sin activación previa se estudió por medio de las curvas cinéticas de absorción de las muestras amorfas (posterior al aleado mecánico) y nanocristalinas (posterior al tratamiento térmico) a temperatura constante de 363 K y presión de H2 constante de 2 MPa. La Fig. 5 muestra la hidruraciones de ambos sistemas. Las aleaciones Mg2Ni0.5Co0.5 pueden absorber mayor cantidad H2 en comparación con el intermetálico Mg2Ni en las mismas condiciones experimentales. Los valores de absorción que se lograron son de 1.2 % en peso de H en estado nanocristalino y 3.6 % en peso de H en estado amorfo a las 18 h a una temperatura de 363 K.

Fuente: Autoría propia
Figura 4 Patrones de difracción del sistema Mg2Ni0.5Co0.5 con 36 h de molienda antes y posterior al tratamiento térmico. (* Mg; o Co(Hex); α Co(cub); x Mg2Co; + Mg2Ni; # MgO).

Fuente: Autoria propia
Figura 5 Curva cinética de hidruración del sistema Mg2Ni0.5Co0.5 en estado amorfo y nanocristalino (363 K y PH2 de 2 MPa).
Las condiciones para que el Mg2Ni(nc) absorba hidrógeno corresponden a una temperatura de 523 K y una presión de hidrógeno de 1,5 MPa después de una activación previa. Por lo tanto, la presencia de cobalto permite absorber hidrógeno a una temperatura mucho menor, alcanzando una capacidad de almacenamiento de 1.2 % en peso de H en 18 h. Aunque se aprecia en la curva de absorción que existe una tendencia a seguir incrementando su capacidad de absorción, mayores tiempos no es útil desde el punto de vista tecnológico debido al gasto energético.
En la aleación Mg2Ni0.5Co0.5 amorfa, la capacidad de absorción aumenta notablemente hasta un 3.6 % en peso de H. Guzmán et al. [8] alcanzan alrededor de 2.0 % en peso de H en un nanocompuesto formado principalmente por Mg2Ni(nc), Ni(nc) residual y una fase amorfa rica en Mg, en las mismas condiciones experimentales. Este incremento en las capacidades de absorción en estado amorfo se debe; i) a la presencia de Co elemental que posiblemente funcionaría como catalizador para la disociación de la molécula de hidrógeno y ii) al no existir un orden de largo alcance el hidrógeno puede difundir más rápidamente, logrando que el Mg2Ni alcance la máxima capacidad de almacenamiento teórica. Asumiendo que existe un 50% de Mg2Ni en la muestra que sería responsable de absorber un 1.8% en peso de H debe existir otra fase no cristalina que absorba el 1.8% en peso de H restante.
En la Fig. 6 se presentan los patrones de difracción de ambas aleaciones posterior al proceso de hidruración. En la aleación Mg2Ni0.5Co0.5 en estado amorfo se observa la aparición de nuevas reflexiones asociadas al Mg2NiH4 siendo esto parte responsable de la alta capacidad de almacenamiento alcanzada (ver Fig. 6a). El resto del hidrógeno absorbido podría encontrarse formando algún tipo de solución sólida en las porciones amorfas del sistema.


Fuente: Autoría propia
Figura 6 Patrones de difracción del sistema Mg2Ni0.5Co0.5 antes y después de hidrurar. a) Amorfo y b) Nanocristalino (* Mg; o Co(Hex); α Co(cub); x Mg2Co; + Mg2Ni, Θ Mg2NiH4; ρ Mg2CoHx; µ Mg2NiHx; # MgO).
Cabe destacar, que las reflexiones del Mg2Ni no se observan con claridad en el patrón de difracción posterior a la hidruración, sólo el pico de la reflexión (203). Este comportamiento posiblemente corresponda a la pérdida del orden de corto alcance producto del ingreso de hidrógeno, tendiendo a la amorfización del intermetálico Mg2Ni, conocido como amorfización inducida por hidrógeno (AIH). Este fenómeno ha sido estudiado mayormente en fases de Laves C15 [15].
En el caso del Mg2Ni0.5Co0.5 en estado nanocristalino, existe un desplazamiento de los picos de difracción hacia ángulos (2θ) menores de aproximadamente 0.2º, producto del incremento de los parámetros de red debido a la formación de soluciones sólidas de Mg2NiHx y Mg2CoHx (ver Fig. 6b). Además, en la zona de 2θ =22-25º no es posible descartar la presencia de la reflexión correspondiente al plano (111) del Mg2NiH4.
3.3. Deshidruración de los compuestos Mg2Ni0.5Co0.5
Las transformaciones térmicas correspondientes al sistema Mg2Ni0.5Co0.5 son presentadas en la Fig. 7. El sistema Mg2Ni0.5Co0.5 en estado amorfo presenta dos eventos exotérmicos a 465 K y 501 K asociados a la cristalización y crecimiento del Mg2NiH4. Además, se observan dos grandes eventos endotérmicos a altas temperaturas atribuidos a la desorción de hidrógeno que ocurren a 668 K y 706 K. Posterior al evento a 668 K se observa la aparición de Mg2CoH5(Hex), Mg2Co y Mg2Ni y posterior al segundo evento endotérmico se observa la desaparición de las fases de hidruros (ver Fig. 7b). La presencia del Mg2CoH5 viene a confirmar la incorporación de parte del hidrógeno absorbido en la porción amorfa del compuesto y sería la responsable de la alta capacidad de almacenamiento conjuntamente con la presencia del hidruro Mg2NiH4.

Fuente: Autoria propia
Figura 7 a) Curvas calorimétricas del Mg2Ni0.5Co0.5 hidrurados y DRX posterior a cada evento térmico b) amorfo y c) nanocristalino. (* Mg; x Mg2Co; ?#9633; Mg2CoH5; + Mg2Ni; Θ Mg2NiH4; τ Mg2NiHx; ρ Mg2CoHx).
Una posible secuencia para la desorción de hidrógeno del Mg2Ni0.5Co0.5(am) se resume a en la ec. (1):
En el sistema Mg2Ni0.5Co0.5 en estado nanocristalino, se observa un evento exotérmico y cuatro eventos endotérmicos asociados a diferentes etapas en el proceso de desorción de hidrógeno. El evento exotérmico a 459 K corresponde a la cristalización y crecimiento de la fase Mg2NiH4 (Fig. 7c), confirmando la presencia del Mg2NiH4, fase que no pudo identificarse claramente en el patrón de difracción de la Fig. 6b.
El primer evento endotérmico (608 K) corresponde a la transformación de la solución sólida Mg2NiHx en la fase hidruro estable. Lo anterior, queda de manifiesto debido al desplazamiento hacia ángulos mayores de las reflexiones correspondientes al Mg2Ni y el incremento en las intensidades de los picos asociados al Mg2NiH4, durante esta reacción se libera una pequeña cantidad de hidrógeno [8]. Posterior al evento situado a 640 K, se observa la aparición de reflexiones asociadas al Mg2CoH5(Hex), producto de la transformación de la solución sólida Mg2CoHx al hidruro estable y la disminución de las intensidades del Mg2NiH4 que marcan el inicio de la desorción de hidrógeno desde este hidruro estable. En el evento a 661 K las intensidades del Mg2NiH4 siguen disminuyendo y se incrementan las intensidades asociadas al Mg2CoH5. Por último, el evento situado en 720 K corresponde a la desorción del Mg2CoH5, ya que en los patrones de difracción de las muestras calentadas hasta esta temperatura no se observan reflexiones asociadas a los hidruros ni corrimiento de las posiciones de las fases cristalinas, solamente se observa la presencia de los intermetálicos Mg2Co y Mg2Ni, y Mg.
Una secuencia para la desorción del Mg2Ni0.5Co0.5(nc) se resume a continuación, ec.(2):
El proceso de desorción del sistema Mg2Ni-H en el sistema Mg2Ni0.5Co0.5 es diferente al observado por Selvam [16] y por Guzmán [8] en el sistema Mg-Ni. Para Selvam el proceso de desorción se produce en tres etapas, a diferencia de las dos observadas en este estudio, la primera la asocia a la transformación del Mg2NiH4 en una solución sólida de no equilibrio a (540 K) la segunda etapa la transformación de la solución sólida de no equilibrio a la solución sólida estable Mg2NiH0.3 (560 K) y finalmente la última etapa está dada por la desorción total del hidrógeno dejando como única fase Mg2Ni.
En este estudio la primera etapa (primer evento endotérmico) se asocia al proceso inverso al indicado por Selvam (ec. (3)), transformación de la solución sólida de no equilibrio al hidruro estable Mg2NiH4 y la segunda etapa (segundo evento endotérmico) corresponde al inicio de la desorción del hidruro estable. Otra diferencia se produce en la temperatura de inicio de la desorción, la que en este trabajo se produce a mayores temperaturas.
En el trabajo de Guzmán (ec. (4)), el proceso de desorción se produce en dos etapas donde la solución sólida de no equilibrio se transforma en la solución sólida estable y el hidruro estable y posteriormente se completa la desorción, por otro lado, la temperatura de inicio de la desorción es significativamente inferior a la de este trabajo.
De acuerdo a lo planteado anteriormente, queda claro que uno de los efectos más notorios de la presencia de Co es el aumento en la temperatura de inicio de la desorción de hidrógeno, la cual si bien no ha sido claramente determinada puede asumirse que es superior a 528 K y de 633 K para el inicio de desorción del sistema Mg2Ni-H en el sistema Mg2Ni0.5Co0.5 en estado nanocristalino y amorfo, respectivamente.
4. Conclusiones
En el sistema Mg2Ni0.5Co0.5 se obtuvo el intermetálico Mg2Ni mediante aleado mecánico y posterior al tratamiento térmico a 673 K, se obtuvo el compuesto Mg2Co y Mg2Ni en estado nanocristalino. La capacidad de absorción de este sistema en estado amorfo incrementa notablemente alcanzando una capacidad de absorción de 3.6 % en peso de H, que es más probable debido a la ausencia de orden de largo alcance.
Las temperaturas de desorción de los hidruros estables son mayores a las esperadas, producto a los diversos pasos que existen en el proceso como se estableció en las secuencias de desorción. Debido a la temperatura baja absorción, así como la alta capacidad de absorción, se requiere un mayor estudio con diferentes relaciones atómicas del sistema Mg-Ni-Co.