Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.44 no.3 Bogotá Sept./Dec. 2015
https://doi.org/10.15446/rcciquifa.v44n3.56286
DOI: http://dx.doi.org/10.15446/rcciquifa.v44n3.56286
Estudio matemático de estabilidad del estado estacionario del desempeño del electrodo de la pasta de carbono, químicamente modificado por un líquido iónico, en la cuantificación del galato de propilo
Mathematical study on the steady state stability of performance of the carbon paste electrode, chemically modified by an ionic liquid, in the quantification of propyl gallate
Valdir Souza Ferreira b
Reza Ojani c
Michel O. Galeano Espínola d
Petró I. Yagodynets' a
Márcia H. de Rizzo da Matta b
a Universidad Nacional de Chernivtsi, 58012. Calle de Kotsyubyns'ky, 2, Ucrania. Correo electrónico: nightwatcher2401@gmail.com.
b Universidade Federal de Mato Grosso do Sul. Av. Sen. Felinto. Müller, 1555, C/P. 549, 79074-460, Campo Grande, MS, Brasil.
c Universidad de Mazandarán. 3er km. Ruta de Fuerzas Aéreas, 47416-95447, Babolsar, República Islámica de Irán.
d Universidad Nacional de Asunción. 10,5 km. Ruta Mcal. Estigarribia, 3023, Ciudad Universitaria, San Lorenzo, Distrito Capital, República del Paraguay.
Recibido para evaluación: 19 de febrero de 2015.
Aceptado para publicación: 5 de diciembre de 2015.
Resumen
El comportamiento y el desempeño electroquímico del electrodo de pasta de carbono químicamente modificado por un líquido iónico (EPCQM), en la detección del galato de propilo, se investigaron matemáticamente desde el punto de vista de la estabilidad del estado estacionario. El modelo matemático correspondiente se analizó por medio de la teoría de estabilidad lineal y análisis de bifurcaciones. Los resultados de modelaje son comparados con los experimentales (para este sistema y semejantes), bien como con los teóricos para otros casos.
Palabras clave: electrodos de pasta de carbono, líquidos iónicos, sensores electroquímicos, teoría de estabilidad lineal, análisis de bifurcaciones.
Summary
The behavior and the electrochemical function of the carbon paste electrode, chemically modified by ionic liquid, have been investigated mathematically from the point of view of steady-state stability. The corresponding mathematical model is analyzed by linear stability theory and bifurcation analysis. The modeling results are being compared with experimental results (for this system and for the similar ones), and with theoretical results for other cases.
Key words: Carbon paste electrode, ionic liquids, electrochemical sensors, linear stability theory, bifurcation analysis.
Introducción
El galato de propilo, es decir, 3,4,5-tri-hidroxibenzoato de propilo, es un antioxidante usado en industrias de alimentos desde los años 1940, para prevenir la oxidación de aceites y grasas, y así prolongar la "vida útil" de los alimentos [1, 2]. Su código internacional de clasificación es E310. También es usado para el quenching en espectrometría de fluorescencia, en industria de tintas, en la producción de biodiésel y como ingrediente farmacéutico activo.
A pesar de su uso frecuente en la industria, no es recomendada su aplicación en productos que requieran el empleo del horno [3]. Otro estudio mostró también su acción antagonista a estrógenos [4], dependiente de su concentración en el organismo. Ello hace que sea importante desarrollar un método preciso, exacto y rápido de su detección [5-7].
Anteriormente, se describieron varios métodos para la detección de E310, mediante el empleo de fluorescencia [8], cromatografía [5, 9], electroforesis [10] y otros métodos [11]. Estos métodos, a pesar de su posible eficiencia, tenían desventajas como respuesta difícil de interpretar, lentitud, influencias fuertes del medio de reacción, etc., y los métodos electroquímicos ofrecerían solución a los mencionados problemas [12-14].
Una de las herramientas modernas en el análisis electroquímico es el uso de los electrodos de pasta de carbono, cuyo primer uso lo dio Adams en 1958 [15]. Las ventajas electroanalíticas de electrodos de pasta de carbono son la rapidez de su preparación y diseño, facilidad de su modificación y eficiencia y claridad de su respuesta electroquímica [16-30], pudiendo ser modificados por diferentes sustancias activas (líquidos iónicos, derivados ferrocénicos, nanopartículas, nanotubos y hasta con la cáscara de plátano). El desempeño semejante también tiene otra clase de materiales novedosos, que son los polímeros conductores (PC) [31-40]. Uno de los problemas de su utilización es la dificultad en la detección del mecanismo concreto de la oxidación e inestabilidades electroquímicas, cuya ocurrencia es posible no solo para el desempeño de los sensores electroquímicos, en particular [31-33], sino también para la oxidación de compuestos orgánicos e hidrógeno, en general [41-50] (incluyendo la electopolimerización de compuestos heterocíclicos).
Como la explicación fenomenológica, que siempre se daba a tales fenómenos, no tiene argumentos fundamentales y rígidos; un modelo matemático capaz de describir su comportamiento y explicarlos de forma exacta, da información importante para la detección del mecanismo concreto de desempeño de electrodos, contribuyendo no solo para la descripción de un sensor concreto, sino también para los semejantes. Otro uso del modelo matemático es la comparación del sistema concreto con los otros (usando sus modelos y los resultados de su análisis).
En el artículo [30] ha sido descrito el sensor electroquímico de galato de propilo, basado en el electrodo de pasta de carbono, modificado por un líquido iónico, basado en imidazol. El presente trabajo continúa el estudio comenzado en el mencionado artículo, se ofrece el modelo matemático para el proceso del desempeño y, mediante este modelo, se compara con los correspondientes al desempeño de polímeros conductores [51-60], ferroceno [61, 62] y nanopartículas de cobre (II) [63]. Es posible también comparar el sistema con los de electropolimerización, matemáticamente descritos en [64-70].
El sistema y su modelo
Antes de introducir el modelo, es preciso describir unas observaciones acerca del propio proceso de la oxidación electroquímica del éster (analito) y del comportamiento del líquido iónico usado.
El analito tiene tres grupos de hidroxilos; dos pueden ser oxidados, formando el sistema quinónico, y dos protones, siguiendo el esquema general:
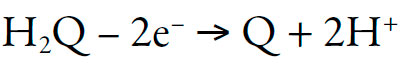 | [1] |
Es preciso subrayar también que las propiedades ácidas del hidrógeno de hidroxilo, vecino al sistema quinónico, son más fuertemente expresas que en el caso de hidroxilo fenólico (por cuenta de la formación del sistema análogo al del ácido triangular -deltaico-, cuadrático -escuárico- y tetra-hidroxi-quinona).
Imidazol es uno de los compuestos heterocíclicos, llamados diazoles, cuyas propiedades anfotéricas son explicadas por la presencia de dos heteroátomos de nitrógeno de diferentes configuraciones (pirólico y piridínico), siendo un ácido más fuerte que el pirrol y una base más fuerte que su isómero pirazol y piridina, lo que hace su comportamiento dependiente del potencial de hidrógeno. Como tiene un sistema aromático conjugado, en el sensor desempeña la función de mediador de transferencia de electrones y como sustancia activa:
 | [2] |
 | [3] |
Se puede concluir que, contrariamente al comportamiento de los compuestos ferrocénicos neutros, el comportamiento de este sensor va a depender del pH y, en este orden de ideas, se utilizarán tres variables para describir el comportamiento del sensor:
c - la concentración del analito en la capa presuperficial;θ - el grado de recubrimiento del electrodo por la forma modificada;
h - la concentración de los protones en la capa presuperficial.
Para simplificar el modelo, evitando la aparición de ecuaciones diferenciales complejas, suponemos que la solución se esté agitando intensamente (lo que da posibilidad de menospreciar el flujo de convección), de que el electrólito soporte esté en exceso (lo que da posibilidad de menospreciar el flujo de migración). También es supuesto que el perfil de concentraciones de analito y protones en la capa presuperficial sea lineal y el espesor de la propia capa sea constante e igual a δ.
El analito entra en la capa presuperficial, mediante su difusión, pudiendo reaccionar con los protones y ser oxidado con la formación del nuevo ácido. En este orden de ideas, la ecuación de balance de su concentración será descrita como:
 | [4] |
Siendo D su coeficiente de difusión, c0 su concentración en la zona interior de la solución, r H la velocidad de la reacción de analito con los protones y r 1 la velocidad de su oxidación hasta la forma quinónica.
El líquido iónico es modificado por medio de su participación en la oxidación de analito y por medio de su reacción por protones. Esta forma después sigue siendo oxidada, terminando la transferencia de electrones. Así puesto, la ecuación de balance de su concentración superficial (expresa en la forma de grado de recubrimiento), será presentada en la forma de:
 | [5] |
en la que Τ es la concentración máxima del líquido iónico sobre la pasta de carbono, r H2 la velocidad de la posible reacción de líquido iónico con los protones, r 2 la velocidad de su oxidación.
Los protones entran en la capa presuperficial mediante su difusión de la zona interior de la solución, siendo capaces de aparecer tanto en la reacción (2), que en este caso podrá ser descrita como:
 | [2'] |
como en la reacción (3), lo que hace la cinética diferente de los casos descritos en [51-63]. Desaparecen de la capa en las reacciones con el analito y con el líquido iónico. Como se trata de un modelo generalista, los dos casos (cuya realización depende del medio de reacción) serán descritos y así, su ecuación de balance será descrita como:
 | [6] |
En la que Δ es su coeficiente de difusión, h 0 es la concentración de protones en la zona interior de la solución.
Las velocidades de los respectivos procesos se podrán calcular así:
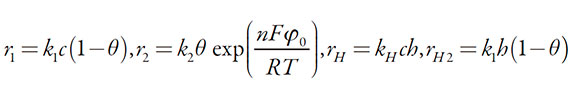 | [7-10] |
Los parámetros k son las constantes de las respectivas velocidades, n el número de electrones transferidos, F el valor de la constante de Faraday, R la constante universal de gases, T la temperatura absoluta del ambiente y φ 0 el salto de potencial, relativo al potencial de carga cero.
Siendo un sistema semejante a los observados en [16-40], según el tercer teorema de semejanza, deberá describirse por el conjunto de ecuaciones semejante al vigente, pero diferente en algunos detalles. Estas diferencias, como la relación entre la parte experimental y la teórica, serán discutidas en la próxima sección.
Resultados y discusión
Para investigar el comportamiento del sistema con la electrodetección del galato de propilo por el electrodo de pasta de carbono, modificado por un líquido iónico derivado de imidazol, necesitamos analizar el conjunto de ecuaciones (4-6) mediante la teoría de estabilidad linear. La matriz funcional de Jacobi, cuyos elementos son calculados para el estado estacionario, se puede describir como:
 | [11] |
en la que:
 | [12-20] |
Para simplificar el análisis del modelo, introducimos las nuevas variables, de modo que el determinante de la matriz se describe como:
 | [21] |
La inestabilidad oscilatoria, cuya aparición acontece en las condiciones de bifurcación de Hopf, es posible para este sistema, como para los semejantes. En términos simples, la condición se realiza en el caso de haber elementos positivos en la diagonal principal de la matriz. Como en los sistemas [51-63], el único elemento de la diagonal, capaz de ser positivo, es - ∑, que describe las influencias del proceso electroquímico sobre las capacitancias y cargas de la doble capa eléctrica (DCE). En ausencia del comportamiento electrocatalítico, es el único factor responsable por la posible aparición del comportamiento oscilatorio en este sistema. Ya la amplitud y frecuencia de oscilaciones se harán en dependencia de la composición de la solución del electrólito.
La estabilidad del estado estacionario. Utilizando el criterio de Routh-Hurwitz y la inecuación Det J < 0, que se infiere de sus condiciones, se podrá obtener el requisito de estabilidad del estado estacionario para este sistema. Resuelta la inecuación (21) < 0, relativamente al parámetro de difusión del analito κ1, este requisito se obtendrá en la forma de:
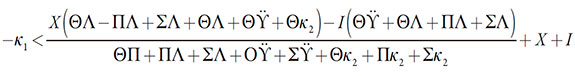 | [22] |
Se puede ver que la región de la respuesta clara del sensor es amplia, solo pudiendo ser "recortada" por las influencias del proceso electroquímico a las capacitancias y cargas de doble capa eléctrica (DCE), descritas por alto valor negativo del criterio ∑. Es esta la región del trecho lineal de la curva "parámetro electroquímico-concentración". La estabilidad del estado estacionario (y en consecuencia, el desempeño estable y sensible del sensor en general), en ausencia de reacciones laterales, se controlará por la difusión del analito.
Mientras tanto, se puede ver que el alto valor del parámetro Π, responsable por la reacción de protones y el parámetro κ2, responsable por su difusión, disminuyen las tendencias de estabilidad del estado estacionario (especialmente del estado estacionario "ciclado" por las reacciones del analito). Así se puede confirmar que el valor reducido del pH no contribuirá con la estabilidad del estado estacionario, pero sí dará malas influencias a la precisión del sensor. Esto concuerda no solo con lo observado experimentalmente en [30], sino también con los resultados teóricos, descritos en [51-63], salvo el desempeño del electrodo ferrocénico no derivatizado con los analitos, cuya oxidación no depende del potencial de hidrógeno.
Es preciso observar que en el medio alcalino, la base también reaccionaría con el éster formando sal del ácido gálico, bien como con el líquido iónico (también forma su propia sal y derivado del catión imidazólico). Así, en medio alcalino, el desempeño del sensor también sería influenciado de forma negativa, pero de modo desigual al del medio ácido. Así, la curva pH-pico del parámetro electroquímico tendrá valor máximo en el valor del pH, igual a 7, observado experimentalmente, pero de manera contraria a lo observado para algunos casos en polímeros conductores (como se ve experimentalmente en [40] y descrito de manera teórica en [60]); la expresión de la curva es más próxima de simetría que en el caso mencionado de la detección de omeprazol, a pesar de que este sea un compuesto de naturaleza semejante a la del líquido iónico usado (en aquel caso se usó la polializarina como polímero conductor). El modelo para la función electroanalítica de tales sensores en medio alcalino será uno de los próximos pasos de esta investigación.
La inestabilidad monotónica ocurre en el valor crítico del parámetro de difusión, sirviendo de "margen" entre los estados estacionarios estables y los estados inestables. Su condición de aparición es la siguiente:
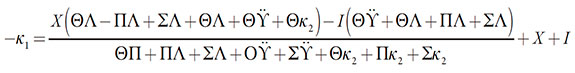 | [23] |
En este valor, para el sistema coexisten varios estados estacionarios (siendo cada uno inestable), y solo escoge uno. Este se destruye, cuando se alteran las condiciones.
Autocatálisis. En este caso, el modelo está siendo alterado, conforme lo mostrado, por ejemplo, en [50] o [51]. Como ya se mencionó, la autocatálisis será otra causa del comportamiento oscilatorio en este sistema (como en los semejantes) [51-63], y también en algunos ejemplos de otros sistemas, descritos en [64-70].
La presencia de otras sustancias que puedan intervenir en el proceso, puede ser descrita por un modelo análogo al presentado en este trabajo (alterando algunas condiciones cinéticas), siendo, según las observaciones hechas en el modelo, posible prever la dependencia entre su presencia y el desempeño del sensor, tomando en cuenta apenas las condiciones de estabilidad y las propiedades químicas de la sustancia (y los ensayos experimentales solo serán útiles para confirmar las propiedades electroanalíticas de un sistema teórico).
Conclusiones
El líquido iónico, basado en imidazol, puede funcionar como mediador en el sensor electroquímico del galato de propilo, pues consigue desempeñar la transferencia de electrones o protones del sistema analítico para el sistema transductor. Sus propiedades son explicadas por su sistema conjugado y presencia de dos átomos de nitrógeno de estructura diferente.
El estado estacionario se mantiene estable, si no hay influencias fuertes del proceso electroquímico a las capacitancias y cargas de la doble capa. En ausencia de las reacciones laterales y sustancias que intervengan en el proceso analítico, la estabilidad del estado estacionario será controlada por la difusión. Las reacciones laterales tienden a desordenar la respuesta del sensor y contribuyen negativamente a la estabilidad del estado estacionario.
Generalmente, la influencia de la presencia de sustancias que intervienen en el desempeño del sensor es desigual, pero en la cuestión del pH, la curva pH-parámetro electroquímico del pico debe presentar el pico en el valor del pH, igual a 7, pero más próximo de la simetría, que en el caso de los polímeros conductores.
Las inestabilidades monotónica y oscilatoria para este sistema son posibles, siendo causadas por influencias fuertes del proceso electroquímico sobre capacitancias y cargas de la doble capa eléctrica. Otra causa puede ser el autocatálisis (si lo hay).
De esta manera, es posible la existencia de estructuras disipativas temporales, que se mantienen por la difusión del analito y por la formación de la forma final del líquido iónico.
Referencias
1. http://www.nlm.nih.gov/cgi/mesh/2006/MB_cgi?mode=&term=Propyl+Gallate, consultado el 7 de febrero de 2015. [ Links ]
2. J. Widergen, A. Chmyrov, C. Eggeling et al., Strategies to improve photostabilities in ultrasensitive fluorescence spectroscopy, J. Phys. Chem., 111, 429 (2007). [ Links ]
3. [No authors listed], Final report on the amended safety assessment of propyl gallate, Int. J. Toxicol., 26, 89 (2007). [ Links ]
4. A. Adamasi, A. Mozzarelli, C. Meda et al., Identification of xenoestrogens in food additives by an integrated in silico and in vitro approach, Chem. Res. Toxicol., 22, 52 (2009). [ Links ]
5. A. Alnokkari, M. Ataie, M. Rajab, Z. Alassaf, Determination of propyl gallate in some vegetable oil samples by thin layer chromatography - image analysis method, Int. J. Pharm. Sci., 26, 268 (2014). [ Links ]
6. F. Aguilar, R. Crebelli, B. Dusemund et al., Scientific opinion on the re-evaluation of propyl gallate (E310) as a food additive. EFSA Panel on Food Additives and Nutrient Sources added to Food (ANS), EFSA J., 12, 3642 (2014), URL: http://www.efsa.europa.eu/it/efsajournal/doc/3642.pdf, consultado el 7 de febrero de 2015. [ Links ]
7. M. Debbab, S. El-Hajjaji, A.H. Aly et al., Cypermethrin residues in fresh vegetables: Detection by HPLC and LCESIMS and their effect on antioxidant activity, Mater. Environ. Sci., 5, 2257 (2014). [ Links ]
8. J.Y. Wang, H.L. Wu, Y. Chen et al., Quantitative determination of butylated hydroxyanisole and n-propyl gallate in cosmetics using three-dimensional fluorescence coupled with second-order calibration, Talanta, 116, 347 (2013). [ Links ]
9. N. Pedije, Perkin Elmer Inc., URL: http://www.perkinelmer.com/pdfs/downloads/app_antioxidantsinedibleoilbyuhplc.pdf, consultado el 7 de febrero de 2015. [ Links ]
10. Q. Xiang, Y. Gao, Y. Xu, E. Wang, Capillary electrophoresis-amperometric determination of antioxidant propyl gallate and butylated hydroxyanisole in foods, Anal. Sci., 23, 713 (2007). [ Links ]´
11. S. Panadero, A. Gómez-Hens, D. Pérez-Bendito, Stopped flow kinetic determination of nalidixic acid and norfloxacin based on lanthanide-sensitized fluorescence, Analyst, 120, 125 (1995). [ Links ]
12. Y. Ni, L. Wang, S. Kokot, Voltammetric determination of butylated hydroxyanizole, butylated hydroxytoluene, propyl gallate and tbutylhydroquinone by use of chemometric approaches, Anal. Chim. Acta, 412, 185 (2000). [ Links ]
13. G. Xu, Y. Chi, L. Li et al., Imprinted propyl gallate electrochemical sensor based on graphene/single walled carbon nanotubes/sol-gel film, Food Chem., 177, 37 (2015). [ Links ]
14. Y.-M. Choong, H.-J. Lin., A rapid and simple gas chromatographic method for direct determination of safrole in soft drinks, J. Food Drug Anal., 9, 27 (2001). [ Links ]
15. R.N. Adams, Carbon paste electrodes, Anal. Chem., 30, 1576 (1958). [ Links ]
16. G.L. Luque, M.C. Rodríguez, G.A. Rivas, Glucose biosensors based on the immobilization of copper oxide and glucose oxidase within a carbon paste matrix, Talanta, 66, 467 (2005). [ Links ]
17. R. Ojani, J.B. Raoof, S.R. Hosseini, Electrocatalytic oxidation of methanol on carbon paste electrode modified by nickel ions dispersed into poly(1,5-diaminonaphthalene) film, Electrochim. Acta, 23, 2402 (2008). [ Links ]
18. R. Ojani, J.B. Raoof, P.S. Afagh, Electrocatalytic oxidation of some carbohydrates by poly(1-naphthylamine)/nickel modified carbon paste electrode, J. Electroanal. Chem., 571, 1 (2004). [ Links ]
19. R. Ojani, J.B. Raoof, A. Ahmady, S.R. Hosseini, Highly improved methanol oxidation onto carbon paste electrode, modified by poly(2,5-dymethylaniline), Casp. J. Chem., 2, 45 (2013). [ Links ]
20. J.B. Raoof, R. Ojani, S. Rashid-Nadimi, Voltammetric determination of ascorbic acid and dopamine in the same sample at the surface of a carbon paste electrode modified with polypyrrole/ferrocyanide films, Electrochim. Acta, 50, 4694 (2005). [ Links ]
21. S.B. Hocevar, I. Svancara, K. Vytras, B. Ogorevc, Novel electrode for electrochemical stripping, based on carbon paste, modified with bismouth powder, Electrochim. Acta, 51, 6 (2005). [ Links ]
22. H. Beitollahi, S. Tajik, M.H. Asadi, P. Biparva, Application of a modified graphene nanosheet paste electrode for voltammetric determination of methyldopa in urine and pharmaceutical formulation, J. Anal. Sci. Tecn., 5, 29 (2014). [ Links ]
23. S. Tajik, M. Ali-Taher, H. Beitollahi, First report for electrochemical determination of levodopa and cabergoline: Application for determination of levodopa and cabergoline in human serum, urine and pharmaceutical formulations, Electroanal., 796, 26 (2014). [ Links ]
24. M.M. Foroughi, H. Beitollahi, S. Tajik et al., Hydroxylamine electrochemical sensor based on a modified carbon nanotube paste electrode: Application to determination of hydroxylamine in water samples, Int. J. Electrochem., 9, 2955 (2014). [ Links ]
25. M.M. Foroughi, H. Beitollahi, S. Tajik et al., Electrochemical determination of N-acetylcysteine and folic acid in pharmaceutical and biological samples using a modified carbon nanotube paste electrode, Int. J. Electrochem., 9, 8407 (2014). [ Links ]
26. Ch. Li., Voltammetric determination of ethinylestradiol at a carbon paste electrode in the presence of cetyl pyridine bromine, Bioelectrochem., 70, 263 (2007). [ Links ]
27. Ch.C. Vishwanath, B.E. Kumara-Swamy, Electrochemical studies of paracetamol at poly (anilineblue) modified carbon paste electrode: A voltammetric study, Anal. Bioanal. Electrochem., 5, 573 (2014). [ Links ]
28. S.E. Baghamidi, H. Beitollahi, S. Tajik, Graphene oxide nano-sheets/ferrocene derivative modified carbon paste electrode as an electrochemical sensor for determination of hydrazine, Anal. Bioanal. Electrochem., 5, 634 (2014). [ Links ]
29. J.B. Raoof, A. Kiani, R. Ojani, R. Valliolahi, Electrochemical determination of dopamine using banana-MWCNTs modified carbon paste electrode, Anal. Bioanal. Electrochem., 3, 59 (2011). [ Links ]
30. L.H. de Oliveira, A.C. Dias Souza, L. Pizzuti et al., Determinação voltamétrica do antioxidante galato de propila em biodiesel empregando eletrodos de pasta de carbonomodificados com líquido iônico, Orbital Elec. J. Chem., 6, 255 (2014). [ Links ]
31. R. Singh, Prospects of organic conducting polymer modified electrodes: Enzymosensors, Int. J. Electrochem., N 502707 (2012). [ Links ]
32. O. Korostynska, K. Arshak, E. Gill, A. Arshak, Review on state-of-the-art in polymer based pH sensors, Sensors, 7, 3027 (2008). [ Links ]
33. M. Gholami, M. Rezayi, P.M. Nia et al., A novel method for fabricating Fe2+ ion selective sensor using polypyrrole and sodium dodecyl sulfate based on carbon screen-printed electrode, Measurement, 69, 115 (2015). [ Links ]
34. R. Ojani, J.-B. Raoof, A.A. Maleki, S. Safshekan, Simultaneous and sensitive detection of dopamine and uric acid using a poly(L-methionine)/gold nanoparticle-modified glassy carbon electrode, Chin. J. Cat., 35, 423 (2014). [ Links ]
35. J.W. Park, S.J. Park, O.S. Kwon et al., High-performance Hg(2+) FET-type sensors based on reduced graphene oxide-polyfurannanohybrids, Analyst, 139, 3852 (2014). [ Links ]
36. H. Shu, "Applications of poly(3-hexylthiophene) thin film as a hydrazine-sensitive chemoresistor", M. Sc. Thesis, Alburn, Alabama, 2006. [ Links ]
37. S. Lee, B.-J. Yi, K.-Y. Chun et al., Chitosan-polypyrrole fiber for stain sensor, J. Nanosci., Nanotechn., 15, 2537 (2015). [ Links ]
38. L. Wang, H. Xu, Y. Song et al., Carbon fiber ultramicrodic electrode electrodeposited with over-oxidized polypyrrole for amperometric detection of vesicular exocytosis from pheochromocytoma cell, Sensors, 15, 868 (2015). [ Links ]
39. J. Li, X. Li, Y. Zhang et al., Electrochemiluminescence sensor based on cationic polythiophene derivative and NH2-graphene for dopamine detection, RSC Adv., 5, 5432 (2015). [ Links ]
40. K.R. Mantesha, B.E. Kumara-Swamy, K. Vasantakumar-Pai, Poly(alizarin) modified glassy carbon electrode for the electrochemical investigation of omeprazole: A voltammetric study, Anal. Bioanal. Electrochem., 6, 234 (2014). [ Links ]
41. L. Hudson, M.R. Bassett, Oscillatory electrodissolution of metals, Rev. Chem. Eng., 7, 108 (1991). [ Links ]
42. M. Pagitsas, S. Dimitra, The improved Franck-FitzHugh model for the electrodissolution of iron in sulphuric acid solutions: Linear stability and bifurcation analysis. Derivation of the kinetic equations for the forced Franck-FitzHugh model, Electrochim. Acta, 36, 1301 (1991). [ Links ]
43. A.J. Pearlstein, J.A. Johnson, Global and conditional stability of the steady and periodic solutions of the Franck-FitzHugh model of electrodissolution of Fe in H2SO4, J. Electrochem. Soc., 136, 1290 (1991). [ Links ]
44. I. Das, N.R. Agrawal, S.A. Ansari, S.K. Gupta, Pattern formation and oscillatory polymerization of thiophene, Ind. J. Chem., 47, 1798 (2008). [ Links ]
45. S.U. Rahman, M.S. Ba-Shammakh, Thermal effects on the process of electropolymerization of pyrrole on mild steel, Synth. Met., 140, 207 (2004). [ Links ]
46. A.S. Liu, M.A.S. Oliveira, Electrodeposition of polypyrrole films on aluminium from tartrate aqueous solution, J. Braz. Chem. Soc., 18, 143 (2007). [ Links ]
47. D. Sazou, The dynamic behavior of the electrochemical polymerization of indole in acetonitrile-water mixtures, Synth. Met., 130, 45 (2002). [ Links ]
48. I. Das, N. Goel, N.R. Agrawal, S.K. Gupta, Growth patterns of dendrimers and electric potential oscillations during electropolymerization of pyrrole using mono- and mixed surfactants, J. Phys. Chem., 114, 12888 (2010). [ Links ]
49. M. Bazzaoui, E.A. Bazzaoui, L. Martins, J.I. Martins, Electropolymerization of pyrrole on zinc-lead-silver alloys' electrodes in neutral and acid organic media, Synth. Met., 130, 73 (2002). [ Links ]
50. I. Das, N. Goel, S.K. Gupta, N.R. Agrawal, Electropolymerization of pyrrole: Dendrimers, nano-sized patterns and oscillations in potential in presence of aromatic and aliphatic surfactants, J. Electroanal. Chem., 670, 1 (2012). [ Links ]
51. V. Tkach, V. Nechyporuk, P. Yagodynets', A investigação matemática do desempenho de biossensores eletroquímicos enzimáticos, baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 41, 203 (2012). [ Links ]
52. V. Tkach, V. Nechyporuk, P. Yagodynets', El estudio de estabilidad en el proceso del desempeño de los sensores y biosensores, basados en los polímeros conductores en medio fuertemente ácido, Rev. Colomb. Cienc. Quím. Farm., 42, 30 (2013). [ Links ]
53. V. Tkach, V. Nechyporuk, P. Yagodynets', The mathematical stability study of the work of isomerization sensors, based on conduction polymers, Anal. Bioanal. Electrochem., 6, 273 (2014). [ Links ]
54. V. Tkach, V. Nechyporuk, P. Yagodynets', A descrição matemática do processo da detecção de duas substâncias com um grupo funcional comum pelos sensores e biossensores eletroquímicos baseados nos polímeros condutores, Rev. Colomb. Cienc. Quím. Farm., 42, 215 (2013). [ Links ]
55. V. Tkach, V. Nechyporuk, P. Yagodynets', I. Rusnak, The CP-based electrochemical biosensors with autocatalytic stage in their function and the mathematical description of their work, Orbital Elec. J. Chem., 4, 136 (2012). [ Links ]
56. V. Tkach, V. Nechyporuk, P. Yagodynets', Yu. Meslyuk, Mathematical model of the work of the mediated conducting polymer sensors with the use of the polymers of heterocyclic compounds, Rev. Soc. Quím. Perú, 77, 259 (2011). [ Links ]
57. V. Tkach, H. Nascimento, V. Nechyporuk, P. Yagodynets', A descrição matemática do desempenho de sensores e biossensores eletroquímicos de pH, baseados em polímeros condutores, nos processos de medição do pH dos líquidos de cavidade bucal no modo de voltagem constante, Rev. Colomb. Cienc. Quím. Farm., 43, 196 (2014). [ Links ]
58. V. Tkach, R. Ojani, S.C. de Oliveira et al., The mathematical description for the hydrazine detection by Michael reaction with naphtholaminosulphonic acids, Anal. Bioanal. Electrochem., 7, 291 (2015). [ Links ]
59. V. Tkach, B. Kumara-Swamy, R. Ojani et al., O comportamento de paracetamol durante a sua oxidação eletrocatalítica sobre poli(azul da anilina) e a sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 148 (2015). [ Links ]
60. V. Tkach, B. Kumara-Swamy, R. Ojani et al., El mecanismo de la oxidación de omeprazol sobre el electrodo de carbono vitroso, modificado por polializarina, y su descripción matemática, Orbital Elec. J. Chem., 7, 1 (2015). [ Links ]
61. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets', Modelagem matemática do desempenho de elétrodos, modificados por camada de ferroceno, nos processos da eletrooxidação de compostos orgânicos em meios neutro e ácido, Rev. Colomb. Cienc. Quím. Farm., 43, 35 (2014). [ Links ]
62. V. Tkach, S. Tajik, R. Ojani et al., Mecanismo de desempenho eletroanalítico da 2,7-bis(ferrocenil-etinil)-fluoreno-9-ona para eletrodetecção da hidrazina e sua descrição matemática, Rev. Colomb. Cienc. Quím. Farm., 44, 208 (2015). [ Links ]
63. V. Tkach, R. Ojani, V. Nechyporuk, P. Yagodynets', A Descrição matemática do desempenho eletroanalítico de nanopartículas de óxido de cobre(II) na eletrodetecção de hidrazina, Orbital. Elec. J. Chem., 6, 142 (2014). [ Links ]
64. V. Tkach, V. Nechyporuk, P. Yagodynets', The mathematical description for the electropolymerization of furan, pyrrole and thiophene derivatives in alkaline media, Med. J. Chem., 3, 1122 (2015). [ Links ]
65. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets', O estudo de estabilidade do processo da eletropolimerização de pirróis N-substituídos, Proc. Quím., 8, 49 (2014). [ Links ]
66. V.V. Tkach, V.V. Nechyporuk, P.I. Yagodynets', Eletropolimerização dos compostos heterocíclicos. Modelos matemáticos, Ciên. Tecn. Mat., 24, 54 (2012). [ Links ]
67. V. Tkach, V. Nechyporuk, P. Yagodynets', Aseletro polimerizações galvanostática e potenciodinâmica (em voltagem constante) dos compostos heterocíclicos e a sua descrição matemática, Tecn. Met. Mat. Min., 10, 249 (2013). [ Links ]
68. V. Tkach, V. Nechyporuk, P. Yagodynets', Estudio matemático de las condiciones de estabilidad en la polimerización electroquímica de compuestos heterocíclicos en presencia de oxidantes, Afinidad, 70, 73 (2013). [ Links ]
69. V.V. Tkach, V.V. Nechyporuk, P. Yagodynets', M. Hryhoryak, A investigação do comportamento eletroquímico durante a síntese eletroredutiva de polímeros condutores na presença de catiões dos metais, Ciên. Tecn. Mat., 24, 50 (2012). [ Links ]
70. V.V. Tkach, V.V. Nechyporuk, O.T. Slipenyuk, A descrição matemática do fenômeno oscilatório durante a síntese eletroquímica dos filmes de oxi-hidroxi compostos de cobalto (III) e durante síntese dos compósitos deles com polímeros condutores, Ecl. Quím., 37, 74 (2012). [ Links ]














