Abreviações, siglas e símbolos
ATCC - American Type Culture Collection
ATP - Trifosfato de adenosina
AnB - Anfotericina B
BIP - 2, 2'- bipiridina
Ca+2 - Íon Cálcio
cAMP - Monofosfato de adenosina cíclico
CasP - Caspofungina
Cat - Catalase
CIM - Concentração inibitória mínima
CFM - Concentração fungicida mínima
1∆g O2 - Oxigênio singleto
DNA - Deoxyribonucleic acid, ácido desoxirribonucleico
EN - Estresse nitrosativo
EO - Estresse oxidativo
ERNs - Espécies reativas do nitrogênio
EROs - Espécies reativas do oxigênio
Fe - Ferro
Fe2+ - Íon Ferroso
Fe3+ - Íon Férrico
FLC - Fluconazol
fMLP - N-formil-metionil-leucil-fenilalanina
GPx - Glutationa peroxidase
GR - Glutationa redutase
GSH - Glutationa reduzida
H2O2 - Peróxido de hidrogênio
HO• - Radical hidroxila
HOCl - Ácido hipocloroso
IFIs - Infecções fúngicas invasivas
ITC - Itraconazol
iNOS - Óxido nítrico sintetase induzida
LASER - Light amplification by stimulated emission of radiation
LT - Laserterapia
MΦ - Macróffago
MF - Micafungina
MN - Miconazol
NAC - N-acetil-l-cisteína
NADPH oxidase - Nicotinamida adenina dinucleotídeo fosfato oxidase
•NO - Óxido nítrico
Nox - Subunidade catalítica de NADPH oxidases
O2 - Oxigênio molecular
O2•- - Superóxido
OCl- - Anion hipoclorito
ONOO- - Peroxinitrito
PMA - Acetato Miristato de Forbol
RE - Retículo endoplasmático
Sod - Superóxido dismutase
UFC - Unidade formadora de colônias
Destaques
- Antifúngicos tradicionais e candidatos a antifúngicos podem induzir o acúmulo de EROs/ERNs na célula fúngica que, quando acompanhado de uma não efetiva defesa antioxidante do fungo, gera os chamados EO/EN, causando danos a biomoléculas do microrganismo e provocando uma inibição do crescimento ou morte do fungo.
- Os antifúngicos ou candidatos a antifúngicos podem incrementar a produção de oxidantes via fontes naturais de produção basal de EROs/ERNs na célula fúngica e/ou criar novos alvos redox para a produção de oxidantes, desse modo levando ao acúmulo na célula fúngica.
- Através da avaliação de sistemas de detoxificação de oxidantes em microrganis-mos e/ou uso de antioxidantes exógenos, o papel do EO e/ou EN no mecanismo de ação de antifúngicos tem sido estabelecido.
- Independente do EO e/ou EN induzido pelo antifúngico (ou candidato) gerar um efeito fungistático ou fungicida, o acúmulo de EROs/ERNs leva a uma diminuição da viabilidade celular e possível morte fúngica associada.
- Por outro lado, doses/concentrações sub-letais de antifúngicos pode gerar baixas produções de EROs/ERNs e, causar um priming da defesa antioxidante do fungo, dessa forma esta sinalização via oxidantes pode contribuir com a resistência aos antifúngicos através de múltiplos mecanismos.
INTRODUÇÃO
As doenças infecciosas causadas por fungos apresentam considerável incidência em todo o mundo, sendo que, os fungos considerados oportunistas (como exemplos, Candida spp., Cryptococcus spp. e Aspergillus spp.) acometem principalmente pacientes imu-nocomprometidos e, os chamados patógenos fúngicos verdadeiros (como exemplos, Paracoccidioides brasiliensis, Coccidioides immitis e Histoplasma capsulatum), normalmente acometem tanto pacientes imunocomprometidos como os imunocompetentes. Ambos, fungos oportunistas ou patogênicos, podem causar infecções fúngicas invasivas (IFIs), com repercussão em altas taxas de mortalidade (20-90%, dependendo do contexto) [1-3].
Resistência aos agentes antifúngicos é um problema atual, sendo reportados, anualmente, aproximadamente 3400 casos de doenças infecciosas causadas por C. albicans resistente ao flucanozol (FLC) em hospitais dos EUA, com sérias repercussões para a saúde pública, elevando as taxas de morbimortalidade (neste caso, com aproximadamente 220 mortes anuais) e aumentando os gastos com internações e tratamentos [1, 2]. No Brasil, embora os dados sejam escassos e subestimados, a problemática quanto às inffecções fúngicas e perfis de resistência aos agentes terapêuticos demonstram também serem preocupantes. Portanto, a busca por novos antifúngicos tem crescido nos últimos anos e a possibilidade de encontrar novos alvos terapêuticos também tem sido reavaliada [3, 4].
Neste contexto, diferentes estudos têm visado a busca por compostos que possam induzir elevada produção de espécies reativas de oxigênio ou nitrogênio (ERO/ERN) na célula fúngica [5-9]. Esta elevação de ERO/ERN, quando acompanhada de uma ineficiência dos sistemas de detoxificação redox da célula fúngica (como exemplos, das enzimas superóxido dismutase [Sod], catalase [Cat], glutationa peroxidase [GPx], tioredoxinas, entre outras), pode culminar nos chamados estresses oxidativos ou nitrosativos (EO/EN). Como consequência do EO/EN, ocorrem, danos a importantes macromoléculas do fungo, como lipídeos, proteínas e o DNA, independentemente de a ação antifúngica principal ser fungiostática (efeito de inibição do crescimento) ou fungicida (com morte microbiana imediata) [6].
Não apenas restrito à busca por novos compostos, tem sido reportado que, consagrados fármacos antifúngicos, como exemplos, os azóis (FLC, itraconazol [ITC] e miconazol [MN]) [4, 6, 10], polienos (anffotericina B [AnB]) [11] e equinocandinas (micaffungina [MF]) [12], tomam parte na produção aumentada de ERO/ERN, como parcela de seus mecanismos de ação, podendo haver nestes casos, efeito fungiostático ou fungicida associado ao tratamento.
A possibilidade da indução do EO ou EN como alvo no tratamento de infecções fúngicas atrai o interesse de novos estudos, uma vez que este processo pode induzir a morte fúngica, seja via apoptose ou vias correlatas (incluindo aquelas que levam a indução de danos a biomoléculas do fungo e um efeito fungicida associado) [13]. Portanto, o objetivo desta revisão sistemática foi fornecer uma visão geral sobre os estudos relacionados à indução de EO ou EN como alvo terapêutico nas infecções fúngicas, além das implicações e perspectivas quanto à exequibilidade na prática clínica.
METODOLOGÍA
Nesta revisão sistemática da literatura nós, primariamente, avaliamos a associação entre o EO ou EN e a atividade antifúngica. Para tal, foi realizado um levantamento bibliográfico nas bases de dados indicados na tabela 1, usando uma combinação dos descrito-res: "oxidative stress", "antifungal", "nitrosative stress", "reactive oxygen species (ROS), "reactive nitrogen species (RNS)", "natural compounds" e "fungicidal". As questões norteadoras desta revisão sistemática foram: Quais as reais associações entre o EO ou EN e a ação antiffúngica? Como o EO ou EN podem causar danos a biomoléculas e morte fúngica? Quais fatores podem interferir ou serem considerados durante a indução de um EO ou EN por compostos de interesse? Quais são os compostos de fontes naturais que podem induzir o EO ou EN na célula fúngica? Apenas artigos publicados em periódicos, a qualquer período, foram considerados elegíveis. Dentre os critérios de elegibilidade (tabela 2) foram considerados os seguintes aspectos: (i) disponibilidade do texto integral para estudo; (ii) clareza no detalhamento metodológico utilizado (metodologia fidedigna para avaliar diretamente EROs/ERNs, danos oxidativos associados [peroxidação lipídica e danos ao DNA] e viabilidade fúngica); e (iii) relevância científica e clínica (indutores de EO ou EN com aplicabilidade clínica, com baixa toxicidade e ausência ou poucos efeitos colaterais). Para a consolidação do artigo, a contex-tualização do tema apresentado foi complementada com outras referências relevantes aos propósitos desta revisão.
Tabela 1 Estratégias de pesquisa conduzida nesta revisão sistemática sobre o tema abordado, realizada em diferentes bases de dados/domínios públicos.
| Banco de dado | Palavras-chave | Período | Critérios de inclusão primária | Critérios de exclusão primária |
|---|---|---|---|---|
| PubMed (via PubMed); Embase (via OVID); Lilacs (via Bireme); Cochrane Library; Web of Science; Science Direct; OMIM; SciELO (via SciELO); CI-NAHL; MEDLINE (viaBireme); Scopus; BIOSIS; HNO | "oxidative stress", "antifungal", "nitrosative stress", "reactive oxygen species (ROS), "reactive nitrogen species (RNS)", "natural compounds" e "fungicidal" | Sem restrição | Pertinência/ relevância ao tema | Texto integral não disponível |
Tabela 2 Sumário dos critérios de inclusão e exclusão adotados nesta revisão sistemática.
| Portal | Descritos na tabela 1 |
|---|---|
| Período aceito | Qualquer época |
| Interstício | Abril-junho 2017 |
| Palavras-chave | "oxidative stress", "antifungal", "nitrosative stress", "reactive oxygen species (ROS), "reactive nitrogen species (RNS)", "natural compounds" e "fungicidal" |
| Critérios para triagem primária* | (i) Dados reportando a relação entre estresse oxidativo ou nitrosativo e ação antifúngica comprovada (independente de induzir apoptose ou das ações serem fungistática ou fungicida); Relevância da proposta, plausibilidade biológica e clínica/terapêutica; (ii) Viabilidade metodológica respaldando os achados; Conclusão suportada pelos resultados; (iii) Clareza na descrição dos mecanismos que permeiam o estresse oxidativo como evento primário ou coadjuvante da ação antifúngica |
| Tipos de documentos | Apenas artigos publicados em periódicos indexados |
| Critérios de elegibilidade | (i) Disponibilidade do documento integral (ii) Metodologia apropriada (iii) Estudos com relevância científica |
| Total de artigos abordando o tema | 64 |
*Para produtos de origem natural, apenas compostos isolados e identificados com concentração inibitória mínima (CIM) ou concentração fungicida mínima (CFM) < 600 μg/mL e baixa ou nenhuma toxicidade para humanos (bom índice de seletividade [IS]) foram considerados.
Última pesquisa no PubMed em maio de 2017. Última pesquisa no Embase em maio de 2017. Última pesquisa no Lilacs em maio de 2017. Última pesquisa no Cochrane Library em maio de 2017. Última pesquisa no Web of Science em maio de 2017. Última pesquisa no Science Direct em maio de 2017. Última pesquisa no OMIM em maio de 2017. Última pesquisa no SciELO em maio de 2017. Última pesquisa no CINAHL em maio de 2017. Última pesquisa no MEDLINE em maio de 2017. Última pesquisa no Scopus em maio de 2017. Última pesquisa no BIOSIS em maio de 2017. Última pesquisa no HNO em maio de 2017. *Apenas artigos publicados foram aceitos como documentos, para uma prévia triagem.
DISCUSSÃO
Nesta revisão nós analisamos artigos que relatam sobre novos compostos com ação antifúngica, cujo mecanismo de ação, foi reivindicado para ser dependente de ERO/ ERN. Além disso, nós avaliamos trabalhos que tratam de mecanismos de ação anti-fúngica dependente de ERO/ERN, creditados a antifúngicos rotineiramente usados na prática clínica, com possíveis mecanismos de ação paralelos ou ainda parcialmente elucidados. Motivo de controvérsias por parte da comunidade científica, o chamado "mecanismo comum para a morte microbiana" (do inglês unified mechanism of killing), induzida por ERO/ERN, tem sido amplamente abordado para antibacterianos e agora é relatado também para os antiffúngicos [14-19]. De fato, determinados níveis de ERO/ ERN tomam partes na sinalização apoptótica e [20], até o momento, está via tem sido considerada um alvo promissor para a ação de candidatos a antiffúngico [7].
Nós realizamos criteriosa revisão sistemática, na qual 64 artigos que claramente abordavam o tema alvo (figura 1) foram encontrados. Como observado na figura 1, as pesquisas neste campo de estudo são recentes (apenas um artigo publicado antes dos anos 2000) e crescentes (50 artigos foram publicados entre 2007-2017, figura 2), visto que o tema EO ou EN é relativamente recente [21]. Controvérsias a parte, é notória a convergência de achados mostrando a estreita relação entre a indução e acúmulo de EROs/ERNs na célula fúngica e consequente ação antifúngica, quando a defesa antioxidante da célula microbiana é superada, desde que, na definição de "estresse oxidativo ou nitrosativo", há favorecimento para o aumento de fatores pró-oxidantes em detrimento dos antioxidantes (sistemas de defesa enzimáticos, entre outros), por tempo e contexto definidos, levando em conta que o ambiente redox pode variar significativamente [21]. Ainda, nós consideramos possíveis ações adjuvantes dos indutores/clássicos antifúngicos, como a imunomodulação, bem como consideramos a presença de cepas ffúngicas que exploram mecanismos de resistência ao EO ou EN como repertório de virulência e patogenicidade.

Figura 1 Número de artigos abordando o tema "Estresse oxidativo ou nitrosativo e atividade antifúngica" encontrados nesta revisão e estratificados de acordo com o foco. Antifúngicos clássicos: Aqueles usados na prática clínica (exemplos: AnB, FLC, MF); Outros: estudos que abordavam a elevação de ERO/ERN e atividade antifungica induzida por compostos de origem sintética.

Figura 2 Número de artigos abordando o tema "Estresse oxidativo ou nitrosativo e atividade anti-fúngica" ao longo dos anos.
Possíveis fontes de ERNs/ERNs na célula fúngica
Após estabelecer os conceitos de EO/EN, nós examinamos as fontes de ERO/ERN na célula fúngica. A produção de superóxido (O2 •-), relativamente um fraco oxidante que, normalmente, é o primeiro formado dando origem a EROs/ERNs mais fortes em cascatas subsequentes, tem o oxigênio molecular (O2) como aceptor de elétrons. O O2 •-em fungos pode ser de origem mitocondrial (mais comum, por conta de um aumento na atividade da cadeia transportadora de elétrons e a consequente toxicidade do O2) ou originário da atividade do retículo endoplasmático (RE) [22-25]. Estruturas proteicas homólogas em fungos, semelhantes aquelas do complexo enzimático nicotinamida adenina dinucleotídeo fosfato (NADPH) oxidase encontrado em humanos, podem gerar O2 •- (segundo a equação: 4 O2 + 4 NADPH à 4 O2 •- + 2 NADP+ + 4 H+).
Quando o O2 •- é formado, este oxidante pode ser dismutado espontaneamente ou enzimaticamente (catalizada pela Sod, na reação: 2 O2 •- + H+ à O2 + H2O2), formando o peróxido de hidrogênio (H2O2). O H2O2 pode sofrer ação de catalases/peroxidases fúngicas (como exemplo, a GPx) ou seguir diferentes caminhos originando outras EROs. Assim, o H2O2 pode gerar radical hidroxila (HO•-), através da reação de Fenton e a reação acoplada de Haber-Weiss (dependentes de Fe2+/Fe3+). Paralelamente, o O2 •- pode reagir com o óxido nítrico (•NO) ou alguns outros compostos, gerando o peroxinitrito (ONOO-, uma ERN). De nota, alguns destes oxidantes podem ser gerados intensamente durante ação específica de um fármaco/composto. O HO• e o ONOO-são altamente reativos e podem prontamente causar danos aos lipídios, proteínas e DNA e, na ausência ou ineficiência de sistemas de reparos destas biomoléculas, podem levar a perda de função e a morte microbiana.
Como exemplos de ativação pontual do EO em fungos, Avci et al. [25] mostraram que ascorbato pode elicitar aumento de EROs, exclusivamente, via reação de Fenton, com aumento de HO• a partir do H2O2 e O2 •-. Yu et al. [24] demonstraram que alguns agentes que podem perturbar a parede celular fúngica (40 μg/mL de calcoflúor branco, em inglês Calcofluor White [CFW], ou 0, 1 μg/mL de caspoffungina [CasP]) causam quadro de EO (em até 60 min após o tratamento) intracelular via aumento de EROs (oxidantes totais avaliados com a sonda DCFH-DA) originários do RE em C. albicans, gerando peroxidação lipídica e danos associados. N-acetil-l-cisteína (NAC) preveniu a elevação dos níveis de EROs e os danos associados a ação antiffúngica do CFW (NAC regenera GSH, que previne a formação das induzidas pelo antiffúngico), demonstrando a dependência de EROs (principalmente o H2O2, como verificado em sistemas de hipe-rexpressão de SOD1 e CAT1 por um forte promotor de ACT1) para a ação destes disruptores de parede. Disfunção mitocondrial e, aumento de O2 •- a partir desta organela, não foram observadas. Além disso, os grupos tratados com CFW ou CasP com adição de um quelante de ferro (2, 2'- bipiridina [BIP]) ou scavenger de HO• (etanol) ou efeito do CFW/CasP sobre cepas mutantes para este alvo (reação de Fenton) não atenuaram o EO e a consequente inibição do crescimento microbiano.
O aumento de EROs a partir do RE foi atribuído pelos autores a uma hiperexpressão gênica e indução de uma resposta via acúmulo de proteínas desdobradas (do inglês unfold protein response (UPR)], por conta da disrupção na parede fúngica. Isto se refletiu em um aumento na secreção de proteínas e consequente aumento da enzima oxi-doredutina do RE (Ero1), relacionada ao dobramento oxidativo de proteínas, fazendo um rearranjo redox de pontes dissulffeto, como contrarresposta para superar o quadro de UPR ou de proteínas oxidadas encontradas em células tratadas com CFW ou CasP. Assim, durante sua função, Ero1na forma redutiva recebe elétrons do O2, formando H2O2, fazendo com que haja predominância da forma oxidada de Ero1 e, explicando, tanto este incremento em Ero1 oxidada, quanto os altos níveis de H2O2 provenientes do RE. Estes dados estabelecem um novo link entre a integridade da parede celular fúngica, função do RE e aumento de EROs e danos associados (aumento de H2O2 causa peroxidação lipídica como evidenciado pelos autores), demonstrando também um possível novo alvo terapêutico, com especifficidade/seletividade para o fungo [24].
Em fungos, o O2 •- formado pode reagir instantaneamente com o •NO, gerando ONOO-. Este fato é comprovado em prévios trabalhos [4, 22, 23], que avaliaram estas ERNs ou a resposta antioxidante do fungo (por exemplo, via aumento na expressão persistente de YHB1, ou tardia de TRR1) frente à exposição a tais oxidantes [22]. Estes dados destacam a plausibilidade cronológica dos eventos relacionados ao EN na célula fúngica, desde que exposição as ERNs geram uma resposta imediata e persistente via YHB1, e uma resposta tardia é verificada via aumento na expressão de tioredoxi-nas (gene TRR1), desde que esta classe de enzimas tenta controlar os danos oxidativos a proteínas (evento seguinte à exposição das biomoleculas as ERNs).
Ainda, segundo Cánovas et al. [23], o •NO endógeno de fungos pode ter origem em algumas rotas metabólicas, como a da arginina/poliaminas (mediado por enzimas com atividades similares a do óxido nítrico sintetase [NOS]) ou do NO2 - (ação do nitrato redutase, niaD). O •NO é detoxificado pelas rotas das fl avohemoglobinas (hemC, fhbA, fhbB), do citocromo P450 NO redutase (nicA, norA, norB) ou da GSNO redutase (genes GNO1 e SFA1). Esta ERN tem variadas funções em fungos, como a regulação do metabolismo do nitrogênio, morfogênese e reprodução.
Complementarmente, Ferreira et al. [4] mostraram que, o ONOO- é induzido em Cryptococcus gattii pela ação da AnB, em que associação de AnB com concentrações de até 50 j/M de porfirinato de ferro III (um scavenger de ONOO-), atenuou os danos associados ao EN. Os autores relataram que, no C. gattii, assim como em outros contextos químico-biológicos, o •NO compete com a Sod pelo O2 •-, tendo cinética favorável, como demonstrado pela marcante formação de ONOO- e pela paralela diminuição na atividade da Per (uma enzima que atua sobre o H2O2 cujas concentrações diminuem como consequência da menor dismutação do O2 •- pela Sod).
Associado as fontes de EROs/ERNs na célula fúngica e, dependentes do contexto que permeia e as características físico-químicas dos oxidantes (difusão, meia vida, entre outros), normalmente, o H2O2 causa peroxidação lipídica (tem boa difusão, maior meia vida e atravessa membranas), ERNs (principalmente ONOO-) leva a oxidação proteica e o potente oxidate HO• tem alta capacidade de alcançar o DNA e causar sérios danos oxidativos a esta biomolécula, explicando, em parte, o fato de alguns compostos, que serão adiante discutidos, terem a capacidade de induzir maiores níveis de determinado oxidante e consequentemente maiores danos a uma determinada biomolécula, o que também será diretamente proporcional ao aumento nas concentrações de tal oxidante.
Sistemas de defesa antioxidante do fungo como marcadores da elevação de ERO/ERN
Seguindo a exposição as EROs e/o ERNs, a ativação de diversos sistemas de defesa antioxidante (tanto os constitutivos como os induzíveis), temporalmente, primeiro, permitem à célula fúngica detoxifficar os oxidantes (através da Sod [detoxiffica o O2 •-], Cat e GPx [detoxifficam o H2O2], entre outras), segundo, caso haja necessidade (em caso de EO ou EN), em reparar os danos oxidativos a biomoléculas (por exemplo, via tioredoxinas, regenerando proteínas oxidadas). A detoxificação e os reparos permitem a prevenção de maiores danos e evita possível morte celular fúngica. Para haver ação antifúngica, a indução de EROs/ERNs deve ser acompanhada de uma ineficiência destes sistemas de defesa antioxidante da célula fúngica. Vários sistemas específicos de defesa antioxidante têm sido destacados para fungos, alguns, controlados em clusters gênicos. Cabe salientar que, como ainda será visto nesta revisão, a estratégia de adição de antioxidantes exógenos, visando prevenir o EO/EN e provando o efeito de EROs/ERNs, não é discutido nesta seção.
Cepas mais virulentas de fungos podem apresentar marcante produção de enzimas do sistema antioxidante, como verificado por Lee et al. [26], que mostrou que cepas fún-gicas que expressam mais o gene para Sod são menos afetadas pelo efeito de EROs induzidas pela radiação. Como implicação, isto foi refletido em uma ineficiência na ação irradiante para induzir um mecanismo fungicida associado. Outro exemplo, bem sucedido, de resposta antioxidante contendo danos oxidativos em fungos, foi demonstrado por Paul et al. [27], em que a resistência de Cryptococcus neoformans ao FLC foi correlacionada a hiperexpressão do YAPI visto que mutação neste gene causou extrema hipersensibilidade do fungo ao EO e ao FLC, nas mesmas faixas de concentração testadas para as o fungo com o YAP1 funcional. Como foi demonstrado que C. albicans ou Aspergillus fumigatus deficientes de YAP1 também são hipersensíveis ao EO, mas não ao FLC, foi sugerido que este gene apresenta um papel único na resposta de C. neoformans a este agente antifúngico.
Ainda, aumento na expressão gênica de enzimas do sistema de detoxificação de oxidantes nem sempre significa efetiva resposta do fungo. Guirao-Abad et al. [12] mostraram que a ação indutora de EROs/ERNs por AnB pode ser acompanhada de aumento na expressão dos genes que codificam Cat, glutationa redutase (GR) e Sod, como parte da resposta antioxidante do fungo. Provavelmente, o desfecho fungicida promovido por AnB mostra que, embora exista aumento, este é ineficaz para o controle redox, prevalecendo os oxidantes no balanço oxidante-antioxidante. Este desequilíbrio redox culmina em danos oxidativos irreversíveis para o fungo, o qual também foi evidenciado por Ferreira et al. [4]. Os autores concluíram que o aumento na capacidade de defesa antioxidante (como aumento de Sod) de C. gattii pode não ser suficiente para conter os danos oxidativos induzidos por AnB ou ITC.
Rossignol et al. [28] demonstraram que cetonas sintetizadas pela reação de Mannich e derivados sintéticos (com CIM de 0, 8 a 6 μg/mL) podem elevar as EROs em espécies de Candida (C. albicans, C. parapsilosis e C. krusei), e isto causar ativação do gene CAP1 (um gene essencial na montagem da resposta antioxidante), em que tal resposta também não foi suficiente para impedir a atividade antifúngica destes compostos.
Portanto, os estudos aqui demonstrados, apresentam evidências de estresso oxidativo ou nitrosativo na célula fúngica, avaliadas sobre a luz de medidas indiretas das espécies oxidantes (através de sondas como a DCFH-DA, ou outros métodos/sondas), medidas dos danos induzidos por EROs e ou ERNs (peroxidação lipídica [níveis de MDA], oxidação proteica [avaliação de resíduos oxidados] ou danos ao DNA [avaliação de desoxiguanosina com 8-oxodG]). Além disso, a avaliação dos sistemas de defesa antioxidante do fungo, através de análises do perfil de transcrição ou atividades enzimáticas fornecem uma ferramenta valiosa para estabelecer o quadro de EO ou EN.
De relevância clínica, determinadas cepas fúngicas podem apresentar variados níveis de hiperexpressão dos sistemas de defesa antioxidante. Esta variação pode inclusive determinar o grau de virulência destas cepas in vivo bem como o perfil de sensibilidade aos antifúngicos que induzem EO/EN e, extensivamente, ao ataque de fagócitos. A hiperexpressão de genes/proteínas, relacionadas à resposta antioxidante pode favorecer o fungo frente ao ataque de fagócitos, os quais utilizam do EO/EN como mecanismo fungicida. Interessantemente, expressão diferencial para uma determinada enzima antioxidante, independentemente da predileção do oxidante induzido, pode ocorrer, de modo que a enzima em concentrações excessivas pode detoxificar um determinado oxidante, mas favorecer acúmulo de outro. Por exemplo, hiperexpressão do gene para Sod concomitante a repressão de CAT pode favorecer acúmulo de H2O2 na célula fúngica, caso contrário, uma repressão do gene SOD favoreceria o acúmulo de O2 •-
Indução de EROs/ERNs pode levar a apoptose na célula fúngica
A sutileza do limiar entre o que é fisiológico e o que passa a ser patológico depende de complexos fatores e, a dualidade dos oxidantes é destacada, sendo o contexto redox sempre passível de alterações que podem significar grandes alterações funcionais [29]. A figura 3 mostra o sutil limiar entre o fisiológico e patológico, frente às diferentes concentrações de EROs/ERNs.

Figura 3 Limiar entre as concentrações de EROs/ERNs em fungos e a ativação de importantes eventos funcionais sinalizados por estes oxidantes.
Baseado neste contexto, estudos tem demonstrado que ligeira elevação destes oxidantes (a partir de valores intermediários) é importante fator de sinalização e precede a apoptose em fungos, por diferentes rotas (com diferentes mediadores, expressão gênica e danos citolíticos associados) para que este evento ocorra (dependentes dos níveis de determinados oxidantes e interação com componentes chaves que levam a apoptose). Dessa forma, este evento pode fornecer um possível alvo terapêutico, desde que haja especificidade/seletividade para o fungo em questão, uma vez que alguns componentes destas vias são comuns em humanos [30-34]. Assim, em fungos, o aumento de EROs/ ERNs tem sido considerado um fidedigno marcador de apoptose e, portanto, um importante alvo farmacológico.
Notoriamente, existem outras vias de acionamento de apoptose em fungos que são independentes de EROs [33]. Excessivas concentrações de EROs podem sinalizar outros mecanismos de morte, além de apoptose, tais como a necrose na célula fún-gica (também referida como necrose programada) [33]. Na necrose programada, são observados danos oxidativos mais acentuados, com marcante aumento de volume das organelas, intensos danos e perda de integridade de biomoléculas e membranas e uma randômica fragmentação do DNA. Estes mecanismos são mostrados na figura 4.

Figura 4 Possíveis respostas do fungo as altas concentrações de EROs/ERNs. O acúmulo de ERO ou ERNs pode elicitar uma variada gama de defesa endógena do fungo, incluindo os sistemas de defesa antioxidante (para detoxificar oxidantes ou reparar biomoléculas), os de degradação de biomoléculas afetadas (sistema proteassomo dependente de ubiquitina) e finalmente, a autofagia. Contudo, quando tais sistemas de defesa falham, a célula fúngica pode sofrer as consequências do acúmulo de EROs ou ERNs, culminando em EO ou EN e, consequentemente, entrando em apoptose, ou sofrendo necrose ou outros tipos de morte (efeito antifúngico pela indução de EROs/ERNs).
Neste contexto, mecanismos que possam elevar estas concentrações de EROs pró -apoptóticas e causar efeito fungicida contra células planctônicas e biofilmes, são alvos de estudo. Estes estudos não são apenas restritos à busca por novos compostos, mas têm sido descritos para antifúngicos já usados na terapêutica, tais como AnB a baixas doses fungicidas (0.25-μg/ml), ITC e equinocandinas, contra fungos de relevância médica (como C. albicans).
Dessa forma, AnB pode causar alterações nos níveis de ATP, e outras alterações típicas de apoptose, em sub-populações de C. albicans, sustentando o fato que o tratamento de infecções sistêmicas causadas por este microrganismo, com concentrações não ajustadas deste agente antifúngico, diminui a população microbiana via indução de apoptose. A. fumigatus tratado com 0.25-1 μg/ml de AnB apresenta coloração positiva com annexin V, indicando exposição de fosffatidilserina, um marcador clássico de apoptose, sendo também evidenciado fragmentação do DNA, conforme verificado pelo teste do Túnel [30-35].
Ainda segundo Ramsdale [30], as ffenantrolinas podem induzir a morte de C. albicans com marcante elevação nos níveis de EROs não acompanhado por danos ao DNA, o que poderia indicar que este aumento dos oxidantes toma parte, preferencialmente e primariamente, na sinalização de apoptose.
Alguns compostos, que serão discutidos mais adiante, demonstraram induzir apoptose em fungos via aumento de EROs, incluindo a metergolina (um alcaloide da classe das ergolinas que apresenta ação antagonista serotoninérgica a nível de receptores do sistema nervoso autônomo) [36] que pode induzir apoptose em C. krusei, os esfingóides em A. nidulans [37], o (+)-medioresinol [38], a baicaleina [39], o plagiochin E [40, 41], a amentoflavona [42] e styraxjaponoside C [43] em C. albicans. O perilaldeído [PAE], a curcumina e o ácido úsnico serão discutidos mais adiante.
Alguns outros compostos naturais, com estruturas mais complexas, que poderiam levar a apoptose na célula fúngica por incrementar EROs, incluem: proteína osmotina (isolado do tabaco) [30], defensinas de plantas como RsAFP2 (Heuchera sanguinea) e PvD1 (Phaseolus vulgaris) [44, 45], peptídeos antimicrobianos proveniente de plantas, artrópodes e animais entre outros, como psacotheasin (proveniente de Psacothea hila-ris) [46], arenicina-1 (Arenicola marina) [47], pleurocidin (Pleuronectes americanus) [48], papiliocina (Papilio xuthus) [49], e melitina (Apis mellifera) e [50], fatores salivares de humanos, incluindo as lactoferrinas [51] e as histatinas (apesar das controvérsias sobre este polipeptídeo) [30, 52, 53].
Em estudo demonstrando a intricada relação entre EROs e apoptose, Silva et al. mostraram que, o sinergismo entre o FLC e os compostos antioxidantes naturais: cate-quina, quercetina ou epigalocatequina, induziu apoptose em C. tropicalis resistente ao FLC [54]. Interessantemente, com o uso de um antioxidante a baixas concentrações ou concentrações em que estes compostos se comportem puramente como um "antioxidante" em um meio celular, seria esperado a diminuição de EROs induzida por FLC, e uma não ativação do apoptose, como tem sido reportado na literatura, que evidenciam a capacidade de antioxidantes em abolir o efeito microbicida dependente de EROs/ ERNs. Esta situação leva ao desfecho clínico desfavorável ao hospedeiro quando a associação antifúngico + antioxidante é adotada durante o tratamento de infecções fúngicas [14, 15, 18, 19, 24].
Contudo, como é também amplamente destacado na literatura, antioxidantes a altas concentrações ou associados a outros fatores, como o contexto do ciclo redox na célula, podem apresentar um efeito pró-oxidante [25, 55]. O efeito pro-oxidante é visto no estudo de Silva et al., o qual utilizou altas concentrações de flavonoides (128 μg/ml), tendo como desfecho a morte celular programada do fungo. Ainda quanto a ação do FLC, Liu et al demonstram que a adição de Farnesol exógeno (um correlato a via de biossíntese do ergosterol) pode elevar as EROs e causar apoptose em Penicillium expansum, um fungo patógeno de vegetais [56].
Gaoffua et al. demonstraram que um lipopeptídeo surfactante, WH1 ffungina, proveniente de Bacillus amyloliquefaciens, a baixas concentrações de 25-50 μg/mL, pode provocar apoptose em fungos (C. albicans e Rhizoctonia solani) sinalizada por rotas dependentes da mitocôndria com marcante formação de ERO (em contraste, altas concentrações, 100 μg/mL, leva a formação de poros na membrana e consequente necrose) [57]. Clássicos marcadores de apoptose foram evidenciados após o tratamento com 25-50 μg/mL de WH1 ffungina, incluindo desprendimento de citocromo c da mitocôndria (um dos fatores da atividade da metacaspase 9 para sinalizar apoptose) e marcante elevação dos níveis pró-apoptóticos de EROs (avaliadas com DCFH-DA que detecta todas as EROs), precedendo a morte celular fúngica. Outros peptídeos sintéticos também têm sido reportados como causadores de apop-tose em fungos [58].
Indução de EROs/ERNs como parte da ação de fármacos antifúngicos
Diante das atuais altas incidências de doenças infecciosas causadas por fungos, os anti-fúngicos clássicos, pertencentes às classes dos polienos (principalmente AnB e suas formulações lipídicas), azóis (FLC, MN, voriconazol e ITC) e equinocandinas (MF), continuam sendo rotineiramente utilizados na prática clínica, (figura 5). O espectro de ação destes agentes terapêuticos tem variado significativamente nos últimos anos, por conta das altas taxas de resistência em fungos. Devido à diminuição de cepas sensíveis a estes clássicos antifúngicos, houve aumento no número de estudos e publicações quanto à busca de novas alternativas terapêuticas ou compostos em fontes sintéticas ou naturais, em anos recentes, como visto nas figuras 1 e 2.
As atividades destes agentes antifúngicos clássicos, já utilizados na terapêutica, são reivindicadas como sendo também dependentes da prévia produção de EROs/ERNs, como desfecho oriundo das atividades principais, classicamente descritas e vistas na figura 6 e tabela 3, ou como um novo mecanismo paralelo a tais atividades. O desfecho pode ser um mecanismo de ação "fungicida", preferivelmente ao "fungistático", no chamado "mecanismo unificado para a morte microbiana" (como visto na tabela 3). Este fato é comprovado mediante a atenuação de danos oxidativos e prevenção da morte microbiana induzida por EO/EN pela adição de antioxidantes exógenos ou intenso acionamento de sistemas endógenos de defesa antioxidante [59-61].
Tabela 3 Clássicos antifúngicos que geram EROs/ERNs como parte de seus mecanismos de ação.

ADCFH-DA: Não apresenta especificidade, avaliando todas as EROs (O2•- , H2O2 e HO•) com variados graus de seletividade; BOs danos ao DNA encontrados pode também se correlacionar a uma maior formação de HO• (como já discutido), desde que os estudos têm encontrado menores concentrações de outras EROs. Refs.: Referências. As estruturas químicas representadas foram retiradas do CAS, ou dos artigos aqui referenciados (entre parêntesis) ou desenhadas com auxílio do ACD/Labs (Advanced Chemistry Development Inc., version 6.0)
Recentemente, Belenky et al. demonstraram através de estudos metabolômicos que, em C. albicans, AnB, MN e ciclopirox induziram marcantes alterações da dinâmica mitocondrial e perfil funcional, em parte, pela marcante produção os EROs. O aumento na produção de EROs resultou em danos ao DNA e consequente morte microbiana [19]. Xu et al. conduziram estudos proteômicos para a elucidação de possíveis mecanismos indutores de EROs pelo FLC, na argumentação deste agente antifúngico induzir EO e um efeito fungicida [62].
O primeiro artigo reportando dados a respeito da indução de EROs como parte da ação antifúngica foi de 1986 [63], em que Sokol-Anderson et al. mostraram que AnB induzia danos oxidativos associado ao afeito fungistático conta C. albicans. Sangalli -Leite et al. demonstraram que a AnB exerce efeito fungicida contra C. neoformans através de forte indução de EROs [64].
Ainda para a AnB, Ferreira et al. demonstraram que este agente antifúngico pode levar a produção de EROs e ONOO" contra C. gattii [4], em um mecanismo paralelo a inibição da biossíntese de ergosterol. Este mesmo efeito também foi demonstrado pelos autores, durante o mecanismo de ação do FLC ou ITC. Interessantemente, apenas ITC e AnB provocaram peroxidação lipídica em C. gattii, devido ao prévio EO, induzido pelos antifúngicos (EROs induzidos pelo ITC ou EROs e ERNs [ONOO-] pela AnB), com ativação do sistema antioxidante do fungo. Neste caso, a ativação do sistema antioxidante do fungo, foi ineficaz para conter os danos oxidativos. Os autores concluíram que AnB e ITC causam EO em C. gattii como parte de seus mecanismos antifúngicos.
Na sequência, Guirao-Abad et al. [12] encontraram que AnB e MF tomam parte na formação de EROs e que este evento é crucial durante suas atividades fungicidas. AnB (Concentração Inibitória Mínima [CIM] de 0, 5-1 μg/ml) induziu marcante formação de EROs em C. albicans SC5314 acompanhada de morte celular. Uma sutil formação de EROs induzida por MF foi observado em C. albicans, culminando em uma ação fungicida. Interessantemente, pré-incubação de C. albicans com tiou-réia (um antioxidante) suprimiu os efeitos tanto de AnB como de MF, demonstrado por marcante viabilidade celular. Ainda, este estudo demonstrou que durante a ação de AnB ou MF, houve uma marcante ativação de três enzimas antioxidantes, a Cat, GR e Sod. Entretanto, a ativação das enzimas antioxidantes foi ineficiente para conter o intenso EO induzido por AnB. Sutis aumentos de trealose e do potencial de membrana mitocondrial foram também evidenciados em C. albicans, durante o tratamento com AnB.
Contrastando com estes achados para MF, como aqui já discutido, Yu et al. [24] mostraram que EROs (principalmente H2O2) são induzidos por outro antifúngico da classe das equinocandinas, a CasP, contra C. albicans, mas de origem no RE. Estas diferenças entre estudos podem estar relacionadas às diferentes metodologias adotadas para avaliar as EROs, visto que o efeito fungicida associado foi verificado nos dois casos [12, 24]. Estes achados são complementares aos de Hao et al. [65], que demonstraram que a CasP pode conduzir a apoptose ou necrose em C. albicans, provavelmente, por induzir uma sutil elevação (causando apoptose) ou marcante elevação (causando necrose) nos níveis de EROs.
Em 2002, Kobayashi et al. relataram sobre a indução de EROs pelo MN [10]. Este agente antifúngico (com CIM de 0, 125 a 12.5 μg/ml) induziu intensa formação de EROs em isolados clínicos do gênero Candida (C. albicans, C. glabrata e C. tropicalis), em um modo dependente da concentração. Pré-tratamento com 10 μM do antioxidante pirrolidinaditiocarbamato (PDTC) inibiu o mecanismo antifúngico associado à produção de EROs. Os autores também sugeriram que FLC eleva a produção de oxidantes em Candida e isto pode estar relacionado à sua ação antifúngica.
Complementando os estudos de Kobayashi et al e Ferreira et al. [4, 10], Mahl et al. [6] mostraram que como parte do mecanismo principal o FLC pode induzir a formação de EROs em C. glabrata e consequente danos ao DNA (a peroxidação lipídica e oxidação proteica não foram significativas neste caso, como relatado pelos autores).
Paralelamente, foi encontrado um aumento na atividade de GPx, Sod e glutationa-S transferase (GST), demonstrando a plausibilidade do incremento de EROs correlacionada ao efeito deste agente antifúngico.
Ainda para o FLC, Yan et al. mostraram que existe uma via mitocondrial com uma oxidase alternativa em C. albicans, cuja ativação visa a defesa do microrganismo contra os danos oxidativos induzidos por este agente antifúngico, portanto, diminuindo a susceptibilidade de C. albicans ao FLC [66]. Em relação aos outros azóis, Thevissen et al. [67] mostraram a participação de EROs na ação do MN. Rubio et al. relataram possível efeito fungicida do voriconazol associado ao EO [68].
Cabe ressaltar que é atribuído ao FLC, a princípio, uma ação fungistática in vivo, contribuindo com diminuição parcial da carga microbiana e consequentemente facilitando a erradicação do foco infeccioso pelo sistema imune do hospedeiro [69, 70]. Contudo, diferentes estudos têm demonstrado que prolongados tratamentos ou altas concentrações ou doses com este azól conduz à atividade fungicida. In vitro, foi demonstrado que a diminuição no número de unidades formadoras de colônias (UFC) de C. albicans a partir de 2' horas é crescente e, atinge um ápice em torno de 7 dias de exposição a 1 μg/mL de FLC [69]. In vivo, uma dose deste azól de 10 mg/kg/dia por 12 semanas pode erradicar a carga microbiana, comparada ao controle não tratado com FLC [70]. Estes achados são condizentes com danos oxidativos requerendo um mais longo prazo, promovidos por EROs/ERNs, o que, ao menos em parte, poderia explicar este efeito fungicida a longo prazo do FLC.
Novos candidatos a agentes antifúngicos com mecanismos de ação que induzem o acúmulo de EROs/ERNs na célula fúngica
Como observado por Zida et al. [71], as pesquisas por novos antifúngicos, principalmente para substâncias com atividade anti- C. albicans, cresceram substancialmente desde 1966, pois a resistência fúngica vem crescendo cada vez mais e, se torna um desafio para o tratamento. Em hospitais é vista a necessidade de administração de doses elevadas de antifúngicos, o que aumenta o risco de toxicidade por estes fármacos. Diferentes estudos abordam a problemática que permeia a busca por novos antifúngicos e possíveis soluções para o problema, como a associação sinérgica entre os antifúngicos atuais e novos compostos, principalmente aqueles provenientes de fontes naturais [72-74].
Os compostos de fonte natural (resumidos na tabela 4), inclusive aqueles que já apresentam algum uso na medicina popular, são potenciais candidatos como agente antifúngico (baixas CIMs ou CFMs). Estes compostos apresentam mecanismo de ação, ao menos em parte, relacionados à indução de um EO na célula fúngica, que demonstra ser um novo alvo terapêutico com menores propensões à resistência microbiana.
Tabela 4 Compostos de ocorrência natural com atividade antifúngica e mecanismo de ação dependente do acúmulo de EROs ou ERNs endógenos.
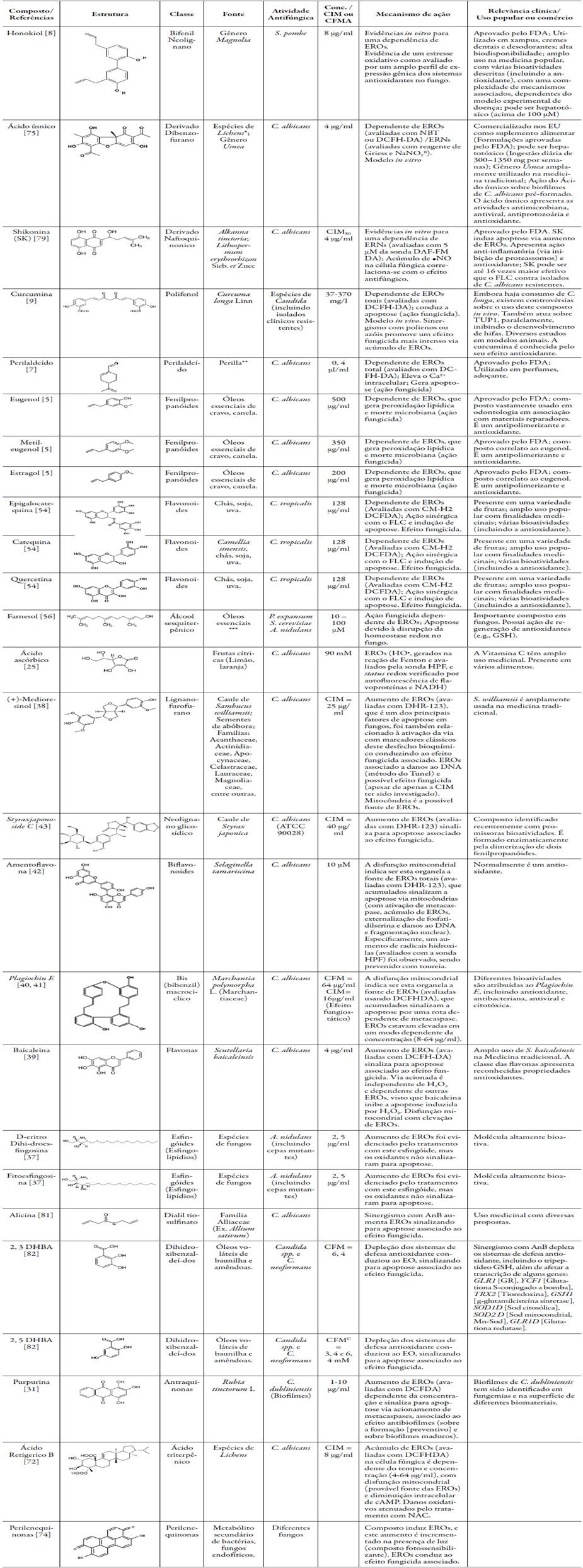
*Também observado em outras poucas espécies não Lichens de ascomicetos
**Família Lamiaceae, também encontrado em uma variedade de outras plantas (incluindo óleos essenciais);
***Da flor de tília, óleo de grãos de almíscar, óleo de neroli e óleo de petitgrain, entre outros.
ANa maior parte dos casos, esta é a concentração que induziu EROs/ERNs mais intensamente, em raros casos, os valores foram bem próximos.
AAvaliação de um intermediário reativo, o nitrito, uma estimativa da produção de ERNs.
CComposto puro (não na associação).
Observação: Notar que alguns indutores de EROs/ERNs na célula fúngica são, na verdade, antioxidantes, sendo que o paradoxo efeito pró-oxidante destes com-postos podem estar associados a uma possível pleiotropia (mecanismos de ação paralelos que gerem oxidantes) ou metabolismo/sistemas de regeneração (balanço entre as formas oxidadas e reduzidas; status redox do sistema biológico) ou uso de altas concentrações (revisado em [25, 55]). As estruturas químicas representadas foram retiradas do CAS, ou dos artigos aqui referenciados (entre parêntesis) ou desenhadas com auxílio do ACD/Labs (Advanced Chemistry Development Inc., version 6.0).
Como exemplos, o ácido úsnico é um composto de ocorrência natural que tem sido utilizado para uma variedade de finalidades terapêuticas, sendo que, recentemente, seu potencial antifúngico foi reportado (como será discutido na seção perspectivas) [75]. Como outro exemplo, Tian et al. [7] demonstraram que um perilaldeído (PAE), proveniente de Perilla frutescens, apresentou CIM de 0, 4 μL/mL contra C. albicans. O mecanismo de ação antifúngico foi demonstrado ser dependente de uma elevação intracelular de Ca2+ e um acúmulo de EROs, de provável origem mitocondrial. Eventos característicos de apoptose foram observados, como disrupção do potencial de membrana mitocondrial, externalização de fosfatidilserina e desprendimento de citocromo c. Ainda, um padrão característico de fragmentação nuclear e danos ao DNA confirmou a indução de apoptose mediada por EO induzido por PAE.
Khan et al. [5] demonstraram que o eugenol (CIM90 = 500 μg/mL), metil eugenol (CIM90 = 350 μg/mL) e estragol (CIM90 = 200 μg/mL), três fenilpropanóides provenientes de óleos essenciais, causam EO em C. albicans (ATCC 90028) culminando em peroxidação lipídica e consequente desarranjo da membrana fúngica com desfecho em morte celular. A peroxidação lipídica aumentou até 4 vezes na presença de concentrações que variaram de 10-100 μg/mL destes compostos, sendo que a sequência da capacidade oxidante foi: metil eugenol > eugenol > estragol. O incremento nos sistemas de defesa antioxidante de C. albicans, como demonstrado pelos autores, foi ineficiente para controlar os danos oxidativos.
De acordo com Wang & Shen [8], o honokiol, um composto isolado de algumas plantas do gênero Magnolia, provou exercer ação antifúngica contra Schizosaccharomyces pombe, com atividade dependente da concentração (0-8 μg/ml) e relacionada à produção de EROs. Este estudo também demonstrou que 512 genes são hiperexpressos e 42 hipoexpressos, sendo que, entre os hiperexpressos, 45% pertencem aos sistemas de defesa antioxidante do fungo.
Interessantemente, Liou et al. [76] demonstraram que, in vitro, concentrações de 0, 1-10 μM de honokiol inibiram o burst oxidativo de neutrófilos de rato, causando marcante diminuição de EROs induzidas por acetato miristato de forbol (PMA, 20 nM) ou N-fformil-metionil-leucil-ffenilalanina (fMLP, 1 μM). Este é um exemplo de efeito contrário a elevação dos níveis de EROs em fagócitos que é atribuído ao honokiol, contrastando com o efeito pró-oxidante (aumentando os níveis de EROs) exercidos na célula fúngica. Esta dualidade na ação deste composto, independente do seu status redox, pode ser atribuída, ao menos em parte, as diferentes concentrações usadas nestes estudos. Além disso, foi demonstrado no mesmo estudo que o honokiol (0, 1-10 μM) impede o influxo de cálcio induzido por tapsigargina (um composto que acelera a montagem dos componentes de Nox2), portanto, também se constituindo como uma proteção contra o aumento de EROs. Outras bioatividades, para o honokiol, têm sido descritas em concentrações de até 10 ,M [77].
Sharma et al. [9] demonstraram que curcumina (37-370 mg/L), um poliffenol presente em uma variedade de vegetais, apresenta significativa atividade antifúngica (CIMs variando na faixa testada de acordo com o microrganismo) contra espécies do gênero Candida (incluindo C. albicans, C. krusei, C. tropicalis, C. parapsilosis, C. kefyr, C. dubliniensis, C. glabrata, C. utilis e uma variedade de isolados resistentes a alguns antifúngicos e mutantes), cujo o mecanismo de ação dependente de EROs conduz a apoptose. Elevação na expressão dos sistemas de defesa antioxidante foram observados (CAP1-1, CaIPF7817, SOD2, GRP2 e CA77), embora não efetivos. Os autores concluíram que a curcumina pode gerar EO e causar apoptose na célula fún-gica, além de inibir o desenvolvimento de hifas por paralelamente e, independente dos níveis de EROs, atuar sobre TUP1. Cabe ressaltar que, como um antioxidante, o efeito esperado para ação da curcumina seria o oposto, ou seja, a prevenção no aumento de EROs. Contudo, as altas concentrações usadas (efeito dependente da concentração) ou os mecanismos redox e de regeneração (ciclo catalítico) durante a atividade do composto em um contexto biológico, podem gerar um quadro pró-oxidativo, como já discutido anteriormente [55].
Como aqui já discutido, o HO• pode ser formado em fungos via reação de Fenton. Recentemente, Avci et al. demonstraram que o tratamento de C. albicans com 90 mM de ascorbato pode diminuir a viabilidade celular, através de um efeito pró-oxidante originário exclusivamente na reação de Fenton (promovendo a regeneração do Fe3+ a Fe2+, gerando o radical ascorbato, e prorrogando o ciclo, favorecendo a formação de HO• a partir do H2O2). Este efeito é dependente da temperatura, oxigenação, disponibilidade de fontes de energia e condições do meio e fase de crescimento do fungo [25]. O aumento intracelular de HO• causado pelo ascorbato foi correlacionado a atividade fungicida e, não houve influência de um inibidor mitocondrial, a antimi-cina A (10 μM), mas sim pelo tratamento com 500 μM de BIP, demonstrando que, neste caso específico, o EO via mitocôndria foi considerado irrelevante para tal atividade. Quanto a este efeito, os autores comentam que, embora a vitamina C seja um antioxidante existe evidências de um provável efeito pró-oxidante nas concentrações farmacológicas (como a usada, 90 mM), fruto da formação de HO•, efeito este referido como de "rebote", sendo amplamente relatado para as altas doses. Além disso, atuando sobre tal via, o ascorbato pode regenerar o ferro e intensificar a formação de outras EROs (mecanismos de reciclagens que favorecem um efeito pró-oxidativo).
Por outro lado, Goswami et al. [60] demonstraram que 10 mM de ácido ascórbico apresenta efeito antioxidante protegendo Escherichia coli da ação de oxidantes (EROs totais) induzidos pelo ciprofloxacino, um antibiótico conhecido por gerar quadro de EO no microrganismo como parte de sua letalidade. Além disso, Khalil et al. [78] reportaram que em concentrações de no máximo 250 μg/ml, o ácido ascórbico não apresenta atividade antifúngica frente C. albicans, mas pode incrementar as atividades antifúngica e antioxidante da curcumina.
Liao et al. [79] mostraram que o shikonina (SK), um composto natural que pode ser isolado de Lithospermum erythrorhizon, promove intensa formação endógena de •NO em C. albicans, de maneira dependente do tempo e concentração, e isto é associado ao efeito antifúngico. A adição de doadores de •NO, como a S-nitrosoglutationa (GSNO) ou L-arginina, pode incrementar a atividade do SK contra C. albicans, enquanto, a adição de um inibidor da produção de •NO, o L-NAME, atenuou a ação antifúngica. Como esperado, uma hiperexpressão do gene YHB1 foi evidenciado em células fúngicas tratadas com SK. Complementando este achado, o mutante nulo YHB1 (yhb1∆/∆) exibiu alta sensibilidade ao SK. Os autores sugerem que a ação de SK in vivo poderia impulsionar também a ação de fagócitos frente ao fungo, desde que tais células usam a produção de •NO para combater patógenos. Ainda, a utilização de compostos que possam induzir •NO em focos infecciosos demonstra ser uma estratégia promissora na terapêutica, desde que este composto apresenta atividade antimicrobiana também contra o Staphylococcus aureus resistente a meticilina, E. coli, Klebsiella pneumoniae, Pseudomonas aeruginosa e Salmonella spp. [79].
Outros compostos naturais são destacados na tabela 4, como o ácido retigerico B [72] e perilenequinonas [74], que também conduzem ao acúmulo de EROs associado ao efeito fungicida. O (+)-medioresinol [38], o styraxjaponoside C [43], a amentoflavona [42], o plagiochin E [40, 41], e a purpurina [31] (com destaque para a sua ação anti-biofilme) elevam as concentrações de EROs e sinalizam para apoptose, culminando na atividade antifúngica com marcantes CIMs, sendo que pode ocorrer disfunção mito-condrial em alguns casos.
Com relação à associação sinérgica entre produto natural e antifúngico tradicional, estudos têm demonstrado que a curcumina (composto já discutido aqui [80]), alicina [81] e a baicaleina [39] frente à C. albicans, e alguns dihidroxibenzaldeidos (2, 3 DHBA e 2, 5 DHBA) contra Candida spp. e Cryptococcus spp. [82], podem incrementar o efeito fungicida da AnB via um acúmulo de EROs na célula fúngica. Como aqui já discutido, alguns flavonoides podem incrementar a ação antifúngica do FLC dependente de EROs.
Imunomodulação como uma possível ação potencializadora do efeito antifúngico in vivo
A esta altura, cabe aqui fazer uma clara distinção entre a indução por alguns compostos, da produção exacerbada de EROs/ERNs diretamente na célula fúngica, de uma possível modulação de fagócitos ou outras células, in vitro ou in vivo, para gerar EROs/ERNs e, consequentemente, facilitar a ação fungicida. Neutrófilos, monóci-tos/macrófagos (MΦ) e outras células fagocíticas geram EROs/ERNs que, em altas concentrações, podem ser tóxicas para maioria dos patógenos fúngicos, causando danos às proteínas, DNA e lipídeos, sendo o complexo enzimático NADPH oxidase (isoforma Nox2) responsável pela produção inicial de O2 •- a partir do O2 [19, 21, 83].
Diferentes células, incluindo as provenientes de humanos, plantas e fungos, podem aumentar a produção de EROs/ERNs, sob certas circunstâncias, mas o termo burst oxidativo (explosão respiratória) é mais bem definido e aplicável ao aumento repentino do consumo de O2 principalmente por ffagócitos (principalmente os neutrófilos, com aumento de até 20 vezes na captação de O2) que não é refletido em produção energética, mas sim na rápida e alta produção de O2 •- pelo sistema Nox 2, quando este complexo enzimático é acionado por estímulos adequados (como os microbianos, químicos ou físicos) e na sequência montado para produzir tal oxidante (figura 7) [84, 85]. Até aqui, nós destacamos que a produção excessiva de EROs/ERNs por indutores, não se relaciona, exceto quando notado, ao burst oxidativo, mas sim a específicos contextos que também dependem do balanço entre os oxidantes induzidos e os sistemas de defesa antioxidante na célula fúngica.
Ainda em ffagócitos, a partir do O2 •-, são formados intermediários mais reativos, tais como o H2O2 e, através da ação da enzima mieloperoxidase (MPO), o HO•, o ácido hipocloroso (HOCl, gera o ânion hipoclorito [OCl-]) e o oxigênio molecular singleto (1∆g O2), que, são altamente reativos e potentes antimicrobianos. Ainda, com ativação da enzima óxido nítrico sintetase induzida (iNOS) que utiliza a arginina como substrato (e NADPH e O2), o •NO formado reage rapidamente com O2 •-, originando o ONOO-, um potente antimicrobiano [86, 87]. A importância do complexo NADPH oxidase e formação de EROs/ERNs na defesa contra fungos é notória, visto que, em pacientes com doença granulomatosa crônica (DGC), uma condição genética que conduz a perda de funcionalidade deste complexo, as infecções por fungos oportunistas são recorrentes e as taxas de mortalidade elevadas [87].
Dante disto, é notório que compostos/outros agentes que possam induzir EROs/ ERNs em fagócitos, para uma ação antifúngica, sob certas circunstâncias, também são desejáveis, como visto em prévios estudos. Assim, os agentes indutores de EO devem ser planejados considerando-se também as ações in vivo, com possível acionamento da produção de oxidantes em outras células/alvos, podendo até mesmo, sob algumas circunstâncias, ser considerado um co-efeito desejável para a ação antifúngica.

Legenda: Após ser ativado por um estímulo/indutor apropriado, o sistema Nox2 do fagócito, seja na membrana plasmática (forma oxidantes extracelulares) ou fagossomal (forma oxidantes intracelulares), é montado e gera O2 •- a partir O2. Em seguida, o O2 •- pode por ação enzimática (via SOD) ou espontaneamente gerar H2O2. Reações subsequentes envolvendo o H2O2 conduzem a formação de outras EROs mais potentes (HO•, OCl-, 1O2) seja pela ação da MPO ou na reação de Fenton. Ainda, o O2 •- pode interagir com o •NO para gerar ONOO-. Como mostrado na figura, alguns destes oxidantes, formados pelos fagócitos, podem causar danos diretos ao microrganismo (normalmente os mais potentes: ONOO-, HO•, OCl-, 1O2), acionar proteínas ou peptídeos com ação antimicrobiana (como exemplo, o H2O2 que modula alostericamente proteínas ou O2 •- que promove uma ativação redox de proteínas), ou sinalizar (O2 •-, H2O2, OCl-, 1O2) para o desprendimento de armadilhas extracelulares que podem capturar e matar o microrganismo (estruturas compostas por cromatina descondensada e grânulos proteicos com ação antimicrobiana, que são nomeadas de acordo com o fagócito que as formam: armadilhas extracelulares de neutrófilos [NETs], de monócitos/macrófagos [METs], de eosinófilos [EETs] ou de mastócitos [MCETs]).
Figura 7 Efeitos da ativação do sistema Nox2 de fagócitos por indutores/estímulos.
Como exemplos, não apenas restrito a agentes químicos, além da conhecida direta ação antifúngica da inativação fotodinâmica contra células planctónicas e biofilmes ffúngi-cos gerando EO/EM [26, 88-91], para uma imunomodulação, nosso grupo de pesquisa tem demonstrado que, sob influência do LASER de baixa potência (laserterapia [LT], comprimentos de onda (λ) de 660 e 780 nm), neutrófilos aumentam o burst oxidativo contra C. albicans ou P. brasiliensis, consequentemente, aumentando a atividade fungicida, sendo a LT considerada uma viável alternativa terapêutica contra as infecções fúngicas superficiais [92]. De relevância clínica, a LT também poderia ser utilizada in vivo para a eliminação de biofilmes fúngicos superficiais e, principalmente, em superfícies de dispositivos médicos, tais como cateteres, desde que esta alternativa também é capaz de induzir o aumento de EROs diretamente em fungos.
Quanto aos clássicos agentes antifúngicos, Roilides et al. demonstraram que a AnB pode induzir o burst oxidativo de neutrófilos, aumentando ainda mais a sua efetividade fungicida in vivo contra conídeos de A. fumigatus [93]. Também, Tohyama et al. demostraram que MO murinos podem aumentar a produção de •NO, TNF-α e IL-1 sob influência da AnB, dessa forma, incrementando a ação anti-Criptococcus spp. [94]. A combinação de AnB e IFN-ү conduz a uma marcante ação anti-Candida spp. de MΦ, mas que pode ser independente de EROs/ERNs, indicando que este agente antifúngico pode também agir através de diferentes vias como um imunomodulador [95]. Estes achados são confirmados pelos estudos de Chapman e Hibbs [96]; Wilson et al. [97], que mostraram que a AnB pode se ligar a membrana de fagócitos e provocar mudanças conformacionais do complexo NADPH oxidase e, consequente acionamento, por exemplo, reforçando o burst oxidativo induzido por PMA, um clássico agente químico ativador deste evento.
Interessantemente, Arana et al. [59] encontraram que concentrações subliminares do FLC pode elevar a defesa antioxidante de C. albicans (incremento na expressão gênica de TRR1, GRE2 e YHB1 como uma resposta adaptativa) e, consequentemente, favorecer a sobrevida do fungo (proteção in vitro), tendo uma repercussão funcional na interação deste microrganismo frente a ffagócitos do hospedeiro humano (provável proteção in vivo), no que diz respeito à detoxificação de oxidantes gerados durante o burst oxidativo e consequente proteção quanto à ação antifúngica destas células. Esta prévia sensibilização, pode gerar um priming de mecanismos de defesa antioxidante no fungo.
Contudo, conforme um estudo conduzido por Kos et al. [98], in vivo, provavelmente, o estresse catiônico promovido por ffagócitos pode atuar sinergicamente com o burst oxidativo para promover o killing de C. albicans, como confirmado por análises do perfil de resposta antioxidante deste fungo. Estas análises mostraram que a expressão e acúmulo do gene CAP1 pode ser alterada sob tais condições, portanto, não protegendo o fungo da ação microbicida de EROs. O autor comenta que este mecanismo micro-bicida combinatório de fagócitos (EO somado ao estresse catiônico), pode ser um efetivo mecanismo de contra-ataque dos fagócitos aos achados de Arana et al. [59], que demonstraram a chamada "proteção cruzada contra o EO", onde uma prévia exposição ao EO (exposição subinibitória) leva a proteção do fungo. Além disso, também evidenciado as diferenças entre in vitro e in vivo, Hazen et al. [99] já haviam relatado que concentrações subinibitórias do FLC, administradas em um longo prazo, podem contribuir com a resistência a candidemia, em que foi avaliada a fagocitose e atividade fungicida (in vitro) de neutrófilos isolados de pacientes imunocompetentes e previamente tratados com FLC. Estas divergências entre estudos, quanto ao desfecho clínico, talvez, em parte, possam explicar a controvérsia quanto ao uso profilático de baixas doses do FLC.
Resistência frente aos antifúngicos e aumentos em virulência e patogenicidade relacionadas a uma prévia resistência ao estresse oxidativo
Mundialmente, a resistência aos antifúngicos, somado a um inadequado diagnóstico do agente causal de infecções, são os maiores problemas no tratamento de IFIs, sendo as taxas de mortalidade nestes casos reportadas entre 20 e 90% para patógenos ffúngicos oportunistas, incluindo C. albicans, C. neoformans e A. fumigatus [31, 100]. Resistência aos azóis (principalmente FLC) tem sido relatado em cepas de fungos expressando consideráveis concentrações de oxidoredutases, como visto em perfis genômicos, trans-criptômicos e metabolômicos (bioquímicos/funcionais), principalmente associados aos genes GPX1 e CDR. Isto reforça que, como parte de seu mecanismo de ação, esta classe de antifúngicos conduz a formação de EROs/ERNs e consequente efeito fungicida. Além disso, cepas resistentes aos antifúngicos expressando altas taxas dos genes IPF10565, ALD5, SOD e CAT tem sido reportada [59, 61]. Como já discutido nesta revisão, Paul et al. mostraram que resistência em C. neoformans ao FLC é correlacionada a hiperexpressão do gene YAP1 e consequente resistência ao EO promovido por este antifúngico [27].
Como visto aqui, exposição de C. albicans a concentrações sub-inibitórias de FLC pode proteger este microrganismo de uma subsequente ação de fagócitos. Este fato relacionase ao fato que, FLC a baixas concentrações, induz quadro de EO mais brando na célula fúngica, com posterior sobrevida e montagem adequada de uma resposta antioxidante, primando o fungo e o favorecendo frente à ação de oxidantes gerados pelos fagócitos.
Diante deste contexto, é plausível que cepas de fungos que expressem naturalmente altas concentrações de enzimas com atividade antioxidante possam favorecer o microrganismo em ambos os contextos, frente à ação de antifúngicos que possam induzir EROs ou ERNs ou frente à resposta microbicida de fagócitos, tendo um notório impacto na virulência e patogenicidade da cepa em questão. Além disso, Navarathna et al. demonstraram que concentrações subinibitórias de FLC aumentam a patogenicidade de C. albicans em um modelo animal de candidíase disseminada, também evidenciando que os efeitos do FLC são estritamente dependentes da concentração [101].
Em linha com os achados de Arana et al. [59], que demonstram que uma proteção cruzada contra o EO, previamente induzido por concentrações subinibitórias de FLC, desfavorecendo o hospedeiro, Kohanski et al. [102] já haviam demonstrado que concentrações sub-letais de alguns antibióticos podem elevar os oxidantes em bactérias e dessa forma induzir mutagênese, tendo como consequência, uma resistência a múltiplos antimicrobianos.
Segundo Brown et al. [20], em C. albicans, a proteína Cta4p é requerida para resistência a ERN, Hog1p, Ssk1p, Sho1p, Capp e Skn7p a ERO e, Pde2p a ERO/ERN. Em Sho1p, SakAp, Skn7p e Yap1p (contra H2O2).
Alguns mecanismos podem ser considerados paralelos para a defesa do fungo contra EROs/ERNs. Como exemplos, na presença de aumentados níveis de EROs/ERNs, além dos sistemas de defesa antioxidante enzimáticos serem acionados, a autofagia é uma forma do fungo preservar biomoléculas e organelas danificadas pela oxidação, de modo que os lisossomos promovem uma intensa recuperação celular. Aproximadamente 33 genes são relacionados à autofagia (GRAs) em fungos, em resposta ao EO/EN. Este mecanismo de defesa em fungos é semelhante aqueles observados em patologias humanas envolvendo resposta ao EO/EN, como ocorre nas doenças neurodegenerativas [33]. A mitofagia é uma autofagia envolvendo a mitocôndria e tem sido observada em casos de EO com disfunção mitocondrial (em que esta orga-nela é a provável maior fonte de EROs) [33]. Ainda, o fungo pode acionar a via proteolítica do sistema ubiquitina-proteassoma (UPS), visando degradar e remover proteínas oxidadas. Embora este mecanismo seja restrito a proteínas dispersas no citoplasma fúngico, proteínas oxidadas ou desdobradas de origem no RE, podem migrar e sofrer este processo de degradação, inclusive naqueles casos de EO relacionado a esta organela [33].
Perspectivas
Diante do exposto, é notório que, a indução do EO ou EN, seja diretamente na célula fúngica ou em fagócitos, pode representar um potencial novo alvo terapêutico. Além disso, este novo mecanismo seria de grande utilidade para conter doenças infecciosas que estão relacionadas à formação de biofilmes, uma vez que a formação de biofilmes por fungos é um sério agravante que dificulta a ação dos antifúngicos, e eleva as taxas de morbimortalidade associadas à doença.
Delattin et al. reportaram sobre o mecanismo de ação dos clássicos antifúngicos MN e AnB contra biofilmes por espécies de Candida [100]. De nota, a formação de biofilmes por cepas mais virulentas de C. albicans, normalmente envolve aumento na capacidade de defesa antioxidante pelo microrganismo. Como revelado por estudos proteômicos conduzidos por Seneviratne et al. [102-103] e por Bink et al. [104]. Linhares et al. [61] encontraram um aumento na defesa antioxidante de C. albicans e C. dubliniensis resistentes a dois antifúngicos, FLC e AnB. Células destas cepas, em biofilme, demonstraram expressar diferencialmente SOD e catalase em resposta ao EO [61].
Existem diversas variáveis a serem consideradas quando o alvo indução de EO ou EN são levados em conta, além do já mencionado elaborado arsenal de defesa antioxidante lançado pelo fungo. Para Brown et al. [20], maior resistência ao EO em espécies de Candida spp. (principalmente C. albicans e C. glabrata) é mais comum in vitro na ffase estacionária, demonstrando que durante o crescimento o fungo apresenta expressão differencial de proteínas chave na defesa frente ao EO. Assim, a resistência ao EO é associada à diminuição nas taxas de multiplicação das células fúngicas.
Mesmo neste contexto, as perspectivas são enormes para estes mecanismos. Sendo assim, não apenas restrito a atividade sobre células planctónicas, Peralta et al. [75] demonstraram que o ácido úsnico (4 μg/mL), um composto natural que foi obtido de Usnea amblyoclada, apresenta ação sobre biofilmes maduros de C. albicans resistente aos azóis, diminuindo em até 71% a massa e espessura desta estrutura. Os autores reportaram que este efeito foi relacionado a um prévio EO e EN induzidos pelo ácido úsnico, apresentou aumento de EROs/ERNs até 30 vezes maior que os controles. A respeito do aumento de EROs/ERNs, os autores demonstram que EROs são formados tanto no ambiente extra-celular do biofilme (avaliados no sobrenadante com o teste do NBT), quanto intracelu-larmente em C. albicans (avaliados por uma sonda que permeia a membrana e detecta todos os tipos de oxidantes, a DCFH-DA), cogitando que os danos associados aos EO e EN podem comprometer a integridade celular, bem como promover danos a componentes extracelulares essenciais ao biofilme, como os polissacarídeos.
Além disso, Peralta et al. [75] demonstraram que os sistemas de defesa antioxidantes enzimáticos (como exemplo, Sodp) e não enzimáticos de C. albicans estavam aumentados em resposta ao tratamento com ácido úsnico, confirmando que houve aumento de EROs/ERNs. Os autores propõem o ácido úsnico como uma alternativa para o tratamento de inffecções as quais ocorrem à formação de biofilmes de C. albicans.
Através de estudos transcriptômicos, Cremer et al. [105] mostraram os perfis de vários genes relacionados a sistemas antioxidantes em C. albicans que são alterados a longo prazo (até 24h) durante a atividade antibiofilme do MN, posteriormente, confirmando que houve um marcante e essencial aumento de O2 •- correlacionado com a atividade (demonstrado com o uso de compostos sinérgicos para induzir O2•-, usando também um mutante triplo para Sodp, ou o inibidor desta enzima, o N-N'-dietilditiocarbamato). Elevados níveis de expressão de genes para mediadores de rotas da biossíntese do ergosterol (ERG6, ERG251, ERG3 e ERG2) e bombas de efluxo (CDR2 e orf19.4531) foram verificados (expressões gênicas reguladas desde um curto prazo de exposição ao MN, ou seja, a partir de 4 horas). Interessantemente, contrastando com outros achados, após 4 ou 24 horas, a maioria dos genes relacionados ao sistema de defesa antioxidante de C. albicans não foram induzidos significativamente (repressão de CAT1), o que pode ser explicado por um efeito pleiotrópico deste antifúngico em elevar os níveis de EROs e regular a expressão gênica, culminando em níveis elevados dos oxidantes e reforçando o efeito fungicida (o sistema de defesa antioxidante do fungo também seria um alvo). De nota, apenas SOD5 foi induzido em C. albicans, após 24 horas de exposição ao MN, provavelmente, para conter o marcante acúmulo de O2•-.
Como mostrado nesta revisão, o campo de estudo englobando a indução de EO ou EN como um novo alvo na busca por novos antifúngicos tem sido explorado, não apenas restrito a busca de novos compostos de variadas fontes naturais ou sintéticos (estes últimos, fugindo do escopo desta revisão, mas destacado na literatura), mas também tentando elucidar o mecanismo de ação de tradicionais antifúngicos [100, 106, 107]. Desde que a resistência ao EO/EN em fungos também pode ocorrer (vias sistemas de defesa antioxidante), elucidar os mecanismos subjacentes torna-se também essencial. Das aproximadamente 400 espécies fúngicas patogênicas para humanos [20], as dos gêneros Candida spp. e Cryptococcus spp. foram as mais reportadas nesta revisão.
Como limitações dos estudos avaliados, grande parte destes não avaliaram as específicas fontes de EROs/ERNs dentro da célula fúngica (com exceções) bem como os específicos oxidantes produzidos, discriminando se, estes oxidantes, são gerados pela ação direta dos indutores em tradicionais vias (fontes) endógenas de EROs ou ERNs estão criando fontes, como parte do mecanismo de ação ou metabolismo do composto pelo fungo. Além disso, nós entendemos as limitações metodológicas que permeiam a identificação de oxidantes relacionados aos EO e EN, bem como a avaliação de eventos relacionados, como os danos a biomoléculas e o desfecho associado, a ação antifúngica.
Cabe ressaltar que, muitas substâncias naturais reportadas aqui apresenta, normalmente, atividade antioxidante e, o paradoxal efeito pró-oxidante promovido por estes compostos, são frutos de seus ciclos redox ou concentrações no ambiente biológico/ celular fúngico, fugindo de o escopo desta revisão acentuar os mecanismos mais detalhados deste efeito pró-oxidante, mas que podem ser revistos em prévios estudos [25, 55, 108]. Existem inúmeras barreiras a serem transpostas entre os estudos in vitro e em determinados modelos experimentais in vivo e a implementação destes "antioxidantes" na terapêutica de infecções fúngicas em humanos, para que o mecanismo antifúngico em doses compatíveis com os estudos preliminares seja alcançado sem danos ao hospedeiro. Notoriamente, embora seja destacado o efeito pró-oxidante destes compostos para induzir EO/EN na célula fúngica, com concentrações/doses e mecanismos específicos, em humanos, estes compostos poderiam exercer efeito dual de acordo com a especificidade da célula alvo, desde que o ciclo redox destes antioxidantes sofra grandes influências do contexto de cada meio, em que diferentes tipos celulares reagiriam com um dos dois possíveis desfechos: efeito pró-oxidante ou antioxidante. Ainda, um efeito destes antioxidantes a altas concentrações, por si só, poderia levar a um quadro de estresse redutivo, ou induzir uma resposta antioxidante exacerbada do hospedeiro, via o fator de transcrição Nrf2, como tem sido descrito em pacientes com predisposição genética ou sob certas condições [108-111].
Também, a aplicabilidade clínica de certos compostos depende de complexos fatores in vivo, como os fatores farmacocinéticos, e de outros fatores que envolvem cores-posta dos fungos aos outros tipos de estresses in vivo (perfil funcional de resistência cruzada), como as alterações de pH, temperatura, osmolaridade, pressão e, principalmente, disponibilidade de fontes de O2 e de nitrogênio. Estudos destes compostos em modelos experimentais mais fidedignos, in vivo, podem lançar luz sobre a possível ação antifúngica envolvendo um EO ou EN neste contexto, desde que não haja extensão dos danos ao hospedeiro. Além disso, os desafios que normalmente são encontrados para a implementação na terapêutica de um novo composto de fonte natural devem ser superados [112].
A literatura é divergente sobre os efeitos de EROs/ERNs e os EO/EN associados serem microbiostáticos ou microbicidas [113]. Independente do efeito, a participação de oxidantes no mecanismo de ação de determinado antifúngico não é descartada, e efeito clínico associado, fungistático ou fungicida, parece ser mais bem entendido tendo como base os dados apresentados na figura 4. Desde que um EO/EN com sutis aumentos de EROs/ERNs induzem uma morte celular mais branda (como exemplo, a apoptose), o efeito in vivo, em curtos intervalos de administração do antifúngico, mais provavelmente seria fungistático. Por outro lado, na indução de um EO/EN mais intenso, com elevados níveis de oxidantes, o desfecho clínico mais provável seria uma ação fungicida, mesmo nas primeiras horas de administração do agente terapêutico.
Por fim, para aqueles antimicrobianos que utilizam a produção de EROs/ERNs durante seu mecanismo de ação, destaca-se que doses subinibitórias (sub-letais) de antimicrobianos podem elevar, paralelamente a outros efeitos, a resposta antioxidante do microrganismo previamente exposto. Isto poderia diminuir ou tornar ineficaz a atividade antimicrobiana em uma utilização futura do antimicrobiano (mesmo que em doses recomendadas), uma vez que o prévio priming (causado pela dose sub -letal) elevaria a resposta antioxidante do microrganismo para a detoxificação das ERO/ERN [114-119].
CONSIDERAÇÕES FINAIS
Após estabelecer um claro conceito de estresse oxidativo e nitrosativo, bem como examinar as metodologias quanto à adequação para avaliar tal evento bioquímico, foi demonstrado nesta revisão sistemática que um considerável número de publicações aborda os temas "indução de EO ou EN como parte do mecanismo antifúngico". Os argumentos para comprovar a participação de EROs ou ERNs na atividade antifúngica incluem: quantificação destes oxidantes, análises de sistemas de defesa antioxidante do fungo, aferições dos danos a biomoléculas causadas por EROs/ERNs, além do uso de antioxidantes exógenos atuando como scavengers de oxidantes para impedir o EO/EN e danos oxidativos associados.
A questão se EROs/ERNs geram efeito fungicida preferencialmente que o fungistá-tico ainda está aberta, em um contexto em que estes oxidantes também podem paralelamente sinalizar eventos apoptóticos por diferentes vias (dependentes ou não de caspases). A sinalização de apoptose pode estar também relacionada à específica fonte de EROs estimulada pelo indutor, que determinara o acionamento de vias paralelas devido a um ou mais oxidantes específicos serem produzidos e, em concentrações apropriadas (como exemplo, o H2O2 é um bom indutor de apoptose). O link entre indução de EROs mitocondrial e o controle do balanço redox para a produção de H2O2 parece ser fundamental para a ativação do apoptose via mitocondrial (interação citocromo c e metacaspase).
Um claro link entre estresse oxidativo ou nitrosativo e a atividade antifúngica (com marcantes e promissoras CIMs ou CFMs) tem sido firmado na literatura recente, tanto para aqueles agentes antifúngicos já utilizados na prática clínica para o tratamento de infecções fúngicas em humanos, quanto para possíveis candidatos a fármaco (resumido na figura 8). Portanto, a indução do EO ou EN como parte do mecanismo de ação demonstra ser importante alvo terapêutico, com perspectivas favoráveis sobre os desfechos na prática clínica. Contudo novos estudos (incluindo os metabolômicos) devem ser conduzidos para um melhor entendimento a nível molecular do efeito global deste evento na célula fúngica, bem como as possíveis repercussões para o hospedeiro.

Figura 8 Representação esquemática das possíveis rotas de formação das EROs/ERNs na célula fúngica induzidas por clássicos agentes antifúngicos ou novos compostos.
Muitas publicações (22 artigos) encontradas nesta revisão destacaram o link entre o aumento de EROs/ERNs associado ao efeito de clássicos antifúngicos, o que demonstra uma preocupação em elucidar o completo mecanismo de ação destes agentes terapêuticos, na tentativa de também entender melhor como a resistência a estes antifúngicos são alcançadas por parte dos fungos. Assim, a possível associação sinérgica entre compostos de origem natural e clássicos antifúngicos tem sido avaliada.
Quanto aos compostos de fontes naturais induzindo EROs/ERNs como parte de seus mecanismos antifúngicos (32 artigos encontrados) contra células planctônicas ou biofilmes, aqueles provenientes de plantas foram os mais ffrequentes. Normalmente, a maiorias deles são antioxidantes (principalmente os flavonoides), mas por conta das concentrações utilizadas ou o ciclo redox dentro da célula fúngica, estes compostos demonstraram exercer também, um efeito majoritariamente pró-oxidante, elevando as concentrações de EROs ou ERNs e causando o efeito antifúngico. Ainda, muitos indutores de EO é da classe dos lignanos (incluindo neolignanos) e correlatos (os fenil-propanóides), demonstrando um papel importante desta classe na sinalização de um acúmulo de EROs em fungos.
Novos estudos na busca de agentes antifúngicos explorando o status redox devem também focar sobre a especificidade da indução de um EO ou EN contra o fungo e os possíveis efeitos tóxicos para humanos, advindos deste evento bioquímico. Neste contexto, a busca por compostos provenientes de fontes naturais parece plausível, visto que metabólitos secundários são naturais mecanismos de defesa, apresentando, normalmente, uma ação antifúngica, que pode ser via aumento de EROs/ERNs, mas sem causar danos ao hospedeiro e, entender os mecanismos dos EO e EN em fungos pode também ser útil para a formulação de novas combinações terapêuticas entre produtos naturais e antifúngicos clássicos, atuando de maneira sinérgica.

















