Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Colombia Forestal
Print version ISSN 0120-0739
Colomb. for. vol.11 no.1 Bogotá Jan./Dec. 2008
DETERMINANTES DE LA COMPOSICIÓN FLORÍSTICA Y EFECTO DE BORDE EN UN FRAGMENTO DE BOSQUE EN EL GUAVIARE, AMAZONIA COLOMBIANA
Determinants of floristic composition and edge effect in a forest fragment of Guaviare, Colombian Amazon
Determinantes da composição floral e o efeito do borde de um fragmento do bosque de Guaviare, Amazonas Colombiano
Pablo R. Stevenson1 & María Elizabeth Rodríguez2
1,2 Laboratorio de Ecología de Bosques Tropicales y Primatología, Centro de Investigaciones Ecológicas La Macarena, Departamento de Ciencias Biológicas, Universidad de los Andes, AA. 4976, Bogotá, Colombia, pstevens@uniandes.edu.co.
Recepción: Julio 4 de 2008/Aprobación: Septiembre 1 de 2008
RESUMEN
La fragmentación de un bosque genera cambios en muchos aspectos bióticos y abióticos de los parches remanentes. En este estudio se describe la composición florística de un fragmento de bosque en el departamento del Guaviare, Colombia, analizando el efecto de borde y factores abióticos. Se establecieron diez parcelas de 100 x 10 m y se muestrearon todas las especies de árboles con DAP≥ 10 cm. El índice de importancia mostró que las especies con mayores valores fueron Iriartea deltoidea, Croton matourensis y Pourouma minor. Se estableció que las especies cerca al borde corresponden mayormente a plantas pioneras (de semillas pequeñas) y las especies lejos de éste son principalmente de bosque maduro (de semillas grandes). Una ordenación demostró que cada una de las parcelas posee una composición florística relativamente diferente, que no se explica por factores como características del suelo o temperatura, aunque la humedad parece jugar un papel importante. La distancia entre las parcelas tampoco fue un buen predictor de la composición florística, indicando que, cuando se mantienen los dispersores de semillas, la dispersión limitada no opera fuertemente a las escalas espaciales estudiadas. El fragmento estudiado presenta una composición con muchos elementos típicos de un proceso de sucesión, aunque conserva una gran diversidad de especies de los bosques originales. Concluimos que la fragmentación ha ocasionado cambios en términos de la composición florística y se recomienda adoptar medidas para detener este proceso, con el fin de mantener parte de la composición y los procesos ecológicos de los bosques nativos.
Palabras clave: Fragmentación, efecto de borde, plantas pioneras, composición florística, Guaviare.
ABSTRACT
Forest fragmentation generates changes in biotic and abiotic factors of remnants. The aim of this study was to describe the floral composition of a forest fragment in Guaviare, Colombia, in relation to the edge effect and abiotic factors. Ten plots of 100 m x 10 m were established and all tree species (DBH≥10 cm) were sampled. The importance value index showed that the most important species in the fragment were Iriartea deltoidea, Croton matourensis, and Pourouma minor. Additionally, it was established that the species found near the edge were mainly pioneer plants (small seeded species) while the species away from it corresponded primarily to mature forest plants (with large seeds). An ordination demonstrated that each plot had a relatively different floristic composition, which could not be explained by soil composition or temperature. However, humidity seems to play an important role. The distance between plots was not a good predictior of floristic affinities, suggesting that when the seed dispersal vectors are maintained, dispersal limitation has weak effects at the spatial scales studied. The fragment exhibits typical elements of a successional process, although it harbors a high species diversity from the original forest. We conclude that fragmentation has caused changes in terms of floral composition, and its necessary to take measures to stop this process in order to maintain part of the floristic composition and the ecological processes of the native forests.
Key Words: Fragmentation, edge effect, pioneer plants, floristic composition, Guaviare.
RESUMO
A fragmentação de um bosque gera mudanças em muitos aspectos bióticos e abióticos dos remendos remanescentes. No estudo se descreve da composição floral de um fragmento de bosque na região de Guaviare, Colômbia, analisando o efeito de borde e fatores abióticos. Estabeleceram-se dez parcelas de 100 x 10 m e se fez amostras de todas as espécies de árvores com dap ≥ 10 cm. O índice de importância mostrou que as espécies com maiores valores foram Iriartea deltoidea, Croton matourensis e Pourouma menor. Se estabeleceu que as espécies perto do borde correspondem a maioria à plantas pioneiras (de sementes pequenas) e as espécies que estão longe deste são principalmente de bosque maduro (de sementes grandes). Uma ordem demonstrou que cada uma das parcelas possui uma composição floral relativamente diferente, que não se explica por fatores como característicos do solo ou da temperatura, embora a umidade pareça jogar um papel importante. A distância entre as parcelas tampouco foi um bom preditor da composição floral, indicando que, quando se mantém os dispersores de sementes, a dispersão limitada não opera fortemente a escalas espaciais estudadas. O fragmento estudado apresenta una composição com muitos elementos típicos de um processo de sucessão, embora conserve uma grande diversidade de espécies dos bosques originais. Concluímos que a fragmentação tem ocasionado mudanças nos termos da composição floral e se recomenda adotar medidas para deter este processo, com o fim de manter parte da composição e os processos ecológicos dos bosques nativos.
Palavras chave: Fragmentação, efeito do borde, plantas pioneiras, composição floral, Guaviare.
INTRODUCCIÓN
Con el fin de que una planta se establezca en un lugar particular deben ocurrir varios procesos ecológicos e históricos. Primero, generalmente las plantas provienen de una semilla, que para llegar a un lugar particular por medio de procesos de dispersión de semillas tuvo que haberse originado de un parental suficientemente cercano al sitio. Antes de esto, tuvo que ocurrir un proceso histórico (e.g. especiación y migración), que permitió que plantas parentales se encontraran en una zona determinada. Después de la llegada de las semillas ocurre una serie de procesos como la germinación, la depredación y el ataque de herbívoros y de patógenos, que funcionan como filtros ecológicos afectando la supervivencia de las plantas en cada etapa del desarrollo (Nathan & Muller-Landau 2000). Adicionalmente, para que la planta se pueda establecer como adulto, debe tener la capacidad de desarrollarse en el ambiente abiótico del lugar. Por lo tanto, la composición de especies vegetales de un sitio va a depender de esa combinación de historia y filtros ecológicos, relacionados con procesos bióticos (e.g., dispersión, depredación) y abióticos (e.g. características del suelo, humedad, temperatura).
Cuando los procesos de dispersión de semillas son poco efectivos, ocurre el fenómeno de dispersión limitada, que puede generar distribuciones agrupadas de individuos de una misma especie. Estas distribuciones agregadas son típicas en bosques tropicales (Hubbell 1979). Si estos procesos fueran comunes, se esperarían distribuciones muy agrupadas y una composición florística que difiere a medida que aumenta la distancia entre los lugares analizados (Hubbell 2001). Estos patrones son comunes a escalas geográficas grandes, pero no hay muchos reportes de lo que puede ocurrir a escalas más pequeñas.
Es claro que factores bióticos y abióticos influyen en la composición florística de los sitios. Por ejemplo, para varios grupos de plantas en el oeste de la Amazonia se encontró que las afinidades florísticas están relacionadas principalmente con los ambientes abióticos, pero también con la distancia geográfica (Tuomisto et al. 2003). Cuando se encuentra que la distancia geográfica está altamente correlacionada con la afinidad florística, se sugiere fuertemente que los procesos de migración y dispersión son determinantes, tal como se contempla en modelos ecológicos basados en el azar (e.g. Hubbell 2001). Terborgh & Andresen (1998) también resaltaron la asociación entre distancia espacial y afinidad florística en un análisis, basados en géneros de plantas reportadas en parcelas de vegetación en la Amazonia. En Panamá y en el Neotrópico en general también se ha reportado una disminución en la afinidad florística de varias familias de plantas, a medida que se comparan zonas más alejadas (Hubbell 2001, Condit et al. 2002). Por otra parte, varias especies de plantas tienen asociaciones con características abióticas, tanto a escalas pequeñas como amplias (e.g. dentro de parcelas de vegetación o entre diferentes unidades geológicas, respectivamente: Wright 2002). Estos aspectos abióticos pueden cambiar drásticamente cuando ocurren alteraciones antrópicas como la fragmentación de bosques.
Los efectos de borde han sido ampliamente estudiados por los ecólogos debido a su fuerte impacto sobre ecosistemas fragmentados y a su influencia en la estructura y la función de sistemas intervenidos. Estos efectos pueden ejercer cambios importantes en la abundancia de especies y en la regeneración de nichos, además de incidir en la susceptibilidad ante la heterogeneidad ambiental (Hobbs & Yates 2003). En las poblaciones de plantas, los patrones de crecimiento y reproducción se ven alterados por los agudos cambios en el microclima, condiciones del suelo y disponibilidad de agua (Laurance et al. 2002). Casos extremos de estas condiciones alteradas pueden repercutir en la mortalidad o la capacidad de regeneración, debido a que sobrepasan los umbrales de tolerancia fisiológica de las especies locales (Hobbs & Yates 2003). De forma particular, los efectos de borde más impactantes son: el aumento en la intensidad de la luz, el incremento en los disturbios del viento, la alteración en el régimen de temperatura y humedad y el aumento en la población de parásitos estructurales como las lianas (Laurance et al. 2002). Estas últimas se ven favorecidas por las nuevas condiciones reduciendo el crecimiento, reproducción y supervivencia de otras especies. El daño y alta mortalidad que causan de manera sinergética estos efectos se ve reflejado en los cambios en la estructura, composición y diversidad del bosque (Laurance et al. 2002). Los estudios relacionados con fragmentación de bosques han demostrado que el reclutamiento de plantas se intensifica en fragmentos, especialmente cerca a los bordes de éstos (Laurance et al. 1998). Por otro lado, también se ha visto que la composición florística de los fragmentos está sesgada hacia especies de sucesión temprana (Saunders et al. 1991, Laurance et al. 1998).
El objetivo de este estudio fue, primero, determinar cuál es la composición florística de un fragmento de bosque en el departamento del Guaviare en Colombia, para establecer si éste se encuentra constituido principalmente por especies de sucesión temprana o tardía. Segundo, determinar el efecto de borde en términos de la variación florística asociada a sistemas de dispersión y tamaño de las semillas dispersadas. Finalmente, quisimos determinar si la variación florística dentro del fragmento se puede asociar a variaciones en factores abióticos o distancia espacial. Predijimos que la composición florística del fragmento en el Guaviare mostrará una proporción de especies de sucesión temprana mayor que la de especies de bosque maduro, dada la naturaleza fragmentada del lugar de estudio (Laurance et al . 2002). Adicionalmente, esperamos encontrar una mayor proporción de plantas pioneras, con semilla pequeña, hacia los bordes de los parches, donde tienen condiciones lumínicas favorables (Laurance et al. 2002). Los modelos de nicho que incluyen especialización a condiciones abióticas particulares predicen que las parcelas más similares florísticamente van a ser las que compartan algunas condiciones abióticas como características del suelo, humedad o temperatura. En contraste, los modelos neutrales que incluyen los procesos de migración como elementos determinantes predicen una relación negativa entre la afinidad florística de las parcelas y la distancia entre ellas.
MATERIALES Y MÉTODOS
DISEÑO EXPERIMENTAL
El trabajo se llevó a cabo en un fragmento de selva húmeda tropical en la estación experimental El Trueno. Esta estación es manejada por el Instituto Amazónico de Investigaciones Científicas (SINCHI) en el municipio de El Retorno, al sur de San José del Guaviare, Colombia. El fragmento tiene un área aproximada de 118 ha, en donde los valores promedio de precipitación, temperatura y humedad relativa son de 259.2 mm mensuales, 25.9° C y 85%, respectivamente (IDEAM 1999). La zona sufrió un proceso de fragmentación hace varias décadas y la estructura actual del fragmento ha sido bastante similar a la observada en 1994, cuando se realizó un primer trabajo de campo por uno de los autores (P. Stevenson).
En total, se realizaron 10 parcelas de 100 x 10 m (1000 m2), cada una dividida en 10 subparcelas de 10 x 10 m (100 m2). Para el estudio se marcaron y contaron todos los árboles cuyo diámetro a la altura del pecho (DAP) era mayor o igual a 10 cm. Las especies se determinaron de acuerdo a la Guía de frutos de los bosques del Río Duda (Stevenson et al. 2000). También se realizaron colectas que fueron revisadas en el Herbario Nacional Colombiano (COL) y el Herbario Amazónico Colombiano (COAH), donde se depositaron los ejemplares fértiles. La ubicación de 6 de las parcelas fue perpendicular al borde, teniendo en cuenta que la última subparcela se encontrara lo suficientemente lejos de otro borde (distancia mayor a 30 m). Las otras 4 parcelas se establecieron dentro del fragmento, con una distancia mínima al borde de 50 m (Figura 1). Es importante tener en cuenta que dentro del fragmento se encontraron zonas que antiguamente eran cultivos, pero que por su estructura actual no se pueden diferenciar de los otros bosques del área.

ANÁLISIS DE DATOS
Se calculó el índice de importancia de las diferentes especies registradas con base en la densidad, frecuencia y dominancia relativa. La dominancia se cuantificó a partir del área basal de los tallos. Para cuantificar el efecto que el borde genera sobre la flora estudiada, se realizó un análisis del tamaño de la semilla de cada especie encontrada en las primeras seis parcelas. Este análisis se hizo con el fin de establecer si existen patrones diferenciales de distribución de especies en función de la distancia al borde. Para esto, se le asignó a cada especie una categoría de tamaño de semilla basada en el ancho mayor. Cuando no se pudieron medir semillas, se asignó como categoría de ancho el reportado en la literatura (e.g. Roosmalen 1985, Stevenson et al. 2000, Stevenson datos sin publicar). Se consideraron 3 categorías de ancho de semilla (Stevenson & Aldana 2008): pequeña (< 5 mm), mediana (5-10 mm) y grande (>10 mm). Las semillas de mayor tamaño son las que se espera encontrar con mayor frecuencia en el interior del bosque y las de menor tamaño cerca al borde (Foster & Janson 1985). Adicionalmente, se separaron las especies por el tipo de dispersión: biótica o abiótica (viento y explosión mecánica). En ambos casos se realizó un análisis de varianza entre las diferentes subparcelas, utilizando las categorías de ancho de semilla y de tipo de dispersión como factores, y el área basal como variable de salida.
Se realizó una ordenación de escala multidimensional para determinar las afinidades florísticas entre parcelas, basada en la densidad de las diferentes especies. También se realizó una ordenación por medio del Análisis de Correspondencia Canónico (ACC) con el programa XLStat 2008, para verificar las afinidades florísticas entre parcelas y determinar si esta similitud se encuentra asociada con la distancia de la parcela a los bordes, así como con otros factores ambientales y químicos del suelo. La distancia al borde se calculó a partir de la fusión de una imagen satelital y el mapa de los caminos estimado en campo, mediante mediciones y coordenadas de GPS. La Figura 1 muestra la ubicación de las parcelas y del borde. Factores ambientales como el porcentaje de humedad y temperatura se midieron con 10 data-loggers de la marca i-button desde el mes de agosto hasta noviembre del año 2007. Muestras de suelo se tomaron en cada una de las parcelas, las cuales se analizaron químicamente por el Instituto Geográfico Agustín Codazzi (IGAC). Se tuvieron en cuenta variables como la Granulometría, pH, cuantificación de materia orgánica (Carbón orgánico y Nitrógeno Total), variables del complejo de cambio (Capacidad de Intercambio Catiónico -CIC-, calcio, magnesio, potasio, sodio, bases totales) y cuantificación del fósforo. Todas las variables abióticas se correlacionaron entre sí. Se observó que elementos como calcio, potasio, sodio y magnesio se encontraban altamente relacionados entre sí y con la Capacidad de Intercambio Catiónico (CIC; r > 0.80). A su vez, el porcentaje de carbón orgánico se encontraba correlacionado con los elementos anteriormente mencionados, al igual que con CIC (r > 0.85). Debido a ello solamente se incluyeron como variables independientes el pH, el porcentaje del nitrógeno total (N total%), la Capacidad de Intercambio Catiónico (CIC meq/100g), el porcentaje de saturación de bases (%SB) y el fósforo (fósforo ppm). La distancia espacial entre parcelas se manejó como la distancia entre los centros de cada parcela, también basadas en el mapa de la Figura 1.
RESULTADOS
COMPOSICIÓN FLORÍSTICA
En el levantamiento completo (1 ha) se encontraron 653 individuos de 193 especies o morfotipos, pertenecientes a 41 familias. De estas morfoespecies, 30 no pudieron ser determinadas a especie o género. Observamos que las especies dispersadas por mecanismos bióticos predominan en los fragmentos estudiados y que, por el contrario, las plantas que utilizan factores abióticos tuvieron una representación baja. Por ejemplo, en la lista de las 20 especies más importantes, únicamente dos tienen un sistema de dispersión abiótico por viento (Tabla 1). En cuanto a dominancia, las especies más importantes fueron Croton matourensis, Iriartea deltoidea, Cecropia sciadophylla, Pourouma minor, Oenocarpus bataua y Pourouma bicolor. Teniendo en cuenta la densidad, las especies más importantes fueron Iriartea deltoidea, Croton matourensis, Oenocarpus bataua, Pourouma bicolor y Pseudolmedia laevis. Por último, las especies con mayor frecuencia en las parcelas corresponden a Iriartea deltoidea, Pourouma minor, Croton matourensis, Pourouma bicolor, Pseudolmedia laevis y Crepidospermum goudotianum. Todas estas especies pertenecen a las familias con mayor índice de importancia en el fragmento, que fueron Arecaceae, Moraceae, Fabaceae, Urticaceae, Euphorbiaceae y Burseraceae (Tabla 2).

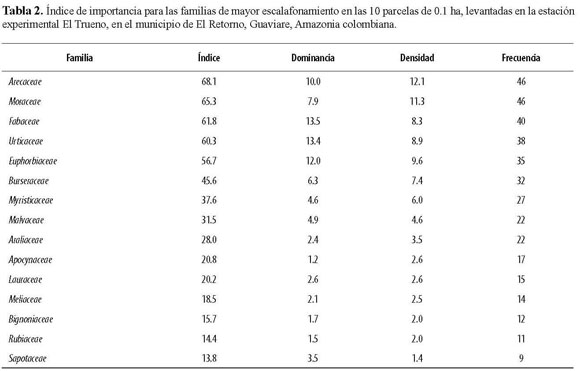
EFECTO DE BORDE
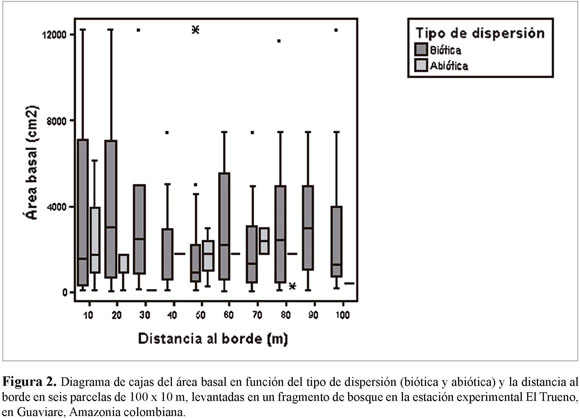
En las seis parcelas levantadas desde los bordes no encontramos diferencias significativas entre subparcelas en términos del área basal (ANOVA n=309, F=0.28, p=0.98). El área basal de plantas con distinto tipo de sistema de dispersión tampoco varió en función de la distancia al borde (ANOVA n=309, F=3.48, p=0.06) (Figura 2). Sin embargo, al realizar una separación de las especies de dispersión biótica de acuerdo al tamaño de la semilla (pequeña, mediana y grande), se encontró que el área basal de las especies de semilla pequeña es significativamente mayor cerca del borde en comparación con el interior del bosque (Figura 3). Por su parte, las plantas de semillas medianas y grandes fluctúan en las diferentes distancias, mostrando una tendencia a aumentar en abundancia en subparcelas cercanas al interior del bosque (Figura 3).

ORDENACIONES
La ordenación de escala multidimensional de la composición florística de cada una de las parcelas florísticas no mostró un patrón bien definido de agrupación de parcelas particulares (Figura 4). Algo similar ocurrió en el Análisis de Correspondencia Canónica (ACC), donde se establecieron los patrones de similitud florística de las parcelas estudiadas y su asociación con variables ambientales y la distancia del borde (Figura 5). Los resultados sugieren que no existe una relación fuerte de las parcelas con estas variables ambientales y químicas del suelo. Por lo tanto, no hay apoyo de una relación entre la composición de especies y particularidades abióticas del medio, excepto por la humedad y la ya mencionada abundancia de especies pioneras en los bordes, pero que afecta mayormente los primeros 30 m desde el borde de las parcelas. La matriz de diferencias florísticas entre parcelas estuvo significativamente correlacionada con la matriz de humedad (prueba de Mantel: P = 0.004, r = 0.390) a excepción de las demás matrices de variables abióticas (temperatura: P = 0,485, r = 0.006; CIC meq/100g: P =0.059, r = 0.233; NTotal%: P = 0.596, r = 0.040; %SB: P = 0.832, r = 0.146; Fósforo: P = 0.826, r = 0.144). Las parcelas 1, 5, 7, 8 y 9 se comportan de manera similar en cuanto a la humedad y presencia de ciertas especies, siendo las parcelas 6, 4, 10, y las parcelas 2 y 3 las más disímiles. Sin embargo, estas agrupaciones no son evidentes en las ordenaciones.


Se esperaba que aquellas parcelas que se encontraban más cerca entre sí presentaran una composición florística similar. Sin embargo, la prueba de Mantel, que compara la matriz de correlación de la distancia geográfica entre parcelas y la matriz de afinidad en la composición florística entre parcelas, sugiere que la distancia entre las parcelas no determina la composición florística de cada una de ellas (P = 0.23; r = 0.18).
DISCUSIÓN
Los resultados de la composición florística (Tabla 1), sugieren que las especies con mayor índice de importancia incluyen bastantes especies de plantas pioneras como Croton matourensis, Cecropia sciadophylla, Jacaranda copaia, Capirona decorticans y Apeiba aspera. De acuerdo a estudios realizados en bosques del Amazonas, C. matourensis es una de las especies más importantes en los bosques del Guaviare y está reportada como pionera, con un banco de semillas persistente (Gerwing 2006). Esto último, sumado al hecho de que hay bastante formación de claros por razones naturales y para prácticas silvopastoriles (Muñoz 2008), posiblemente permiten la amplia distribución de esta especie y otras pioneras en los fragmentos de este bosque. En este estudio, el 25% de las especies más importantes son pioneras, el cual es más alto (5-10%) a lo encontrado en bosques continuos no inundables del Parque Nacional Natural Tinigua, al noroeste del área de estudio (Stevenson et al. 2004). Por lo tanto, los resultados apoyan la predicción que indica la ocurrencia de una mayor proporción de plantas de sucesión temprana, la cual puede haber ocurrido por los procesos antrópicos de uso y fragmentación.
A pesar de lo anterior, también es claro que otros componentes de la flora estudiada son abundantes en bosques inalterados de la región. Por ejemplo, Iriartea deltoidea, Oenocarpus bataua, Pourouma minor, P. bicolor, Pseudolmedia laevis, Crepidospermum goudotianum, C. rhoifolium, Protium sagotianum y Socratea exorrhiza, entre otras, son abundantes en la región de La Macarena (Stevenson et al. 2004). Dentro de estas especies de sucesión tardía, Iriartea deltoidea de la familia Arecaceae, resultó ser la más importante en el estudio. Ésta es una palma ampliamente distribuida en los bosques tropicales del neotrópico (Condit et al. 2002, De la Quintana 2005), principalmente en los bosques del oeste amazónico y cercanos a la cordillera de los Andes, razón por la cual era de esperarse su presencia en las parcelas del Guaviare. Otras plantas típicas de bosques maduros fueron Crepidospermum goudotianum, Protium sagotianum y Ocotea longifolia (Laurance et al. 1998). Sin embargo, de éstas, únicamente P. sagotianum posee semillas grandes. En el caso de Pourouma sp., a pesar de tener semillas grandes y medianas, en algunos bosques amazónicos es clasificada como planta pionera, con base en datos de longevidad (Laurance et al. 2004).
En términos de riqueza de especies, encontrar 193 morfoespecies en un levantamiento de una hectárea corresponde a una alta riqueza. Por ejemplo, en levantamientos de parcelas en bosques no inundables de una hectárea en la región de La Macarena, la riqueza varió entre 127 y 168 especies (Stevenson et al. 2004). Se puede argumentar que la distribución no contigua de las parcelas en este estudio puede hacer más probable encontrar un mayor número de especies. Sin embargo, en un levantamiento de una hectárea del Parque Nacional Natural Tinigua, utilizando parcelas discontinuas, se encontró un total de 175 especies. Comparando el resultado de este estudio con levantamientos de parcelas de una hectárea realizados en la región del Chiribiquete, al sur del Guaviare, se han reportado menores valores de riqueza de especies (entre 75 y 158 especies: Duque et al. 2008). Esto resalta, nuevamente, la representación de especies en el fragmento estudiado. Incluso en términos de diversidad, 193 especies representadas en 653 individuos, corresponde a un índice de diversidad de Fisher de 93.3, mayor que el encontrado en la parcela más comparable del Parque Nacional Natural Tinigua (70.6).
EFECTO DE BORDE
La fragmentación ocasiona diferentes alteraciones en los ecosistemas mediante el aislamiento poblacional y los cambios en los procesos del paisaje. Entre las variaciones más importantes se encuentran: la alteración del régimen de disturbios, la invasión de especies exóticas y el efecto de borde. Este último ocasiona cambios en la composición e interacciones entre especies, aumentando la vulnerabilidad y el deterioro genético de las poblaciones (Hobbs & Yates 2003). En los alrededores de la estación experimental El Trueno del Instituto DBH, los efectos antrópicos como ganadería y agricultura han producido numerosos fragmentos de bosque de diversos tamaños. Los resultados obtenidos en el análisis realizado en esta zona demuestran claramente que a medida que la distancia al borde disminuye, existe una mayor abundancia de especies con semilla pequeña dispersadas bióticamente. Además, se reveló que la abundancia de las plantas que utilizan mecanismos abióticos para la dispersión no se ven tan afectadas por el efecto de borde. Debido a que estudios previos indican que el tamaño de la semilla es un buen indicador del tipo de planta (pionera o de bosque maduro: Laurance et al. 1998), se pueden ratificar los supuestos teóricos y concluir que, en un fenómeno de fragmentación, las especies pioneras van a dominar en las zonas cercanas a los bordes. Esto genera un cambio en las abundancias relativas con respecto a la vegetación original y la encontrada al interior de los fragmentos.
Por lo tanto, es posible afirmar que la abundancia de plantas pioneras cerca de las márgenes del fragmento es un estimativo certero de la intensidad del efecto de borde en un bosque tropical húmedo. Debido a los diversos cambios microclimáticos a los que el bosque es sometido, las plantas de interior adaptadas a la sombra y a las condiciones previas al disturbio sufren de tasas de mortalidad elevadas, permitiendo la regeneración por parte de las especies pioneras. Estas últimas poseen amplios rangos de tolerancia fisiológica para sobrevivir a las altas intensidades lumínicas y temperaturas elevadas. Además las plantas cuentan con adaptaciones ecológicas como semillas pequeñas que las hacen más resistentes a las condiciones estocásticas propias de estas zonas alteradas (D'Antonio & Meyerson 2002). Se podría pensar que este patrón se debe a una menor tasa de dispersión de especies de semilla grande hacia los bordes. Sin embargo, en el sistema estudiado, esto no parece ser el factor más importante ya que se han registrado altas tasas de dispersión de semillas en el fragmento, incluyendo bordes y lugares de prácticas de silvicultura (Muñoz 2008). Las tasas de dispersión de semillas estimadas para el fragmento son altas, incluso al compararlas con lugares de bosque continuo en la Amazonia Colombiana (Castillo 2008) y parecen estar asociadas a la abundancia de dispersores de semillas eficientes como los micos churucos (Stevenson 2007). Estos dispersores se caracterizan por ser legítimos dispersores de semillas pequeñas, medianas y algunas grandes (Stevenson et al. 2005). Por lo tanto, pueden estar favoreciendo el reclutamiento de una gran variedad de especies endozoocóricas. En varias poblaciones de monos atelinos, como los churucos, se han reportado altas tasas de dispersión de semillas. Por ejemplo, una población densa de churucos puede dispersar cerca de un millón de semillas al día en 1 km2 (Stevenson 2007). Teniendo en cuenta que se han encontrado dos grupos de estos monos en los fragmentos y las densidades son altas (Stevenson, observaciones personales), es muy probable que las altas tasas de dispersión que ellos generan sea la causa para que no haya una relación entre distancia geográfica y afinidad florística. Por lo tanto, la dispersión limitada no parece estar operando de manera muy fuerte en este sistema de estudio.
La alta producción de semillas pequeñas, así como el oportunismo para desarrollarse en lugares con alta intensidad lumínica, hacen parte de la estrategia utilizada por las especies r. Éstas logran colonizar eficientemente espacios intervenidos, como lo son las zonas fragmentadas. Por el contrario, las especies K se identifican por ser longevas, persistentes y por sobrevivir en ambientes densos con altas tasas de competencia. En las plantas, estas características se traducen en alcanzar tamaños considerables para producir periódicamente frutos grandes en baja cantidad (Begon et al. 2006). De esta forma se explica la gran abundancia de plantas de semilla pequeña (especies r) cerca a los bordes, ya que sus adaptaciones les permiten soportar los impredecibles cambios ambientales, que a su vez no serían suficientes para sobrevivir a la intensa competencia propia del interior del bosque. Adicionalmente, en este estudio se demuestra que el desplazamiento de las plantas de semilla grande y mediana (especies K) hacia las zonas alejadas de las márgenes de los fragmentos surge como respuesta a la preferencia por el hábitat constante y predecible que se encuentra lejos de estas márgenes.
ORDENACIÓN
En la teoría neutral de Hubbell se propone que todas las especies tienen la misma probabilidad de tener éxito en una comunidad, y que lo que determina la composición de ésta es principalmente el azar (Walter 2007). En este estudio se observa que cada una de las parcelas se constituye de manera diferencial en su composición florística, mientras que las variables abióticas no fueron muy exitosas explicando las diferencias florísticas. Al parecer sólo existe una relación significativa entre la afinidad florística y la humedad. Es muy probable que la humedad esté relacionada con el tipo de suelo y con la cercanía al borde. Sin embargo, la ausencia de relaciones florísticas claras entre estas variables posiblemente se debe a la ubicación perpendicular de las parcelas con respecto al borde (de tal forma que una parcela incluía subparcelas cerca al borde y también al interior).
El hecho de no encontrar una correlación negativa entre la afinidad florística de las parcelas y la distancia entre ellas, sugiere que los procesos de dispersión no están particularmente limitados a las escalas estudiadas en este trabajo. Muy posiblemente esto se deba a las altas tasas de dispersión de las semillas mencionadas (Muñoz 2008, Castillo 2008), que pueden llevar a cabo vectores como primates.
CONCLUSIONES
Encontramos que la composición florística de este fragmento tiene una proporción relativamente alta de especies pioneras, al comparar con lo observado en bosques no inundables intactos en la misma región. Sin embargo, la mayor parte de las especies encontradas en las parcelas son componentes comunes de la flora regional en lugares menos perturbados. De hecho, encontramos una riqueza de especies relativamente alta, que nos indica que la conservación de parches de vegetación es una opción para la conservación de la diversidad de plantas y posiblemente de otros organismos. Es claro que los principales efectos de la fragmentación se dan por un cambio significativo en la alta representación de plantas de semillas pequeñas hacia los bordes del fragmento. Aunque el mayor efecto se observa en los primeros 30 m del borde del fragmento, es claro que una disminución del tamaño de los fragmentos o un aumento en su perímetro pueden generar cambios grandes en la composición florística. Por lo tanto, recomendamos que se tomen medidas para que no se disminuya más el área, ni se aumente el perímetro de los fragmentos, con el fin de conservar la alta diversidad de plantas que aún se conserva en ellos. Finalmente, parece probable que tanto la alta diversidad, como los patrones de distribución espacial de las plantas, estén relacionados con los procesos de dispersión de semillas por parte de primates y otros vectores. Por lo tanto, la conservación de los agentes dispersores parece importante para poder mantener la diversidad y los procesos ecológicos dentro de estos ambientes fragmentados.
AGRADECIMIENTOS
Agradecemos al SINCHI por permitirnos realizar los estudios en este fragmento de bosque. A Ángela Cano, Juliana López, Camila Martínez y Cecilia Prada por su trabajo y colaboración durante la fase de campo y análisis. AAna Belén Hurtado, Juan Camilo Muñoz y Diego Zarate por sus valiosos aportes durante la fase de campo y en la instalación de instrumentos de medición. Al grupo de estudiantes y monitores de Biología de la Conservación de la Universidad de los Andes, quienes ayudaron en el trabajo de campo. Agradecemos al Laboratorio de Ecología de Bosques Tropicales y Primatología de la Universidad de los Andes por proveer de instrumentos de medición, apoyo y colaboración en la realización del estudio.
REFERENCIAS BIBLOGRÁFICAS
Begon, M., C. Townsend & J. Harper. 2006. Ecology. From Individuals to Ecosystems. 4th Edition. Blackwell Publishing. Oxford. Pg. 477. [ Links ]
Castillo, S. 2008. Importancia del banco de semillas y la dispersión pos-disturbio en la regeneración de plantas en claros naturales de un bosque amazónico colombiano. Tesis de pregrado. Universidad de Los Andes. Bogotá. 14 pp. [ Links ]
Condit, R., N. Pitman, E. G, Leigh, J. Chave, J. Terborgh, R. B. Foster, P. Núñez, S. Aguilar, R. Valencia, G. Villa, H. C. Muller-Landau, E. Losos & S. P. Hubbell. 2002. Beta-Diversity In Tropical Forest Trees. Science 295: 666-669. [ Links ]
De la Quintana, D. 2005. Diversidad florística y estructura de una parcela permanente en el bosque amazónico preandino del sector del río Hondo, Área Natural de Manejo Integrado Madidi (La Paz, Bolivia). Ecología en Bolivia 40 (3): 418-442. [ Links ]
D'Antonio, C. & L. A. Meyerson. 2002. Exotic Plant Species as Problems and Solutions in Ecological Restoration: A Synthesis. Restoration Ecology 10 (4): 703-713. [ Links ]
Duque, A., J. F. Phillips, P. v. Hildebrand, C. A. Posada, A. Prieto, A. Rudas, M. Suescún & P. R. Stevenson. 2008. Distance Decay of Tree Species Similarity in Protected Areas On Tierra Firme Forests in Colombian Amazonia. Sometido a Biotropica. [ Links ]
Foster, S.A. & C. H. Janson. 1985. The Relationship Between Seed Size And Establishment Conditions In Tropical Woody-Plants. Ecology 66: 773-780. [ Links ]
Gerwing, J. J. 2006. The Influence of Reproductive Traits on Liana Abundance 10 Years After Conventional and Reduced-Impacts Logging in The Eastern Brazilian Amazon. Forest Ecology and Management 221 (1-3): 83-90. [ Links ]
Hobbs, R. J. & C. J. Yates. 2003. Impacts of Ecosystem Fragmentation on Plant Populations: Generalizing the Idiosyncratic. Australian Journal of Botany 51: 471-488. [ Links ]
Hubbell, S. P. 1979. Tree Dispersion, Abundance and Diversity in a Tropical Dry Forest. Science 203: 1299-1309. [ Links ]
Hubbell, S. P. 2001. The Unified Neutral Theory of Biodiversity and Biogeography. Princeton University Press. Princeton. [ Links ]
IDEAM. 1999. Cartas Climatológicas-Medias Mensuales. San José del Guaviare. disponible en: http://bart.ideam.gov.co/cliciu/guavi/tabla.htm [ Links ]
Laurance, W. L., L. V. Ferreira, J. M. Rankin de Merona, S. G. Laurance, R. W. Hutchings & T. E. Lovejoy. 1998. Effects of Forest Fragmentation on Recruitment Patterns in Amazonian Tree Communities. Conservation Biology 12: 460-464. [ Links ]
Laurance, W. F., T. E. Lovejoy, H. L. Vanconcelos, E. M. Bruna, R. K. Didham, P. C. Stouffer, C. Gascon, R. O. Bierregaard, S. G. Laurance & E. Sampaio. 2002. Ecosystem Decay of Amazonian Forest Fragments: A 22-Year Investigation. Conservation Biology 16 (3): 605-618. [ Links ]
Laurance, W. F., H. E. M. Nascimento, S. G. Laurance, R. Condit, S. D'Angelo & A. Andrade. 2004. Inferred Longevity of Amazonian Rainforest Trees Based on a Long-Term Demographic Study. Forest Ecology and Management 190 (23): 131-143. [ Links ]
Muñoz, J. C. 2008. Dispersión de semillas y regeneración temprana en un bosque amazónico con plantaciones maderables en Guaviare, Colombia. Tesis de pregrado. Departamento de Ciencias Biológicas. Universidad de Los Andes. 34 pp. [ Links ]
Nathan, R. & H. C. Muller-Landau. 2000. Spatial Patterns of Seed Dispersal, Their Determinants and Consequences for Recruitment. Trends in Ecology & Evolution 15: 278-285. [ Links ]
van Roosmalen, M. G. 1985. Fruits of the Guianan Flora. 1ra edición. Institute of Systematic Botany. Guyana. 438 pp. [ Links ]
Saunders, D. A., R. J. Hobbs & C. R. Margules. 1991. Biological Consequences of Ecosystem Fragmentation: A Review. Conservation Biology 5: 18-32. [ Links ]
Stevenson, P. R., M. J. Quiñones & M. C. Castellanos. 2000. Guía de frutos de los bosques del río Duda, La Macarena, Colombia. 1ra edición. Asociación para la Defensa de La Macarena & IUCN, Bogotá, Holanda. [ Links ]
Stevenson, P. R., M. Suescún & M. J. Quiñones. 2004. Characterization of Forest Types at the CIEM, Tinigua Park, Colombia. Field Studies of Fauna and Flora, La Macarena Colombia 14: 1-19. [ Links ]
Stevenson, P. R., M. Pineda & T. Samper. 2005. Influence of Seed Size on Dispersal Patterns of Woolly Monkeys (Lagothrix lagothricha) at Tinigua Park, Colombia. Oikos 110: 435-440. [ Links ]
Stevenson, P. R. 2007. Estimates of the Number of Seeds Dispersed by a Population of Primates in a Lowland Forest in Western Amazonia. En: A. J. Dennis, E. W. Schupp, R. J. Green & D. W. Westcott (eds). Seed Dispersal: Theory and its Application in a Changing World. CAB International. Wallingford, UK. Págs. 340-362. [ Links ]
Stevenson, P. R. & A. M. Aldana. 2008. Potential Effects of Forest Fragmentation and Ateline (Primates) Extinction on Plant Diversity and Composition in the Estern Orinoco Basin, Colombia. International Journal of Primatology 29: 365-377. [ Links ]
Terborgh, J. & E. Andresen. 1998. The Composition of Amazonian Forests: Patterns at Local and Regional Scales. Journal of Tropical Ecology 14: 645-664. [ Links ]
Tuomisto, H., K. Ruokolainen & M. Yli-Halla. 2003. Dispersal, Environment, and Floristic Variation of Western Amazonian Forests. Science 299: 241-244. [ Links ]
Walter, S. C. 2007. When and Why do Non-Neutral Metacommunities Appear Neutral? Theoretical Population Biology 71: 318-331. [ Links ]
Wright, J. S. 2002. Plant Diversity in Tropical Forests: a Review of Mechanisms of Species Coexistence. Oecologia 130: 1-14. [ Links ]
SOFTWARE * XLStat 2008. Thierry Fahmy. 1995-2008. Addinsoft. [ Links ]














