Introducción
Diferentes metales base Níquel, aleados con Cromo (Cr), Molibdeno (Mo), Tungsteno (W) y otros elementos son ampliamente usados para la construcción de elementos y dispositivos en diversos sectores, como por ejemplo el petroquímico, químico y energético, esto debido a su excelente resistencia tanto ambientes oxidantes como reductores 1.
En general las aleaciones de Níquel son más resistentes a la corrosión que los aceros inoxidables 2. Sin embargo, pueden sufrir corrosión en rendijas cuando están en contacto con soluciones que contienen cloruro. La corrosión en rendijas es un tipo de corrosión localizada que puede ocurrir cuando en la superficie de un material expuesto a un medio corrosivo se forma una rendija, que produce el desarrollo de una solución estanca 2 Las aleaciones Ni-Cr-Mo como la aleación 22 son resistentes a corrosión por picado pero pueden ser más susceptibles a corrosión en rendijas bajo condiciones agresivas como la temperatura y altas concentraciones de cloruros 2,3,4. De otro lado, el efecto de oxianiones como nitratos 3,5 7, sulfatos 3,5,6.7,8, carbonatos y bicarbonatos 9,10,11 son bien conocidos por su carácter inhibidor de la corrosión localizada en aceros inoxidables y algunas aleaciones de níquel, sin embargo existen pocos datos en esta área de estudio disponibles para la aleación 22.
La corrosión localizada de una aleación solo puede ocurrir cuando el potencial de corrosión (ECORR) es igual o mayor que el potencial crítico (ECRIT), bajo condiciones de servicio 12. En corrosión en rendijas se ha propuesto el potencial de repasivación (ERP) como potencial crítico. La relación de concentraciones de inhibidor y cloruro (R) es un parámetro importante. R se define en la Ecuación 1 como el cociente entre las concentraciones molares de inhibidor y cloruro. Existe una relación de concentraciones crítica (RCRIT) por encima de la cual la inhibición de la corrosión en rendijas es completa. RCRIT es el menor valor de R al cual la aleación no sufre corrosión en rendijas a ningún potencial para condiciones ambientales determinadas.
Una variedad de técnicas electroquímicas estandarizadas como el método electroquímico Tsujikawa-Hisamatsu (THE) y ensayos de polarización potenciodinamica cíclica (CCP) se han usado para determinación del potencial de repasivación de la aleación 22 en diferentes ambientes y condiciones metalúrgicas. Recientemente se han utilizado otras técnicas electroquímicas no estandarizadas como la Potenciodinámica-Galvanostática-Potenciodinámica (PD-GS-PD)y Potenciodinámica-Potenciostática-Potenciodinámica (PD-PS-PD) para la determinación de dicho potencial.
El objetivo de este trabajo fue evaluar el comportamiento frente a la corrosión en rendijas de la aleación 22 en soluciones que contienen diferentes concentraciones de cloruro y especies químicas del carbonato utilizando la técnica electroquímica PD-GS-PD.
Procedimiento experimental
La composición química en peso de la aleación 22 utilizada fue de 59,43% Ni, 20,94% Cr, 13,93% Mo, 2,68% W, 2,80% Fe, 0,01% Co, 0,14% Mn, 0,002% C y 0,0001% Si. En los ensayos de corrosión en rendijas se utilizaron probetas tipo PCA (Prism Crevice Assembly), especialmente diseñadas para el estudios de corrosión en rendijas (Figura 1) 13. El dispositivo experimental contiene 24 pequeñas rendijas formadas por dos formadores de rendijas que se posicionan sobre dos caras opuestas de la probeta. Los formadores de rendija son fabricados de material cerámico (alúmina) y se cubren con una cinta de teflón de aproximadamente 80μm de espesor. A este conjunto constituido por la probeta y los formadores de rendija se le aplicó un torque de 5Nm mediante un sistema de tornillo y tuerca de titanio. El tornillo, que se insertó por el orificio central de la probeta, fue aislado eléctricamente de la misma mediante una cinta de teflón. Se ha demostrado que este sistema de formadores de rendijas de material cerámico cubierto con cinta de teflón es el que conduce a los resultados más conservadores y reproducibles 14,15 El área expuesta de la probeta fue aproximadamente de 14cm2. Cada probeta se preparó con una terminación superficial correspondiente a papel abrasivo de carburo de silicio # 600. Las probetas se desengrasaron con acetona y se lavaron con agua destilada antes de ser introducidas en el medio corrosivo.
Las mediciones electroquímicas se llevaron a cabo utilizando una celda convencional de vidrio de tres electrodos. Se desplazó el oxígeno de la solución mediante el burbujeo de N2 durante la hora previa a cada ensayo y en el trascurso de los mismos. Se utilizó una lámina de platino de 50cm2 como contraelectrodo y un Electrodo de referencia de Calomel Saturado (ECS) que posee un potencial de 0,242V con respecto al electrodo normal de hidrógeno. El mismo se conectó con la solución mediante un capilar de Luggin. El electrodo se mantuvo a temperatura ambiente a través de un circuito de refrigeración de agua. La temperatura de la solución se controló mediante la inmersión de la celda electroquímica en un baño termostático que se mantuvo a una temperatura constante de 90ºC a lo largo de cada ensayo. Todos los potenciales reportados en el presente trabajo se refieren en la escala del Electrodo de Calomel Saturado. Los potenciales de repasivación de la corrosión en rendijas se determinaron mediante el método Potenciodinámico-GalvanostáticoPotenciodinámico (PD-GS-PD) 16. Este método consiste en tres etapas: (1) una polarización potenciodinámica en el sentido anódico hasta alcanzar una corriente predeterminada de 30μA, (2) la aplicación de una corriente constante de IGS=30μA (iGS~2μA/cm2) durante 2h, y (3) una polarización potenciodinámica en el sentido catódico hasta alcanzar una corriente neta catódica. Los barridos de potenciales de las etapas 1 y 3 se realizaron a una velocidad de barrido de 0,167mV/s. Se realizaron al menos tres repeticiones para cada condición de ensayo. Previamente a cada ensayo PD-GS-PD se registró el potencial de corrosión de la probeta en solución durante 15min. Posteriormente se aplicó una densidad de corriente catódica de 5μA/cm2 durante 5min. Cada ensayo PD-GS-PD se inició al potencial correspondiente a la finalización de este pretratamiento catódico.
Se utilizaron soluciones de NaCl de concentraciones 0,1mol/L y 1mol/L a las cuales se les adicionó alguna especie química del carbonato en determinadas concentraciones. El carbonato, bicarbonato y ácido carbónico se obtuvieron a partir de bicarbonato de sodio. La denominación corresponde a la especie mayoritaria en el equilibrio químico.
Los equilibrios para las disoluciones de las sales provenientes del ácido carbónico se muestran en las ecuaciones (2 y 3).
Las constantes de hidrólisis (Kh) para cada uno de ellos toman la forma de las ecuaciones 4 y 5.
En donde Kw es la constante de equilibrio de ionización del agua, la cual tiene un valor de 1,0x10-14 a 25ºC. K1 y K2 son la primera y segunda constante de disociación del H2CO3, con valores de 4,6x10-7 y 4,4x10-11 a 25ºC, respectivamente 17. Debido a que en el presente trabajo se utilizó una temperatura de 90ºC, el valor de las constantes de disociación y consecuentemente la concentración de las diferentes especies en función del pH difieren de los informados para 25ºC. En la literatura se informa un gráfico correspondiente a una simulación termodinámica por medio del programa MINTEQA2 18,19, el cual relaciona la concentración de carbonato, bicarbonato y ácido carbónico en función del pH a 90ºC, en un ambiente cerrado en soluciones de NaCl 1M 19. Este gráfico se utilizó para definir los valores de pH en los cuales predominaba cada especie (Figura 2). Se definieron los valores de pH correspondientes al predominio de cada una de las especies: pH=3 para el ácido carbónico, pH=7 para el bicarbonato y pH=11,5 para el carbonato. El pH de la solución se ajustó mediante adiciones de pequeños volúmenes de HCl o NaOH. El cociente entre las concentraciones de ácido carbónico y cloruros vario entre 0,01 y 0,5, y bicarbonato-carbonato y cloruros varió entre 0,01 y 2 R=(Inhibidor)/(Cloruro).

Figura 2 Concentración de especies carbonato, bicarbonato, ácido carbónico en función del pH, a 90ºC, en un ambiente cerrado, en soluciones de NaCl 1M con concentraciones de carbonato 1M. Los cálculos de especiación se llevaron a cabo mediante el software MINTEQA2 19.
Se realizaron curvas de polarización potenciodinámicas utilizando probetas prismáticas sin formadores de rendijas en algunas de las soluciones indicadas anteriormente (Figura 3). Se utilizó una velocidad de barrido de 0,167mV/s.
Todas las probetas fueron observadas en el microscopio óptico luego de cada ensayo y se seleccionaron algunas las cuales fueron analizadas Microscopio Electrónico de Barrido (MEB). Igualmente, se utilizaron probetas prismáticas (Figura 3) para determinar las velocidades de corrosión de la aleación 22 en medios aireados donde predominada las especies bicarbonato y carbonato, mediante la técnica de Espectroscopía de Impedancia Electroquímica (EIS). Los ensayos se realizaron al potencial de corrosión para 1h y 24h de inmersión. Se realizó un barrido de frecuencias entre 10KHz y 1mHz. Se midió la impedancia tomando cinco frecuencias por cada década equiespaciadas logarítmicamente. Se utilizaron valores de 0,12V/década para las pendientes de Tafel anódica y catódica, lo que conduce a un valor de B=0,026V. Estos son valores medios, recomendados en la bibliografía, que no implican ninguna suposición sobre el mecanismo del proceso corrosivo 20. Se ajustaron circuitos equivalentes sencillos para determinar la resistencia de polarización, la cual está asociada con la resistencia de la constante de tiempo a bajas frecuencias y posteriormente calcular la velocidad de corrosión con las siguientes ecuaciones:
En donde B es la constante de Stern‑Geary, la cual se calcula mediante las pendientes de Tafel anódica (βA) y catódica (βC) y Rp es la resistencia de polarización. El parámetro iCORR es la densidad de corriente de corrosión, k es la constante faradaica, PE es el peso equivalente y ρ es la densidad de la aleación. La densidad de la aleación 22 es r=8,69g/cm3. El peso equivalente, suponiendo disolución estequiométrica de los aleantes mayoritarios como Ni2+, Cr3+, Mo6+, Fe3+ y W6+, es PE=23,28. El factor de conversión faradaico es k=3,27x106μmgA-1cm-1año-121.
Resultados y discusión
Curvas de polarización potenciodinámicas
En la Figura 4(a,b) se presenta las curvas de polarización de la aleación 22 realizadas en soluciones desaireadas de NaCl 0,1M+NaHCO3 0,1M, NaCl 0,1M+NaHCO3 0,2M, NaCl 1M+NaHCO3 0,1M, NaCl 1M+NaHCO31M, NaCl 1M+NaHCO3 2M, a pH 7 y 11,5 a 90ºC, respectivamente. Las curvas de polarización presentan una región de pasividad donde la densidad de corriente se mantuvo relativamente constante y baja (alrededor de 1μA/cm2) y una zona transpasiva en la cual al aumentar el potencial aplicado, la densidad de corriente anódica se incrementó rápidamente. En todas las soluciones estudiadas se identificó un pico anódico pronunciado, el cual se presentó a un potencial aproximado de 0,1VECS. Para las soluciones con una menor concentración de NaHCO3 el pico alcanzó valores de densidad de corriente aproximadamente de 100μA/cm2, mientras que las soluciones que contenían una mayor concentración de NaHCO3 alcanzaron valores de densidad de corriente entre 1 y 3mA/cm2. Luego del pico anódico las curvas presentan una zona de potenciales donde la densidad de corriente disminuyó muy lentamente, hasta llegar a un potencial aproximado de 0,6VECS donde nuevamente las curvas presentan un aumento brusco en la densidad de corriente. Rodríguez 22 encontró la presencia de un pico de transpasividad para la aleación 22 en soluciones de NaF(SAT) y NaCl 0,5M+NaF 0,5M en diversas condiciones microestructurales. Reportó EPICO>0,6VECS para soluciones de NaCl 0,5M+NaF 0,5 a 90ºC y un pH=6. Shukla et al. 19 encontraron que la susceptibilidad a la corrosión bajo tensión de la aleación 22 está relacionada con la presencia de iones bicarbonato-carbonato en solución, en un rango de pH de 8,5 y 10,5. Igualmente determinaron la aparición de un pico anódico dentro de las curvas de polarización previo a la zona transpasiva. Recientemente, Zadorozne et al. 23 demostraron que la presencia de un pico anódico en la aleación 22 puede ser debido a uno de los elementos aleantes mayoritarios. Igualmente, Zadorozne 24 encontró la presencia de un pico anódico en la aleación HYBRID-BC1 cuando ésta fue expuesta a una solución de NaCl 1M a 90ºC. Según el autor, esto puede estar relacionado a la transpasividad del molibdeno, ya que para las aleaciones con mayor contenido de Mo el pico se presenta mucho más definido.
La presencia de un pico anódico a un valor de potencial de 250mVECS aproximadamente, está sujeta a un cambio en el estado de oxidación o a la disolución preferencial de los elementos de la aleación. En la Figura 5 se muestra el diagrama de Pourbaix para el cromo a 90ºC, donde se representan los potenciales de pico correspondientes al máximo de corriente para diversos medios donde se presentó el pico anódico. Se observa como los valores de potenciales de pico de las diferentes soluciones se encuentran por encima de la zona de pasividad (Cr2O3). Considerando que la barrera interna del Cr2O3 en la película de óxido es la responsable de la pasividad de la aleación, si ésta se destruyera se perdería la pasividad del metal. Sin embargo, la película de óxido es estable en soluciones que contienen bicarbonatos y carbonatos como lo indica la existencia de una débil pasividad secundaria que se da a potenciales superiores a 350mVECS (Figura 4a y 4b). Lo anterior sugiere que el pico anódico detectado no puede asociarse con un cambio de oxidación del cromo que destruyese la barrera interna.

Figura 4 Curvas de polarización en NaCl 0,1M y 1M con adiciones de NaHCO3 (pH 7, 11,5) a diferentes concentraciones 90ºC
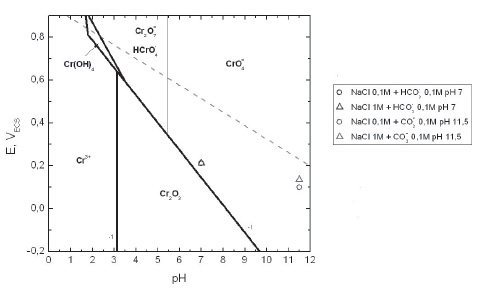
Figura 5 Diagrama de Pourbaix para el cromo (considerando Cr2O3) en agua pura a 90ºC. Los símbolos representan los potenciales máximos de pico anódico (EPICO) en función del pH, para la aleación 22 en contacto con soluciones de cloruro de bicarbonato y carbonato, a 90ºC. El número -1 indica el logaritmo de la concentración de las especies que contienen Cr. Se representa en línea de trazo la reacción de evolución del oxígeno.
Realizando un análisis para el diagrama de Pourbaix del molibdeno similar al realizado para el cromo en relación a los potenciales de pico correspondiente al máximo de corriente para diversos medios (Figura 6), se observó cómo los valores de potenciales de pico de las diferentes soluciones se encuentran igualmente como en el caso del cromo, por encima de la zona de pasividad (MoO2). Según datos termodinámicos que se ilustran en las Figuras 5 y 6 indican que la oxidación del Mo4+ a Mo6+ se produce a menores potenciales que la oxidación del Cr3+ a Cr6+ (25. Miyagusuku y Devine26 estudiaron el comportamiento electroquímico de la aleación 22, y lo confrontaron con el comportamiento de los elementos puros, cromo y molibdeno. Este trabajo indica que la disolución transpasiva del molibdeno ocurre a menores potenciales que la del cromo. Considerando que esto se mantiene para mayores valores de pH, el pico anódico observado en la aleación 22 para las distintas soluciones evaluadas podría atribuirse al molibdeno. Experiencias electroquímicas en compañía de análisis de superficies llevadas a cabo en la solución que simula aguas subterráneas bajo un pH=11 y temperaturas de 60ºC y 90ºC, indican que el pronunciado pico anódico hallado entre 0,200VECS y 0,400VECS se debe a la oxidación del Mo4+ a Mo6+ dentro de la película pasiva 27.

Figura 6 Diagrama de Pourbaix para el molibdeno en agua pura a 90ºC. Los símbolos representan los potenciales máximos de pico anódico (EPICO) en función del pH, para la aleación 22 en contacto con soluciones de cloruro con adiciones de bicarbonato y carbonato, a 90ºC. El número -1 indica el logaritmo de la concentración de las especies que contienen Mo. Se representan en líneas de trazo las reacciones de evolución del hidrógeno y oxígeno, que marcan el rango de estabilidad del agua
En las Figura 7, 8 y 9 presentan ensayos PD-GSPD realizados a la aleación 22 en soluciones de NaCl 0,1M+NaHCO3 para diferentes valores de R, a pH 3, 7 y 11,5. De acuerdo a esta técnica, el potencial de repasivación se determina con la intersección de los barridos de potencial de las etapas 1 y 3 16. A este potencial se le denomina ERP (Potencial de Repasivación). En los casos en los que los barridos no se intersecan, ERP se determinó extrapolando la densidad de corriente de pasividad de la etapa 1 hasta intersecar a la curva de la etapa 3. La caída de potencial durante la etapa 2 (galvanostática) está asociada con el desarrollo de la corrosión en rendijas.

Figura 7 Curvas de PD-GS-PD de la aleación 22 en soluciones acuosas desaireadas de NaCl 0,1M con diferentes adiciones de NaHCO3 pH 3 a 90ºC

Figura 8 Curvas de PD-GS-PD de la aleación 22 en soluciones acuosas desaireadas de NaCl 0,1M con diferentes adiciones de NaHCO3 pH 7 a 90ºC.

Figura 9 Curvas de PD-GS-PD de la aleación 22 en soluciones acuosas desaireadas de NaCl 0,1M con diferentes adiciones de NaHCO3 pH 11,5 a 90ºC.
La Figura 10 presenta imágenes de Microscopía Electrónica de Barrido (MEB) de la aleación 22 luego de ensayos PD-GS-PD en diferentes soluciones. Las figuras (10a,b,c) muestran las probetas que sufrieron corrosión en rendijas en soluciones de cloruros y bicarbonato de sodio a pH 11,5, para R<RCRIT. El ataque se produjo debajo de los formadores de rendijas, en la zona adyacente a la solución. Se observaron productos de corrosión en las zonas que sufrieron ataque localizado. El tipo de ataque registrado se denomina cristalino y se caracteriza por la observación de granos y maclas28. La profundidad del ataque fue pequeña (menor a 10μm). La Figura 10(d) presenta una probeta ensayada en soluciones de cloruros y carbonatos, a R>RCRIT. En este caso, no se observó corrosión en rendijas.

Figura 10 Imágenes MEB de la aleación 22 luego de ensayos PD-GS-PD en (a),(b),(c) NaCl 0,1M+NaHCO3 0,01M y (d) NaCl 0,1M+NaHCO3 0,1M pH 11,5 a 90ºC.
Potenciales de repasivación
Se estudió el efecto inhibidor de las especies del equilibrio carbonato/bicarbonato/ácido carbónico. En la Figura 11(a) se evidencia que el ácido carbónico (predominante a pH 3) no presentó ningún efecto inhibidor en soluciones de NaCl 0,1M y 1M para valores de R hasta 0,5. No se estudiaron los valores de R mayores que 0,5 dado que no se pudo ajustar el pH. El bicarbonato (predomínate a pH 7) se estudió en soluciones de NaCl 0,1M y 1M para valores de R de hasta 2 (Figura 11(b)). No se observó ningún efecto inhibidor de la corrosión en rendijas, exceptuando en las soluciones más concentradas, cuyo pH final fue de 9,5. En estos casos se atribuyó el efecto inhibidor a la presencia de cantidades significativas del carbonato debido al incremento del pH. Es importante señalar que en soluciones de NaCl 1M, a 90oC, el potencial de repasivación es independiente del pH en el rango de 2 a 12,5 29. Por tanto, ningún efecto inhibidor en ese rango de pH se puede atribuir a la influencia del oxidrilo. La Figura 11(c) presenta los resultados obtenidos en soluciones de cloruros y carbonatos (pH 11,5). El potencial de repasivación ERP se incrementó con el aumento de R. Se determinó un RCRIT=1 en soluciones de NaCl 0,1M, lo cual significa que a partir de este valor no se producirá corrosión en rendijas en la aleación para las condiciones de estudio. Un posible mecanismo de inhibición del carbonato es el secuestro de H+ libre en la rendija, debido a una constante de disociación menor del correspondiente ácido con respecto a la del HCl. Igualmente, los iones carbonato pueden acumularse preferencialmente dentro de la rendija debido a su carga eléctrica doble, lo que permite menos acumulación de iones cloruro los cuales son los encargados del proceso corrosivo y la creación de una acidificación localizada dentro de la rendija. Para un R=2, se observó una disminución de ERP en NaCl 0,1M. Esta disminución de ERP no corresponde con un aumento en la susceptibilidad a la corrosión en rendijas, sino que se atribuyó al corrimiento del pico anódico observado en las curvas de polarización de la Figura 4.
Velocidades de corrosión
Para todas las soluciones en estudio se obtuvieron diagramas puramente capacitivos, para los cuales se ajustó correctamente el circuito equivalente propuesto en la Figura 12.
En la Figura 13 se muestran los diagramas de Bode para los ensayos de EIS (símbolos: datos experimentales; líneas: ajustes) para la aleación estudiada en soluciones de NaCl 0,1M con concentraciones de NaHCO3 a pH=7 y 11,5. Se utilizaron circuitos eléctricos con una constante de tiempo (Figura 12). En general se observó un buen ajuste de los circuitos equivalentes propuestos a los resultados experimentales. La bondad del ajuste (determinada por el valor de chi-cuadrado) resultó en casi todos los casos del orden de 10-3.
En la Figura 14(a) y 14(b) se observan las velocidades de corrosión, en soluciones aireadas naturalmente, calculadas con el parámetro RP, obtenido por medio del ajuste de circuitos equivalentes a los datos de EIS. Teniendo en cuenta las mediciones realizadas después de 1h de inmersión, la mayor velocidad de corrosión de la aleación 22 se presentó en contacto con la solución de NaCl 1M+NaHCO3 2M pH 7 y pH 11,5, con un valor aproximado de 3,0μm/año y 2,2μm/año, respectivamente. El intervalo de velocidad de corrosión que se obtuvo durante la primera hora osciló dentro de 1,2 y 3,0μm/año (Figura 14(a)) y 0,8μm/año y 2,2μm/año (Figura 14(b)). Para un tiempo de 24h de inmersión la velocidad de muy similares con valores por debajo de 0,4μm/año, corrosión de todas las probetas expuestas a las independientemente de la concentración de soluciones estudiadas presentaron resultados bicarbonato y cloruro.

Figura 13 Diagramas de Bode correspondientes a mediciones de EIS sobre una probeta prismática de aleación 22 en soluciones aireadas naturalmente a 90ºC. a) NaCl 0,1M+NaHCO3 0,1M a pH 7, luego de 1h de exposición.b) NaCl 0,1M+NaHCO3 0,1M a pH 7, luego de 24h de exposición. c) NaCl 0,1M+NaHCO3 0,1M a pH 11,5, luego de 1h de exposición. d) NaCl 0,1M+NaHCO3 0,1M a pH 11,5, luego de 24h de exposición.
Conclusiones
Se estudió el efecto inhibidor de la corrosión en rendijas de la aleación 22 en las diferentes especies químicas del carbonato en soluciones de NaCl 1M y 0,1M, a 90oC. Basándose en los resultados obtenidos, se llegó a las siguientes conclusiones:
La presencia de un pico anódico está relacionado con la presencia de iones carbonato y este se ve afectado por la concentración de dicho ion.
Se comprobó que el ácido carbónico no genera ningún efecto inhibidor de la corrosión en rendijas para valores de R≤0,5. Igualmente, los iones bicarbonatos no presentaron ningún efecto inhibidor, salvo en las soluciones más concentradas donde se atribuye dicho efecto a la presencia de iones carbonatos.
El carbonato presentó un RCRIT=1 independiente de la concentración de cloruros.
Se obtuvieron velocidades de corrosión por debajo de 0,4μm/año a 24h de inmersión, independiente de la concentración de la especie presente (bicarbonato, carbonato) en solución.



























