Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Acta Agronómica
Print version ISSN 0120-2812
Acta Agron. vol.63 no.3 Palmira July/Sept. 2014
https://doi.org/10.15446/acag.v63n3.35809
http://dx.doi.org/10.15446/acag.v63n3.35809
Agroindustria
Efecto del fósforo y del potasio en la producción de ácido cítrico utilizando una cepa de Aspergillus niger
Effect of P and K in the citric acid production using an Aspergillus niger strain
Ana Lucía Gómez Schouben1*, Marina Sánchez de Prager2, Jaime Eduardo Muñoz2, e Isabel Cristina Valencia1
1Sucroal S.A., Palmira, Valle del Cauca, Colombia 2Universidad Nacional de Colombia sede Palmira, Facultad de Ciencias Agropecuarias, Palmira, Colombia. *Autora para correspondencia algomez@sucroal.com.co
Rec.: 04.12.2012 Acept.: 19.05.2014
Resumen
En la investigación se evaluaron el rendimiento (%) y la productividad (g/lt por hora) de la fermentación sumergida de ácido cítrico con el uso de una cepa de Aspergillus niger mejorada por exposición a luz UV, cuando se incrementa el nivel de potasio (K) y reduce el nivel de fósforo (P) en una formulación de base que contiene sacarosa, micro- y macronutrientes. Se evaluaron cinco tratamientos en un diseño completamente al azar con tres repeticiones en una estructura multifactorial completa aumentada 22 + punto central. Los mejores resultados de rendimiento y productividad se obtuvieron con 329 mg/ lt de P y 271 mg/lt de K (tratamiento 2), equivalentes a 63.2% de rendimiento y 1.20 g/lt por hora de productividad. Se encontró que sólo el potasio es altamente significativo y que no existe interacción significativa entre K y P, adicionalmente los resultados obtenidos podrían generar una reducción en los costos de producción de ácido cítrico. A partir del análisis de regresión de superficie de respuesta se obtuvieron modelos útiles para predecir los resultados de productividad y rendimiento de la fermentación de ácido cítrico dentro del rango de evaluación. Igualmente se encontró que el 8.01% de la variación total para la productividad y el 48.94% de la variación total para el rendimiento no se explican con el modelo. Los resultados obtenidos son diferentes a los reportados por otros autores debido a que estos han utilizado condiciones sub-óptimas para asegurar la máxima acumulación de ácido cítrico y/o cepas de colección las cuales se caracterizan por una menor productividad en ácido cítrico en comparación con las cepas industriales (Papagianni, 2007).
Palabras clave: Aspergillus niger, ácido cítrico, fermentación, macronutrientes, fósforo, potasio.
Abstract
To evaluate the effect of increasing potassium (K) level and reducing phosphorus (P) level, in a base formulation (containing sucrose, micro and macronutrients) in the citric acid fermentation yield (%) and productivity (g/lt/hour) and using a UV light improved strain of Aspergillus niger; 5 different treatments were tested in a completely randomized design with 3 replicates using a full multivariate increased structure (22 + central point). The best results 63.2% yield and 1.20 g/lt/hour productivity were obtained with treatment #2 having 329 mg/lt of phosphorus and 271 mg/lt of potassium. It was concluded that only potassium is highly significant and that there is no significant interaction between both factors, however, note that the proposed changes may lead to significant savings. From the regression analysis, a useful response surface model to predict outcomes within the range of assessment was obtained. It was also found that 8.01% of the total variation for productivity and that 48.94% of the total variation for yield was not explained by the model. The results are far from those reported by many authors because their research has used sub optimal conditions to ensure the maximum citric acid accumulation or culture collection strains that are characterized by their low production of citric acid compared to industrial strains (Papagianni, 2007).
Key words: Aspergillus niger, citric acid, fermentation, macronutrients, phosphorous, potassium.
Introducción
El ácido cítrico es una sustancia natural de múltiples usos en las industrias alimenticia, de bebidas, y farmacéutica, así como en la de detergentes y sus aplicaciones. Su demanda se incrementa continuamente dada su naturaleza GRAS y características como biodegradabilidad, biocompatibilidad, notoxicidad y efecto antibacterial (Dhillon et al., 2011). En la producción industrial de ácido cítrico el microorganismo más ampliamente utilizado es el hongo Aspergillus niger (Soccol et al., 2006 y Rywinska et al., 2010). El ácido cítrico se produce en presencia de azúcar como sustrato, fuentes de nitrógeno, micro- y macronutrientes y condiciones ambientales definidas. Finalmente, el ácido es recuperado y purificado del caldo fermentado mediante una serie de reacciones químicas.
Aunque se encuentran registros del potencial de producción de micotoxinas por parte de A. niger, es ampliamente reconocido que su producción es una característica específica de la cepa influenciada por las condiciones del proceso. Se ha demostrado que hay una relación inversa entre las condiciones que facilitan la producción de micotoxinas, el favorecimiento del crecimiento del hongo y la producción de enzimas (Olempska-Beer et al., 2006).
Los macronutrientes fósforo (P) y potasio (K) son fundamentales en el proceso de producción de ácido cítrico. El primero se requiere para las fosforilaciones de sustrato, la producción de ATP/ADP y, la síntesis de ADN/ ARN de células nuevas y/o en crecimiento. Por su parte el potasio es un co-factor de varias enzimas glicolíticas, es un activador de enzimas del ciclo de Krebs y juega un papel importante como osmorregulador (Bomba Na+/K+) (Papagianni, 2007).
Una de las estrategias de optimización de procesos es el desarrollo de microorganismos con mayores productividades y más eficientes a través de programas de mejoramiento de cepas (Gómez, 2004), estrategia que ha demostrado ser exitosa aun en la era tecnológica (Parekh et al., 2000). Como resultado de los programas de mejoramiento de cepas frecuentemente se generan duplicaciones de los genes que codifican para la síntesis de enzimas determinantes en la acumulación del ácido cítrico y por tanto, el requerimiento de nutrientes y co-factores como potasio y el fósforo puede ser alterado.
Estudios preliminares de laboratorio mostraron que una reducción en el fósforo acompañada de un incremento en el potasio genera un aumento en la productividad (g/lt por hora) y en el rendimiento (%) del proceso de producción de ácido cítrico, resultados que señalan la importancia de estudiar en detalle el efecto de diferentes niveles de estos elementos y comprender su participación en el proceso.
Materiales y métodos
Preparación de sustrato para la fermentación sumergida de ácido cítrico
Como sustrato para la fermentación se utilizó jarabe de sacarosa de caña a una concentración de 250 g/lt decationizado a través de una resina catiónica Ref. Lewatit Mono Plus S100 de Lanxess. La solución azucarada se esterilizó en autoclave a 120 °C y 15 psig por 5 minutos.
Preparación del inóculo
Se utilizaron esporas de la cepa de Aspergillus niger obtenida por mutación con luz ultravioleta Lámpara UVG-54 de 254nm (Ikram-Ul et al., 2004) y seleccionada por su alta producción de ácido cítrico. La cepa se mantuvo en silica gel y se cultivó en agar Sabouraud por un periodo de 7 días a 30 °C. Posteriormente, las suspensiones de esporas se prepararon adicionando 10 ml de agua destilada estéril al cultivo puro y se dispersaron con la ayuda de un asa de inoculación. Las esporas se cuantificaron en un contador de partículas automático HIAC 8000 previa agitación vigorosa. A partir de los recuentos obtenidos, se prepararon suspensiones con una concentración de 107 esporas/ml.
Condiciones y medio de producción
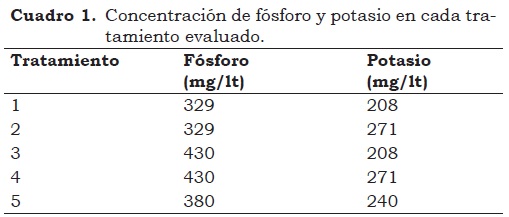
Las fermentaciones de ácido cítrico se llevaron a cabo en frascos agitados de 250 ml con bafles que contenian 30 ml de medio de cultivo el cual, además de incluir 250 g/lt de sacarosa como fuente de carbono, se suplementó con micronutrientes (Cu, Zn, Fe), macronutrientes (Mg, K, P), urea y sulfato de amonio como fuente de nitrógeno (Shu et al., 1948) (Darouneh et al., 2009) (Dhillon et al., 2011). El pH inicial del medio se ajustó a un valor 3.0. Las fermentaciones se inocularon con una suspensión de esporas equivalente a 1% del volumen total. Posteriormente, se incubaron en agitación continua en un equipo orbital marca New Brunswick Scientific a 225 r.p.m. ubicado en un cuarto con temperatura (34.5 +/- 0.5 °C) y humedad relativa (60 - 70%) controlada. Las fermentaciones se corrieron durante 143 h. Los tratamientos evaluados aparecen en el Cuadro 1.
Técnicas analíticas.
Las muestras finales de las fermentaciones de ácido cítrico fueron filtradas a través de papel filtro Whatman de 0.45 µ, Ref. 69702504, para separar la biomasa de A. niger del filtrado que contenía el ácido cítrico. El filtrado obtenido se utilizó para medir el pH, la concentración de ácido cítrico (g/lt) y la de azúcares residuales (g/lt).
Cálculo de las variables de respuesta
La productividad de la fermentación se obtuvo dividiendo la concentración de ácido cítrico sobre el tiempo de fermentación en horas; el rendimiento se calculó dividiendo la cantidad en gramos de ácido cítrico generada sobre la cantidad en gramos de sacarosa adicionada y se expresó en términos de porcentaje.
Diseño experimental
Se utilizó un diseño experimental completamente al azar con tres repeticiones. La estructura del diseño de los tratamientos fue multifactorial completo aumentado con dos factores (fósforo y potasio) y dos niveles más un punto central (22 + punto central).
Análisis de datos
Para el análisis se utilizó el paquete estadístico Minitab versión 15 del 2008. Con los resultados obtenidos se hicieron gráficos de efectos principales e interacciones, análisis de varianza y se calcularon los coeficientes de regresión de superficie de respuesta y de correlación.
Resultados y discusión
Los mejores resultados de rendimiento y productividad en la fermentación de ácido cítrico fueron obtenidos en el tratamiento 2 (fósforo: 329 mg/lt y potasio: 271 mg/lt)(Figura 1). Se observó un coeficiente de variación (CV) bajo (< 0.5%) lo que demuestra un buen control de las condiciones del ensayo (Cuadro 2).
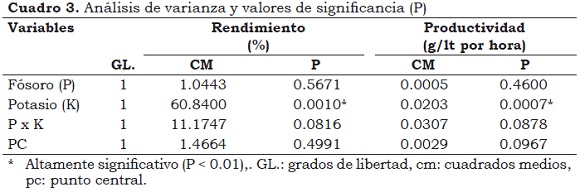
Con base en los valores de significancia (P < ) se concluye que de los efectos principales (K y P) sólo el primero es altamente significativo (P < 0.01) y que no existe interacción entre ellos (Figura 2) (P > 0.05); es decir, que los niveles de P y K influyen directamente en la productividad y rendimiento de la fermentación del ácido cítrico, pero lo hacen en forma independiente (Cuadro 3). El coeficiente de correlación entre rendimiento (%) y productividad (g/lt por hora) fue de 0.216, lo que indica que estas variables se comportan de forma independiente.
A partir de los coeficientes de regresión de la superficie de respuesta, estimados para productividad y rendimiento se obtuvieron los modelos matemáticos siguientes:
Para productividad:
Y = 1.14633 + (0.04117 x K) + (0.0065 x P) - (0.016 x P x K) + (0.3467 x Ppc x Kpc)
Para rendimiento:
Y = 59.65170 - (0.2950 x p) + (2.2517 x k) - (0.9650 x P x K) + (0.7817 x Ppc x Kpc)
donde, P: fósforo, K: potasio, Ppc y Kpc: punto central fósforo y potasio.
En el Cuadro 4 aparecen los valores estimados utilizando las ecuaciones anteriores, así como los valores experimentales. En este experimento, los valores de coeficiente de correlación R fueron 0.9591 y 0.7215 para productividad y para rendimiento, respectivamente, lo que demuestra un alto grado de correlación entre los valores experimentales y los estimados para la variable de rendimiento. El valor de R2, coeficiente de determinación, indica que el 91.99% y el 51.06% de las variables evaluadas para productividad y rendimiento, respectivamente, contribuyen positivamente a la respuesta. El R2 adicionalmente es una medida del ajuste del modelo y se puede decir que el 8.01% de la variación total para la productividad de la fermentación y el 48.94% de la variación total para el rendimiento no se explican con el modelo.
Papagianni (2007) señaló la dificultad para la comparación de datos registrados en diferentes investigaciones científicas, debido a la utilización de condiciones sub-óptimas y cepas de colección de baja producción, en comparación con cepas industriales; adicionalmente anotó que dichas investigaciones no reflejan la realidad de la fermentación industrial. A estos factores se suma el hecho de que las industrias no están interesadas en publicar sus resultados; por un lado, por considerarlo como propiedad intelectual y por otro, como estrategia de competitividad.
El mejoramiento de cepas por mutación para lograr mejores rendimientos es un objetivo continuo en los procesos industriales y su importancia ha sido ampliamente demostrada en microorganismos como Penicillium chrysogenum utilizado para la producción industrial de antibióticos, no obstante para la producción de ácido cítrico los trabajos publicados son escasos, probablemente porque las compañías quieren guardar en secreto sus métodos más exitosos (Yigitoglu, 1992), aunque existen reportes de que se mejoran las características fisiológicas y morfológicas del hongo que favorecen la cinética del proceso (Angumeenal y Venkappayya, 2013).
Con el objeto de reducir los costos de producción de ácido cítrico, algunos investigadores han evaluado la sustitución de sacarosa de caña por melaza, además usan cepas de A. niger mejoradas por mutación con luz UV derivadas de una cepa silvestre aislada del suelo; una metodología que fue utilizada para la obtención de la cepa en estudio y su parental (Lofty et al., 2007). Con la mejor cepa, estos investigadores obtuvieron un rendimiento de 60% y una productividad de 0.659 g/lt por hora, valores inferiores a los encontrados con el mejor tratamiento en la presente investigación, que fueron 5.3% y 82% mayores, respectivamente. Las diferencias se pueden atribuir al tipo de sustrato, la concentración, la cepa utilizada y algunas condiciones de fermentación.
Peksel y Kubicek (2003) estudiaron el efecto de la concentración de sacarosa en la acumulación de ácido cítrico por A. niger ATCC11414, cepa de colección que no ha sido objeto de mejoramiento, y encontraron los mejores resultados (10.7% y 16% en rendimiento y 0.21 y 0.22 g/lt por hora en productividad) con las mayores concentraciones de sacarosa (140 y 100 g/lt); lo cual se explica por la presencia de más sustrato disponible; no obstante estos valores son muy bajos en comparación con los obtenidos en la presente investigación.
Nielsen y De Jongh (2008) trabajando con cepas derivadas de A. niger A742 con producción de cítrico incrementada por inserción de genes que codifican para la síntesis de enzimas críticas del proceso, encontraron en frascos agitados con 100 g/lt de glucosa una producción de ácido cítrico 7 g/lt en 60 h vs. 4.5 g/lt de la cepa silvestre, valores que son inferiores a los encontrados en la presente investigación (178.7 g/lt en 143 h) con una concentración de sacarosa de 250 g/lt.
Estudios recientes se enfocan en la utilización de sustratos alternativos a la sacarosa, entre ellos residuos agroindustriales y glicerol, en los cuales se utilizan microrganismos diferentes a A. niger como la levadura Yarrowia lipolytica y fermentación en estado sólido en lugar de fermentación sumergida, y el uso de biorreactores agitados en vez de frascos agitados, lo que no permite una comparación con los datos obtenidos en este estudio (Kim et al., 2006; Nielsen y Jongh, 2007; Imandi et al., 2007; Levinson et al., 2007; Imandi et al., 2008; Niamul et al., 2009; Kamzolova et al., 2011; Kola y Goli, 2012).
Aunque la mutación es un procedimiento que puede resultar en cambios genéticos no esperados, es una herramienta que ha demostrado ser exitosa y esa es la razón para que se continúe utilizando, aún en la era de la biotecnología de punta, la cual, hacia el futuro inmediato puede generar respuestas complementarias para su utilización. La tendencia actual es emplear estrategias combinadas de técnicas clásicas, moleculares y de ingeniería bioquímica, para lograr un efecto sinérgico en los procesos de mejoramiento (Bailey, 1998).
Conclusiones
- En esta investigación se encontró que para maximizar el potencial a escala industrial de las nuevas cepas mejoradas, es necesario realizar estudios sistemáticos de los requerimientos nutricionales particulares de cada nueva cepa.
- Tanto el P como el K son nutrientes fundamentales y determinantes para el rendimiento y productividad de la fermentación de ácido cítrico, obteniendo los mejores resultados con la combinación de 271 mg/ lt de K y 329 mg/lt de P. Aunque sólo el efecto del potasio resultó estadísticamente significativo, los aumentos obtenidos en rendimiento y productividad podrían representar ahorros potenciales a escala industrial.
- El modelo de regresión de superficie de respuesta permite predecir adecuadamente el rendimiento y la productividad de la fermentación de ácido cítrico de la cepa en estudio dentro del rango de evaluación. Se presentó correlación entre los valores experimentales y los estimados a partir del modelo y se encontró un adecuado ajuste de éste a través del coeficiente de determinación, lo que indica que un alto porcentaje de la variación obtenida se explica bien a través del modelo en la mayoría de los casos.
- Las distintas condiciones tecnológicas y ambientales en las cuales se han realizado las investigaciones, concordantes con los objetivos del presente trabajo, dificultan la comparación de resultados, como ha sido reconocido por otros autores. Sin embargo, el conocimiento generado en esta investigación es importante desde el punto de vista básico y es una tecnología aplicable y disponible inmediatamente para el sector industrial.
Referencias
Angumeenal, A. R. y Venkappayya, D. 2013. An overview of citric acid production. Food Sci. Technol. 50:367 - 370. [ Links ]
Darouneh, E.; Alavi, A.; Vosoughi, M.; Arjmand, M., Seifkordi, A.; y Rajabi, R. 2009. Citric acid production: surface culture versus submerged fermentation. Afr. J. Microb. Res. 3(9):541 - 545. [ Links ]
Dhillon, G. S.; Brar, S.K.; Verma. M.; y Tyagi, R. D. 2011. Recent Advances in citric acid bio-production and recovery. Food Bioprocess Technol. 4:505 - 529. [ Links ]
Bailey, J. E. 1998. Mathematical modeling and analysis in biochemical engineering: past accomplishments and future opportunities. Biotechnol. Prog. 14:8 - 20. [ Links ]
Gómez., A. L. 2004. Mejoramiento de cepas para la producción industrial de ácido cítrico. Monografía. Universidad Nacional de Colombia sede Palmira. 71 p. [ Links ]
Ikram-Ul, H.; Ali, S.; Qadeer, M.A.; e Iqbal, J., 2004. Citric acid production by selected mutants of Aspergillus niger from cane molasses. Bioresour. Technol. 93:125 - 130. [ Links ]
Imandi, S. B.; Bandaru, V. V.; Somalanka, S. R.; y Garapati, H. R. 2007. Optimization of medium constituents for the production of citric acid from glycerol using Doehlert experimental design. Enzyme Microbial Technol. 40:1367 - 1372. [ Links ]
Imandi, S. B.; Bandaru, V. V.; Somalanka, S. R.; Garapati, H. R.; y Bandaru, S. R. 2008. Application of statistical experimental designs foe the optimization of medium constituents for the proof citric acid from pineapple waste. Biores. Technol. 99:4445 - 4450. [ Links ]
Kamzolova, S. V.; Fatykhova, A. R.; Dedyukhina, E. G.; Anastassiadis; S. G.; Golovchenko, N. P.; y Morgunov, I. G. 2011. Citric acid production by yeast. Food Technol. Biotechnol. 49(1):65 - 74. [ Links ]
Kim, J. W., Barrinngton, S.; y Sheppard, B. 2006. Nutrient optimization fir the production of citric acid by Aspergillus niger NRRL 567 grown on peat moss enriched with glucose. Process Bioch. 41:1253 - 1260. [ Links ]
Kola, A. K. y Goli, V. R. 2012. Design and optimization of citric acid fermentation process by statistical method. International Conference on Chemical, Environmental and Biological Sciences. Penang, Malaysia. p. 70 - 73. [ Links ]
Levinson, W. E.; Kurtzman, C. P.; y Kuo, M. T. 2007. Characterization of Yarrowia lipolytica and related species for citric acid production from glycerol. Enzyme Microbial Technol. 41:292 - 295. [ Links ]
Lofty, W. A.; Ghanem, M. K.; y Helow, E. R. 2007. Citric acid production by a novel Aspergillus niger isolate: mutagenesis and cost reduction studies. Biores. Technol. 98:3464 - 3469. [ Links ]
Niamul, M. D.; Alam, Z.; Muyibi, A. S.; Jamal, P.; y Al-Mamun, A. 2009. Improvement of production of citric acid from oil palm empty fruit bunches: optimization of media by statistical experimental designs. Bioresource Technol. 100:3113 - 3120. [ Links ]
Nielsen, J. y Jongh, de W. A. 2008. Enhanced citrate production through gene insertion in Aspergillus niger. Metabolic Engin. 10:87 - 96. [ Links ]
Olempska-Beer., Z. S.; Merker, R. I.; Ditto, M. D.; y DiNovi, M. J. 2006. Food-processing enzymes from recombinant microorganisms-a review. Regul. Toxicol. Pharmacol. 45(2):144 - 158. [ Links ]
Papagianni, M. 2007. Review: Advances in citric acid fermentation by Aspergillus niger: Biochemical aspects, membrane transport and modeling. Biotechnol. Adv. 25:244 - 263. [ Links ]
Parekh, S.; Vinci, V. A.; y Strobel, R. J. 2000. Improvement of microbial strains and fermentation processes. Applied Microbiol. Biotechnol. 54:287 - 301. [ Links ]
Peksel, A.; y Kubicek, C. 2003. Effects of sucrose concentration during citric acid accumulation by Aspergillus niger. Turk J. Chem. 27:581 - 590. [ Links ]
Rywinska, A., Rynowicz, W., Zarawska, B.; y Skrzypinski, A. 2010. Comparison of citric acid production from glycerol and glucose by different strains of Yarrowia lipolytica. World J. Microbiol. Biotechnol. 20:1217 - 1224. [ Links ]
Shu, P. y Johnson, J. 1948. The interdependence of medium constituents in citric acid production by submerged fermentation. J. Bacteriol. 56(5):577 - 585. [ Links ]
Soccol, C. R.; Vanderberghe, L. P.; Rodrigues, C.; y Pandey, A. 2006. New perspectives for citric acid production and applications. Food technol. biotechnol. 44:141 - 149. [ Links ]
Yigitoglu, M. 1992. Production of citric acid by fungi. J. Islamic Academy Sci. 5(2):100 - 1061. [ Links ]