Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
Print version ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.64 no.2 Bogotá May/Aug. 2017
https://doi.org/10.15446/rfmvz.v64n2.67210
Doi: 10.15446/rfmvz.v64n2.67210
FACTORES DE RIESGO ASOCIADOS A LA INFECCIÓN POR Cystoisospora suis EN GRANJAS PORCINAS DE LA REGIÓN CENTRAL DE VENEZUELA
RISK FACTORS ASSOCIATED WITH Cystoisospora suis INFECTION IN SWINE HERDS OF THE CENTRAL REGION OF VENEZUELA
J. C. Pinilla León1*, N. Da Silva2
1 Facultad de Ciencias Agropecuarias, Programa de Medicina Veterinaria, Universidad de Santander. Lagos de Cacique, Bucaramanga (Colombia).
*Autor para correspondencia: jcpinilla@hotmail.com
2 Profesora Agregada. Área de Parasitología Animal. Universidad Rómulo Gallegos, Venezuela.
Artículo recibido: 6 de febrero de 2017 • Aprobado: 27 de agosto de 2017
RESUMEN
Se condujo una investigación en Venezuela con la finalidad de conocer algunos aspectos epidemiológicos sobre la presencia de Cystoisospora suis en 67 granjas porcinas intensivas. Para la determinación de la carga parasitaria se seleccionaron 572 camadas con signos de diarrea, así como 1.712 muestras fecales de cerdos adultos. Las muestras se cultivaron en dicromato de potasio al 2,5% y posteriormente se procesaron mediante una técnica copro-parasitológica. Además, en cada granja se aplicó una encuesta epidemiológica. El protozoario se encontró en 55 granjas (82,1%) y 210 camadas (36,7%). Al referirlo a camadas, se observaron ooquistes en lechones menores de tres días de edad, lo que podría indicar la existencia de rutas alternativas de la infección. En cerdos adultos se encontró correlación significativa (rho = 0,35; P < 0,05) entre la excreción de ooquistes en lechones y en madres, lo que sugiere que estas podrían actuar como fuentes de infección. Se constató correlación entre el número de partos de la cerda y la prevalencia en camadas y cerdas lactantes (P < 0,05), pues, a mayor número de partos, disminuye la prevalencia. Probablemente estos hallazgos están asociados con mecanismos inmunológicos desconocidos. El tamaño de la granja no afectó la presencia del parásito; sin embargo, las granjas con pisos plásticos mostraron mayor control de la infección. Se concluye que algunos mecanismos inmunológicos, aún sin dilucidar, podrían estar involucrados en la cadena de transmisión del protozoario, los cuales podrían jugar un papel importante en el desarrollo de la cystoisosporosis porcina.
Palabras clave: Cystoisospora suis, epidemiología, granjas, porcinos, Venezuela.
ABSTRACT
It was carried out an investigation in Venezuela with the aim of studying the epidemiological aspects of Cystoisospora suis in intensive swine herds. Sixty-seven intensive swine herds were included. For parasite determination 572 litters with signs of diarrhea, as well as 1,712 faecal samples from mature pigs were selected. Stool samples were cultured in a 2.5% potassium dichromate solution and later processed by copro-parasitological technique. Epidemiological surveys were applied on each farm. The results indicated that C. suis was observed in 55 herds (82.1%) and 210 litters (36.7%). Regarding to litters, oocysts were observed in piglets less than three days of life, which could indicate the existence of alternative infection way. Regarding to mature pigs, there was a significant correlation (rho = 0.35; P < 0.05) among oocysts excretion in piglets and sows, suggesting that sows may act as infection sources. Sows parity was statistically correlated with the prevalence values in litters as in lactating sows (P < 0.05). This might indicate that as parity increase, prevalence decreases in these groups. Probably, these findings are associated with unknown immunologic mechanisms. The herd size did not affect the presence of the parasite, however, farms with plastic floors showed greater control of the infection. It is concluded that non elucidated immunologic mechanisms might be involved in the protozoa transmission cycle and play an important role in the development of porcine cystoisosporosis.
Key words: Cystoisospora suis, epidemiology, herds, swine, Venezuela.
La coccidiosis neonatal porcina es una enfermedad causada por Cystoisospora suis, un protozoario con distribución mundial que afecta principalmente cerdos mantenidos en confinamiento (Lindsay et al. 1999). Los animales que se infectan desarrollan diarrea de color amarillo a partir de la segunda semana de edad, la cual inicialmente es pastosa para hacerse fluida dos o tres días después. El período prepatente es de cuatro días y su prevalencia en lechones es muy variada (Lindsay et al. 1999).
La epidemiología de C. suis aún es confusa y se piensa que las cerdas madres pueden jugar un papel importante en la transmisión. Sin embargo, Stuart y Lindsay (1986), Lindsay et al. (1999) y Farkas et al. (2004) no encontraron cerdas excretando ooquistes en granjas porcinas de EE.UU. y Hungría, respectivamente, por lo que concluyeron que el medio ambiente es la fuente de infección de los lechones. Por el contrario, González de Wilinski (1993) y Pinilla y Coronado (2008) determinaron en Venezuela excreción de ooquistes en cerdas madres, así como Meyer et al. (1999) y Karamon y Ziomko (2004) en granjas de Alemania y Polonia, respectivamente. Igualmente, González de Wilinski (1993) y Pinilla (2009) determinaron 43,4% y 19,1% de prevalencia en lechones destetados, respectivamente, concluyendo que las cerdas madres y los lechones de iniciación podrían jugar un rol en la transmisión del parásito, en especial en las etapas de lactancia y destete las cuales representan el momento de mayor estrés del cerdo (Nilsson 1988, Roth 1999) y, por tanto, podría aumentar la excreción de ooquistes de C. suis. Karamon et al. (2007) y Sotiraki et al. (2008) han señalado la posibilidad de formas evolutivas extraintestinales; sin embargo, Stuart y Lindsay (1986) y Lindsay et al. (1999) no comprobaron la existencia de tales formas en lechones y ratones inoculados experimentalmente con C. suis. La presencia de formas evolutivas extraintestinales ha sido comprobada en varias especies de Cystoisospora en caninos, felinos y humanos (Lindsay et al. 1999).
En Australia, Driesen et al. (1993) encontraron 53,8% de prevalencia en lechones lactantes diarreicos con edades entre 5 y 30 días. En EE.UU., Otten et al. (1996) señalaron que todas las granjas examinadas estaban infectadas y hallaron una prevalencia de 62,2% en lechones lactantes. En Alemania, Niestrath et al. (2002) demostraron 42,5% de prevalencia en camadas y en la República Checa, Hamadejova y Vitovec (2005) reportaron 21,8% de prevalencia. Con respecto a la edad, Sayd y Kawazoe (1996), Hamadejova y Vitovec (2005) y Pinilla (2009) señalaron que la mayor prevalencia se encontró en la segunda semana de vida, mientras que Otten et al. (1996) encontraron 17,4 y 41,3% de prevalencia en lechones de dos y tres semanas de edad, respectivamente. Niestrath et al. (2002), señalaron mayores tasas de prevalencia en lechones de tres y cuatro semanas de edad. En Venezuela, González de Bilinski (1993) determinó 21,8% de prevalencia en lechones criados en granjas de los estados Aragua y Carabo-bo; posteriormente, González de Bilinski et al. (2000) demostraron 75% de prevalencia en granjas con manejos sanitarios eficientes y deficientes, y concluyeron que el parásito se presentó en cualquier tipo de explotación. Luego, Pinilla y Coronado (2008) determinaron 93,3% de prevalencia en granjas ubicadas en la región centro-occidental de Venezuela, así como 31,6% en lechones lactantes, mientras que Pinilla (2009) determinó 31,9% de prevalencia en camadas y 75% en granjas ubicadas en la región central de Venezuela.
Con relación a la dinámica del pro-tozoario, Harleman y Meyer (1984) y Lindsay et al. (1999) señalaron que el ciclo de desarrollo de C. suis es bifásico, con la formación de dos picos de excreción; sin embargo, Christensen y Henriksen (1994) comprobaron la formación de un tercer pico de excreción.
Con relación a la consistencia de las heces, Meyer et al. (1999), Estrada et al. (2004) y Pinilla (2009) determinaron asociación estadística entre la presencia de ooquistes del protozoario en muestras de consistencia pastosa y cremosa, así como en aquellas líquidas. Sin embargo, Hamadejova y Vitovec (2005), además de Pavlovic et al. (2008), señalaron mayor excreción de ooquistes en las muestras líquidas.
El número de partos juega un rol importante sobre el sistema inmune de la cerda, ya que se ha demostrado disminución de anticuerpos contra ciertas infecciones (Cardona et al. 2002, Holyoake 2006), sobre todo en primerizas, las cuales se pueden ver inmunocomprometidas por efecto del parto y la lactancia (Klopfenstein et al. 1999, Lanfranchi et al. 2008). Koudela y Kucerová (2000) señalaron que la inmunidad mediada por células juega un rol muy importante en la resistencia a la cystoisosporosis porcina, mientras que Lindsay y Dubey (2005) demostraron que los anticuerpos calostrales no protegen contra la enfermedad. Recientemente, Schwarz et al. (2014), señalaron que el calostro y la leche maternal contienen sustancias protectoras en las primeras dos semanas de vida del lechón. El tamaño de la granja también podría afectar la presencia del protozoario (Holm 2001), sin embargo, Farkas et al. (2004) y Estrada et al. (2004) señalaron que no existe asociación estadística entre C. suis con respecto al tipo y tamaño de explotación. Por su parte, Niestrath et al. (2002) y Heylen et al. (2004) demostraron mayor presencia del protozoario en granjas pequeñas y medianas, mientras que Kara-mon y Ziomko (2004) encontraron mayor presencia en granjas grandes. Con relación al piso de la maternidad, Sayd y Kawazoe (1996), Niestrath et al. (2002) y Heylen et al. (2004) encontraron valores bajos de prevalencia (<4%) en unidades paritorias donde emplean pisos plásticos perforados, posiblemente debido al menor contacto de los lechones con sus heces.
Según Feporcina (2010), la región central de Venezuela cuenta con más del 70% del total de granjas organizadas en el país y alrededor de 80 mil cerdas en producción, lo que representa un 53% del total de vientres en Venezuela y la región más representativa de la producción porcícola nacional. En este orden de ideas, se planteó como objetivo de la presente investigación estudiar algunos aspectos epidemiológicos de Cystoisospora suis en granjas porcinas de la región central de Venezuela.
Ubicación geográfica del estudio
Las granjas examinadas se encuentran localizadas en la región central de Venezuela, específicamente en los estados Aragua y Carabobo. Las características climatológicas de la región corresponden a las de clima tropical, con registros pluvio-métricos anuales entre 500 y 1.450 mm, temperaturas medias anuales entre 24,5 y 27°C y 70% de humedad relativa. Los estados están situados entre 600 y 2.400 m.s.n.m (MARNR 2010).
Para el estudio se incluyeron 67 granjas porcinas intensivas (32 granjas en Aragua y 35 en Carabobo) con problemas de diarrea en el área de maternidad, pobres condiciones sanitarias en su mayoría y con 100 o más madres en producción, lo que supone una sólida actividad económica de las mismas (Rodríguez 1995). De acuerdo con el Departamento de Epidemiología del Servicio Autónomo de Sanidad Agropecuaria (SASA 2010), las granjas seleccionadas representan 46,2% del total de explotaciones intensivas ubicadas en la región central de Venezuela (Tabla 1). Las granjas incluidas en el estudio únicamente utilizan animales mestizos de las razas Yorkshire y Landrace que son alimentados con raciones balanceadas.
La investigación realizada es de tipo descriptivo y de corte transversal. Para el estudio se diseñó un muestreo aleatorio bietápico por conglomerados (Lohr 2000) empleando los registros de censos porcinos existentes en el Departamento de Epidemiología del Servicio Autónomo de Sanidad Agropecuaria (SASA 2010). En la primera etapa del muestreo, se seleccionaron 40% de los municipios de cada estado, los cuales fueron escogidos al azar utilizando una tabla de números aleatorios; en los municipios seleccionados se visitaron todas las granjas organizadas. Así, en Aragua se llevaron a cabo visitas a 43 granjas que representan el 59,7% del total de explotaciones organizadas del estado; sin embargo, solamente se pudieron examinar 32 granjas (73,6%) puesto que, en el momento de la visita, no permitieron el ingreso en 11 explotaciones por motivos sanitarios. En el caso de Carabobo se visitaron 45 granjas (58,9%); no obstante, 10 granjas no se examinaron por cuanto en el momento de la visita cuatro no contaban con inventario de animales, cuatro tenían modalidades de sitio II, y en dos de ellas no se ingresó por razones de bioseguridad, para una proporción de 77,77% (35 de 45) de explotaciones examinadas. En la segunda etapa del muestreo, se tomaron las muestras en cada granja de manera proporcional al total de camadas y cerdos adultos existentes en cada una (Lohr 2000). Para determinar el tamaño de la muestra se empleó la fórmula n = Z2 (p) . (q) / EMA2, utilizando 38,9% de prevalencia (Pinilla 2009), un nivel de confianza de 95% y un error máximo asociado (EMA) de 5% (Morales y Pino 1987). Se determinó un total de 370 muestras, sin embargo, se decidió fijar el tamaño total en 2.284 ya que se contaba con suficientes recursos y logística para la colección, envío y procesamiento de las muestras.
Se seleccionaron de forma aleatoria un total de 572 camadas de diferentes edades con signos de diarrea: en Aragua (n = 283) y Carabobo (n = 289). De cada camada se tomaron aleatoriamente de 4 a 5 lechones con la finalidad de realizar un pool de muestra en cada camada. A cada lechón se le introdujo un hisopo por vía rectal con el propósito de estimular la defecación y colectar las heces en tubos de ensayo previamente identificados. En una planilla se registró la consistencia de la muestra (Cochran 2008), edad de la camada y número de partos de la madre, como variables asociadas a la prevalencia.
También se colectaron 1.712 muestras fecales en otros grupos de edad, siguiendo un orden de menor a mayor según la edad: lechones de iniciación (n = 268), lechones de crecimiento (n = 172), lechones de engorde (n = 137), cerdas de reemplazo (n = 48), madres gestantes en edad de gestación avanzada (n = 252), madres lactantes de las camadas examinadas (n = 572) y verracos (n = 263). A las cerdas lactantes, gestantes, reemplazo y verracos se les tomó la muestra de heces directamente de la ampolla rectal. La muestra de heces en lechones de iniciación, crecimiento y engorde fue tomada directamente del piso o recién depuesta, tomando una pequeña porción de heces en cinco puntos dentro del corral. Las muestras se colectaron en bolsas plásticas previamente identificadas y se introdujeron en una cava refrigerada para ser trasladadas a la Unidad de Investigación en Parasitología de la Facultad de Agronomía de la Universidad "Rómulo Gallegos" donde fueron conservadas en refrigeración hasta su procesamiento.
En cada granja se aplicó una encuesta epidemiológica con la finalidad de obtener información referente al tipo de granja de acuerdo con su ciclo de producción (completo e incompleto), cantidad de madres y tipo de piso de las áreas de maternidad.
Todas las muestras se cultivaron en cápsulas de Petri utilizando 20 mL de una solución de dicromato de potasio al 2,5%, durante un lapso de 24 a 48 h (pool de cada camada) y de dos semanas para el resto de grupos (Hendrix 1999). Transcurrido ese tiempo, se empleó una técnica de centrifugación-flotación empleando una solución de azúcar-sal (Henriksen y Christensen 1992) para realizar el diagnóstico. En aquellas muestras donde la cantidad de grasa dificultaba observar los ooquistes de C. suis se empleó una técnica de sedimentación con PBS-éter descrita por Ortega-Mora etal. (1992).
La visualización e identificación de los ooquistes se hizo con un microscopio binocular, usando magnificación de 10 y 40X, asumiendo que la presencia de al menos un ooquiste por campo microscópico define la positividad de la muestra y de la granja.
Los resultados obtenidos se analizaron mediante estadísticos descriptivos y test de Ji-cuadrado (X2) para determinar asociaciones estadísticas entre valores positivos con respecto a las variables cualitativas (consistencia de las muestras, tipo y tamaño de la granja, tipo de piso del área de maternidad). Se utilizó el coeficiente con rangos de Spearman (rho) para determinar correlaciones entre prevalencia y grupos productivos, y la prueba exacta de Fisher para establecer comparaciones entre valores de prevalencia relativos a la edad de las camadas y grupos de cerdos en iniciación. El nivel de significancia para los análisis fue de 5%. Para los cálculos se utilizó el programa estadístico Statistix (Statistix 2003).
Se encontró C. suis en 55 de 67 granjas examinadas (82,1%) con niveles similares de prevalencia entre los dos estados (Figura 1), lo cual reflejó una alta presencia del parásito en granjas porcinas intensivas. Sin embargo, los resultados obtenidos se analizaron mediante un test de Ji-cuadrado y no se encontraron asociaciones estadísticas (P > 0,05) entre los valores de prevalencia del parásito con respecto a los dos estados: 81,3% (26/32) en el estado Aragua y 82,9% (29/35) en Carabobo (Figura 1). Estos resultados coinciden con lo señalado por González de Wilinski et al. (2000), Pinilla y Coronado (2008) y Pinilla (2009) quienes reportaron prevalencias en granjas entre 75 y 93%.
Al referirlo a los lechones, se determinó 36,7% de prevalencia (35% en Aragua y 38,4% en Carabobo), en coincidencia con Niestrath et al. (2002), Pinilla y Coronado (2008) y Pinilla (2009) quienes determinaron valores de prevalencia similares en lechones lactantes, lo que podría deberse a la falta de programas de control apropiados para el protozoario. Sin embargo, estos resultados difieren con lo señalado por Driesen et al. (1993) y Otten et al. (1996), quienes señalaron mayores valores de prevalencia en camadas. En la Tabla 2 se muestra la comparación entre los valores de prevalencia en camadas de diferentes edades; los resultados indican que hubo diferencias estadísticas entre los cuatro grupos examinados, pues se observa que camadas con 1 a 7 y 8 a 14 días presentaron los mayores valores de prevalencia (P < 0,05) con respecto aquellas con edades mayores (15 a 21 y > 21 días). Estos resultados coinciden con lo señalado por Sayd y Kawazoe (1996), Hamadejova y Vitovec (2005), quienes señalaron mayores valores de prevalencia en camadas de dos semanas de edad, ya que la contaminación del paritorio en estas granjas provoca una elevada presión de infección, lo que trae como consecuencia que los animales se infecten en sus primeros días de vida. Por otro lado, estos resultados difieren con lo señalado por Otten et al. (1996) y Niestrath et al. (2002), quienes señalaron mayores tasas de prevalencia en lechones de tres y cuatro semanas de edad.
En la Figura 2 se muestra la distribución de frecuencia de camadas positivas a C. suis con menos de 7 siete días de vida. De 55 muestras positivas, se encontraron nueve en lechones menores a tres días de edad, para una frecuencia de 16,3%. Igualmente, se determinaron seis camadas (10,9%) con menos de 24 h de nacidas excretando ooquistes, lo que representa un hallazgo importante en la epidemiología del parásito. Estos resultados se obtuvieron de nueve granjas con manejos sanitarios deficientes y en seis de ellas se trataba de cerdas primíparas. Estos resultados difieren con lo señalado por Lindsay et al. (1999), quienes afirman que no es probable encontrar cerdos con menos de tres días de edad excretando ooquistes, ya que el período prepatente de C. suis es de cuatro días. Por tanto, la presencia de ooquistes en lechones menores a tres días de edad podría deberse a varias razones. En primer lugar, el cultivo fecal en solución de dicromato de potasio confirma la presencia de ooquistes de C. suis, ya que la esporulación (100%) permite diferenciar con respecto a ooquistes de Eimeria spp. En segundo lugar, se podría pensar en la presencia de ooquistes en tránsito intestinal, o bien, que estos lechones recién nacidos se hayan contaminado con heces de camadas previas, de la madre o de las tetas de la cerda. Sin embargo, esta hipótesis se descarta ya que tendrían que haber esporulado para poder resistir la temperatura y humedad del paritorio; además, en el caso que la contaminación provenga del ambiente, los ooquistes no esporulados en tránsito intestinal no serían capaces de sobrevivir debido a la acción de ácidos y enzimas digestivas. Otra respuesta a este hallazgo sería la existencia de alguna ruta alternativa de infección, probablemente por la existencia de formas evolutivas extraintestinales, mediante la cual las cerdas madres pueden transferir formas evolutivas del protozoario a los lechones; sin embargo, esta hipótesis aún está en discusión (Karamon et al. 2007, Sotiraki et al. 2008). Cordero del Campillo et al. (1999) también han señalado la posibilidad de existencia de formas evolutivas en hígado y tejidos linfoides (bazo y ganglios), tomando en consideración la presencia de brotes clínicos de coccidiosis neonatal en granjas con buenas medidas sanitarias; no obstante, Stuart y Lindsay (1986) y Lindsay et al. (1999) no comprobaron la existencia de formas evolutivas extraintestinales en lechones y ratones inoculados experimentalmente con C. suis. La presencia de formas evolutivas extraintestinales ha sido comprobada para especies de Cystoisospora en caninos y felinos (Dubey y Frenkel 1972, Lindsay et al. 1999), así como en C. belli en humanos (Lindsay et al. 1999). Probablemente los merozoítos, en vez de continuar con su ciclo normal de desarrollo en el tracto intestinal, dejan el intestino y se diseminan por vía linfática para invadir linfonódulos mesentéricos, así como otros órganos del sistema retículo endotelial (Lindsay et al. 1999), especialmente en pacientes inmunosuprimidos. Sin embargo, no se han encontrado formas evolutivas extraintestinales de Cystoisospora en tejidos de lechones infectados o en ratones inoculados experimentalmente (Stuart y Lindsay 1986; Lindsay et al. 1999). Por otra parte, Karamon et al. (2007) han señalado que la falta de cuerpo de Stieda en los esporoquístes de C. suis sugieren la ocurrencia de formas extraintestinales en el ciclo de vida del protozoario, tal y como sucede con el grupo de Cystoisosporas que afectan a perros y gatos. Probablemente, cerdas gestantes mantenidas en granjas con pobres condiciones sanitarias y que presenten estados de inmunosupresión ocasionados por efecto del estrés, así como por infecciones como el Síndrome Respiratorio y Reproductivo Porcino (PRRS) o el Circovirus porcino tipo 2 (CPV tipo II), propician la presencia de formas evolutivas de C. suis en tejidos extraintestinales, que de esta manera viajan por vía linfohema-tógena (transplacentaria) para infectar a sus fetos. En el momento del nacimiento, seguramente tendremos lechones infectados por vía transplacentaria, que también actuarán como agentes multiplicadores y diseminadores del parásito al resto de las camadas.
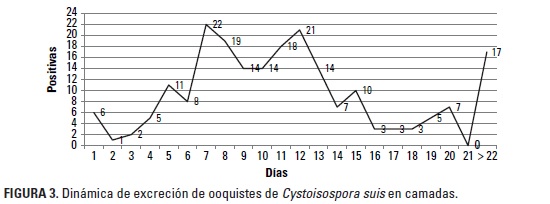
En la Figura 3 se observa la dinámica de excreción de ooquistes en lechones lactantes; se muestra la formación de una curva trifásica con tres picos de excreción (Christensen y Henriksen 1994): un primer pico a los 7 días de edad, un segundo a los 12 días y el tercero a los 21 días. Estos resultados difieren de lo señalado por Harleman y Meyer (1984) y Lindsay et al. (1999) quienes afirman que en lechones inoculados experimentalmente el ciclo de desarrollo de C. suis es bifásico, con la formación de dos picos de excreción e interrupción en la excreción durante dos o tres días entre el primero y segundo período de eliminación. Sin embargo, estos resultados coinciden con lo señalado por Christensen y Henriksen (1994) quienes comprobaron un tercer pico de excreción de ooquistes en lechones infectados experimentalmente. La presencia de un segundo pico de excreción de ooquistes es causada por un segundo ciclo interno de desarrollo del protozoario (segunda esquizogonia); sin embargo, Harleman y Meyer (1984) postularon que este segundo pico se debe al retorno de formas extraintestinales hasta el tracto intestinal, hipótesis que aún no ha sido comprobada. El tercer pico de excreción refleja un retraso en la resistencia inmunológica contra el parásito, resultado de una pobre estimulación antigénica, e incluso, esto podría explicar el retorno en la excreción de ooquistes en cerdos de 5 a 6 semanas de edad cuando son trasladados a otra unidad de producción o corral (Christensen y Henriksen 1994), que teóricamente se ven afectados por el estrés causado por el destete.
En la Figura 4 se muestra la relación entre los valores de prevalencia de C. suis en camadas provenientes de cerdas con diferente número de partos; se encontró que a mayor número de partos menor es la prevalencia en camadas (rho= -0,77; P < 0,05). Estos resultados coinciden con lo señalado por Pinilla (2009) quien determinó efecto de la paridad sobre la prevalencia de C. suis. Por otro lado, estos resultados difieren de lo señalado por Meyer et al. (1999) quienes no comprobaron diferencias estadísticas entre valores de prevalencia a C. suis en camadas provenientes de cerdas con diferente número de partos. Según Cardona et al. (2002) el número de partos de la cerda podría ser un factor de riesgo importante que puede afectar el desempeño productivo en las salas de parto y por eso, en muchas empresas porcinas, se busca mantener cierta uniformidad en esta variable. Además, han señalado que las cerdas adquieren un mejor estatus inmunitario en la medida que se hacen viejas y esto también ha sido comprobado para Micoplasma hyop-neumoniae. También se han comprobado diferencias estadísticas respecto a infecciones por Haemophilus parasuis en cerdas con diferentes pariciones (Holyoake 2006). Probablemente, los lechones que se crían con cerdas primerizas no reciben la cantidad y calidad de anticuerpos calostrales para combatir infecciones por C. suis, mientras que aquellos que se crían con cerdas adultas con sistemas inmunológicos más desarrollados, reciben los anticuerpos necesarios que les permiten adquirir una mejor inmunidad pasiva y combatir infecciones por C. suis. Sin embargo, Lindsay y Dubey (2005) demostraron que los anticuerpos calostrales no protegen contra la enfermedad. Kou-dela y Kucerová (2000) señalaron que la inmunidad mediada por células juega un rol muy importante en la resistencia a la enfermedad en los lechones; sin embargo, en cerdas primerizas con bajo estatus in-munológico no son capaces de transferir a sus hijos los elementos necesarios para el desarrollo de mecanismos de respuesta no específicos (activación de complemento, fagocitosis y citoquinas), lo que significa que los lechones viven sus primeras semanas de vida con un sistema inmune vulnerable y, por tanto, no son capaces de contrarrestar la infección. En cerdas primíparas, la falta de una estimulación antigénica continua puede ser un factor que hace vulnerable a sus crías contra la infección por C. suis, a diferencia de las cerdas multíparas que han estado en mayor contacto con el protozoario y, en consecuencia, han desarrollado un sistema inmunológico capaz de inducir una mejor respuesta en lechones lactantes. Probablemente, la respuesta inmune ante infecciones primarias (inmunidad innata) en lechones de cerdas primíparas sea muy baja, y en la medida que el lechón va creciendo, se activan los mecanismos de inmunidad adaptativa capaces de contrarrestar la infección. Schwarz et al. (2014) demostraron la presencia de sustancias protectoras en el calostro y leche de madres infectadas experimentalmente, las cuales podrían actuar favoreciendo la respuesta inmune del lechón.
En la Tabla 3 se muestra la comparación entre los porcentajes de positividad de acuerdo a la consistencia de las heces. Se encontraron diferentes grados de positividad, lo que refleja que hubo asociación estadística (P < 0,05) con respecto a la consistencia. Aunque se constató presencia de ooquistes en los tres tipos de consistencia de las heces, se observa una frecuencia de 64,8% en aquellas de consistencia semipastosa y pastosa. Estos resultados coinciden con lo señalado por Meyer et al. (1999) y Pinilla (2009), quienes señalaron mayores valores en muestras de consistencia pastosa y cremosa que en aquellas líquidas. Igualmente, Estrada et al. (2004) señalaron que el parásito se encuentra con mayor frecuencia en heces de consistencia pastosa, que en las de consistencia líquida y/o normales de animales clínicamente enfermos. Sin embargo, estos resultados difieren de lo señalado por Hamadejova y Vitovec (2005) y Pavlovic et al. (2008), quienes asociaron al parásito con mayor frecuencia de diarreas acuosas (35,2%) que aquellos que presentaron diarreas de consistencia pastosa (17%). La diarrea en los lechones se deriva de las acciones patógenas del parásito en el epitelio intestinal durante el transcurso de las diferentes etapas que se cumplen en la fase endógena de su ciclo de vida. Durante la esquizogonia se produce diarrea debido a la invasión y multiplicación del parásito dentro de la célula epitelial; sin embargo, la producción de ooquistes es muy baja. En la medida que avanza la infección la diarrea va cediendo y la consistencia de las heces comienza hacerse pastosa e incluso normal, hasta que se cumpla el ciclo de vida del parásito con la debida producción de ooquistes. De acuerdo a esto es improbable conseguir animales excretando ooquistes y con producción de heces liquidas, por lo que habría que considerar otros copatógenos como E.coli, Rotavirus y Cryptosporidium.
Al referir los resultados en cerdos adultos, se determinó que todos los grupos evaluados presentaron excreción de ooquistes, con excepción de las cerdas de reemplazo (Tabla 4). Los resultados obtenidos se analizaron mediante correlación con rangos de Spearman, y se determinó correlación positiva sin significancia estadística (rho = 0,03; P > 0,05), lo que refleja que la edad y la prevalencia a C. suis en cerdos adultos actúa de manera independiente. Las cerdas lactantes presentaron excreción de ooquistes (9,4%), con valores muy similares entre los dos estados. También se observó excreción en machos reproductores (4,9%), con valores similares en los dos estados. Los hallazgos en cerdas madres difieren con lo hallado por Lindsay et al. (1999) y Farkas et al. (2004), quienes no encontraron cerdas madres excretando ooquistes del protozoo y, por tanto, concluyen que las cerdas no juegan ningún rol en la cadena de transmisión del parásito. Sin embargo, coincidimos con González de Wilinski (1993), Meyer et al. (1999), Karamon y Ziomko (2004) y Pinilla y Coronado (2008), quienes señalaron diferentes proporciones del parásito en cerdas madres. La baja presencia de ooquistes de C. suis en heces de madres y verracos, demuestra que estos grupos pueden excretar cantidades de ooquistes que no son detectables con las pruebas convencionales; no obstante, esas cantidades bajas de ooquistes pueden tornarse infectivas y diseminarse por toda la paridera, sobre todo cuando existen problemas higiénico-sanitarios y de manejo. Por tal motivo, las cerdas juegan un papel importante en la cadena de transmisión, bien sea por un parasitismo activo no determinado, o por transporte pasivo de ooquistes a sus lechones. Con relación a los cerdos después del destete, se determinó excreción de ooquistes en las tres etapas, con especial significancia en la iniciación (23,8%). Estos resultados coinciden con González de Wilinski (1993) y Pinilla y Coronado (2008), quienes determinaron la presencia del protozoario en animales destetados, y por tanto se infiere, que lechones destetados criados y mantenidos en corrales próximos al área de maternidad actúan como fuentes diseminadoras del parásito, sobre todo en aquellas granjas donde no aplican buenas medidas de bioseguridad.
Los resultados obtenidos en cerdas lactantes se distribuyeron de acuerdo al número de partos y se analizaron mediante una prueba de correlación con rangos de Spearman, el cual arrojó una correlación negativa y estadísticamente significativa (rho =-0,98; P < 0,05), lo que indica que existe una disminución de la prevalencia en madres en la medida que aumenta el número de partos (Tabla 5). Según estos resultados existe asociación estadística, y se observa mayor excreción de ooquistes en cerdas de primer parto, lo que probablemente se deba a factores de tipo inmu-nológico involucrados. Aunque se ha reportado que cerdas madres excretan pocas cantidades de ooquistes, este hallazgo tiene un significado importante para entender el comportamiento epidemiológico de C. suis. Por tanto, se confirma que las cerdas madres excretan ooquistes del parásito a través de las heces; sin embargo, del total de cerdas lactantes excretando ooquistes de C. suis (9,4%), se observó que 6,5% eran de primer parto, lo que reflejó la asociación estadística existente. Probablemente, las cerdas durante su crecimiento mantienen y esconden formas evolutivas intra y extraintestinales del protozoario; cuando llega el momento del primer parto comienzan a excretar cantidades suficientes de ooquistes que son detectados por medio de técnicas de concentración - flotación; no obstante, en la medida que avanzan en edad sus sistemas inmunológicos se desarrollan hasta el punto de contrarrestar la infección y, por tal motivo, disminuye la cantidad de ooquistes los cuales no son detectables por técnicas convencionales de flotación. También se podría pensar que las cerdas primerizas se tornan más vulnerables que las cerdas viejas ante los cambios ocurridos en el traslado a la sala de partos, ruidos, personal y eventos del primer parto que ocasionan un gran estrés a estos animales los cuales pueden alterar su sistema inmunológico y, de esta manera, iniciar la excreción de ooquistes de Cystoisospora. Klopfenstein etal. (1999) y Lanfranchi et al. (2008) señalaron que los nuevos eventos y cambios que ocurren en el parto de las cerdas (dolor, nerviosismo), son fuente principal de estrés, sobre todo en cerdas primíparas, las cuales también se pueden ver inmunocomprometidas por efecto de la lactancia.
En la Tabla 6 se muestra la comparación entre valores de prevalencia a C. suis en lechones de iniciación de diferentes semanas de producción. Según estos resultados existen diferencias estadísticas (P < 0,05) en los seis grupos examinados, así: los animales con cuatro y cinco semanas de edad presentaron los mayores valores de prevalencia (16%). El destete de los cerdos ha sido señalado como el momento de mayor estrés en la etapa productiva del animal. Nilsson (1988) asoció el estrés ocasionado por el destete con la excreción de ooquis-tes de C. suis en cerdos de 5 y 6 semanas de edad. Indudablemente, la respuesta inmune del lechón ante cualquier agente patógeno puede verse comprometida por situaciones de manejo que desencadenen estrés. Existen suficientes evidencias que señalan que el estrés tiene efectos sobre el sistema inmune del cerdo. En tal sentido, se ha comprobado que el estrés aumenta los niveles sanguíneos de corticoesteroides, especialmente cortisol, pudiendo reducir la proliferación de linfocitos, así como el tamaño de los linfonódulos y, por consiguiente, promueve la disminución del número de anticuerpos producidos (Roth 1999). Esta alteración en los mecanismos inmunes del lechón podría jugar un papel importante en la aparición de ooquistes en cerdos jóvenes; sin embargo, se desconoce el papel que juegan las cerdas madres en la respuesta inmune del lechón.
Con respecto al tamaño de las granjas, se determinaron 17 granjas pequeñas (< 150 cerdas), 32 medianas (150 a 500) y 18 grandes (> 500). En la Figura 5, se muestra la comparación entre resultados de C. suis en granjas con diferentes tamaños. De acuerdo a estos resultados no se encontraron diferencias estadísticas (P > 0,05) entre la presencia del parásito con respecto al tamaño de las granjas. Estos resultados coinciden con Farkas et al. (2004) y Estrada et al. (2004), quienes no hallaron diferencias estadísticas entre la presencia o ausencia de ooquistes, e incluso, tampoco con respecto a la época y condiciones sanitarias de las explotaciones examinadas. Sin embargo, diferimos de Niestrath et al. (2002) quienes demostraron mayor presencia de C. suis en granjas pequeñas (20 a 69 madres) y medianas (75 a 130), que en aquellas consideradas grandes (252 a 320). Igualmente, Heylen et al. (2004) demostraron mayor presencia del parásito en granjas pequeñas. Por otra parte, los resultados obtenidos se apartan de lo señalado por Karamon y Ziomko (2004) quienes reportaron mayores valores de prevalencia en granjas grandes, donde existe mayor cantidad de animales. Por su parte, Holm (2001) señaló que el uso intensivo de las salas de maternidad y el incremento en el número de madres han traído como consecuencia que las jaulas paritorias no se limpien y desinfecten adecuadamente, y por tanto, aumenta la incidencia del protozoario en las explotaciones porcícolas.
De acuerdo a la encuesta aplicada, se determinó que 55 granjas eran de ciclo completo (82%) y 12 de ciclo incompleto (18%). En la Figura 6 se muestra la comparación entre resultados a C. suis en granjas con diferentes ciclos de producción. De acuerdo con estos resultados no se encontraron diferencias estadísticas (P > 0,05) entre valores positivos con respecto al ciclo de producción, lo que indica que en ambos tipos de granja existe la misma probabilidad de encontrar la infección. Pinheiro (1973) señaló que las granjas porcinas se clasifican de acuerdo al ciclo de producción en explotaciones de ciclo completo e incompleto. Según los resultados obtenidos se comprueba que la dinámica del protozoario no se vio afectada por el ciclo de producción. Ahora bien, en aquellas granjas con ciclos completos de producción donde existen corrales de destete cercanos al área de maternidad y pobres condiciones sanitarias, los mecanismos de dispersión (personal, roedores, etc.) se encargan de mantener mayores niveles de prevalencia que aquellas granjas donde el ciclo de producción es interrumpido (incompleto).
Con respecto al tipo de piso de la maternidad, se determinó que 22 (32,8%) presentaban pisos sólidos, 27 con pisos de plástico (40,2%) y 18 (27%) presentaban la combinación de ambos (mixto). En la Figura 7 se muestra la comparación entre resultados positivos a C. suis en granjas con diferentes tipo de piso. Según estos resultados se encontraron diferencias estadísticas (P < 0,05) entre la presencia del protozoario y el tipo de piso. Se puede inferir que en aquellas granjas con pisos de plástico y mixto existe menor probabilidad de conseguir el parásito, respecto de aquellas que tienen piso sólido. Probablemente estos resultados coinciden con lo señalado por Heylen et al. (2004), quienes determinaron menor presencia de la infección en aquellas camadas criadas en jaulas con piso plástico. Igualmente, estos resultados coinciden con lo señalado por Sayd y Kawazoe (1996), que encontraron ooquistes en tres tipos de pisos; sin embargo, observaron menor cantidad en aquellos denominados como "autolimpiables", los cuales se caracterizan por ser de paletas de plástico. Las camadas criadas en pisos sólidos y mixtos son más vulnerables a la infección, ya que se dificulta realizar una buena limpieza y desinfección, lo que trae como consecuencia mayor viabilidad y permanencia del parásito dentro de la unidad paritoria, a diferencias de aquellas mantenidas en pisos plásticos, donde se puede realizar una mejor limpieza y desinfección del piso.
1. Existe una amplia distribución del protozoario y alta variabilidad de la prevalencia en Venezuela, la cual podría ser controlada si se mejoran las condiciones higiénico-sanitarias de las explotaciones porcícolas. Sin embargo, mediante estudios multivariados se podría establecer interacciones entre factores de riesgo epidemiológico con el propósito de implementar programas de control y prevención del protozoario.
2. Se demostró la presencia de ooquistes no esporulados de C. suis en cerdos con menos de 72 h de nacidos, así como la excreción de ooquistes en cerdas madres y lechones en iniciación, lo que supone que estos grupos podrían actuar como fuentes de infección y diseminación del parásito.
3. El número de partos de la cerda tuvo impacto sobre la prevalencia obtenida en camadas y madres; sin embargo, el tamaño y tipo de granja no tuvieron efecto significativo sobre los resultados obtenidos.
4. Los hallazgos de este estudio permiten redireccionar futuras investigaciones con respecto a los mecanismos de transmisión y control del enterococci-dio. Igualmente, existen mecanismos inmunológicos aún sin dilucidar que podrían estar involucrados en la cadena de transmisión del protozoario y jugar un papel importante en el desarrollo de la cystoisosporosis porcina.
Cardona A, Pijoan C, Utrera V, Deen J. 2002. Prevalence of Mycoplasma hyopneumoniae in different parity cull sows. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th IPVS Congress. Vol. 1; 2004 Jun 27-Jul 1; Hamburg (GE): International Pig Veterinary Society. p. 402. [ Links ]
Christensen JP, Henriksen S. 1994. Shedding of oocysts in piglets experimentally infected with Isospora suis. Act Vet Scand. 35(2): 165-172. [ Links ]
Cochran R. 2008. Avances en la eficiencia y salud en cerdos de recría y engorde: clasificación de la consistencia de las heces. En: Memorias de la Expoferia Porcina, Maracay, Venezuela. [ Links ]
Cordero del Campillo M, Hidalgo M, Diez N. 1999. Parte IV: Parasitosis del cerdo. En: Cordero del Campillo M, Rojo FA, Martínez AR, Sánchez MC, Hernandez S, Navarrete I, Diez P, Quiroz H, Carvalho M, editores. Parasitología Veterinaria. 1° ed. Madrid (ES): McGraw-Hill / Interamericana. P. 451-456. [ Links ]
Driesen SJ, Carland PG, Fahy VA. 1993. Studies on preweaning piglet diarrhoea. Aust Vet J. 70(7): 259-262. [ Links ]
Dubey J, Frenkel J. 1972. Extra - intestinal stages of Isospora felis and I. rivolta (Protozoa: Eime-riidae) in cats. J of Protozool. 19: 89-92. Doi: 10.1111/j.1550-7408.1972.tb03419.x. [ Links ]
Estrada E, Morilla A, Lafranchi E. 2004. Frequency of Isospora suis infected herds in Mexico. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th IPVS Congress. Vol. 1; 2004 jun. 27 - jul. 1; Hamburg (GE): International Pig Veterinary Society. p. 309. [ Links ]
Farkas R, Szeidemann Z, Majoros G. 2004. Prevalence and Geographical distribution of Isosporosis in swine farms of Hungary. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th IPVS Congress. Vol. 1; 2004 jun. 27-jul. 1; Hamburg (GE): International Pig Veterinary Society. p. 314. [ Links ]
[Feporcina] Federación Venezolana De Porcicultura. 2010. Comportamiento del sector porcino venezolano en el año 2005. Rev. Inf. Divulg. 1: 10-12. [ Links ]
González de Wilinski Y, De Moreno L, García G. 2000. Isospora suis en granjas con diferentes condiciones de instalaciones y manejo. Vet Trop. 25(2): 257-265. [ Links ]
González de Wilinski Y. 1993. Prevalencia de coccidias en suinos del estado Aragua y Municipio Diego Ibarra del estado Carabobo. Vet Trop. 18: 45-57. [ Links ]
Hamadejova K, Vitovec J. 2005. Ocurrence of the coccidium Isospora suis in piglets. Vet Med Czech. 50(4): 159-163. [ Links ]
Harleman JH, Meyer RC. 1984. Life cycle of Isospora suis in gnotobiotic and conventionalized piglets. Vet Parasitol. 17(1): 27-39. Doi: 10.1016/0304-4017(84)90062-1. [ Links ]
Hendrix CM. 1999. Diagnóstico Parasitológico Veterinario. 2° ed. Madrid (ES): Editorial Harcourt Brace. [ Links ]
Henriksen SA, Christensen JP. 1992. Demonstration of Isospora suis oocysts in faecal samples. Vet Rec. 131(19): 443-444. [ Links ]
Heylen P, De Smet K, Vyt P, Gevaert D. 2004. Routine coprological confirmation of the history of Isosporosis in 10 - 18 day old piglets. Vlaams Diergeneeskundig Tijdschrift. 73: 420-423. [ Links ]
Holm A. 2001. Coccidiosis in piglets seen from the point of view of the practising veterinarian. Parasitol Res. 87(4): 357-359. Doi: 10.1007/PL00008593. [ Links ]
Holyoake PK. 2006. Dam parity affects the performance of nursery pigs. En: Nielsen JP, Jorsal SE, editores. Proceedings of the 19th IPVS Congress. Vol 1. 2006 jul. 16-19; Copenhagen (DM): International Pig Veterinary Society. p. 149. [ Links ]
Karamon J, Ziomko I, Cencek T. 2007. Prevalence of Isospora suis and Eimeria spp. in suckling piglets and sows in Poland. Vet Parasitol. 147(1-2): 171-175. Doi: 10.1016/j.vetpar.2007.03.029. [ Links ]
Karamon J, Ziomko I. 2004. Prevalence of coccidia invasions in sows and suckling piglets in Poland. En: Blaha T, Pahlitzsch C, editores. Proceedings of the 18th International Pig Veterinary Society Congress; 2004 jun. 17 - Jul. 1; Hamburg (DE): International Pig Veterinary Society. p. 21. [ Links ]
Klopfenstein C, Farmer C, Martineau G. 1999. Diseases of the mammary glands and lactation problems. En: Straw BE, D'Allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 8° ed. Ames (IW): Iowa State University Press. p. 833-860. [ Links ]
Koudela B, Kucerová S. 2000. Inmunity against Isospora suis in nursing piglets. Parasitol Res. 86(10): 861-863. Doi: 10.1007/PL00008515. [ Links ]
Lanfranchi E, Gonxález J, Filios S. 2008. The efficacy of butafosfan in the periparturient sow-Field trial Mexico. En: Proceedings of the 20th IPVS Congress; 2008 jun. 22-26; Durban (SA): International Pig Veterinary Society. p. 479. [ Links ]
Lindsay D, Blagburn B, Dubey J. 1999. Coccidia and Other Protozoa. En: Straw BE, D'Allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 8° ed. Ames (IW): Iowa State University Press. p. 655-660. [ Links ]
Lindsay D, Dubey J. 2005. Coccidia and Other Protozoa. En: Straw BE, D'allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 9° ed. Ames (IW): Iowa State University Press. p. 861 - 873. [ Links ]
Lohr S. 2000. Muestreo: Diseño y análisis. International Thomson Editores. México. 480 p. [ Links ]
[MARNR] Ministerio del Ambiente y de los Recursos Naturales Renovables. 2007. Anuario Climatológico. Estados Aragua y Carabobo. 170 p. [ Links ]
Meyer C, Joachim A, Daugschies A. 1999. Ocurrence of Isospora suis in larger piglet production units and on specialized piglet rearing farms. Vet Parasitol. 82(4): 277-284. [ Links ]
Morales G, Pino A. 1987. Parasitología cuantitativa. Caracas (VZ): Fondo Editorial Acta Científica Venezolana. 132 p. [ Links ]
Niestrath M, Takla M, Joachim A, Daugschies A. 2002. The role of Isospora suis as a pathogen in conventional piglet production in Germany. J Vet Med B Infect Dis Vet Public Health. 49(4): 176-180. Doi: 10.1046/j.l439-0450.2002.00459.x. [ Links ]
Nilsson O. 1988. Isospora suis in pigs with post weaning diarrhea. Vet Rec. 122(13): 310-311. [ Links ]
Ortega-Mora L, Troncoso J, Rojo-Vázquez F, Gómez-Bautista M. 1992. Evaluation of an improved method to purify Cryptosporidium parvum oocysts. Res Rev Parasitol. 52(3-4): 127-130. [ Links ]
Otten A, Takla M, Daugshies A, Rommel M. 1996. The epizootiology and pathogenic significance of infections with Isospora suis in ten piglet production operations in Nordrhein-Westfalen. Berl Munchen Tierarztl Wochenschr. 109(6-7): 220-223. [ Links ]
Pavlovic I, Savic B, Jakic-Dimic D. 2008. Prevalence of coccidiosis in farm - farrowing conditions. En: Proceedings of the 20 th IPVS Congress; 2008 jun. 22-26; Durban (SA): International Pig Veterinary Society. p. 345. [ Links ]
Pinheiro L. 1973. Los cerdos. Buenos Aires (AR): Editorial Hemisferio Sur S.R.L. [ Links ]
Pinilla JC, Coronado A. 2008. Prevalencia de Isospora suis en lechones criados en granjas de la región Centro-Occidental de Venezuela. Zoot Trop. 26(1): 47-53. [ Links ]
Pinilla JC. 2009. Prevalencia de Isospora suis en granjas porcinas intensivas ubicadas en el estado Aragua (Venezuela). Zoot Trop. 27(2): 1-9. [ Links ]
Rodríguez D. 1995. Estudio Seroepidemiológico de la enfermedad de Aujeszky en granjas porcinas del estado Carabobo [tesis de maestría]. [Maracay (VZ)]: Universidad Central de Venezuela. [ Links ]
Roth JA. 1999. The System Inmune. En: Straw BE, D'allaire S, Mengeling WL, Taylor DJ, editores. Diseases of swine. 8° ed. Ames (US): Iowa State University Press. p. 799-820. [ Links ]
[SASA] Servicio Autónomo de Seguridad Agropecuaria. 2010. Censo de granjas porcinas de los estados Aragua y Carabobo. En: Reportes de programa vacunación contra Fiebre Aftosa. Departamento de epidemiología, Servicio Autónomo de Sanidad Agropecuaria. [ Links ]
Sayd S, Kawazoe U. 1996. Experimental infection of swine by Isospora suis Biester 1934 for species confirmation. Mem Inst Oswaldo Cruz. 93(6): 851-854. [ Links ]
Schwarz L, Worliczek H, Winkler M, Joachim A. 2014. Superinfection of sows with Cystoisospora suis ante partum leads to a milder course of cys-toisosporosis in suckling piglets. Vet Parasitol. 204 (3-4): 158-168. [ Links ]
Sotiraki S, Roepstorff A, Nielsen JP, Maddox-Hyttel C, Enoe C, Boes J, Murrell K, Thamsborg S. 2008. Population dynamics and intra-litter transmissions patterns of Isospora suis in suc-kling piglets under on- farms conditions. Parasitology. 135(3): 395-405. Doi: 10.1017/S0031182007003952. [ Links ]
Statistix. 2003. Statistix 8. Analytical Software for Windows. USA. [ Links ]
Stuart BP, Lindsay DS. 1986. Coccidiosis in swine. Vet Clin North Am Food Anim. Pract. 2(2): 455-468. Doi: 10.1016/S0749-0720(15)31256-1. [ Links ]
Pinilla JC, Da Silva N. 2017. Factores de riesgo asociados a la infección por Cystoisospora suis en granjas porcinas de la región central de Venezuela. [Risk factors associated with Cystoisospora suis infection in swine herds of the central region of Venezuela]. Rev Med Vet Zoot. 64(2): 25-43. Doi: 10.15446/rfmvz.v64n2.67210.