Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157On-line version ISSN 2590-7379
Biomédica vol.27 suppl.1 Bogotá Jan. 2007
Caracterización biológica y genética de dos clones pertenecientes a los grupos I y II de Trypanosoma cruzi de Colombia
Luz Adriana Botero, Ana María Mejía, Omar Triana
Grupo de Chagas, Instituto de Biología, Universidad de Antioquia, Medellín, Colombia.
Recibido: 19/12/05; aceptado: 24/04/06
Introducción. T. cruzi I y T. cruzi II son grupos genéticamente diferentes y se cree que dicha variabilidad es determinante del tropismo tisular en el hospedero vertebrado y responsable de las diversas manifestaciones clínicas de la enfermedad de Chagas.
Objetivo. Caracterizar biológica y genéticamente dos clones colombianos de los grupos T. cruzi I y II en el modelo murino.
Materiales y métodos. Las cepas CAS15 y AF1 pertenecientes a los grupos T. cruzi I y II fueron clonadas en medio semisólido. Un clon de cada una de ellas y una mezcla de ambos se utilizaron para infectar ratones, los cuales se sacrificaron a diferentes tiempos post-infección. Para analizar la presencia del parásito en sangre y diferentes órganos, se utilizaron el microhematocrito y la reacción en cadena de la polimerasa con los marcadores de la secuencia satélite del ADN nuclear y con el espaciador intergénico del gen mini-exón.
Resultados. El clon T. cruzi I fue más infectivo, observándose un tropismo preferencial por corazón, recto y músculo esquelético, mientras que el clon T. cruzi II presentó un tropismo preferencial por bazo e hígado. Durante la infección con la mezcla de los clones, se observó que el clon T. cruzi I predominó sobre el T. cruzi II tanto en sangre como en órganos.
Conclusiones. Los resultados confirman que las diferencias genéticas entre los grupos de T. cruzi podrían estar determinando el tropismo tisular y de esta manera jugar un papel fundamental en el entendimiento de las manifestaciones clínicas de la enfermedad de Chagas en Colombia.
Palabras claves: Trypanosoma cruzi, enfermedad de Chagas, variación (Genética), tropismo.
Biological and genetic characterization of two Colombian clones of Trypanosoma cruzi groups I and II
Introduction. Genetic differences between T. cruzi I and T. cruzi II may determine differences in their tissue tropism in the vertebrate host and may also be responsible for the differences in clinical manifestations of Chagas disease.
Objective. Two Colombian clones of the T. cruzi groups I and II were characterized biologically and genetically in a murine model.
Materials and methods. Strains Cas15 and AF1 belonging to the T. cruzi groups I and II were cloned in semisolid medium. A clone of each strain and a mix of both were used to infect mice; the mice were subsequently sacrificed at selected post-infection intervals. In order to identify the parasite presence in blood and organs, two methods were used (a) microhematocrit and (b) polymerase chain reaction with primers for satellite DNA and the intergenic region of mini-exon.
Results. The T. cruzi I clone was more infectious, with a preferential tropism observed in heart, rectum and skeletal muscle, whereas clone T. cruzi II exhibited a preferential tropism for spleen and liver. During the infection with the clone mixture a predominance of the T. cruzi I clone over clone II in blood as well as in organs was observed.
Conclusions. The results corroborate that the genetic differences between the T. cruzi groups correlate with their tissue tropism, and can play an essential role in explaining the clinical manifestations of Chagas disease observed in Colombia.
Key words: Trypanosoma cruzi, Chagas disease, variability (Genetics), tropism.
La enfermedad de Chagas, causada por el parásito Trypanosoma cruzi, se encuentra ampliamente distribuida en países de Centro y Sur América, afectando aproximadamente a 20 millones de individuos (1). En Colombia, afecta a cerca del 5% de la población y aproximadamente el 11% está en riesgo de contraer la infección (2).
La enfermedad presenta un curso clínico variable que inicia con una fase aguda asintomática, caracterizada por alta parasitemia y detección de T. cruzi prácticamente en todos los órganos del hospedero (3). La enfermedad avanza a una fase crónica, caracterizada por baja parasitemia y un impredecible curso clínico que puede involucrar problemas cardiacos o gastrointestinales (4). En esta fase el parasitismo en tejidos es muy alto y restringido a algunos órganos como corazón, músculo esquelético, hígado, esófago, bazo y recto (5,6). La habilidad del parásito para sobrevivir a la fase aguda y avanzar hacia la fase crónica e invadir determinados órganos depende tanto de factores genéticos del parásito como del hospedero (7-11). Por esto, diversas investigaciones han estudiado la variabilidad genética del parásito y su posible relación con las manifestaciones clínicas de la enfermedad (7). En T. cruzi se han utilizado diferentes marcadores bioquímicos y moleculares para tratar de correlacionar la diversidad genética del parásito con sus características biológicas. El uso del espaciador intergénico de los genes mini-exón genera dos claras divisiones filogenéticas conocidas como T. cruzi I y T. cruzi II (12), las cuales permiten establecer algunas asociaciones importantes entre la taxonomía y la biología del parásito, el desarrollo de la enfermedad y diferentes parámetros epidemiológicos, entre otros (13,14).
Tradicionalmente, el grupo T. cruzi I se ha asociado al ciclo selvático de transmisión y se dice que predomina en los países ubicados al norte de la cuenca amazónica, entre ellos Colombia, mientras que el grupo T. cruzi II predomina en los países del sur y se encuentra asociado a los humanos y, por ende, al ciclo doméstico de transmisión (15). Por otra parte, se ha visto que áreas con gran morbilidad presentan la circulación del grupo T. cruzi II, mientras que en donde circula el grupo T. cruzi I es poco frecuente la enfermedad (7). Sin embargo, estudios recientes muestran que los dos grupos están circulando en ambos ambientes (13-16); en Venezuela, por ejemplo, un estudio realizado durante el año 2004 reveló un mayor número de pacientes infectados con el grupo T. cruzi I que presentaban la fase aguda de la enfermedad con manifestaciones clínicas similares a las observadas en pacientes infectados con el grupo T. cruzi II (16). Así mismo, en infecciones experimentales se ha encontrado que el grupo al que pertenecen los parásitos determina el tropismo a tejidos, la parasitemia y la patogénesis de la enfermedad (1,7,17).
En Colombia también se ha reportado recientemente la presencia simultánea de los dos grupos filogenéticos en varias de las cepas estudiadas, evidenciando una mezcla de ambos, pero con predominio del grupo I en medios de cultivo (18). Este resultado, junto con el hallazgo de los dos grupos de T. cruzi en las heces de vectores recolectados de poblaciones silvestres del norte de Colombia (datos no publicados), sugiere la posibilidad de que ambos grupos circulan de manera simultánea en la naturaleza, generando una epidemiología más compleja, pues tanto vectores como hospederos podrían estar infectados con los dos grupos y, en éstos últimos, darse un tropismo diferencial a tejidos ocasionan-do manifestaciones clínicas diversas (1,18,19).
Por lo anterior, y teniendo en cuenta que en Colombia se ha reportado la presencia de los dos grupos de T. cruzi, el objetivo del presente trabajo fue caracterizar biológica y genéticamente dos clones de T. cruzi aislados de cepas colombianas pertenecientes a los grupos I y II. Para esto, se evaluó el tropismo a órganos de ratones infectados individualmente con cada uno de ellos y durante una infección mixta con ambos clones. Este aspecto es de gran importancia para entender las manifestaciones clínicas y la epidemiología de la enfermedad de Chagas en Colombia.
Materiales y métodos
Parásitos
Se utilizaron las cepas colombianas I.RHO/CO/00/CAS-15.CAS (CAS15) y I·PANS/CO/93/AF-1.ANT (AF1) caracterizadas genéticamente por isoenzimas, por RAPD y con el marcador mini-exón como T. cruzi I y T. cruzi IIb, respectivamente (datos no publicados). La cepa CAS15 se aisló en el año 2000 del vector Rhodnius prolixus silvestre del departamento de Casanare y la cepa AF1 del vector Panstrongylus geniculatus silvestre del municipio de Amalfi, departamento de Antioquia. Las cepas se han mantenido en el laboratorio del Grupo de Chagas de la Universidad de Antioquia por repiques cada siete días en medio de cultivo LIT suplementado con suero bovino fetal al 10% y a una temperatura de 28°C (20).
Clonación de las cepas
Los clones para cada una de las cepas fueron obtenidos a partir de epimastigotes cultivados en medio semisólido AGAR-LIT-BHI-sangre (21). Para esto se mezclaron 50 ml de agar estéril con pH 7,2, 100ml de LIT con suero bovino fetal al 10%, 100 ml de infusión de hígado y corazón (BHI) estéril y 6,25 ml de sangre desfibrinada. A continuación, se vertieron 25 ml de esta mezcla en cajas de Petri de 95 mm de diámetro y, luego de comprobar la esterilidad del medio, se sembraron 20 células por caja. Posteriormente se envolvieron las cajas en papel estéril y se incubaron aproximadamente 30 días a 28°C hasta observar el crecimiento de colonias puntiformes transparentes. Se aislaron y cultivaron siete clones para la cepa CAS15 y dos para la cepa AF1 en medio LIT suplementado con suero bovino fetal al 10%, según lo reportado previamente (22).
Extracción de ADN y caracterización genética de los clones en cultivo
El ADN de las cepas parentales y de sus respectivos clones se obtuvo por el método salting out (23). Cada clon se caracterizó genéticamente por la técnica de reacción en cadena de la polimerasa (PCR) con el espaciador intergénico de los genes del mini-exón para evaluar si efectivamente el grupo de T. cruzi encontrado correspondía al de su cepa de origen, debido a que se han encontrado en las cepas mezclas de ambos grupos (18).
Para amplificar dicha región se utilizaron los iniciadores TC1 (5´-GTGTCCGCCACCT-CCT-TCGGGCC-3´), TC2 (5´-CCTGCAGGCACAC-GTGTGTGTG-3´) y TCC (5´-CCCCCCTCCCAG-GCCACACTG-3´), los cuales amplifican un fragmento de 350 pb para el grupo T. cruzi I y un fragmento de 300 pb para el grupo T. cruzi II (13). La PCR se hizo en un volumen final de 25 µl que contenían 2,5 µl de ADN molde, 50 mM KCl, 10mM Tris-HCl, 0,1% Triton X-100, 1,5mM MgCl2, 12,5 pmol de cada iniciador, 200mM dNTPs y 0,625 unidades de Taq ADN polimerasa. Los ciclos de amplificación se realizaron a una temperatura inicial de 94°C por 3 minutos, seguida de 27 ciclos a 94°C por 30 segundos, 55°C por 30 segundos, 72°C por 30 segundos y un ciclo final de 72°C por 10 minutos.
Para determinar si los clones aislados eran genéticamente diferentes se utilizó la técnica PCR de baja astringencia con un único iniciador específico (LSSP-PCR), que requiere un primer paso de amplificación de la región variable del ADN del cinetoplasto (kADN). Para amplificar dicha región se utilizaron los iniciadores S35 (5´-AAATAATGTACGGGGAGATGCATGA-3´) y S36 (5´-GGGTTCGATTGGGGTTGGTGT-3´), los cuales amplifican un fragmento de 330 pb correspondiente a la región variable de los minicírculos (24). La PCR se llevó a cabo en un volumen final de 50 µL de reacción que contenía 1 ml de ADN molde, 50 mM de KCl, 10 mM Tris-HCl, 0,1% Triton X-100, 1,5 mM de MgCl2, 10 pmol de cada iniciador, 200 mM de dNTPs y 2,5 unidades de Taq ADN polimerasa. Los ciclos de amplificación se realizaron a una temperatura inicial de 94°C por 3 minutos, seguida de 35 ciclos de 94°C por 45 segundos, 63°C por 45 segundos y 72°C por 45 segundos, y un ciclo final de 72°C por 10 minutos.
La banda de 330 pb, obtenida del kADN, se purificó a partir de geles de agarosa de bajo punto de fusión al 1,5% y se diluyó 10 veces en agua bidestilada. Se usó 1 µl de la dilución como molde para la reacción de LSSP-PCR (24), la cual se llevó a cabo en 25 µl de volumen final utilizando 50 mM de KCl, 10 mM Tris-HCl, 0,1% Triton X-100, 1,5 mM de MgCl2, 120 pmoles del iniciador S35, 200 mM de cada dNTP y 4 unidades de Taq polimerasa. Los ciclos de amplificación se realizaron a una temperatura inicial a 94°C por 3 minutos, seguida de 35 ciclos a 94°C por 45 segundos, 30°C por 45 segundos y 72°C por 45 segundos y un ciclo final a 72°C por 10 minutos (5). Los productos amplificados se analizaron en geles de poliacrilamida al 6% (25) teñidos con nitrato de plata (1). Este procedimiento se realizó por duplicado con el fin de evaluar la reproducibilidad de la técnica.
Infección experimental de ratones
Tres grupos de dieciocho ratones machos suizos de 20 días de nacidos fueron inoculados intraperitonealmente con tripomastigotes obtenidos de medio de cultivo de cada clon y con una mezcla de ambos. El inoculo utilizado fue de 800.000 tripomastigotes de cada clon, tanto en las infecciones individuales como en la mixta. Para determinar la presencia de parásitos en sangre, al séptimo día de infección se revisaron los ratones por el método del microhematocrito y se tomó una muestra de sangre de la cola de los ratones infectados con la mezcla de los clones en un trozo de tela para su posterior análisis por PCR (26). Para determinar la presencia de los clones en órganos, se sacrificaron grupos de tres ratones de cada infección y se les extrajo corazón, hígado, bazo, recto y músculo esquelético tomado del fémur de cada ratón. Estos procedimientos se repitieron cada siete días hasta llegar al día 28 y luego se hicieron a los días 60 y 90 de la infección (pi). Como control negativo se utilizó un ratón macho suizo no infectado al que se le tomaron las mismas muestras. El sacrificio de los ratones se llevó a cabo por el método de inhalación de CO2, el cual fue aprobado por el Comité de Bioética de la Universidad de Antioquia.
Extracción del ADN
La obtención del ADN de la tela impregnada con sangre de los ratones se hizo por el método de Chelex®, que consiste en adicionar a la sangre una resina y someterla a altas temperaturas que liberan el ADN en el sobrenadante (26). El ADN de los órganos fue extraído por el método de fenol-cloroformo-alcohol isoamilico (25:24:1), previa homogenización en solución de digestión (SDS 10%, NaCl 5 M, EDTA 0,5M, Tris-HCL 1M pH 7,5) y proteinasa K (100mg/ml), con posterior precipitación con etanol (27).
Detección del parásito por PCR
Para determinar si el parásito se encontraba presente en los diferentes órganos de los tres tipos de infección se usó una secuencia satélite del ADN nuclear de T. cruzi (Sat-ADN).
Para amplificar el Sat-ADN se utilizaron los iniciadores TcZI (5´-CGAGCTCTTGCCCACACG GGTGCT-3´) y TcZII (5´-CCTCCAAGCAGCGG ATAGTTCAGG-3´), los cuales amplifican un fragmento de 188 pb (28). La PCR se llevó a cabo en un volumen final de 50 µL de reacción que contenía 1 µl de ADN molde, 50 mM de KCl, 10 mM Tris-HCl, 0,1% Triton X-100, 1,5 mM de MgCl2, 20 pmol de cada iniciador, 200 mM de dNTPs, y 2,5 unidades de Taq ADN polimerasa. Los ciclos de amplificación se realizaron a una temperatura inicial de 94°C por 3 minutos, seguida de 35 ciclos de 94°C por 45 segundos, 60°C por 1 minuto y 72°C por 1 minuto, y un ciclo final de 72°C por 10 minutos.
Además, para determinar el grupo filogenético presente en las muestras de sangre y órganos de la infección con la mezcla de los clones se utilizó el marcador mini-exón mediante el procedimiento descrito anteriormente.
Los productos amplificados fueron analizados en geles de agarosa al 2%, teñidos con bromuro de etidio y visualizados bajo un transiluminador UV (29). Cada uno de estos ensayos se hizo por duplicado.
Resultados
Aislamiento y caracterización genética de los clones
Para la cepa CAS15 se aislaron 7 clones, los cuales se denominaron como CAS15 cl1 hasta CAS15 cl7. Todos los clones amplificaron la banda de 350 pb para el marcador del gen mini-exón, característica del grupo T. cruzi I (figura 1). Para la cepa AF1 se aislaron dos clones a los que se les denominó AF1 cl1 y AF1 cl2, los cuales amplificaron la banda de 300 pb, característica del grupo T. cruzi II (figura 1). El análisis de los patrones electroforéticos con la técnica LSSP-PCR indicó que los clones CAS15 cl1, CAS15 cl3, CAS15 cl4, CAS15 cl5 y CAS15 cl6 presentaron un patrón de bandas idéntico, mientras que los clones CAS15 cl2 y CAS15 cl7 presentaron perfiles únicos (figura 2). Debido al bajo número de clones obtenidos para la cepa AF1 no se realizó el análisis por LSSP-PCR. Para realizar la caracterización biológica de los clones pertenecientes a estos dos grupos de T. cruzi se seleccionaron al azar los clones CAS15 cl3 y AF1 cl1.


Detección de parásitos en sangre por microhematocrito
Durante la infección individual con el clon Cas15 cl3 se observó que los parásitos en sangre comenzaron a aparecer al día 7 de la infección (pi), con un 78% de muestras positivas, mientras que para la infección con el clon AF1 cl1 los parásitos en sangre empezaron a aparecer al día 14 pi, encontrándose sólo un 28% de muestras positivas. A los días 21, 28 y 60 pi, todas las muestras analizadas para el clon CAS15 cl3 fueron positivas, mientras que para el clon AF1 cl1 se encontró al día 21 pi un 41% de muestras positivas y a los días 28 y 60 pi un 100%. Para la infección con la mezcla de los clones se encontró que los parásitos aparecieron en sangre el mismo día que el clon CAS15 cl3, presentando un 100% de muestras positivas. Al día 90 pi se observó ausencia de parásitos en todas las muestras (cuadro 1).

Detección del parásito por PCR en sangre y órganos de ratones
Las muestras de sangre positivas por PCR amplificaron sólo la banda de 350 pb, indicando la predominancia del grupo T. cruzi I (figura 3). Con el marcador sat-ADN se observó que el porcentaje de órganos parasitados disminuyó con el transcurso de la infección, encontrándose a los días 7, 14 y 21 pi un tropismo por casi todos los órganos, tanto en infecciones individuales como en la mixta, mientras que a partir del día 28 pi se observó un histotropismo preferencial de cada clon. En las infecciones individuales se encontró la presencia del clon CAS15 cl3 en el 88,8% de los corazones y en el 100% de los músculos esqueléticos analizados, mientras que en recto, hígado y bazo se observó el 66,6, 44,4 y 38,8% de infección, respectivamente. Con el clon AF1 cl1 se observó un porcentaje de infección en bazo, hígado, músculo esquelético y recto del 83,3, 61,1, 50 y 27,7%, respectivamente, mientras que el corazón de estos ratones no presentó infección. Con la infección mixta se encontró un porcentaje de infección en corazón y músculo esquelético del 100%, mientras que en recto, hígado y bazo se encontró una infección del 94,4, 72,2 y 11,1%, respectivamente (cuadro 2 y figuras 4a, 4b y 4c).


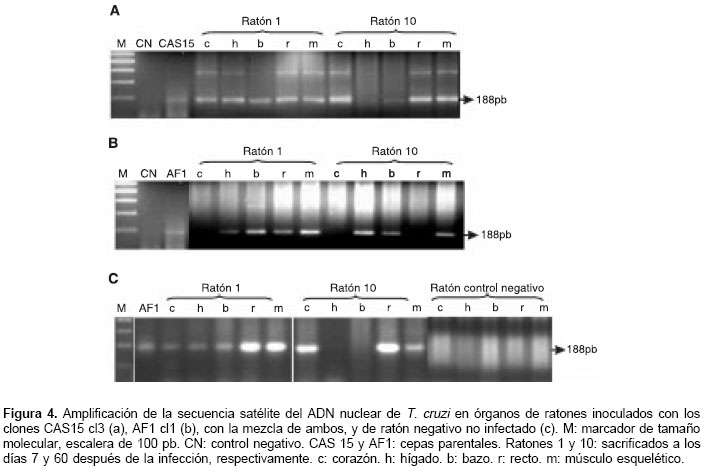
La caracterización molecular con el marcador mini-exón de los parásitos presentes en órganos durante la infección mixta reveló en todos los órganos positivos un amplificado de 350 pb, mostrando un 88,9% de corazones y un 66,7% de músculos esqueléticos positivos, mientras que el recto e hígado mostraron un porcentaje de infección del 44,4 y 11,1%, respectivamente. Sin embargo, las muestras de bazo positivas con sat-ADN no amplificaron con el marcador mini-exón, imposibilitando determinar el grupo filogenético presente en dicho órgano (figura 5).

Discusión
La enfermedad de Chagas se considera un problema de salud pública en muchos países por la gran cantidad de personas afectadas y la variedad de manifestaciones clínicas con que se presenta. Muchos estudios han llevado a pensar que dicha variación está ligada directamente al genotipo de los parásitos circulantes, ya que diferencias genéticas en las poblaciones del parásito hacen que estos presenten un tropismo diferencial por tejidos del hospedero durante la fase crónica de la enfermedad (1).
Muchas de las cepas naturales de T. cruzi son multiclonales y se encuentran compuestas de poblaciones del parásito tanto del grupo T. cruzi I como del grupo T. cruzi II. Sin embargo, este número de clones puede cambiar drásticamente a medida que trascurre el tiempo de infección, ya que en la fase crónica de la enfermedad ciertos clones del parásito son eliminados probablemente como resultado de factores inmunológicos del hospedero o debido a la capacidad de multiplicación o requerimientos nutricionales de cada clon (30). En el presente trabajo, mediante una infección mixta de clones pertenecientes a los dos grupos de T. cruzi, se simularon las condiciones de una infección natural en el modelo murino, permitiendo entender varios aspectos de la enfermedad, entre ellos, cuál es el genotipo causante de un tropismo específico y cuál de estos predomina en el hospedero después de un largo periodo de infección.
La clonación de las cepas de T. cruzi ha permitido establecer la homogeneidad o heterogeneidad genética y el comportamiento biológico y bioquímico de las poblaciones del parásito que las componen. Campos y Andrade (31) encontraron que la cepa 21SF, aislada de un paciente en la fase aguda de la enfermedad, presentó homogeneidad en cuanto a parámetros biológicos y bioquímicos entre los clones y subclones que la componen, sugiriendo la presencia de un clon principal representante del comportamiento biológico de dicha cepa. Los resultados encon-trados en este estudio, específicamente durante la clonación de la cepa CAS15, nos permiten sugerir que también se observa la predominancia de un clon, ya que los perfiles de bandas obtenidos con la LSSP-PCR son iguales para cinco de los siete clones aislados. Por otra parte, se podría pensar que muchos de los resultados encontrados en este trabajo son consecuencia del clon seleccionado, pues al ser uno de los predominantes en la cepa CAS15 puede sobresalir frente al clon de AF1 debido a una mayor capacidad de replicación, favoreciendo su presencia en el transcurso de la infección como se observó en el presente estudio.
En cuanto a la cinética de aparición de los clones en sangre de los ratones en los diferentes cortes de tiempo pi, se encontró que los dos clones presentaron diferentes tiempos de aparición. El clon CAS15 cl3 apareció en sangre en el día 7 pi y el clon AF1 cl1, en el día 14. Además, la cantidad de muestras de sangre de ratones que fueron positivas en todos los tiempos de infección fue mayor para el clon CAS15 cl3 que para el AF1 cl1. Estos resultados evidencian la capacidad de infección de cada clon, encontrándose un genotipo más infectivo en el clon CAS15 cl3.
Reportes previos han encontrado en suero de humanos provenientes de Argentina, Chile y Brasil anticuerpos contra los dos grupos de T. cruzi (32), indicando infección con ambos grupos. Los resultados obtenidos en este estudio con el marcador mini-exón nos permiten inferir que probablemente haya en la sangre de los ratones inoculados con la mezcla de los clones un predominio del clon CAS15 cl3 con respecto al clon AF1 cl1, ya que las pocas muestras que se encontraron positivas amplificaron la banda de 350 pb. Sin embargo, podría pensarse también que en sangre había muy pocos parásitos pertenecien-tes a ambos clones, principalmente al clon AF1 cl1, y que éstos fueron escasamente detectados por la PCR con dicho marcador. Por otra parte, numerosos estudios han mostrado que durante la fase crónica de la enfermedad los parásitos ya han invadido y colonizado órganos y, por tanto, no están circulando en sangre, lo que se verificó en este estudio, pues se encontró una ausencia total de parásitos en sangre a los tres meses después de la infección, tanto en las infecciones individuales como en la mixta.
Trabajos previos en ratones machos BALB/c han demostrado que luego de tres meses de infección, periodo correspondiente a la fase crónica de la enfermedad en dicho modelo experimental, diferentes clones de T. cruzi presentan distribu-ciones titulares diferenciales (9). Así mismo, otros autores han mostrado un tropismo preferencial de la cepa CAS15 por corazón (18) y de la cepa AF1 por bazo e hígado (33). Nuestro estudio apoya tales resultados, al ser el corazón uno de los órganos que más se encontró parasitado con el clon CAS15 cl3, y el hígado y el bazo con el clon AF1 cl1 en la fase crónica de la infección. Esta idea nos permite sugerir que la variabilidad genética de los parásitos es uno de los factores determinantes de la distribución diferencial en los tejidos y, probablemente, de las manifestaciones clínicas de la enfermedad de Chagas.
Por otro lado, se ha encontrado que tanto en Chile como en otros países del Cono Sur, donde se sabe que prevalece el grupo T. cruzi II, predominan las formas digestivas de la enfermedad (7), mientras que en Colombia la manifestación clínica más frecuente es la cardiaca. Nuestros resultados aportan evidencia que confirma que la forma cardiaca de la enfermedad en Colombia puede ser causada por T. cruzi I, puesto que el clon AF1 cl1, representante de T. cruzi II en Colombia, no invadió corazón, mientras que el clon del grupo I se encontró en la mayoría de los corazones. Sin embargo, es necesario que en futuros estudios se evalúe el tropismo tisular de un mayor número de clones pertenecientes a T. cruzi II para verificar lo anterior.
Nuestros resultados concuerdan con lo planteado por N. Añez y col (16), quienes encontraron que la infección con T. cruzi I presenta parasitemias mucho más altas que las causadas por T. cruzi II y que, además, T. cruzi I genera en pacientes durante la fase crónica un alto grado de daño en miocardio y músculo esquelético (34). Por el contrario, otros autores han encontrado que las infecciones con T. cruzi II son bastante graves y que comprometen algunos tejidos como recto y esófago (1,16,31). Los resultados encontrados en este estudio muestran que la parasitemia y el tropismo por órganos de parásitos pertenecientes al grupo T. cruzi II es menor que la de parásitos del grupo T. cruzi I, con tropismo preferencial por bazo e hígado. Consideramos que estas diferencias pueden deberse al alto polimorfismo encontrado en parásitos pertenecientes al grupo T. cruzi II, ya que se ha comprobado que los diferentes subgrupos en los que se encuentra dividido difieren en su infectividad, virulencia y patogenicidad. Como ejemplo está el clon CL-Brener, perteneciente al grupo T. cruzi IIe, que después de ser inoculado en ratas presentó una alta tasa de mortalidad al sobrevivir a la fase aguda de la infección (31).
Es importante destacar que diversos estudios han reportado el músculo esquelético como uno de los órganos que más se encuentra parasitado con T. cruzi tanto en la fase aguda como en la fase crónica de la enfermedad (35). Lo encontrado en este estudio corrobora lo anterior, pues en las infecciones individuales ambos clones se encuentran parasitando dicho músculo. Además, los resultados obtenidos en este órgano y en el hígado fueron muy interesantes, ya que a pesar de que el parasitismo en dichos órganos se observó en las dos infecciones individuales, durante la infección mixta sólo se encontró la presencia del grupo T. cruzi I (clon CAS15 cl3). Esto podría explicarse por diferencias entre los dos clones en la cinética de la fase aguda, ya que las respuestas inmunes estimuladas por una población de T. cruzi podrían favorecer la invasión y colonización tisular de la otra (16). Además, como se ha informado anteriormente, algunos clones pueden ser eliminados por su inhabilidad para competir y propagarse en el hospedero, o por la acción de sus mecanismos de defensa (36). Se podría pensar también en la posibilidad de que ambos grupos lleguen a infectar los órganos, pero al igual que ocurre con las cepas, T. cruzi II no se puede detectar por estar presente en menor proporción. A pesar de que el mini-exón es un buen marcador para diferenciar los dos grupos de T. cruzi, los resultados obtenidos mostraron que no fue muy sensible en la detección del parásito, posiblemente por su bajo número de copias comparado con el marcador sat-ADN.
Finalmente, nuestro trabajo aporta evidencia que sugiere que en Colombia el grupo T. cruzi I es más virulento que T. cruzi II y probablemente por ello es que predomina en las infecciones. Además, se comprueba que el polimorfismo genético de las poblaciones de T. cruzi puede ejercer influencia sobre el tropismo tisular y consecuentemente sobre las manifestaciones clínicas de la enfermedad. Estos aspectos son de gran importancia para una mejor comprensión de la epidemiología de la enfermedad de Chagas.
Agradecimientos
Luz Adriana Botero recibió apoyo del CODI–Universidad de Antioquia a través del programa de jóvenes investigadores.
Conflicto de intereses
Los autores declaramos que no existe ningún conflicto de intereses.
Financiación
Este proyecto fue financiado por el programa de sostenibilidad 2005–2006 del CODI, Universidad de Antioquia.
Correspondencia:
Omar Triana Chávez, Calle 62 N° 52-59, Sede de Investigación Universitaria SIU, U de A, Medellín, Antioquia, Colombia, teléfono 2106520, fax 2105622,
otriana@gmail.com
Referencias [ Links ]
2. Moncayo A. Chagas disease: current epidemiological trends after the interruption of vectorial and transfusional transmission in the Southern Cone countries. Mem Inst Oswaldo Cruz 2003;98:577-91. [ Links ]
3. Lenzi HL, Oliveira DN, Lima MT, Gatas CR. Trypanosoma cruzi: paninfectivity of CL strain during murine acute infection. Exp Parasitol 1996;84:16-27. [ Links ]
4. Prata A. Clinical and epidemiological aspects of Chagas disease. Lancet Infect Dis 2001;1:92-100. [ Links ]
5. Vago AR, Macedo AM, Oliveira RP, Andrade LO, Chiari E, Galvao LM, et al. Kinetoplast DNA signatures of Trypanosoma cruzi strains obtained directly from infected tissues. Am J Pathol 1996;149:2153-9. [ Links ]
6. Vago AR, Andrade LO, Leite AA, dAvila Reis D, Macedo AM, Adad SJ, et al. Genetic characterization of Trypanosoma cruzi directly from tissues of patients with chronic Chagas disease: differential distribution of genetic types into diverse organs. Am J Pathol 2000;156:1805-9. [ Links ]
7. Macedo AM, Machado CR, Oliveira RP, Pena SD. Trypanosoma cruzi: genetic structure of populations and relevant of genetic variability to the pathogenesis of Chagas disease. Mem Inst Oswaldo Cruz 2004;99:1-12. [ Links ]
8. Oliveira RP, Broude NF, Macedo AM, Cantor CR, Smith CL, Pena SD. Probing the genetic population structure of Trypanosoma cruzi with polymorphic micro-satellites. Proc Natl Acad Sci USA 1998;95:3776-80. [ Links ]
9. Andrade LO, Machado CR, Chiari E, Pena SD, Macedo AM. Trypanosoma cruzi: role of host genetic background in the differential tissue distribution of parasite clonal populations. Exp Parasitol 2002;100:269-75. [ Links ]
10. Macedo AM, Martins MS, Chiari E, Pena SD. DNA fingerprinting of Trypanosoma cruzi: a new tool for characterization of strains and clones. Mol Biochem Parasitol 1992;55:147-53. [ Links ]
11. Tibayrenc M, Neubauer K, Barnabé C, Guerrini F, Skarecky D, Ayala FJ. Genetic characterization of six parasitic protozoa: parity betweem random-primer DNA typing and multilocus enzyme electrophoresis. Proc Natl Acad Sci USA 1993;90:1335-9. [ Links ]
12. Souto RP, Fernandes O, Macedo AM, Campbell DA, Zingales B. DNA markers define two major phylogenetic lineages of Trypanosoma cruzi. Mol Biochem Parasitol 1996;83:141-52. [ Links ]
13. Fernandes O, Souto RP, Castro JA, Pereira JB, Fernandes NC, Junqueira AC, et al. Brazilian isolates of Trypanosoma cruzi from humans and triatomines classified into two lineages using mini-exon and ribosomal RNA sequences. Am J Trop Med Hyg 1998;58:807-11. [ Links ]
14. Fernandes O, Mangia RH, Lisboa CV, Pinho AP, Morel CM, Zingales B, et al. The complexity of the sylvatic cycle of Trypanosoma cruzi in Rio de Janeiro state (Brazil) revealed by the non-transcribed spacer of the mini-exon gene. Parasitology 1999;118:161-6. [ Links ]
15. Miles MA, Feliciangeli MD, de Arias AR. American trypanosomiasis (Chagas disease) and the role of molecular epidemiology in guiding control strategies. BMJ 2003;326:1444-8. [ Links ]
16. Añez N, Crisante G, da Silva FM, Rojas A, Carrasco H, Umezawa E, et al. Predominance of lineage I among Trypanosoma cruzi isolates from Venezuelan patients with different clinical profiles of acute Chagas disease. Trop Med Int Health 2004;9:1319-26. [ Links ]
17. Magalhães-Santos IF, Souza MM, Lima CS, Andrade S. Infection of Calomys callosus (Rodentia Cricetidae) with strains of different Trypanosoma cruzi biodemes: Pathogenicity, histotropism, and fibrosis induction. Mem Inst Oswaldo Cruz 2004;99:407-13. [ Links ]
18. Mejía AM, Triana O. Análisis por LSSP-PCR de la variabilidad genética de Trypanosoma cruzi en sangre y órganos de ratones. Biomédica 2005;25:76-86. [ Links ]
19. Freitas JM, Lages-Silva E, Crema E, Pena SD, Macedo AM. Real time PCR strategy for the identification of major lineages of Trypanosoma cruzi directly in chronically infected human tissues. Int J Parasitol 2005;35:411-7. [ Links ]
20. Bernabé C, Tibayrenc M. Trypanosoma cruzi: long-term sub-cultures in two different culture media do not confirm the existence of highly versatile multilocus genotypes. Int J Parasitol 2004;34:779-84. [ Links ]
21. Goldberg SS, Chiari E. Growth and isolation of single colonies of Trypanosoma cruzi on solid medium. J Parasitol 1980;66:677-9. [ Links ]
22. Camargo EP. Growth and differentiation in Trypanosoma cruzi. Origin of metacyclic trypanosomes in liquid media. Rev Inst Med Trop São Paulo 1964;12:93-100. [ Links ]
23. Miller SA, Dykes DD, Polesky HF. A simple salting out procedure for extracting DNA from human nucleated cells. Nucleic Acids Res 1988;16:1215. [ Links ]
24. Sturm N, Degrave W, Morel C, Simpson L. Sensitive detection and schizodeme classification of Trypanosoma cruzi cells by amplification of kinetoplast minicircle DNA sequences. Use in diagnosis of Chagas disease. Mol Biochem Parasitol 1989;33:205-14. [ Links ]
25. Pena SD, Barreto G, Vago AR, De Marco L, Reinach F, Dias Neto E, et al. Sequence-specific gene signatures can be obtained by PCR with single specific primers at low stringency. Proc Natl Acad Sci USA 1994;91:1946-9. [ Links ]
26. Campos RF, Goncalves MS, dos Reis EA, dos Reis MG, Andrade SG. Comparative analysis by polymerase chain reaction amplified minicircles of kinetoplast DNA of a stable strain of Trypanosoma cruzi from Sao Felipe, Bahia, its clones and subclones: possibility of predominance of a principal clone in this area. Mem Inst Oswaldo Cruz 1999;94:23-9. [ Links ]
27. Walsh PS, Metzger DA, Higuchi R. Chelex® 100 as a medium for simple extraction of DNA for PCR-based typing from forensic material. Biotechniques 1991;10:506-13. [ Links ]
28. Sambrook J, Fritsch EF, Maniatis T. Molecular cloning. A laboratory manual. Second edition. Cold Spring: Harbor Laboratory Press; 1989. [ Links ]
29. Virreira M, Torrico F, Truyens C, Alonso-Vega C, Solano M, Carlier Y, et al. Comparison of polymerase chain reaction methods for reliable and easy detection of congenital Trypanosoma cruzi infection. Am J Trop Med Hyg 2003;68:574-82. [ Links ]
30. Franco DJ, Vago AR, Chiari E, Meira FC, Galvao LM, Machado CR. Trypanosoma cruzi: mixture of two populations can modify virulence and tissue tropism in rat. Exp Parasitol 2003;104:54-61. [ Links ]
31. Campos RM, Andrade SG. Characterization of subpopulations (clones and subclones) of the 21 SF strain of Trypanosoma cruzi after long lasting maintenance in the laboratory. Mem Inst Oswaldo Cruz 1996;91:795-800. [ Links ]
32. Di Noia JM, Buscaglia CA, De Marchi CR, Almeida IC, Frasch CC. A Trypanosoma cruzi small surface molecule provides the first immunological evidence that Chagas disease is due to a single parasite lineage. J Exp Med 2002;195:401-13. [ Links ]
33. Rios JF. Estudio del tropismo tisular de dos cepas colombianas de Trypanosoma cruzi (Tesis). Medellín: Universidad de Antioquia; 1995. [ Links ]
34. Camandaroba EL, Campos RF, Magalhaes JB, Andrade SG. Clonal structure of Trypanosoma cruzi Colombian strain (biodeme type III): biological, isoenzymic and histopathological analysis of seven isolated clones. Rev Soc Bras Med Trop 2001;34: 151-7. [ Links ]
35. Cummings KL, Tarleton RL. Rapid quantitation of Trypanosoma cruzi in host tissue by real-time PCR. Mol Biochem Parasitol 2003;129:53-9. [ Links ]
36. Macedo AM, Pena SD. Genetic variability of Trypanosoma cruzi: implications for the pathogenesis of Chagas disease. Parasitol Today 1998;14:119-23. [ Links ]














