Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Biomédica
Print version ISSN 0120-4157
Biomédica vol.34 supl.1 Bogotá Apr. 2014
https://doi.org/10.7705/biomedica.v34i0.2199
ARTÍCULO ORIGINAL
doi: http://dx.doi.org/10.7705/biomedica.v34i0.2199
1 Laboratorio Nacional de Referencia e Investigaciones en Tuberculosis y Micobacterias, Instituto de Medicina Tropical Pedro Kourí, La Habana, Cuba
2 Vicedirección de Microbiología, Instituto de Medicina Tropical Pedro Kourí, La Habana, Cuba
3 Dirección Nacional de Epidemiología, Viceministerio de Higiene, Epidemiología y Microbiología, Ministerio de Salud Pública, La Habana, Cuba.
Contribución de los autores:
Dihadenys Lemus y Miguel Echemendía: montaje de pruebas de sensibilidad, lectura e interpretación de los datos.
Todos los autores participaron en la redacción del manuscrito.
Recibido: 22/05/13; aceptado: 12/11/13
Introducción. La vigilancia de la resistencia a medicamentos antituberculosos permite alertar sobre el hallazgo de aislamientos de Mycobacterium tuberculosis multirresistentes y extremadamente resistentes .
Objetivo. Determinar los patrones de resistencia de los aislamientos de M. tuberculosis recuperados en Cuba entre los años 2010 y 2011 y demostrar el desempeño del Laboratorio Nacional de Referencia en la ejecución de las pruebas de sensibilidad.
Materiales y métodos. Se realizó un estudio prospectivo longitudinal en el que se incluyeron 657 aislamientos de M. tuberculosis recibidos de todo el país. Se empleó el método de la nitrato reductasa para detectar resistencia a isoniacida y rifampicina, y el método de las proporciones para corroborar la resistencia a dichos medicamentos e investigar la sensibilidad a estreptomicina, etambutol, ofloxacina, kanamicina y capreomicina en aislamientos multirresistentes. Como parte del control de calidad externo de las pruebas de sensibilidad, se evaluaron dos paneles de cepas de M. tuberculosis .
Resultados. En 95,69 % de los aislamientos recuperados de casos nuevos de tuberculosis y en 72,64 % de los recuperados de casos previamente tratados, se encontró sensibilidad a isoniacida y rifampicina, siendo la multirresistencia de 1,03 y 10,38 %, respectivamente. Se encontraron dos aislamientos extremadamente resistentes. Con la excepción del etambutol y la capreomicina, para todos los medicamentos la eficiencia fue de 100% en el control de calidad externo.
Conclusiones. Se confirmó la baja prevalencia de aislamientos de M. tuberculosis multirresistentes en Cuba, resultado avalado por el excelente desempeño demostrado en el control de calidad externo de las pruebas de sensibilidad.
Palabras clave: Mycobacterium tuberculosis , tuberculosis resistente a múltiples medicamentos, Cuba.
doi: http://dx.doi.org/10.7705/biomedica.v34i0.2199
Surveillance of antituberculosis-drug resistance in Cuba, 2010-2011
Introduction: Antituberculosis-drug resistance surveillance is very important to identify multidrug-resistant and extensively drug-resistant Mycobacterium tuberculosis isolates.
Objective: To determine the prevalence of resistance in M. tuberculosis strains isolated between 2010 and 2011, and to demonstrate the laboratory performance in the external quality control of drug susceptibility testing.
Materials and methods: A prospective longitudinal study was carried out to determine antituberculosis-drug resistance in 657 M. tuberculosis isolates obtained throughout the country. The nitrate reductase assay was used to detect resistance to isoniazid and rifampin. The proportion method was performed to confirm resistance to these drugs and to further investigate in multidrug-resistant isolates their susceptibility to streptomycin, ethambutol, ofloxacin, kanamycin and capreomycin. Additionally, as part of external quality control, susceptibility was evaluated in two M. tuberculosis strain panels.
Results: In 95.69% of the isolates recovered from new tuberculosis cases, and in 72.64 % of isolates from previously treated patients we found susceptibility to isoniazid and rifampicin; multidrug resistance was 1,03 and 10.38%, respectively. We found two extensively resistant isolates. Except for ethambutol and capreomycin, the efficiency of all other drugs was 100% in the external quality control.
Conclusion: The study confirmed the low prevalence of M. tuberculosis multidrug-resistant isolates in Cuba. This result was confirmed by the external quality control of drug susceptibility testing.
Key words: Mycobacterium tuberculosis ; tuberculosis, multidrug-resistant; Cuba.
doi: http://dx.doi.org/10.7705/biomedica.v34i0.2199
La resistencia desarrollada por Mycobacterium tuberculosis a los medicamentos utilizados en el tratamiento constituye un importante problema de salud pública en varios países y se considera uno de los principales obstáculos para lograr el control de la tuberculosis a nivel mundial.
A partir de 1994, con la ejecución de los estudios mundiales de vigilancia de la resistencia, se ha recopilado información sobre la sensibilidad de M. tuberculosis y se ha estimado la circulación de aislamientos multirresistentes ( multidrug- resistant, MDR) en, aproximadamente, 3,7 % de los casos nuevos y en 20,0 % de los pacientes con antecedentes de tratamiento previo con medicamentos antituberculosos. Además, estos estudios han alertado sobre la circulación de aislamientos de M. tuberculosis extremadamente resistentes ( extensively drug-resistant, XDR), poniendo de manifiesto la necesidad de la vigilancia de la resistencia a los medicamentos antituberculosos de segunda línea en los aislamientos de M. tuberculosis multirresistentes (1,2).
El estudio longitudinal de vigilancia de la resis tencia comenzó en Cuba en 1982 (3), vigilancia que está a cargo del Laboratorio Nacional de Referencia e Investigaciones en Tuberculosis y Micobacterias del Instituto de Medicina Tropical Pedro Kourí. En sus inicios se utilizaba solamente el método de las proporciones; actualmente se cuenta, además, con el método de la nitrato reductasa (4). La vigilancia sostenida ha permitido demostrar que la resistencia de M. tuberculosis a los medicamentos utilizados en el tratamiento no constituye un problema en Cuba (5,6).
El presente estudio se propuso determinar los patrones de resistencia de los aislamientos de M. tuberculosis recuperados entre los años 2010 y 2011 de pacientes enfermos con tuberculosis y, al mismo tiempo, demostrar el desempeño del laboratorio en la ejecución de las pruebas de sensibilidad mediante la participación en el control de calidad externo de las pruebas de sensibilidad que es liderado por la Organización Mundial de la Salud (OMS).
Materiales y métodos
Se llevó a cabo un estudio prospectivo longitudinal. El universo de trabajo lo integraron 657 aislamientos de M. tuberculosis recuperados de pacientes con baciloscopia positiva y cultivo de más de 20 colonias, que fueron recibidos en el Laboratorio Nacional de Referencia entre el 1° de enero de 2010 y el 31 de diciembre de 2011.
Estos aislamientos (uno por caso) fueron remitidos desde los 15 Centros Provinciales de Higiene, Epidemiología y Microbiología del país, el Centro Municipal de la Isla de la Juventud y el Hospital Neumológico Nacional. Se incluyeron, además, los aislamientos recuperados por el servicio de diagnóstico del Laboratorio Nacional de Referencia. Cada aislamiento se acompañó de un formulario donde se recolectaron, entre otros datos, el antecedente de tratamiento previo con fármacos antituberculosos. La muestra estudiada correspondió a 37,7 y 71,3 % de los aislamientos recuperados de casos nuevos con baciloscopia positiva en los años 2010 y 2011, respectivamente, así como a 68,8 y 100 % de los casos previamente tratados notificados en dichos años.
La totalidad de los aislamientos se analizó mediante el método de la nitrato reductasa en medio de Löwenstein-Jensen en cuanto a la sensibilidad a isoniacida y rifampicina, empleando una concentración crítica de 0,2 µg/ml y 40 µg/ml, respectivamente (7). En los aislamientos que resultaron multirresistentes se evaluó mediante el método de las proporciones en medio de Löwenstein-Jensen (8) la sensibilidad a isoniacida, rifampicina, estreptomicina, etambutol, ofloxacina, kanamicina y capreomicina, utilizando las concentraciones críticas recomendadas para cada una de ellas: 0,2 µg/ml, 40 µg/ml, 4 µg/ml, 2 µg/ml, 2 µg/ml, 30 µg/ml y 40 µg/ml, respectivamente. En los aislamientos que resultaron monorresistentes mediante el método de la nitrato reductasa se investigó la sensibilidad a isoniacida y rifampicina con el método de las proporciones (8).
Como parte de la ejecución del control de calidad externo de las pruebas de sensibilidad, entre los años 2010 y 2012 el Laboratorio Nacional de Referencia trabajó con dos paneles de cepas de M. tuberculosis remitidos desde el Laboratorio de Referencia Supranacional de Tuberculosis del Instituto Nacional de Enfermedades Infecciosas "Dr. Carlos G. Malbrán" de Argentina. En el 2010 se estudió la sensibilidad de 28 cepas (panel 16 de la OMS) a isoniacida, estreptomicina, etambutol, rifampicina, ofloxacina, kanamicina y capreomicina. En el 2012 se estudiaron 17 cepas (panel 17 de la OMS) mediante el método de las proporciones para los medicamentos anteriormente descritos y por primera vez se controló la calidad de la ejecución del método de la nitrato reductasa para isoniacida y rifampicina con el empleo de 18 cepas de M. tuberculosis (panel 17 de la OMS).
Tanto para la ejecución del método de la nitrato reductasa como para la del método de las proporciones, se verificó la calidad a cada lote de medio de cultivo utilizado mediante el empleo de cepas de M. tuberculosis con patrón de sensibilidad conocido. En el caso de los medicamentos de primera línea, se utilizaron las cepas de M. tuberculosis ATCC 35822, ATCC 35820, ATCC 35837 y ATCC 35838, portadoras de monorresistencia a isoniacida, estreptomicina, etambutol y rifampicina, respectivamente. Para los medicamentos de segunda línea se emplearon cepas con resistencia conocida a ofloxacina, kanamicina y capreomicina procedentes del Laboratorio de Referencia Supranacional de Tuberculosis en los años 2009 y 2010 como parte de la ejecución del control de calidad externo de las pruebas de sensibilidad. La cepa de M. tuberculosis H37Rv (ATCC 27294), sensible a los medicamentos antituberculosos de primera y segunda línea, también se utilizó.
Resultados
Los patrones de sensibilidad encontrados en los aislamientos estudiados se muestran en el cuadro 1. En 95,69 % de los aislamientos provenientes de casos nuevos de tuberculosis se encontró sensibilidad frente a isoniacida y rifampicina; en 13 aislamientos (2,67 %) se observó monorresistencia a isoniacida y en tres (0,62 %), a rifampicina, evidenciándose para esta categoría de caso una multirresistencia de 1,03 %.
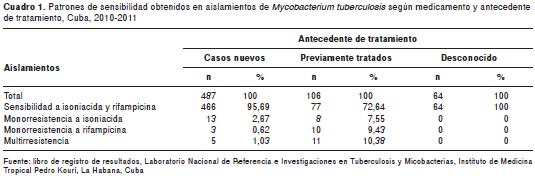
En relación con los aislamientos de pacientes con antecedentes de tratamiento, 72,64 % fue sensible a isoniacida y rifampicina; la monorresistencia a ambos medicamentos se observó en ocho (7,55 %) y 10 (9,43 %) aislamientos, respectivamente, mientras que 10,38 % de los aislamientos se reveló como multirresistentes.
En 100 % de los aislamientos provenientes de pacientes en los que no fue posible conocer el antecedente de tratamiento se observó sensibilidad a isoniacida y rifampicina.
En todos los aislamientos la resistencia a estos dos fármacos identificada mediante el método de la nitrato reductasa se confirmó con el empleo del método de las proporciones. Como se observa en el cuadro 2, entre los 16 aislamientos con multirresistencia se encontraron siete patrones diferentes de sensibilidad; cuatro fueron sensibles al resto de los medicamentos investigados mientras que en dos aislamientos, de pacientes previamente tratados, se evidenció un comportamiento extremadamente resistente.

En cuanto al desempeño alcanzado por el Laboratorio Nacional de Referencia en los dos estudios de control de calidad, en el panel 16 se alcanzaron valores de sensibilidad, especificidad, eficiencia y reproducibilidad intralaboratorio de 100 % para todas los fármacos, con excepción del etambutol, empleando el método de las proporciones. De igual manera, en el panel 17, se alcanzaron valores de 100 % para los parámetros anteriormente mencionados, excepto con la capreomicina. Con el método de la nitrato reductasa se alcanzó una eficiencia y reproducibilidad intralaboratorio de 100 % con los dos medicamentos objeto de estudio (isoniacida y rifampicina).
Discusión
La ejecución del proyecto mundial de vigilancia de la resistencia a los medicamentos antituberculosos iniciada en 1994 ha permitido a la OMS recopilar y analizar de manera sistemática los resultados de la sensibilidad de los aislamientos de M. tuberculosis estudiados en 135 países alrededor del mundo (2).
Según el reporte mundial de tuberculosis del 2012, se estima que en el 2011 se produjeron 310.000 casos de tuberculosis multirresistente (TB-MDR), fenómeno que alcanza grandes proporciones en algunas partes del mundo, encontrándose 60 % de estos casos en India, China, la Federación Rusa y Sudáfrica. La proporción de casos de TB-MDR frente al total de casos nuevos osciló entre 0 y 32,3 %, y las cifras mayores se informaron en Bielorrusia (32,3 %), Kazajstán (30,3 %), Kirguizistán (26,4 %), Uzbekistán (23,2 %), Estonia (22,9 %) y la República de Moldavia (19,4 %). Entre los casos con antecedente de tratamiento, la TB-MDR osciló entre 0 y 65,1 %, y las mayores cifras se reportaron en Bielorrusia (75,6 %), la República de Moldavia (63,5 %), Uzbekistán (62,0 %), Estonia (57,7 %), Tayikistán (53,6 %), Kirguizistán (51,6 %) y Kazajstán (51,3 %). Estos datos ponen de manifiesto que Europa Oriental y Asia Central siguen encabezando las denominadas 'zonas calientes', con cerca de un tercio de los casos nuevos y dos tercios de los casos previamente tratados afectados con TB-MDR (2).
En el 2010 se contó en la región de las Américas con los resultados de las pruebas de sensibilidad a medicamentos en 6,2 % de los casos nuevos de tuberculosis notificados y en 22 % de los casos de tratamiento por recaídas y se notificaron 2.600 casos de TB-MDR. Países como Perú, Brasil, México, Ecuador, Haití, República Dominicana y Colombia aportaron más de 80 % de los casos estimados de TB-MDR en la región. La TB-MDR representó 2,1 % de los casos nuevos de tuberculosis y 12 % de los casos de tratamiento por recaída. Del total de casos nuevos, la proporción de casos de TB-MDR fue de 0 a 7 % y entre los casos de tratamiento por recaída, de 0 a 27 % (9).
Aunque las cifras de TB-MDR en casos nuevos reveladas en este trabajo (1,14 y 0,95 % en el 2010 y 2011, respectivamente) denotan un ligero incremento con respecto al decenio 2000-2009 (0,36 %) (6), y alertan, además, sobre un aumento en el número de aislamientos con resistencia a isoniacida y rifampicina, Cuba muestra una situación muy diferente a la compleja problemática de la resistencia en tuberculosis que se presenta a nivel internacional. Los resultados alcanzados en el presente estudio corroboran reportes previos realizados por el Laboratorio Nacional de Referencia que ponen de manifiesto una baja prevalencia de aislamientos de M. tuberculosis con multirresistencia en Cuba (5,6).
Otro aspecto importante es la circulación de aislamientos de M. tuberculosis extremadamente resistente ( extensively drug-resistant, XDR). Estas cepas se reportaron por primera vez en el 2006 (10) y hasta el 2011 se habían identificado en 84 países, describiéndose en 9 % de los aislamientos multirresistentes. Esta situación amenaza con agravarse debido al gran número de aislamientos con multirresistencia y resistencia adicional a alguna fluoroquinolona ya detectado (2).
A pesar de la baja frecuencia de aislamientos de M. tuberculosis multirresistentes observada en Cuba, cabe señalar el hallazgo de aislamientos XDR. En el reporte mundial de tuberculosis del año 2012, se incluyeron los dos aislamientos con esta característica que fueron identificados en el presente estudio (2), los cuales se recuperaron de pacientes que habían recibido varios esquemas de tratamiento por recaídas.
Los datos del 2011 indican que la mayor proporción de tuberculosis extremadamente resistente (TB-XDR) se detectó en Tayikistán (Dushanbe, 21,0 %), Estonia (18,7 %), Lituania (16,5 %), Azerbaiyán (Bakú, 12,7 %), Letonia (12,6 %) y Bielorrusia (11,9 %) (2). En la región de las Américas ocho países habían notificado, al menos, un caso de TB-XDR hasta el 2010: Argentina, Brasil, Canadá, Colombia, Ecuador, México, Perú y Estados Unidos (9).
Una de las metas de la estrategia mundial "Alto a la tuberculosis, 2006-2015" es la realización de la prueba de sensibilidad a fármacos de primera línea a todos los pacientes con tratamiento antituberculoso previo y, al menos, a 20 % de los casos nuevos con bacteriología positiva, así como la realización de pruebas de sensibilidad a medicamentos de segunda línea a todos los casos de TB-MDR. Sin embargo, en el año 2011 menos de 4 % de los casos nuevos, y solo 6 % de los casos previamente tratados a nivel global se investigaron mediante pruebas de sensibilidad a medicamentos de primera línea; la carencia de estudios se hizo más evidente en África y en el sudeste asiático. La sensibilidad a fluoroquinolonas y fármacos inyectables de segunda línea solamente se investigó en 23 % de los casos notificados como TB-MDR (2).
La puesta en práctica de métodos rápidos de diagnóstico, que ofrezcan oportunamente un resultado de sensibilidad, contribuye al fortalecimiento de las capacidades de los laboratorios de tuberculosis y constituye una prioridad a nivel mundial. En este sentido, la OMS ha recomendado la introducción de varias herramientas, entre las cuales se destaca el sistema molecular GeneXpert MTB/RIF que ha sido incorporado en un gran número de países (11).
En el Laboratorio Nacional de Referencia se trabaja desde hace varios años en la evaluación de métodos alternativos para la detección de resistencia en M. tuberculosis (12,13). A partir de la aprobación del método de la nitrato reductasa para investigar la resistencia a isoniacida y rifampicina (14), este método se incorporó a la vigilancia de la resistencia y los resultados alcanzados, corroborados con el método de las proporciones, han sido excelentes. La incorporación del método de la nitrato reductasa a la rutina de trabajo, así como la utilización de métodos moleculares (Genotype®MTBDR plus y Genotype®MTBDR sl ), contribuyen al fortalecimiento de la capacidad diagnóstica del Laboratorio Nacional de Referencia y, por tanto, permiten ofrecer a las autoridades de salud un resultado oportuno de la resistencia a medicamentos antituberculosos de primera y segunda línea.
Un aspecto de gran importancia para garantizar la calidad del diagnóstico de la resistencia es demostrar el desempeño para ejecutar dicha actividad. Cuba ha participado regularmente en los estudios de control de calidad que realiza anualmente la OMS con la colaboración del Laboratorio de Referencia Supranacional de Tuberculosis y ha demostrado la competencia necesaria para la ejecución de las pruebas de sensibilidad en M. tuberculosis , siendo muestra de ello los resultados alcanzados en la evaluación de los paneles 16 y 17.
El desempeño también ha sido aceptable en la mayoría de los laboratorios de la región de las Américas (9). La evaluación realizada de los paneles 6-14 en la red de laboratorios concluyó que la mayoría de ellos tuvieron éxito en la realización de las pruebas de sensibilidad (15).
El reporte de aislamientos de M. tuberculosis 'totalmente resistentes' en varios países (16-18) alerta sobre una nueva forma de tuberculosis mucho más difícil de tratar. Sin embargo, aún no hay consenso en torno al término para definir la resistencia que presentan aislamientos de M. tuberculosis extremadamente resistentes a otros medicamentos utilizados en el tratamiento, pues no se dispone de métodos confiables para el diagnóstico de la resistencia a la totalidad de los medicamentos antituberculosos (19,20).
Los resultados alcanzados en el presente estudio ponen de manifiesto, una vez más, la baja prevalencia de aislamientos de M. tuberculosis multirresistentes en Cuba y alertan sobre la nece-sidad de continuar perfeccionando la vigilancia de este fenómeno debido a los nuevos retos que este microorganismo representa para la salud pública a nivel mundial.
Se agradece la participación de los microbiólogos y epidemiólogos de la Red Nacional de Laboratorios de Tuberculosis y del Programa Nacional de Control por el envío de los aislamientos de M. tuberculosis y de las encuestas, actividades que garantizan la correcta ejecución de la vigilancia de la resistencia a las drogas antituberculosas en Cuba.
No existen conflictos de intereses.
El presente estudio se realizó con el apoyo financiero del proyecto del Fondo Mundial Ronda 7 en Cuba: "Fortalecimiento del Programa Nacional de Control en la República de Cuba" y el Proyecto de colaboración con Bélgica: "Desarrollo de métodos rápidos para diagnóstico y detección de resistencia en Mycobacterium tuberculosis" .
Correspondencia: Dihadenys Lemus, Laboratorio Nacional de Referencia e Investigaciones en Tuberculosis y Micobacterias, Instituto de Medicina Tropical Pedro Kourí, Autopista Novia del Mediodía Km 6 ½, PO Box 601, La Lisa, La Habana, Cuba Teléfono: (537) 255 3527; fax: (537) 204 6051 dlemus@ipk.sld.cu, dihadenys@infomed.sld.cu
1. World Health Organization/International Union against Tuberculosis and Lung Disease. Global project on anti-tuberculosis drug resistance surveillance, 1999-2002. Anti- tuberculosis drug resistance in the world. Third global report. WHO/CDS/TB/2004. Geneva: WHO; 2004. [ Links ]
2. World Health Organization. Global tuberculosis control: WHO report 2012. Geneva: WHO; 2012. [ Links ]
3. V aldivia JA, Jiménez C, Rodríguez R, Mederos L, E chemendía M, Valdés L, et al . Estudio cooperativo de la resistencia a las drogas antibacilares en cepas de Mycobacterium tuberculosis aisladas en pacientes tuberculosos. Rev Cub Med Trop. 1982;34:119-25. [ Links ]
4. World Health Organization. Noncommercial culture and drug-susceptibility testing methods for screening patients at risk for multidrugresistant tuberculosis. WHO/HTM/TB/ 2011.9. Geneva: WHO; 2011. [ Links ]
5. Montoro E, Lemus D, Echemendía M, Armas L, González-Ochoa E, Llanes MJ, et al . Drug-resistant tuberculosis in Cuba. Results of the three global projects. Tuberculosis. 2006;86:319-23. http://dx.doi/10.1016/j.tube.2006.01.013 [ Links ]
6. Montoro E, Lemus D, Echemendía M, Díaz R, Mederos L, Martínez MR, et al . Vigilancia de la resistencia a los fármacos antituberculosos en Cuba, 2000-2009. Rev Panam Salud Pública. 2011;30:615-8. http://dx.doi.org/10.1590/S1020-49892011001200020 [ Links ]
7. Angeby KA, Klintz L, Hoffner SE. Rapid and inexpensive drug susceptibility testing of Mycobacterium tuberculosis with a nitrate reductase assay. J Clin Microbiol. 2002;40:553-5. http://dx.doi/10.1128/JCM.40.2.553-555.2002 [ Links ]
8. Canetti G, Fox W, Khomenko A, Mahler HT, Menon NK, Mitchison DA, et al . Advances in techniques of testing mycobacterial drug sensitivity, and the use of sensitivity tests in tuberculosis control programs. Bull World Health Organ. 1969;41:21-43. [ Links ]
9. Organización Panamericana de la Salud. La tuberculosis en la Región de las Américas. Informe Regional 2011. Epidemiología, control y financiamiento. Washington, D.C.: OPS; 2011. [ Links ]
10. Centers for Disease Control and Prevention. Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs-worldwide, 2000-2004. MMWR Morb Mortal Wkly Rep. 2006;55:301-8. [ Links ]
11. Evans EA. GeneXpert - A game-changer for tuberculosis control? PLoS Med. 2011;8:e1001064. http://dx.doi/10.1371/journal.pmed.1001064 [ Links ]
12. Montoro E, Lemus D, Echemendía M, Martín A, Portaels F, Palomino JC. Comparative evaluation of the nitrate reduction assay, the MTT test and the resazurin microtiter assay for drug susceptibility testing of clinical isolates of Mycobacterium tuberculosis . J Antimicrob Chemother. 2005; 55:500-5. http://dx.doi/10.1093/jac/dki023 [ Links ]
13. Lemus D, Montoro E, Echemendía M, Martín A, Portaels F, Palomino JC. Nitrate reductase assay for detection of drug resistance in Mycobacterium tuberculosis : Simple and inexpensive method for low resources laboratories. J Med Microbiol. 2006;55:861-3. http://dx.doi/10.1099/jmm.0.46540-0 [ Links ]
14. World Health Organization. Noncommercial culture and drug-susceptibility testing methods for screening patients at risk for multidrug-resistant tuberculosis. WHO/HTM/TB/ 2011.9. Geneva: WHO; 2011. [ Links ]
15. Van Deun A, Wright A, Zignol M, Weyer K, Rieder HL. Drug susceptibility testing proficiency in the network of supranational tuberculosis reference laboratories. Int J Tuberc Lung Dis. 2011;15:116-24. [ Links ]
16. Velayati AA, Masjedi MR, Farnia P, Tabarsi P, Ghanavi J, Hassan A, et al . Emergence of new forms of totally drug-resistant tuberculosis bacilli. Super extensively drug- resistant tuberculosis or totally drug-resistant strains in Iran. Chest. 2009;2:420-5. http://dx.doi/10.1378/chest.08-2427 [ Links ]
17. Shah NS, Richardson J, Moodley P, Moodley S, Babaria P, Ramtahal M, et al . Increasing drug resistance in extensively drug-resistant tuberculosis, South Africa. Emerg Infect Dis. 2011;17:510-3. http://dx.doi/10.3201/eid1703.101363 [ Links ]
18. Udwadia ZF, Amale RA, Ajbani KK, Rodrigues C. Totally drug-resistant tuberculosis in India. Clin Infect Dis. 2012;54:579-81. http://dx.doi/10.1093/cid/cir889 [ Links ]
19. World Health Organization. Policy guidance on drug- susceptibility testing of second-line antituberculosis drugs. Geneva: WHO; 2008. [ Links ]
20. World Health Organization. "Totally Drug-Resistant" tuberculosis: A WHO consultation on the diagnostic definition and treatment options. Geneva: WHO; 2012. Fecha de consulta: 19 de abril de 2013. Disponible en: http://www.who.int/tb/challenges/xdr/xdrconsultation/en/ [ Links ]













