INTRODUCCIÓN
La esclerosis múltiple (EM) es una enfermedad crónica neuroinflamatoria, degenerativa, incurable, mediada por el sistema inmune, que afecta a adultos jóvenes y causa desmielinización y pérdida neuronal en el sistema nervioso central (SNC) 1,2. En su progresión genera grados crecientes de discapacidad y deterioro cognoscitivo, hasta llegar a la discapacidad total en algunos casos. La mayoría de los afectados son diagnosticados cuando tienen entre 20 y 40 años, siendo más frecuente en mujeres en una relación 3 : 1 3. Diagnosticar pacientes con EM es bastante retador y siempre existe la posibilidad de errores, de ahí la importancia de un buen enfoque de manejo 4-6. La EM puede afectar a 2,5 millones de personas en el mundo 3,7,8.
La prevalencia varía entre los países, siendo estimada en 150 por cada 100.000 habitantes en Escocia, 188,9/100.000 habitantes en Suecia, 100-125/100.000 habitantes en España, 55-248 por cada 100.000 en Canadá y en Uruguay se ha estimado en 30/100.000 habitantes 9-11. En Colombia se cuenta con dos estudios que analizan la carga de enfermedad de la EM: el estudio realizado por Jiménez y colaboradores en el 2015 12, quienes estimaron la prevalencia de EM para Colombia en 7,52 por cada 100.000 habitantes, correspondiente a 3.462 personas diagnosticadas entre el 2009 y el 2013 (Bogotá con 1.213 fue la ciudad con mayor número de casos ); y el trabajo publicado por Toro y colaboradores, quienes reportan que en Colombia existe una baja prevalencia de EM (< 5/100.000 habitantes) 13.
Los dos tipos de EM más frecuentes son la remitente-recurrente (EMRR), con el 85 % de todos los casos, y la primaria progresiva (EMPP), que representa entre 5 y 10 % de todos los eventos de EM. En el año 2018 el costo de tratamiento de la EM reportado por el Gobierno de Suecia fue superior a los 150.000 millones de dólares 14, con costos directos anuales hasta de US $24.327 por persona con EM 3. En Noruega, un paciente con inicio temprano de la enfermedad y progresión rápida puede llegar a costar hasta US $650.000, equivalentes a unos 2.000 millones de pesos 15, donde los medicamentos representan entre el 29 % y el 85 % del costo. Para nuestro país, durante el mismo periodo (2014) se invirtieron cerca de US $43 millones, equivalentes a $ 123.000 millones de pesos en medicamentos para tratar la EM 12. El objetivo de este trabajo fue evaluar la eficacia y la seguridad del rituximab en el manejo actual de esta enfermedad.
MATERIALES Y MÉTODOS
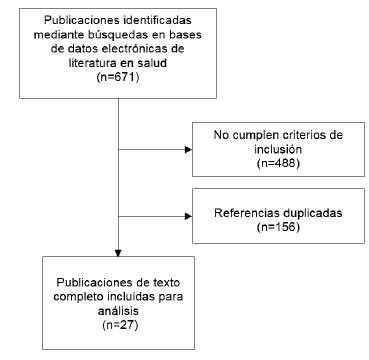
Se realizó una revisión de la literatura en bases de datos de PubMed, Embase, Lilacs y Scielo, limitada a la última década. La estrategia de búsqueda fue la siguiente: ("efficacies"[All Fields] OR "efficacious"[All Fields] OR "efficaciously"[All Fields] OR "efficaaousness"[All Fields] OR "efficacy"[All Fields]) AND ("safety"[MeSH Terms] OR "safety"[All Fields] OR "safeties"[All Fields]) AND ("rituximab"[MeSH Terms] OR "rituximab"[All Fields] OR "rituximab s"[All Fields]) AND ("therapeutics"[MeSH Terms] OR "therapeutics"[All Fields] OR "treatments"[All Fields] OR "therapy"[MeSH Subheading] OR "therapy"[All Fields] OR "treatment"[All Fields] OR "treatment s"[All Fields]) AND ("multiple sclerosis"[MeSH Terms] OR ("multiple"[All Fields] AND "sclerosis"[All Fields]) OR "multiple sclerosis"[All Fields]). Inicialmente, se identificaron 671 artículos, de los cuales se seleccionaron 27 en texto completo para el análisis (figura 1).
Los criterios de inclusión fueron población adulta (≥ 18 años), ambos sexos y diagnóstico confirmado por especialista en neurología de EM, que recibiera tratamiento con rituximab como único esquema terapéutico o comparado con otros esquemas de manejo (fingolimod, natalizumab, dimetilfumarato, alemtuzumab y ocrelizumab) (figura 1). Se seleccionaron publicaciones que permitieran evaluar la seguridad y la eficacia (recaída, remisión, eventos adversos, discapacidad y mortalidad) relacionadas con el uso de rituximab.
También se incluyeron dentro del análisis los estudios pivotales con los cuales fue aprobado el uso de la molécula al laboratorio farmacéutico. La información fue analizada, discutida y consensuada por un panel de expertos clínicos en el manejo de la EM, miembros de la Asociación Colombiana de Neurología y el grupo de expertos metodólogos del Centro de Evaluación de Tecnologías en Salud (ETES) y del Centro de Medicina Basada e Informada en Evidencia (MBIE) del Instituto Global de Excelencia Clínica. Los estudios incluidos se analizaron bajo el enfoque de evaluación de tecnología de salud tipo mini-HTA (Health Technology Assesment, por sus siglas en inglés) 16.
RESULTADOS
Uso actual de la tecnología
Los medicamentos utilizados en el tratamiento de la EM se agrupan bajo la denominación de "tratamientos modificadores de la enfermedad (TME)", caracterizados por su efecto inmunomodulador o inmunosupresor, lo que les permite disminuir la progresión de la enfermedad y la frecuencia de las recaídas.
Eficacia
Los medicamentos con evidencia publicada sobre su eficacia incluida en este análisis fueron:
Interferón beta (interferón beta 1a y 1b): ha demostrado que reduce la frecuencia de las recaídas y la velocidad de progresión en forma moderada del deterioro neurológico 17-19.
Acetato de glatiramero: ha demostrado que puede disminuir las exacerbaciones. No ha sido recomendado por la más reciente guía de manejo de EM del Instituto Nacional de Excelencia en Salud y Atención de Inglaterra (NICE, por sus siglas en inglés) 20.
Anticuerpos monoclonales: se incluyen alemtuzumab, natalizumab, ocrelizumab y rituximab, con eficacia demostrada para disminuir la progresión de la enfermedad (tabla 1) 21-23.
Fingolimod: ha demostrado que reduce la tasa de recurrencias comparado con el interferón 24.
Dimetilfumarato: ha demostrado que reduce el riesgo de recurrencias 25.
Tabla 1 Eficacia y seguridad en anticuerpos monoclonales.
| Medicamento | Eficacia | Seguridad |
|---|---|---|
| Alemtuzumab |
|
|
| Natalizumab |
|
Asociado con leucoencefalopatía multifocal progresiva (0,2 %) |
| Ocrelizumab |
|
|
| Rituximab |
|
Tasa de reacciones adversas similar al placebo (13 %) |
RR: riesgo relativo. IC: intervalo de confianza. RM: resonancia magnética.
Fuente: elaboración propia.
De los anticuerpos monoclonales usados como TME, el rituximab, medicamento que no tiene indicación aprobada para el manejo de EM, ingresó al mercado en 1998 con indicaciones para artritis reumatoide y linfoma no Hodgkin. En el 2008 inició su desarrollo clínico para EM con dos estudios, un ensayo clínico fase II en pacientes con EMRR y un estudio de fase II/III en pacientes con EMPP 26. Los resultados obtenidos eran alentadores, pero el patrocinador decidió suspender el programa de desarrollo en EM. En la actualidad, el medicamento está siendo utilizado de manera creciente para el manejo de la EM en Suecia, donde representa el 53 % de las prescripciones para EM 27.
A pesar de esta situación, la tendencia creciente en los patrones de prescripción evidenciados en varios sistemas de salud de países europeos tiene varias explicaciones. La primera surge de la evidencia publicada por el patrocinador que muestra reducción en la tasa de recurrencias y mejoría de las lesiones cerebrales en las imágenes de resonancia magnética (RM). En segundo lugar, los datos de eficacia obtenidos a partir de múltiples estudios muestran que las tasas de abandono de la terapia, especialmente por progresión de la enfermedad, son inferiores con rituximab (0,03) comparadas con otras TME inyectables (0,53), dimetilfumarato (0,32), fingolimod (0,38) y natalizumab (0,29) 28. Pacientes en tratamiento con natalizumab en riesgo de leucoencefalopatía multifocal progresiva y que fueron cambiados a otros tratamientos, desarrollaron recurrencias en el 1,8 % con rituximab y 17,6 % con fingolimod 29,30. La tasa de mortalidad del estudio de rituximab fue más baja (0,61) comparada con todas las terapias 6,8. Finalmente, la tercera explicación surge de los costos comparativos de las terapias. El costo del rituximab, con 20 años en el mercado, es muy inferior al de los nuevos medicamentos TME y tiende a ser cada vez más bajo por la expiración de la patente y la consecuente aparición de medicamentos biosimilares 31.
Evidencia en eficacia del rituximab
Varias publicaciones permitieron identificar en población objeto y ajustado a los criterios de inclusión, los aspectos más relevantes en la evaluación de eficacia:
Bar-Or y colaboradores 32: ensayo fase I, multicéntrico, abierto en Canadá, con n = 26 diagnosticados con EMRR. El 80,8 % de los pacientes estaba libre de recaídas en la semana 72, y la tasa anual de recaídas disminuyó de forma significativa en las semanas 24 y 72 en comparación con la basal (1,27 vs. 0,23 vs. 0,12). Los eventos adversos se relacionaron con la infusión y no fueron graves.
Hauser y colaboradores 26: ensayo fase II, doble ciego con n = 104 pacientes de EMRR, 69 asignados a recibir rituximab por vía intravenosa en dos dosis únicas de 1.000 mg, con un intervalo de 14 días entre ellas y un tiempo de seguimiento de 48 semanas. En comparación con los pacientes que recibieron placebo, los pacientes de rituximab tuvieron menor recuento de lesiones identincadas con realce de gadolinio en las semanas 12, 16, 20 y 24 (p < 0,001) y de lesiones nuevas con realce de gadolinio en el mismo período (p < 0,001); estos resultados se mantuvieron durante 48 semanas (p < 0,001). De igual manera, se redujo el volumen de lesiones en T2 calculado a la semana 24 (p = 0,008) y a la semana 36 (p = 0,004) de tratamiento. La proporción de pacientes con brotes fue significativamente menor en el grupo de rituximab en la semana 24 (14,5 % vs. 34,3 %; p - 0,02) y en la semana 48 (20,3 % vs. 40,0 %; p - 0,04). La tasa anualizada de brotes fue significativamente más baja en el grupo tratado, contando de la semana 0 a la 24 (0,37 vs. 0,84; p - 0,04). El número de eventos fue similar en los dos grupos, sin embargo, en el grupo de rituximab estos fueron más frecuentes dentro de las 24 horas posteriores a la primera infusión.
Hawker y colaboradores 33: Ensayo aleatorizado, controlado con placebo doble ciego. Incluyó n - 439 pacientes con EMPP; 292 fueron asignados al brazo de tratamiento con rituximab, con un tiempo de seguimiento total de 96 semanas. No se identificaron diferencias en el objetivo primario definido como el tiempo hasta la progresión confirmada de la enfermedad (CDP, por sus siglas en inglés), (tasas de 96 semanas: 38,5 % de placebo, 30,2 % de rituximab; p - 0,14), no obstante, desde el inicio hasta la semana 96, los pacientes con rituximab tuvieron un aumento menor (p < 0,001) en el volumen de la lesión T2; el cambio en el volumen cerebral fue similar (p - 0,62) al placebo. El análisis de subgrupos mostró que el tiempo hasta la CDP se retrasó en los pacientes tratados con rituximab de edad < 51 años (cociente de riesgo [HR] - 0,52; p - 0,010), aquellos con lesiones que aumentan el gadolinio (HR - 0,41; p- 0,007), o en los que coexistían ambas condiciones (p- 0,009), el tiempo hasta la progresión confirmada de la discapacidad se retrasó de forma significativa, y estos factores se comportaron como posibles predictores de buena respuesta al tratamiento. Los eventos adversos fueron comparables entre los grupos.
Salzer y colaboradores 34: estudio retrospectivo realizado en Suecia, con n - 822 pacientes, la mayoría con EMRR. Reporta evidencia de disminución de la tasa anual de recaídas (TAR). Este estudio proporciona evidencia de nivel IV de que el rituximab es seguro y efectivo para tratar la EM.
Xie y colaboradores 35: metaanálisis para para evaluar la eficacia y la seguridad de los anticuerpos monoclonales de células anti-B (rituximab, ocrelizumab y ofatumumab) en pacientes con cualquier tipo de EM. Se incluyeron cuatro ensayos clínicos controlados, con un total de n- 745 pacientes, y se encontró reducción en la formación de lesiones con gadolinio, así como disminución en el volumen de las lesiones identificadas por RM sin aumentar la frecuencia de los eventos adversos versus placebo. Aunque el estudio solo incluyó para el análisis los estudios Hermes y Olympus, los autores concluyen que, en comparación con el tratamiento con placebo, los tres medicamentos tienen un efecto benéfico y los eventos adversos fueron tolerables en los pacientes con EM.
Granqvist y colaboradores 28: estudio de cohortes retrospectivo en Suecia, con n = 494 pacientes de EMRR. La tasa de recaídas clínicas y/o la actividad de la enfermedad neurorradiológica fueron significativamente menores para rituximab en comparación con TME inyectables y dimetilfumarato, con una tendencia a tasas de recaída más bajas, también en comparación con natalizumab y fingolimod. Se evidenció superioridad del rituximab con respecto a todos los TME en cuanto a la interrupción del fármaco, y también mostró una mejor eficacia clínica en comparación con los TME inyectables.
Durozard y colaboradores 36: estudio observacional retrospectivo multicéntrico en Francia, con n = 50 pacientes con EMRR. Se encontró que el rituximab redujo la actividad de la enfermedad evidenciada por la clínica e imagen de RM en pacientes con EMRR activa, a pesar del tratamiento previo con TME.
Boremalm y colaboradores 24: estudio retrospectivo en Suecia con n = 241 pacientes para comparar la eficacia, la seguridad y la persistencia de la medicación con natalizumab, rituximab y fingolimod como terapia de escalonamiento en la EMRR. La TAR fue 0,02 para natalizumab y 0,03 para rituximab. En pacientes con EMRR que venían en tratamiento con interferón/acetato de glatiramero; el cambio a natalizumab o rituximab se asoció con menos actividad de la enfermedad en comparación con fingolimod. El rituximab mostró superioridad en comparación con el natalizumab y el fingolimod.
Hu y colaboradores 37: revisión sistemática y metaanálisis para evaluar la eficacia y la seguridad del rituximab en EMRR. Incluyó 15 estudios que en total sumaban n = 946 pacientes. El tratamiento con el medicamento se asoció con una disminución de 0,80 (IC 95 %: 0,451,15) en la tasa anual de recaídas (TAR). La puntuación media en la Escala de Estado de Discapacidad Expandida (EDSS) disminuyó en 0,46 (IC 95 %: 0,05-0,87). La probabilidad de que los pacientes experimentaran una recaída después de iniciar el tratamiento con rituximab fue solo del 15 %. El 29,6 % de los pacientes presentó eventos adversos leves a moderados, sin evidencia de eventos adversos graves. Este estudio mostró una disminución de la TAR y la EDSS en pacientes con EMRR, siendo bien tolerado sin eventos adversos graves.
Evidencia de la seguridad del rituximab
La mayor parte de las reacciones adversas al rituximab son leves y se relacionan con la infusión en las primeras 24 horas (78,3 % y 67,1 % en pacientes que recibieron rituximab frente a 40 % y 23,1 % en el grupo placebo), pero con el tiempo disminuyen a valores similares al placebo 26. Los efectos descritos con mayor frecuencia en la literatura son malestar general, cefalea, náusea, prurito, rubor, fiebre, escalofríos, rigidez, dolor orofaríngeo, vértigo, fatiga e hipotensión. En los ensayos clínicos se observó una incidencia de infecciones similar entre el grupo tratado y el placebo (69,6 % y 68,2 % frente a 65,3 % y 71,4 %, respectivamente) 26.
Se describen con mayor frecuencia infecciones del tracto respiratorio superior y de las vías urinarias 38. Varios estudios concluyen que el rituximab es seguro para su uso en EM, con la posibilidad de ocurrencia de algunos eventos adversos definidos como tolerables 3,37,39-41. Hasta en el 67 % de una cohorte de 466 embarazos, en 375 mujeres que ingresan con enfermedad no controlada, el rituximab es un posible tratamiento en mujeres que desean embarazo y quieren tratamiento de alta eficacia por su acción inmunomoduladora prolongada. Se recomienda iniciar antes del embarazo, a dosis de 500 mg cada seis meses, mantener infusión durante el embarazo, y continuar cada seis a doce meses después del parto o antes si la actividad de la enfermedad regresa o el paciente lo solicita 42.
Otra serie recientemente publicada de 55 mujeres y 74 embarazos indica que el tratamiento con rituximab es seguro y eficaz en EM subóptimamente controlada, o en aquellos que venían con fingolimond o natalizumab, iniciando o cambiando el tratamiento antes del embarazo, sin suspender lactancia 43. Las mujeres con un control de la enfermedad subóptimo antes del embarazo, pueden beneficiarse de TME eficaces que sean compatibles con el embarazo y la lactancia. Las mujeres con EM deben ser estimuladas a lactar con seguridad 42.
DISCUSIÓN
La EM es una enfermedad neuroinflamatoria, crónica, degenerativa e incurable, asociada a pérdida neuronal, grados crecientes de discapacidad y deterioro cognoscitivo 1,44. Su manejo representa grandes costos para los sistemas de salud y la sociedad en general. Estudios recientes han confirmado que la terapia con rituximab es efectiva en el manejo de la EMRR, con una tasa de interrupción o abandono del tratamiento más baja que la de otras TME 45-50; no obstante, y a pesar de los resultados positivos de los ensayos de fase II, en la actualidad el rituximab no está aprobado para el tratamiento de la EM, pero se puede utilizar como una opción de tratamiento off-label, y no ha sido presentado aún ante las autoridades de regulación para considerar su inclusión en el listado de medicamentos con usos no incluidos en registro sanitario (UNIRS) 51-54.
La adopción del rituximab como alternativa de tratamiento en algunos sistemas de salud (Suecia y Suiza) ha mostrado buenos resultados clínicos, menores costos y un alto perfil de seguridad. La evaluación de desenlaces clínicos en la mayor cohorte publicada de pacientes con EM tratados con rituximab, en Suiza 3,55, proporciona evidencia adicional de que este medicamento es efectivo y seguro en esta condición altamente incapacitante; además, es necesario considerar que la expiración de la patente del rituximab permitirá el ingreso de biosimilares con la consecuente reducción en los costos para el sistema de salud 48,56-59.
En Colombia, según información del Ministerio de Salud para el período 2002-2005, la EM se ubicó en el lugar 13 entre los medicamentos con mayores costos por recobros al sistema de salud, con aproximadamente 28.000 millones de pesos 60, y para el 2013 casi duplicaba este valor. Por ello, el uso de medicamentos con efectividad adecuada y menores costos puede tener un impacto relevante en los costos de esta patología 61.
La evidencia actual ha demostrado el beneficio del rituximab en el tratamiento de la EM, debido a su perfil de efectividad, seguridad y costos 6,34, sin embargo, existe evidencia heterogénea de su impacto en el contexto de la infección por SARS-CoV-2. Varios estudios sugieren que el rituximab se asocia con una mayor tasa de infección, hospitalización y mortalidad en pacientes con covid-19 en comparación con otras terapias 62-65, por lo cual existe variabilidad en las recomendaciones emitidas. El consejo global para pacientes con EM durante la pandemia sugiere no suspender el tratamiento con rituximab 66-68. La Federación Internacional de Esclerosis Múltiple (MSIF, por sus siglas en inglés) recomienda varios ítems relacionados con el uso de rituximab en EM:
Existe alguna evidencia de que las terapias que se dirigen al CD20 (rituximab) pueden estar relacionadas con una mayor probabilidad de tener un covid-19 más grave, incluido un mayor riesgo de hospitalización. Sin embargo, estas terapias aún deben considerarse una opción para tratar la EM durante la pandemia 69.
Existe alguna evidencia de que las personas con rituximab pueden tener una respuesta de anticuerpos reducida a las vacunas covid-19. Los datos son limitados hasta el momento 69.
Los pacientes con EM vacunados pueden infectarse con covid-19 y contagiar a otras personas. Esto es incluso más probable para aquellos que se encuentran con rituximab, el cual podría reducir la efectividad de las vacunas 69.
La MSIF recomienda estar completamente vacunado antes de iniciar el medicamento y esperar entre dos y cuatro semanas entre la última dosis de vacuna y la primera infusión 69. No se dispone de estudios que evalúen la eficacia de las vacunas covid-19 en poblaciones con EM en tratamiento con rituximab, sin embargo, se sugiere una disminución de la respuesta protectora por atenuación de la respuesta humoral y celular. El tratamiento se asocia con una depleción casi completa de las células B que comienza dos semanas después de la infusión y dura de seis a doce meses, aunada a una reducción de células T CD3+ CD20 que puede extenderse hasta un año después del tratamiento 70,71. La recuperación de células B puede lograrse después de 12 meses, sin embargo, el agotamiento de las células B de memoria puede persistir durante varios años. Por lo tanto, se recomienda administrar las vacunas covid-19 al menos tres a seis meses después de la dosis de rituximab y al menos seis semanas antes de la siguiente infusión para optimizar la eficacia de la vacuna. Dada la complejidad de la enfermedad, tanto para definir la continuidad como la suspensión del rituximab y el momento de la vacunación, la decisión dependerá de una evaluación integral de las preferencias del paciente, el estado de la enfermedad y los riesgos de exposición. Se sugiere que la medición de los niveles de inmunoglobulinas y linfocitos puede ayudar a guiar el momento de la vacunación y la modificación de los intervalos de dosificación. No se recomiendan vacunas vivas atenuadas durante el tratamiento con rituximab hasta la recuperación completa de las células B 72,73.
CONCLUSIÓN
La evidencia disponible sugiere que el tratamiento con rituximab en EM representa una alternativa efectiva en EMRR, con beneficio potencial también en EMPP, razón por la cual el rituximab puede ser usado dentro del panel de tratamiento para EM y constituye una terapia adicional efectiva, segura y a un costo racional en términos de sostenibilidad del sistema de salud colombiano, e incluso en los costos indirectos asociados a esta enfermedad.