Introducción
El virus de la hepatitis C (VHC) pertenece a la familia Flaviviridae y al género Hepacivirus. Su genoma es un ARN monocatenario de sentido positivo, de aproximadamente 9600 nucleótidos y que contiene un solo marco de lectura abierto (ORF por sus siglas en inglés). El genoma viral es traducido en una poliproteína que es procesada por proteasas celulares y proteasas virales en al menos 10 proteínas: 3 estructurales (C, E1, E2), 5 no estructurales que hacen parte del complejo de replicación del ARN (NS3, NS4A, NS4B, NS5A, NS5B) y otras 2 no estructurales, p7 y NS2, que participan en el ensamblaje, maduración y liberación de la partícula viral 1 (Figura 1).

Fuente: elaboración propia
Figura 1 Organización genómica del VHC Representación gráfica de la cadena simple de ARN positivo y de las proteínas estructurales y no estructurales.
El VHC tiene una alta variabilidad genética que ha sido clasificada en 7 genotipos (del 1 al 7) y uno provisional, el genotipo 8, que fue recientemente descrito en muestras de pacientes en Punjab, India 2,4. La variabilidad del VHC es consecuencia de la ARN polimerasa dependiente de ARN (NS5B), debido a la ausencia de actividad correctora y la alta tasa de replicación del virus, además de la presión selectiva que ejerce el sistema inmune del huésped y el tratamiento antiviral 5. La diversidad genética de los genotipos del VHC es aproximadamente del 30% y de los subgenotipos del 15%. El genotipo 1 es el más frecuente a nivel mundial, con el 44% de las infecciones asociado al subgenotipo 1b 6.
En Colombia, según la cuenta de alto costo de la cohorte de pacientes bajo tratamiento con antivirales de acción directa (AAD), en el 2019 se describió la predominancia del genotipo 1, subgenotipo 1b (64,3%) 7. Sin embargo, el reporte del 2020 presentó un descenso en la frecuencia del genotipo 1 y subgenotipo 1b (22%). De manera interesante, la prevalencia del genotipo 4 ha aumentado con el tiempo con una frecuencia de 31,9% en el año 2019 y 50% en el 2020 en los casos de pacientes con caracterización genotípica bajo tratamiento con AAD 8. Es de notar que una proporción importante de los pacientes de esta cohorte que están en tratamiento corresponden a casos en seguimiento por coinfección con virus de la inmunodeficiencia humana (VIH) tipo 1, factor que puede explicar el cambio en la distribución de los genotipos de VHC, en particular del genotipo 4.
Epidemiología
El VHC se transmite principalmente por exposición a sangre contaminada. Con el paso de los años, la forma más común de transmisión pasó de ser las transfusiones de sangre a la reutilización de agujas y jeringas en población que utiliza drogas inyectables. Otras rutas de transmisión menos eficientes son la transmisión sexual y la transmisión vertical 9.
La prevalencia global estimada de la infección por VHC es de 58 millones 6,10-11. No obstante, esta cifra varía dependiendo del país y de la región. Las áreas de mayor prevalencia de infección por VHC corresponden a la región mediterránea oriental y Europa del este, incluyendo Egipto, Ucrania,
Rusia, Mongolia y Pakistán. Las regiones con moderada prevalencia son Europa occidental, África (donde resalta Gabón, el Congo, Nigeria y Angola), y las de menor prevalencia son en América, Asia Suroriental y la región pacífica occidental. Llama la atención que en la distribución de genotipos se ha evidenciado que el genotipo 1 es más prevalente en países de ingresos económicos altos y medios, mientras que el genotipo 3 y 4 es más prevalente en países de ingresos medios a bajos 12. Se ha descrito la coinfección con el virus de la inmunodeficiencia humana (VIH) hasta en el 50% de los casos, principalmente en personas usuarias de drogas intravenosas (PID) y en hombres que tienen sexo con hombres (HSH) 13-14.
Algunas variables epidemiológicas se han identificado como factores de la evolución a la infección crónica, dentro de las cuales se mencionan la edad, sexo, raza negra y coinfección con VIH 15. La edad de contagio se ha correlacionado en diferentes estudios con la progresión de la enfermedad
16. Poynard et al. reportaron que solo el 2% de los sujetos infectados antes de los 20 años tuvieron progresión a cirrosis, mientras que aquellos infectados después de los 50 años la tuvieron en un 63%
17. Esta correlación puede ser explicada por los cambios en la función inmune y la reducción del flujo sanguíneo y de la capacidad mitocondrial en mayores edades. Por otra parte, los pacientes de raza negra presentan mayor riesgo de desarrollo de hepatocarcinoma y menor tasa de respuesta a la terapia antiviral. Además, el sexo masculino se ha relacionado con una rápida progresión a fibrosis, debida posiblemente a que las células estrelladas son alteradas por el estrógeno, que inhibe su actividad. Finalmente, la coinfección por VIH incrementa el riesgo de cirrosis en un factor de 2,1 16,18.
Manifestaciones clínicas
La presentación clínica de la infección por VHC es diversa, las manifestaciones agudas son un evento inusual en la historia natural de la enfermedad. Estas consisten en un cuadro típico de hepatitis aguda con malestar general, náuseas, dolor en hipocondrio derecho, coluria e ictericia 19. Los casos de falla hepática aguda son raros 20-21.
La infección crónica se desarrolla en el 60% al 85% de las personas infectadas por VHC y usualmente es asintomática, aunque puede haber manifestaciones extrahepáticas como la vasculitis crioglobulinémica, glomerulonefritis membranoproliferativa, porfiria cutánea tarda, diabetes mellitus, enfermedad renal crónica y fatiga crónica 22. Durante la infección crónica, el nivel sérico de la alanina aminotransferasa (ALT) usualmente se encuentra intermitentemente elevado, pero pueden presentarse niveles normales en el 20% de las personas infectadas 23.
En promedio, del 15% al 20% de las personas con infección crónica por VHC desarrollan cirrosis en un periodo de 20 años 24. Los factores epidemiológicos mencionados más arriba aceleraran este proceso. La coexistencia de otras enfermedades hepáticas crónicas, como cirrosis por alcohol, enfermedad de hígado graso no alcohólica o la infección por virus de la hepatitis B son otros factores que aceleran el proceso de fibrosis 17.
Respuesta inmune innata y el interferón
La inmunidad innata es esencial para el control de las infecciones virales y se activa gracias al reconocimiento de la partícula viral y el genoma por los patrones moleculares asociados a patógenos (PAMP) 25. Una cualidad que distingue este tipo de respuesta inmune es la inducción del interferón (IFN) y las citoquinas capaces de crear un estado antiviral en las células 26-27.
Los IFN son proteínas secretadas por el huésped en respuesta a una infección y están clasificadas en tres clases dependiendo del receptor y su función: IFN tipo I (IFN-α, -β, -ε, -κ, -τ, -δ, -ζ, -ωy-ν), IFN tipo II (IFN-γ) e IFN tipo III (IFN-λ1, -λ2 y -λ3) 27-28.
Los IFN tipo I (IFN I) y tipo III (IFN III) son una respuesta fundamental en las infecciones virales. En primer lugar, los receptores del IFN I se encuentran en la mayoría de las células y su actividad antiviral es directa sobre la replicación viral. Además, regula funciones celulares inmunes de la respuesta tanto innata como adaptativa 29. Por otra parte, el receptor para el IFN III se encuentra predominantemente en células dendríticas y epiteliales. Las propiedades inmunes del IFN III son similares a las del IFN tipo I, aunque difieren en el receptor y la vía de señalización intracelular 30.
Para su acción antiviral el IFN I y el IFN III estimulan la Janus quinasa 1 (JAK1) y tirosina quinasa 2 (TyK2), el IFN I lo hace mediante la unión al receptor alfa de IFN (IFNAR) que constituye un complejo IFNAR 1 e IFNAR 2, mientras que el IFN III lo hace con la unión al receptor alfa de IL28 y receptor de IL10 beta (IL-28Ra/IL-10R2), miembro de la familia de la IL10. Esta interacción desencadena la traducción de señales que estimulan la fosforilación y dimerización del complejo transductor de señal y activador de transcripción (STATb) compuesto por STAT1 y STAT2, que junto al factor de regulación de IFN 9 (IRF9) forman el complejo trimérico, factor 3 del gen estimulado por interferón (ISGF3). Este complejo es traslocado al núcleo donde se une a los elementos de respuesta estimulada por IFN (ISRE, por sus siglas en inglés) y produce la transcripción de genes estimulados por IFN (ISG, por sus siglas en inglés). La respuesta mediada por IFN III para la producción de ISGs es la más intensa y sostenida 31-32 (Figura 2).
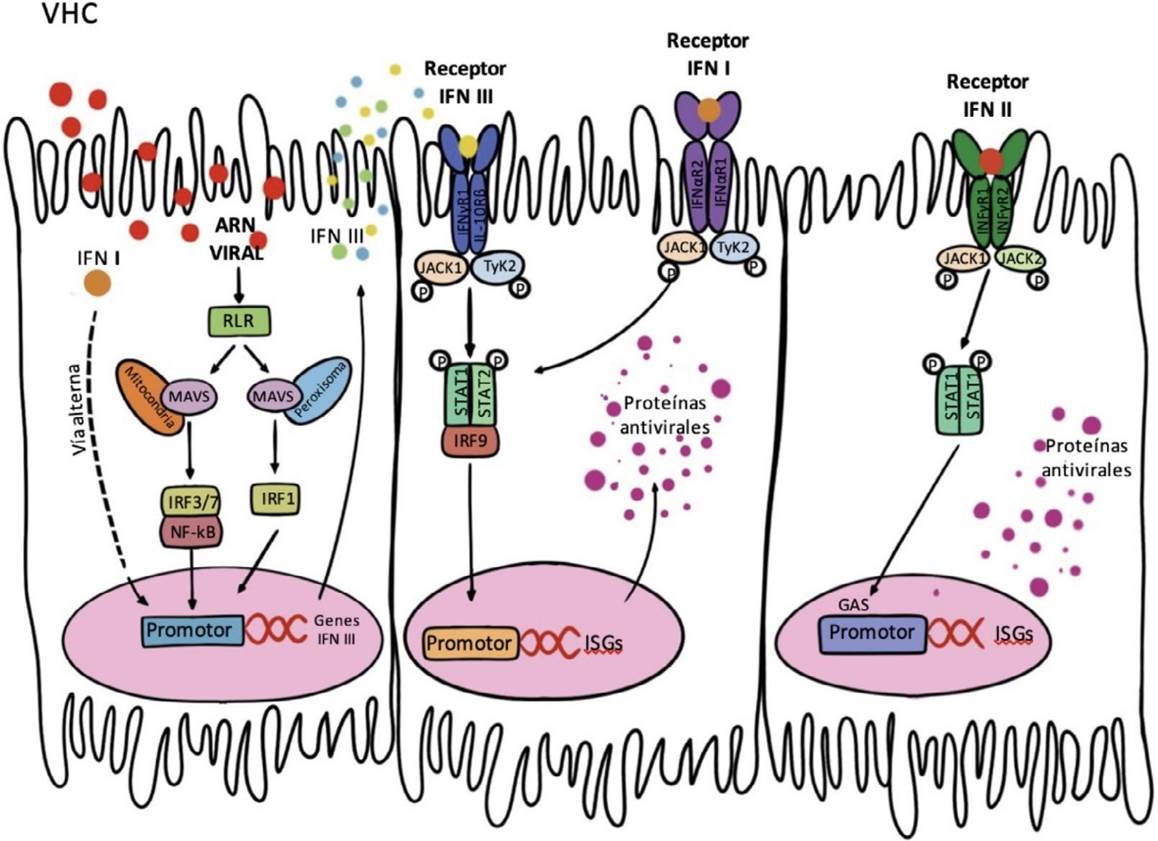
IFN I y el IFN III se unen a sus respectivos receptores IFNAR y IL-28Ra/IL-10R2. Estos dos estimulan JAK1 y TyK2, tras lo cual se desencadena la traducción de señales que estimulan la fosforilación y dimerización del complejo STATb, que junto al IRF9, producen la transcripción de ISG. IFNAR, receptor alfa de interferón, IL-28Ra/IL-10R2, receptor alfa de IL28 y receptor de interleucina 10 beta, JAK 1 Janus cinasa 1, TyK2, tirosina quinasa 2, STAT, transductor de señal y activador de transcripción, IRF9, factor de regulación de IFN 9, ISG de genes estimulados por IFN
Fuente: adaptado de 56
Figura 2 Sistema de interferón con énfasis en interferón III
La actividad de IFN III varía entre los diferentes subtipos dependiendo de su afinidad por el receptor de la IL 28 (IL-28R) y la presencia de polimorfismos de nucleótido único (por las siglas en inglés, SNPs). Los estudios enfocados en el IFN III han encontrado un efecto significativo en la inhibición de la replicación del VHC, la cual puede variar según los polimorfismos de estos SNPs 33.
Inmunidad adaptativa
La producción de citoquinas y quimiocinas en respuesta a la transcripción de los ISG no solo contribuye a la actividad antiviral en la etapa más temprana de la infección, sino que permite organizar la respuesta inmunitaria adaptativa 34.
Actualmente se reconoce la importancia de las células T (LT) específicas contra el VHC en el hígado, indispensables para la eliminación de las partículas virales y de las células infectadas, ya que su aparición y la expresión de IFN II se relaciona con la disminución de la carga viral 9,35. La respuesta de las LT aparece de 6 a 10 semanas después del contagio y se relaciona con el aumento en los niveles séricos de la ALT, en algunas ocasiones con ictericia, y su participación puede llevar al aclaramiento de la infección en aproximadamente el 30% de los individuos infectados. La respuesta vigorosa de los LT CD8+ se ha asociado con aclaramiento viral espontáneo. Estas células inhiben la replicación viral a través de lisis de células infectadas y la producción de IFN II 36.
Los anticuerpos neutralizantes en la infección por VHC se detectan de manera tardía, entre las 8 a 20 semanas de la infección, y normalmente exhiben reactividad cruzada entre los genotipos del VHC. Los anticuerpos no logran la eliminación del virus, aunque ejercen presión de selección sobre las variantes virales (cuasiespecies), lo cual lleva a la evolución de las secuencias de las glicoproteínas de envoltura del VHC a lo largo de la infección 9,35.
La infección crónica por VHC es la consecuencia de múltiples mecanismos de evasión viral a la respuesta inmune. Dentro de estos, la actividad de la proteasa NS3/4A inhibe la acción de IRF3 que promueve la expresión de genes específicos con acciones antivirales o inmunomoduladoras 37. Por otro lado, se ha demostrado que la proteína NS5A suprime la actividad del IFN tipo I a través de la regulación negativa en la expresión de ISG 38. De igual manera, tanto NS5A como E2 son inhibidores de la proteína quinasa dependiente de ARN (PKR por sus siglas en inglés). Otros mecanismos implicados son la alteración de la función de STAT1 por proteínas virales y la supresión de la expresión de ISG56, otro de los genes estimulados por IFN 34. Finalmente, los estudios han demostrado que la persistencia de la infección se correlaciona con el incremento de la complejidad genética viral. Esto indica que la presión inmune del huésped puede llevar a la selección de variantes resistentes a la acción de los IFN 39.
El fallo en la inmunidad de los LT CD8+ se ha atribuido a dos mecanismos principales: el agotamiento del LT y los mecanismos virales de evasión de la respuesta inmune. El primero es consecuencia de la estimulación crónica antigénica que lleva a un estado de pérdida de la función efectora. La población de LT CD8+ con perfil de agotamiento no es homogénea y recientemente se han descrito las subpoblaciones TCF-1+ CD127+ PD-1+ y PD-1hi Eomeshi TOX hiCD127-terminal exhausto. El escape viral es facilitado por la selección de LT CD8+ con disminución en la unión del epítope viral al complejo mayor de histocompatibilidad tipo I (CMH tipo I) o con una alteración en el reconocimiento del antígeno viral por el receptor del LT. Estos mecanismos de fallo en la respuesta inmune del LT CD8+ están ligados a una respuesta disminuida del LT CD4+, que además expresa receptores inhibitorios como la proteína de muerte celular programada tipo 1 (PD-1) y antígeno-4 asociado al linfocito T citotóxico (CTLA-4) 40.
Los polimorfismos del gen IL28B
Existen tres principales polimorfismos de SNPs del gen IL 28B ubicado en el cromosoma 19: rs12979860, rs809917 y rs12980275. Estos SNPs están localizados en la región promotora del gen IL 28B, por lo que pueden afectar el nivel de expresión del ARNm y por tanto el nivel de traducción de la proteína
(Figura 3). Múltiples estudios han demostrado la asociación entre el aclaramiento viral en la infección por VHC y la presencia de estos polimorfismos 41. Esta asociación depende de la respuesta inmune innata del huésped a través del impacto del IFN III en la activación ISG por vías diferentes a las activadas por el IFN I. Asimismo se ha demostrado que el IFN I induce la expresión del IFN III 27.
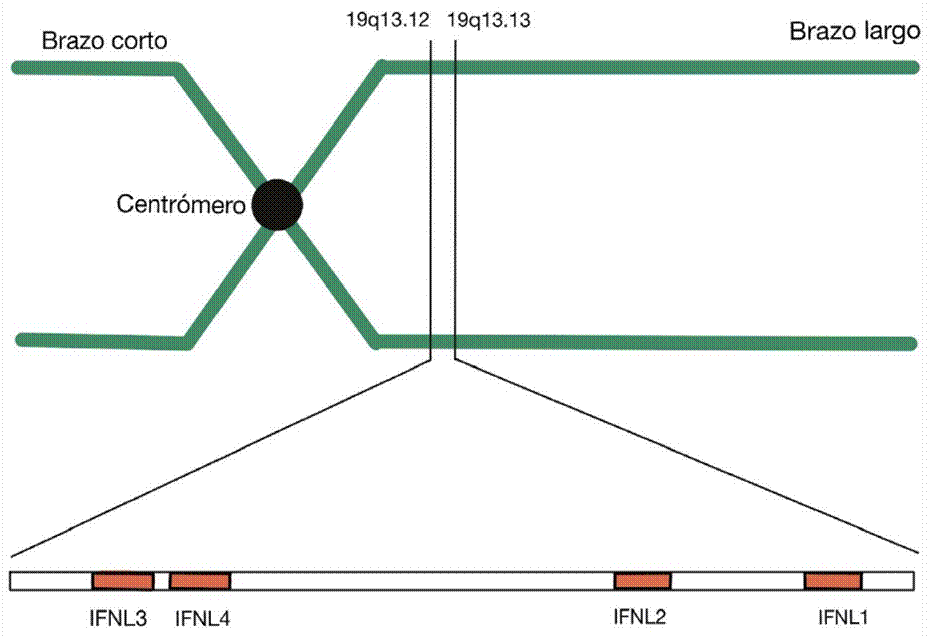
Cromosoma 9, ampliación gráfica de los locus de cada interferón tipo I, tipo II y Tipo III.
Fuente: modificado de 57
Figura 3 Ubicación de la familia genes IFN III en el genoma celular
La evidencia del polimorfismo del gen IL 28B y su relación con el aclaramiento del VHC ha incrementado desde el 2009, con un pico de publicaciones entre 2015 y 2018 antes de la aparición del tratamiento con los antivirales de acción directa (AAD). Sin embargo, el tema continúa siendo de interés por la relación entre los polimorfismos del gen IL 28B con el aclaramiento viral espontáneo y la respuesta virológica sostenida (RVS). Thomas et al. evaluaron la presencia del polimorfismo rs12979860 en muestras de 388 individuos que presentaron aclaramiento viral espontáneo, y en muestras de 620 pacientes con infección persistente por VHC. Los autores documentaron que los pacientes con el genotipo C/C en este SNP tenían tres veces más posibilidad de lograr el aclaramiento viral en comparación con pacientes con el genotipo C/T y T/T (OR = 0,33). Un hallazgo relevante fue el posible rol recesivo del alelo, dado que no se observaron diferencias significativas entre los genotipos C/T y T/T y la posibilidad de aclaramiento viral 42.
Shebl et al. evaluaron los polimorfismos rs12979860 y rs8099917 en una cohorte de 1209 PID. El análisis mostró que, de los pacientes homocigotos para el polimorfismo rs12979860, aquellos con el genotipo C/C tenían cuatro veces más probabilidades de lograr el aclaramiento comparado con los homocigotos con genotipo T/T (OR: 3,88 IC 95% 2,49 6,07). Los resultados fueron similares al evaluar los grupos de pacientes afroamericanos, americanos, europeos, hispanos y asiáticos. Por otro lado, el aclaramiento en caso del polimorfismo C/T mostró resultados estadísticamente no significativos (OR: 1,48 IC 95% 0,96 - 2,28; P 5,08). Los datos para el aclaramiento de la infección viral para el polimorfismo rs8099917 no fueron significativos 43.
Grebely et al. realizaron un estudio retrospectivo con una cohorte de 632 pacientes con infección aguda por VHC y documentaron el aclaramiento viral en 173 de ellos. Dentro de los factores independientes del aclaramiento viral en el análisis multivariado se encontró el polimorfismo CC
del SNP rs12979860 (razón de riesgo [HR]: 2,26 IC 95% 1,52 3,34). Otros factores independientes asociados fueron el sexo femenino (razón de riesgo ajustado [HRA]: 2,16 IC 95% 1,48 3,18) y la infección por el genotipo 1 (HRA: 1,56 IC 95% 1,06 2,30) 44. Los estudios han evaluado principalmente el SNP rs12979860 del gen IL 28B; sin embargo, otros trabajos también han demostrado mayor frecuencia del SNP rs8099917 Т/Т en el 81,3% de los pacientes con infección por VHC con aclaramiento viral espontáneo 45.
Recientemente un equipo de investigadores iraníes realizó un metaanálisis en el que se evaluó la asociación entre el polimorfismo rs12979860 del gen IL 28B y el aclaramiento viral espontáneo en la infección por VHC. Incluyeron 21 estudios retrospectivos y uno prospectivo, y encontraron que aquellos pacientes con el polimorfismo rs12979860 C/C tienen 2,75 veces más probabilidad de presentar aclaramiento viral espontáneo comparado con aquellos que presentan T/T y C/T (OR IC 95% 2,23 3,38). La heterogeneidad entre los estudios fue moderada 41.
En el contexto de tratamiento con AAD, Sakhaee et al. evaluaron la correlación de los polimorfismos de IL28 y la respuesta virológica al tratamiento en 520 pacientes infectados por VHC sin tratamiento previo con estos antivirales. En aquellos con infección por VHC subgenotipo 1a el análisis multivariado mostró una RVS mayor en los que tenían el SNP rs12979860 C/C (P = 0,044), IL28B rs12980275 A/A (P < 0,001), IL28B rs8099917 T/T (P = 0,045), en comparación con otros polimorfismos. En cuanto al VHC subgenotipo 1b, el polimorfismo rs12980275 A/A (P = 0,012) se asoció a RVS comparado con los otros polimorfismos. En los casos de infección por VHC genotipos 3 (subgenotipo 3a) y 2, los polimorfismos rs12979860 C/C (P = 0,045), IL28B rs12980275 A/A (P < 0,001) y IL28B rs12979860 C/C (P = 0,049), IL28B rs12980275 A/A (P = 0,043) fueron factores independientes para RVS 46. Otros estudios siguen demostrando el impacto de la presencia del genotipo favorable del IL28B y RVS bajo los regímenes sin interferón 47.
Esta evidencia demuestra de manera contundente la relación entre la susceptibilidad genética y una respuesta favorable a la infección 48-49. Se podría inferir, entonces, que el desarrollo del aclaramiento viral espontáneo tiene una relación directa con la respuesta innata ante la infección por VHC. Esta hipótesis se complementa con el estudio realizado por Sukanya et al., donde, además, el aclaramiento espontáneo se correlacionó con la respuesta adaptativa, con la presencia de anticuerpos neutralizantes y la reversibilidad del agotamiento de LT en los primeros dos años de la infección crónica 50. Por tanto, la respuesta inmune (innata y adaptativa) juega un papel determinante en el aclaramiento viral espontáneo con particular importancia en ese paso inicial donde se ve implicado el INF III.
Hoy en día, con la accesibilidad a los regímenes pangenotípicos constituidos por AAD con una efectividad del 95%, incluso bajo la presencia de sustituciones asociadas a resistencia, el papel de los polimorfismos del gen IL28B parece ser menos importante. Sin embargo, cabe resaltar que las metas de erradicación para el 2030 planteadas por la Organización Mundial de la Salud (OMS) con estos nuevos regímenes se han visto amenazadas ante la posibilidad de reinfección y recaída antes de las 48 semanas de la RVS, en especial en las poblaciones de alto riesgo (PID, coinfección con VIH), y con el advenimiento de la pandemia del uso de opioides, el cual continúa en ascenso 51.
Además, se ha demostrado de manera persistente que, bajo el tratamiento de los regímenes basados en sofosbuvir, la presencia del polimorfismo IL28B favorable es significativamente mayor en aquellos que son respondedores al tratamiento, tanto así que algunos autores han planteado la posibilidad del beneficio de dar regímenes más cortos a estos pacientes 51-52. Debido a lo anterior, cabe resaltar la importancia de su estudio, no solo en la era actual sino también en el futuro, en pacientes seleccionados provenientes de poblaciones de alto riesgo, países donde los regímenes pangenotípicos son limitados por la accesibilidad a los AAD, al momento de encaminar el tratamiento a una medicina de precisión.
Otras variables del huésped para considerar
Las evidencias anteriormente expuestas demuestran la importancia de la susceptibilidad genética en el huésped en la respuesta a la infección por VHC; sin embargo, cabe anotar que la mayoría de los estudios también incluyen variables como el sexo y la sintomatología, que son sinérgicos en el aclaramiento viral espontáneo 53. Van den Berg et al. demostraron en una cohorte de 106 PID la relación entre el sexo femenino y el polimorfismo de IL28 C/C rs12979860, en la que las mujeres con este genotipo tenían 2,3 veces más probabilidad de aclarar la infección por VHC que los hombres con el mismo genotipo (28,2%/12,2%). La misma relación para los otros polimorfismos T/T y C/T fue de 1,39 (13,5/9,7) 51.
En trabajos mencionados anteriormente también se ha demostrado esta asociación. Grebeley et al. encontraron en un estudio de retrospectivo que las mujeres con el polimorfismo C/C rs12979860 tenían mayor probabilidad de aclaramiento viral espontáneo respecto a hombres con el polimorfismo CT/TT (HRA 4,65 IC 95% 2,71 7,96). Los mecanismos detrás de la asociación y el aclaramiento viral pueden estar relacionados con las diferencias en la inmunidad por sexo 54. Las mujeres tienen una carga menor de infecciones en general, una mayor prevalencia de enfermedades autoinmunes y un aumento en el número y magnitud de respuesta inmune e inflamatoria en comparación con los hombres 55. A pesar de los considerables trabajos que abordan diferencias en la función inmune entre hombres y mujeres, los datos sobre el perfil inmune en aquellos con VHC son limitados, por lo que se requieren estudios de mayor magnitud y calidad metodológica que traten este tema.
Conclusiones
El sexo, la susceptibilidad genética, las características fisiológicas de cada paciente y factores del VHC como la carga viral y número de cuasiespecies se interrelacionan para contribuir e influir en la posibilidad de aclaramiento viral espontáneo en la infección por VHC.
A pesar de la amplia heterogeneidad de los diferentes estudios mencionados, los resultados favorecen la asociación del polimorfismo C/C rs12979860 con aclaramiento viral espontáneo y respuesta viral sostenida en la mayoría de las publicaciones. Esta información es útil sobre todo para tomar decisiones clínicas a futuro con miras a lograr las metas de erradicación planteadas por la OMS para el 2030. Los otros polimorfismos del gen IL28B también se han relacionado con una respuesta favorable en la infección por VHC, aunque con menor evidencia a la documentada con rs12979860. Se espera que los estudios en este tema aumenten en el contexto del uso de antivirales directos y se pueda encontrar evidencia en estudios prospectivos que nutran la investigación de este tema en particular.















