Introducción
El pescado y los productos pesqueros son algunos de los productos alimenticios básicos más comercializados en todo el mundo. La tendencia del consumo de pescado a nivel mundial ha ido en incremento en las últimas décadas, para el 2016 se alcanzó un histórico de 171 millones de toneladas de las cuales el 88% fue para consumo humano directo, lo que equivale a 136 millones de toneladas consumidas (FAO, 2018). Las formas de comercialización están dominadas por el pescado vivo, fresco o refrigerado con un 46%, (63 millones de toneladas), seguido del pescado congelado (29%), pescado preparado o en conserva (13%) y el pescado seco, salado o curado (12%) (FAO, 2012).
Actualmente los consumidores exigen el cumplimiento de normas más estrictas en cuanto al grado de frescura, la diversidad y la inocuidad de los alimentos, con el fin de proteger su salud (FAO, 2014), por eso la gran preocupación sobre las prácticas en el cultivo y la calidad del pescado proveniente de la acuicultura, además de los medios de inspección y control de los productos para prevenir enfermedades transmitidas por los alimentos (Matagaras et al., 2008).
El pescado es un producto altamente perecedero debido a una serie de cambios autolíticos, oxidativos y microbianos, estos últimos en gran parte responsables del deterioro del pescado, produciendo alteraciones en la calidad como el olor, sabor, apariencia y textura y determinando su vida útil durante el almacenamiento (Gram et al., 1996; Footitt, 1999; Altieri et al., 2005). Entre los cambios mencionados, son determinantes la calidad microbiana y el contenido de nitrógeno volátil, los cuales determinan la viabilidad para el consumo humano (Footitt y Lewis, 1999; Lovdal 2015, Tome, 2000; EFSA, 2009; Gómez-Sala et al., 2016).
Los mecanismos de conservación del pescado más usados, son el uso del hielo, refrigeración y congelamiento, cuyo objetivo principal es proporcionar bajas temperaturas con el fin de controlar la flora microbiana al disminuir la velocidad de crecimiento de los microorganismos (Olafsdotirr et al., 2006; Leela- pongwatta et al., 2005). Aunque los dos primeros se consideran tecnologías relativamente sencillas y de bajos costos su desventaja está en el tiempo corto de almacenamiento: alrededor de 8 días, luego del cual el producto debe ser sometido a un proceso de congelamiento, tecnología más compleja que permite un almacenamiento por largos periodos de tiempo, pero con unos costos más altos (Aras et al., 2005). Otras formas de conservación son: las atmósferas modificadas (Prapaiwong et al., 2009; Erkan, 2007), sometimiento a altas presiones (Erkan and Uretener, 2010) técnicas de barreras, (Emborg et al., 2002; Fernandez-Segovia, 2007)-. Sin embargo las exigencias actuales por parte del consumidor para adquirir alimentos inocuos y altamente saludables ha originado que las investigaciones estén encaminadas a nuevos métodos de preservación del pescado como el uso de antioxidantes naturales (laurel Laurus nobilis, tomillo,Thymus vulgaris, ajo, Allium sativum), (Erkan et al., 2011, Mengsha et al., 2014); uso de quitosano (Silva Santos, 2014) o de microorganismos bioprotectores (Gomez, 2013; Bakar et al., 2007; Bromberg, 2004; O'Sullivan et al., 2002) y biopreservacion por impregnación al vacio (Montalvo, 2014).
El objetivo de este trabajo fue determinar el efecto bioconservante de dos cepas de BAL y el tiempo de impregnación en la calidad microbiológica y química de filetes de tilapia.
Materiales y métodos
Obtención del inóculo
Se obtuvieron inóculos de dos cepas puras, criopreservadas a -20°C del laboratorio de Microbiología y Biotecnología aplicada de la Universidad del Valle: Lactobacillus plantarum JCM 1149 y Lactobacillus acidophilus ATCC 4356. Para la activación las cepas se cultivaron en tubos de ensayo con 10 ml. de caldo MRS (De Man Rogosa y Sharpe), e incubaron por un periodo de 24 a 48 horas a 35°C. Se preparó un medio de cultivo a partir de sacarosa, leche de soya y suero de leche, según lo recomendado por Jurado et al.,(2009), en el cual se inoculó el 10% v/v del microorganismo y se incubó durante 24 h a 35°C y 120 rpm de acuerdo a la metodología desarrollada por Montalvo, (2010). La viabilidad de las BAL en el medio de cultivo se verificó siguiendo la metodología APHA, (1992) y la adaptación de Ramírez (2005) para el recuento en placa de BAL en agar MRS con azul de anilina.
Obtención de los filetes
Los peces de tilapia nilótica (Oreochromis niloticus), (w=700 gr) fueron obtenidos en una piscícola de la región y trasladados en bolsas con oxígeno a la planta de alimentos de la Universidad del Valle, donde se obtuvieron los filetes libre de piel manualmente, siguiendo la normatividad de Buenas Prácticas de Manufactura.
Diseño Experimental
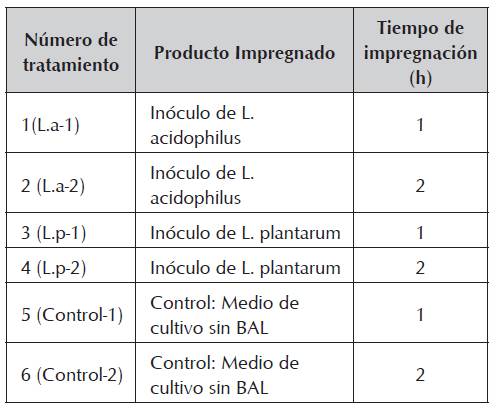
Para la impregnación de los filetes con BAL se implementó un diseño de parcelas divididas con tres factores de entrada, donde los dos primeros (Producto Impregnado, con tres niveles: L. plantarum, L. acidophilus y control que consistió en el medio de cultivo sin BAL y TI: Tiempo de impregnación, con dos niveles: 1h y 2h) formaron una estructura factorial a la parcela completa y el tercer factor (TA: Tiempo de almacenamiento) se empleó en la parcela dividida, este modelo fue aplicado para cada tipo de variable respuesta de forma independiente. Cada análisis se realizó por triplicado. (Tabla 1).
Para comprobar normalidad se utilizó la prueba Shapiro-Wilks; Levene para homogeneidad de varianzas y Box-Pierce para demostrar independencia. Análisis de varianza ANOVA. Los datos microbiológicos fueron ajustados a logaritmo natural. Estos análisis fueron realizados empleando el programa estadístico SPSS versión 1.4. Por último se llevaron a cabo comparaciones múltiples utilizando el test de Tukey, con ayuda del software estadístico R versión 2.10, con un nivel de significancia del 95%.
Se evaluó la influencia del producto imregnado y el tiempo de inmersión en el recuento microbiano y el contenido de nitrógeno volátil del filete de tilapia bio- conservado, determinando el mejor tratamiento que conservara la calidad en el tiempo.
Almacenamiento
Luego de la impregnación, cada filete se escurrió en papel absorbente y se empacó en bolsas de polietileno de baja densidad con barrera de transmisión de oxígeno de 29-45 mL/O2/m2/ 24h/atm, medido a 23°C, y barrera de permeabilidad a gases de 10-15 g/m2 / 24h /medido a 38°C marca CRYOVAC®, utilizando una empacadora de vacío WEBOMATIC® 8224. Finalmente, los filetes se almacenaron a 5°C + 0.5 °C y se evaluaron los cambios la población microbiana y en el contenido de nitrógeno volátil cada 10 días durante 30 días.
Análisis microbiológico
Se maceraron 10 g de cada muestra de filete en 90 mL de agua peptonada a partir de la cual se realizaron diluciones sucesivas para realizar los recuentos de cada grupo microbiano, según lo recomendad por APHA 1992, e INVIMA 1998
El recuento de Mesófilos y Psicrófilos Viables se realizó en Plate Count Agar (PCA) y tiempo de incubación de 48h a 35°C para mesófilos y a 4°C por un período de 5 días para el recuento de psicrófilos.
La determinación de coliformes totales y fecales se realizó según la metodología del Número más Probable (NMP/g) en tubos de ensayo con tubos de Durham invertidos, incubados a 35°C por un periodo de 48 horas. Los tubos que presentaron turbidez o presencia de gas, fueron considerados una prueba presuntiva de la presencia de coliformes, se confirmó la presencia de coliformes con el reactivo de Kovacs e inoculando una muestra de los tubos positivos en caldo Lactosa Bilis Verde Brillante, incubados por 48 horas a 35°C, los tubos que presentaron turbidez y producción de gas (positivos) fueron sembrados en EMB e incubados por 24 horas para determinar la presencia de Escherichia coli.
El recuento de Bacterias Acido Lácticas se realizó mediante siembra en cajas de petri con agar MRS con azul de anilina, e incubadas a 35°C durante 48 horas. A partir del número de colonias obtenidas en las placas, se calculó el número de microorganismos por gramo de la muestra, reportándose como Log UFC/g.
Resultados
La Figura 1 muestra el comportamiento de los microorganismos mesófilos durante el tiempo de almacenamiento para los seis tratamientos evaluados. El conteo inicial para mesófilos fue máximo de 6.25 + 0.85 log UFC/g, en los tratamientos con BAL, mientras que para los filetes control no supero 3.0 + 1.5 log UFC/g, Para el día 10 se observa un crecimiento de los microorganismos en todos los tratamientos, siendo los mayores valores alcanzados en los filetes control 1 y 2, con 11.5 +1.08 log UFC/gr, mientras que para los tratamientos con BAL, el mayor valor corresponde al tratamiento L.p-2 con 8.0 +0.5 log UFC/gr, sin embargo a partir del día 10, se observó una disminución en el recuento total de mesófilos, en los tratamiento que emplearon BAL, alcanzándose una disminución hasta de 6 ciclos log en el tratamiento 3 a los 30 días de almacenamiento. El ANOVA, mostró diferencias significativas entre el tiempo de almacenamiento (P<0.01) y la interacción Producto impregnado x Tiempo de almacenamiento (P<0.01). El análisis múltiple demostró que existen diferencias significativas (P<0.05) entre los filetes tratados con BAL y los filetes control, indicando que hay una mayor cantidad de microorganismos mesófilos en los filetes control. No se observaron diferencias significativas entre los tiempos de impregnación.

Figura 1 Recuento Total de Microorganismos Mesófilos durante el almacenamiento de filetes bioconservados de tilapia
La Figura 2, muestrea el comportamiento de los microorganismos entéricos no fermentadores durante el tiempo de almacenamiento. En general se observó un incremento durante los primeros 10 días encontrándose los valores más altos en los filetes control con valores de 4,8 +0.51 y 4,5 +0.51 log UFC/g , mientras para los tratamientos con BAL los valores no sobrepasaron los 2.7 + 0.5 log UFC/g. Para el día 20 se presentó un leve aumento en todos los tratamientos, tendencia que se mantuvo hasta el día 30 donde los valores mínimos se presentaron para L.p-1 y L.p-2 (2.9+ 0.9 log UFC/g y 3.3 +1.3 log UFC/g (respectivamente) y los máximos para los tratamiento control C1 ( 7.0+0.6 log UFC/g) y C2 (6.5 +0.8 log UFC/g) El análisis múltiple mostro que no existen diferencias significativas al interior de los tratamientos de filetes bioconservados, mientras que si se presentaron diferencias significativas entre estos y los grupos control (P<0.05). De acuerdo al ANOVA se presentaron diferencias significativas (<0,01) en la interacciones producto impregnado x tiempo de almacenamiento, tiempo de inmersión x tiempo de almacenamiento y cepa.

Figura 2 Recuento de Entéricos no Fermentadores durante el almacenamiento de filetes bioconservados de tilapia
La Figura 3 muestra el comportamiento de la Bacterias Acido Lácticas, la presencia de este grupo se evidenció desde el tiempo 0, en todos los tratamientos con BAL, reportándose un mínimo de 5,94 +0.54 log UFC/g (L.a-2), mientras que los grupos control presentaron valores inferiores a 3.16 + 0.8 log UFC/g para el mismo tiempo. En el día 10 se observó un incremento en los tratamientos que emplearon BAL, alcanzando un valor de 8.98 +1.04 log UFC/g (L.p-2), mientras que para el control 1 y control 2 la presencia de BAL disminuyo (1.2 +0,5 log UFC/g y 0.5 log + 0.9UFC/g). A partir del día 10 se observó una disminución de los microorganismos en todos los tratamientos, comportamiento que se mantuvo hasta el final del estudio (día 30), Los valores máximos para este día corresponden a L.p-2 (7.6+0.4 log UFC/g) y L.a-1 (6.86+ 0.04 log UFC/g).

Figura 3 Recuento de Bacterias Lácticas durante el almacenamiento de filetes bioconservados de tilapia
De acuerdo al ANOVA existen diferencias significativas (P<0,01), en el factor C. La comparación múltiple determino que no se presentaron diferencias significativas (P>0.05) entre los grupos de filete tratados con BAL, mientras que si existieron diferencias significativas (P<0,5) entre los tratamiento con BAL y los grupos control.
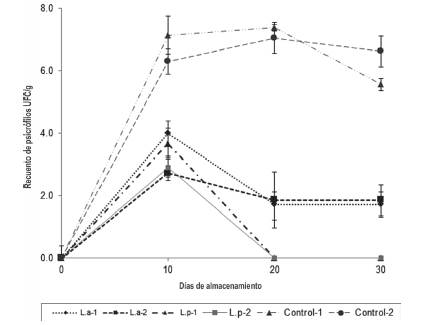
La Figura 4 muestra el comportamiento de los microorganismos psicrófilos durante el tiempo de almacenamiento, durante los primeros diez días se observó un crecimiento en todos los tratamientos, alcanzando los valores máximos en los tratamientos control con valores de 7.14 + 0.6 log UFC/gr 6.3 log + 0.4 UFC/gr respectivamente, mientras que los valores reportados para el mismo periodo en tratamientos con BAL fueron más bajos alcanzado un máximo de 4.0 + 0.74 log UFC/g (T1). Para el día 20 se observó una reducción total de los psicrófilos en los tratamientos L.p-1 y L.p- 2 y una disminución en L.a-1 y L.a-2, con 1.72 log + 0.5 UFC/g y 1.86 log +0.9 UFC/g, y un aumento para el control 1 (7.38 log +0.1 UFC/g) y control 2 (7.05 + 0.5log UFC/g), comportamiento que se mantuvo hasta el día treinta de almacenamiento. El análisis multivariado mostro que no existe diferencias significativas entre los tratamientos con BAL (p>0,05), mientras que si se presentaron diferencias significativas entro los grupos control y los filetes tratados con BAL (P<0.01). El ANOVA mostro diferencias significativas (P<0,01) en las interacciones Producto impregnado x tiempo de almacenamiento y tiempo de impregnación por tiempo de almacenamiento.
De las cepas estudiadas, L. plantarum presentó la mayor capacidad de inhibición del deterioro microbiano de filetes de tilapia hasta por 20 días de almacenamiento refrigerado. En cuanto al tiempo de impregnación, dado que no hubo una diferencia significativa entre 1 y 2 horas, se considera que 1 hora es más eficiente en términos de tiempo de producción. Por lo anterior, se recomienda como método de bioconservación para filetes de tilapia la impregnación con un inóculo de L. plantarum durante una hora, para la obtención de una vida útil de 20 días.
Discusión
Los valores obtenidos para los recuentos de mesófilos son mayores a los reportados para filetes de tilapia (Parias, 2008). En este sentido un recuento de 6 log UFC/g es considerado como indicador de deterioro (Membre et al., 2005; Fernández-Segovia, 2007), sin embargo se debe tener en cuenta que la impregnación a la que fueron sometidos los filetes generó un aumento en los valores iniciales de BALque hacen parte del el recuento de mesófilos y se considera un producto semiprocesado, coincidiendo así a lo expuesto por Huss, (1997) que afirma que para productos bio- preservados, el recuento total de bacterias no puede considerarse como un indicador de deterioro.
Se pudo observar un control del crecimiento de los microorganismos psicrófilos, para ambas cepas estudiadas. Los resultados indican que el producto se encontró en rangos aceptables para esta variable hasta el día 30, con valores menores a los reportados para tilapia, 6,1 log UFC/g. (Barriga et al., 2005), y trucha, 6 log UFC/g, empacadas al vacío y almacenadas a temperatura de refrigeración por 22 y 27 días respectivamente (Lyhs, et al., 2005) y para tilapias sometidas a recubrimiento con quitosano refrigeradas por 30 días (7,36 log UFC) (da Silva et al., 2017)
De otra parte en los filetes tratados con la cepa L. plantarum, el grupo de los psicrófilos, fue inhibido completamente, lo cual indica el efecto bactericida ejercido, por la cepa en el presente estudio, mientras que los tratamientos con L acidophilus, no lograron inhibir totalmente este grupo de microorganismos, pero si reducir su crecimiento, sugiriendo así un efecto bacteriostático.
El control de este grupo de bacterias en los filetes es un aspecto relevante en la vida útil de los productos pesqueros, teniendo en cuenta que gran parte de los microorganismos indicadores del deterioro pertenecen a este grupo (Lyhs, et al., 2005). Resultados similares son reportados por Altieri, et al., (2005), en filetes de lenguado bioconservados con una mezcla de bifidobacterias y thymol Suarez y Beirao, (2008) con el uso de la bacteriocina producida por L plantarum, reportaron un efecto bacteriostático en filetes de cachama empacadas al vacío después de 30 días de almacenamiento. De otra parte los valores obtenidos son menores a los reportados para otras estudios de vida útil bajo otras técnicas de conservación como las atmósferas modificadas; tilapia almacenadas 18 días en hielo, (6.5 log UFC/g) (Guerra et al., 2012), bacalao refrigerado por 28 días (1.69 log CFU/g), (Fernández- Segovia, et al., 2007).
Similares resultados a los reportados para las psicrófilos se observaron en el grupo de entéricos no fermentadores. Teniendo en cuenta que recuentos superiores a 103, UFC/g son considerados como máximos para determinar que el producto comienza su deterioro, se puede considerar que L. plantarum y L. acidophilus, ejercieron un control bacteriostático sobre los coliformes totales hasta el día veinte, logrando así mantener las condiciones microbiológicas aceptables del producto.
Para ambas cepas estudiadas en el presente trabajo se confirma la actividad antimicrobiana característica de las BAL, originada por la producción de ácidos orgánicos, y/o bacteriocinas (Casas y Dobrogsz, 2000, Estrada et al., 2005)
Los valores iniciales de recuento de BAL indicaron que la inmersión de los filetes en los inóculos con bacterias de tipo Lactobacillus, lograron aumentar la presencia de los microorganismos, reportándose valores superiores a los reportados para productos pesqueros donde las bacterias acido lácticas no excedieron los 2 ciclos log, (Tome et al., 2008). Es importante resaltar que aunque las BAL presentaron un incremento en el recuento solo hasta el día diez de almacenamiento, su efecto antagónico sobre los otros grupos de bacterias si se vio evidenciado hasta el final del estudio, probablemente debido a la producción de ácido láctico.
Los resultados obtenidos sugieren que bajos las condiciones del estudio las dos especies de Lactobacillus, son capaces de inhibir y/o disminuir la cinética de crecimiento microbiano en especial del grupo de psicrófilos y coliformes totales, efecto que puede estar originado de una parte por la producción de ácidos orgánicos y de otra por la producción de bacteriocinas (Maldonado et al., 2005, Rodríguez y Schobittz, 2009), coincidiendo así con los estudios realizados con bacteriocinas en salmón, trucha, sardinas y cachamas (Suarez y Beirao, 2008; Rodríguez et al., 2009; Tahiri et al., 2009). El comportamiento presentado por las cepas empleadas corroboran, los reportes de Bromber et al., 2004; Bakar et al., 2008, referentes a que especies de este género son antagonistas de microorganismos patógenos y deterioradores en producto de pescado.
El presente trabajo demostró la actividad antagónica que inóculos de las bacterias del genero Lactobacillus ejercen sobre los grupos de bacterias causantes de deterioro en filetes de tilapia nilótica empacados al vacío y mantenidos bajo refrigeración por un periodo de veinte días, permitiendo así extender el periodo de vida útil del filete fresco.