Introducción
Existen más de 700 especies de hongos entomopatógenos, entre los que destacan los géneros Metarhizium, Beauveria, Isaria, Nomuraea y Lecanicillium (Pedrini et al., 2007; Shah & Pell, 2003; Srivastava et al., 2009). Muchas de estas especies tienen un amplio rango de hospederos y son patógenos de diferentes órdenes de insectos como lepidópteros, coleópteros y hemípteros (Faria & Wraight, 2007). Sin embargo, para que un hongo entomopatógeno sea considerado como un potencial biocontrolador, debe tener como características básicas: alta virulencia contra el insecto plaga, facilidad de producción masiva y la resistencia a condiciones ambientales extremas (Ali et al., 2009a; Rangel, 2011; Rangel et al., 2015). Teniendo en cuenta este potencial, durante las últimas décadas varios bioplaguicidas a base de hongos entomopatógenos han sido comercializados. Sin embargo, de las especies de hongos entomopatógenos actualmente conocidas, sólo 12 especies son utilizadas como principio activo de formulaciones, quedando disponible un número importante de microorganismos con potencial para su desarrollo (Srivastava et al., 2009).
El hongo Nomuraea rileyi (Farlow), está distribuido en amplios agroecosistemas y frecuentemente ocasiona epizootias naturales sobre insectos del orden lepidóptera como Spodoptera frugiperda (J. E. Smith), Anticarsia gemmatalis (Hübner), Trichoplusia ni (Hübner), entre otros (León & Pulido, 1991; Mallikarjuna et al., 2010; Rajan & Muthukrishnan, 2009; Ríos-Velasco et al., 2010). A pesar del potencial que ha demostrado N. rileyi para el control de insectos plagas, la información que existe es escasa, posiblemente debido a las dificultades que presenta este microorganismo para su producción masiva y a la baja estabilidad del mismo en condiciones de almacenamiento (Pavone et al., 2009). Por esta razón, a la fecha no se encuentra registrado ningún bioinsumo a base de este hongo ni en los EE.UU. (EPA, 2015), ni en Colombia (ICA, 2015). Una estrategia para incrementar la tolerancia de hongos entomopatógenos a condiciones drásticas es a través de la manipulación fisiológica, ya que los conidios producidos en condiciones de estrés desarrollan tolerancia, al factor evaluado y a otras condiciones o características diferentes (Andersen et al., 2006; Hallsworth & Magan, 1995; Rangel et al., 2015).
En ese sentido, el aislamiento colombiano de N. rileyi codificado como Nm006, se seleccionó por ocasionar una mortalidad del 95% sobre larvas de tercer instar de S. frugiperda en condiciones de laboratorio (Bosa et al., 2004), y posteriormente se estandarizó su producción masiva y formulación como un concentrado emulsionable. Sin embargo, dicha formulación presentó una corta vida útil, con, 3,26 meses a 10 °C y de 1,27 meses a 20 °C (Zarate et al., 2010), valores inferiores a los reportados para varios bioplaguicidas a base de hongos entomopatógenos disponibles en el mercado (Copping, 2009). Por esta razón, el objetivo del presente trabajo fue evaluar y seleccionar condiciones abióticas de estrés que mejoren las características microbiológicas, enzimáticas y biológicas de los conidios de N. rileyi (Nm006), con miras a obtener un microorganismo más virulento y estable en condiciones de almacenamiento, el cual pueda ser utilizado como principio activo de un bioplaguicida.
Materiales y métodos
Cría masiva de Spodoptera frugiperda: para todos los ensayos de actividad biológica se utilizaron larvas de segundo instar (L2) de S. frugiperda provenientes de una colonia montada bajo condiciones controladas en la Corporación Colombiana Agropecuaria (CORPOICA), Colombia. Esta colonia se estableció con huevos y larvas colectados en un cultivo de maíz del departamento de Tolima, Colombia. Las larvas se mantuvieron a 25 °C y 60% de humedad (HR) con un fotoperiodo de 12:12 (luz: oscuridad) en una dieta semi-sintética a base de germen de maíz, hasta completar su desarrollo (Greene et al., 1976; Murcia et al., 2004).
Microorganismo: el hongo Nomuraea rileyi Nm006 (aislado a partir de larvas de S. frugiperda infectadas naturalmente en un cultivo de maíz en Puerto Gaitán, Meta, Colombia) fue suministrado por el Banco de Germoplasma de Microorganismos con Interés en Control Biológico de CORPOICA.
Producción masiva de conidios utilizando condiciones abióticas de estrés: la producción masiva de N. rileyi se realizó utilizando la metodología previamente estandarizada por Villamizar et al. (2004). Se utilizaron bandejas con un sustrato a base de cereales, el cual se inoculó con una suspensión de 1 x 106 conidios/mL; estas bandejas se incubaron a 25 ± 2 °C durante 7 días. Posteriormente, cada factor de estrés fue implementado individualmente. Para los choques térmicos, las bandejas con el sustrato inoculado se expusieron a la temperatura de 5 ± 2 °C, 15 ± 2 °C, 30 ± 2 °C y 45 ± 2 °C, durante 1 hora. Para los choques con luz UV-B, las bandejas se irradiaron con una lámpara ultravioleta monocromática con una longitud de onda de 302 nm ubicada a 20 cm de altura (4920 mwatts/cm2) durante 5, 10, 15, 30, 60 y 90 minutos. Terminada la exposición al factor de estrés, las bandejas se incubaron nuevamente durante 7 días a 25 ± 2 °C con luz constante. Finalizado el tiempo de fermentación se realizó un muestreo aleatorio del sustrato producido por el hongo siguiendo la metodología descrita por Kang et al. (2005), y se determinó el rendimiento de la fermentación (conidios/g de sustrato) mediante recuento en cámara de Neubauer. Posteriormente, los conidios se separaron utilizando un tamizador eléctrico y se analizaron sus características microbiológicas, enzimáticas y biológicas.
El tratamiento control consistió en bandejas con el medio de producción inoculado de la forma anteriormente descrita e incubadas durante 14 días a 25 ± 2 °C en condiciones de luz constante, las cuales no se sometieron a ningún choque. El diseño experimental fue completamente al azar con tres repeticiones por tratamiento.
Caracterización microbiológica: para la caracterización microbiológica de los conidios se determinó el porcentaje de germinación (%) de tres muestras de 100 mg de conidios Nm006 en un medio de cultivo a base de agar extracto de malta y levadura (Agar YM) utilizando la metodología descrita por Santos et al., 2012. El número de conidios germinados y no germinados se determinó mediante observación al microscopio de 10 campos ópticos, por unidad experimental.
Caracterización enzimática: los conidios de N. rileyi, se caracterizaron enzimáticamente mediante la determinación de la actividad N-acetilglucosaminidasa, quimoelastasa proteasa (Pr1) y β-esterasa. Para el extracto enzimático se siguió la metodología descrita por St Leger et al. (1986), y modificada por Villamizar et al., (2001). Después de separar los conidios, se pesaron 50 mg de éstos y se adicionaron a 1 mL de una solución de Tween® 80 al 1% (v/v). Esta mezcla se agitó fuertemente en vortex durante 1 hora a temperatura ambiente. Posteriormente, la mezcla se centrifugó a 4000 rpm a 4°C durante 10 minutos y el sobrenadante se utilizó para la cuantificación enzimática.
La actividad quitinolítica (actividad N-acetilglucosaminidasa, EC 3.2.1.14) se determinó utilizando como sustrato p-nitrofenil-N-acetilglucosamina (1 mg/mL en tampón citrato 0,1M pH 5) siguiendo la metodología descrita por Villamizar et al., (2001). Para la reacción enzimática, se adicionaron 100 µL del sustrato a 20 µL del extracto enzimático y se incubó por 30 minutos a 35 ± 2 °C. Posteriormente, se adicionaron 150 µL de NaOH-glicina (pH 10,4) y se determinó la absorbancia a 400 nm (Nanodrop® 1000). Una unidad de actividad N-acetilglucosaminidasa se definió como la cantidad de enzima capaz de liberar 1 mmol de p-nitrofenol bajo las condiciones de la prueba. La actividad proteolítica (actividad quimoelastasa proteasa Pr1, EC 3.4.21.62) se determinó utilizando como sustrato N-succinil-ala-ala-propil-fenialanina-p-nitroanilida disuelto en DMSO y 250 µL de tampón Tris-HCl (2 mM, pH 8). Para la reacción enzimática, se adicionaron 20 µL del sustrato a 20 µL del extracto enzimático y se incubó por 5 minutos a temperatura ambiente. Posteriormente, se determinó la absorbancia a 410 nm (Nanodrop® 1000). Una unidad de actividad quimoelastasa proteasa Pr1 se definió como la cantidad de enzima capaz de liberar 1 µmol de p-nitroanilida bajo las condiciones de la prueba. La actividad lipolítica (actividad β-esterasa, EC 3.1.1.3) se determinó utilizando como sustrato p-nitrofenil-palmitato (1 mg/mL en DMSO). Para la reacción enzimática, se adicionaron 100 µL de p-nitrofenil-palmitato a 20 µL del extracto enzimático y se incubó por 30 minutos a 35 ± 2 °C. Posteriormente, se adicionaron 150 µL de NaOH-glicina (pH 10,4) y se determinó la absorbancia a 400 nm (Nanodrop® 1000). Una unidad de actividad β-esterasa se definió como la cantidad de enzima capaz de liberar 1 mmol de p-nitrofenol bajo las condiciones de la prueba.
Caracterización biológica: la actividad biológica de los conidios producidos utilizando diferentes condiciones abióticas de estrés, se determinó mediante un bioensayo siguiendo la metodología descrita por Espinel & Cotes (2008). Para el montaje del bioensayo se utilizaron fragmentos de hojas de higuerilla (Ricinus communis) de 5 cm x 5 cm, los cuales se desinfectaron con hipoclorito de sodio al 0,5% durante cinco minutos y, posteriormente, se lavaron con agua estéril tres veces por el mismo periodo de tiempo. Con los conidios obtenidos bajo las diferentes condiciones de producción masiva se prepararon suspensiones ajustadas a una concentración de 1 x 107 conidios/mL, las cuales se asperjaron por el haz y por el envés de las hojas (1 mL/hoja). El experimento contó con un diseño completamente al azar, con tres repeticiones por tratamiento, cada una con 10 unidades de muestreo correspondientes a un recipiente plástico con una hoja de higuerilla y una larva de segundo instar de S. frugiperda (30 larvas/tratamiento). Además, se realizó un testigo absoluto, para el cual, las hojas no recibieron ningún tratamiento. Los recipientes se incubaron a 24 ± 2 °C y 50% HR. La mortalidad se determinó pasados 14 días y el resultado se corrigió con la mortalidad del testigo utilizando la fórmula de Schneider - Orelli para estimar el porcentaje de eficacia (Zar, 1999):
donde, A corresponde a la mortalidad en el tratamiento y B corresponde a la mortalidad en el testigo.
Análisis estadístico: la normalidad y la homocedasticidad de los resultados se determinaron mediante la prueba de Shapiro Wilks (95%) y Bartlett (95%), respectivamente. Una vez demostrados estos principios, se procedió a realizar un análisis de varianza ANOVA y una prueba de comparación de medias de Tukey (95%). Se realizaron análisis de correlación de Pearson para las variables afectadas significativamente por tratamientos. Todos los análisis se realizaron con el programa Statistix versión 7.0 (Analitycal Software, Florida, USA).
Resultados y discusión
Choque térmico: todos los tratamientos presentaron un crecimiento masivo de conidios sobre el sustrato y una esporulación homogénea. El tratamiento control (sin choque térmico) presentó un rendimiento de 1,48 x 109 conidios/g, valor que no fue significativamente diferente (F= 0,08, gl=4, p=0,9861) de los obtenidos en los cultivos expuestos a los diferentes choques térmicos (tabla 1). Este resultado indica que la exposición de los sustratos colonizados por el hongo, a choques de temperaturas entre 5 °C y 45 °C durante una hora al inicio de la esporulación (7 días de incubación), no tuvo un efecto significativo sobre la conidiación de N. rileyi.
Tabla 1 Características microbiológicas, enzimáticas y biológicas de conidios del hongo N. rileyi Nm006 producidos en fermentación sólida y expuestos a choques de temperatura

El análisis estadístico se realizó de forma independiente para cada variable. Tratamientos con la misma letra no presentaron diferencias significativas según prueba de Tukey (95%).
*Unidad Enzimática UE (mmoles de p-nitrofenol liberados por minuto por mililitro a 35 °C).
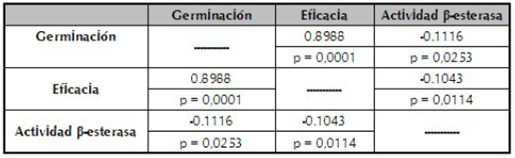
Tabla 2 Coeficientes de correlación de Pearson entre las variables respuestas (germinación, eficacia y actividad β-esterasa) de los conidios del hongo N. rileyi Nm006, producidos en fermentación sólida expuesta a choques térmicos.
Con respecto a la viabilidad expresada como germinación, los conidios del tratamiento control presentaron una germinación de 90,41% a las 48 horas de incubación. Cuando se realizaron los choques térmicos a 5 °C y 45 °C, los conidios presentaron germinaciones del 83,07% y 86,59% respectivamente, valores numéricamente menores pero que no presentaron diferencias significativas con el control (tabla 1). En contraste con estos resultados, los conidios obtenidos después de los choques térmicos a 15 °C y 35 °C presentaron germinaciones significativamente inferiores (F=12, gl=4, p=0,0008) a la del tratamiento control. Este resultado sugiere que los choques con temperaturas superiores en un rango de 20 °C por encima o por debajo de 25 ± 2°C, que corresponde a la temperatura óptima de crecimiento del hongo (Céspedes et al., 2008), no afectaron la capacidad de germinación de los conidios de N. rileyi, mientras que la exposición a temperaturas cercanas a la óptima de crecimiento afectaron negativamente la viabilidad del microorganismo. Este comportamiento sugiere que la exposición de un cultivo de N. rileyi a temperaturas cercanas a la óptima de crecimiento durante un corto tiempo (1 hora), no indujeron los sistemas de adaptación térmica y por el contrario retardaron el proceso de germinación. Comportamientos similares se han evidenciado para diferentes microorganismos como Saccharomyces cerevisiae (Amillastre et al., 2012), Beauveria bassiana (Liu et al., 2009) y Paecilomyces farinosus (Hallsworth & Magan, 1999), para los cuales la exposición por cortos periodos de tiempo a temperaturas cercanas a la óptima, disminuyeron la viabilidad.
La actividad quimoelastasa proteasa (Pr1) no se detectó en ningún extracto enzimático de los conidios de N. rileyi producidos bajo los diferentes choques de estrés ni en el tratamiento control, lo que posiblemente se debe a que la expresión de dicha enzima es inducida por el sustrato, siendo el mejor inductor la cutícula de insectos (Perinotto et al., 2013; Small & Bidochka, 2005). De igual manera, la expresión de los genes involucrados en la síntesis de Pr1 están regulados por la relación C/N del medio de cultivo, comportamiento descrito ampliamente para M. anisopliae y B. bassiana (Safavi, 2011; St Leger et al., 1998). Teniendo en cuenta lo anterior, es posible que el medio de cultivo utilizado en el presente estudio no favoreciera la expresión de esta enzima durante el proceso de fermentación, resultados similares a lo evidenciado para otros hongos entomopatógenos como L. lecanii, B. bassiana, M. anisopliae e I. fumosorosea, cuando fueron producidos en medios de cultivo con una baja relación de C/N (Charnley & St Leger, 1991; Fang et al., 2005; Safavi, 2011; Sheng et al., 2006).
Con respecto a la actividad β-esterasa, los conidios no expuestos (tratamiento control) presentaron una actividad de 0,26 UE, valor significativamente inferior (F=9,54, gl=4, p=0,0001) a la actividad β-esterasa obtenida con los conidios expuestos a todos los choques térmicos. En general, todos los conidios obtenidos después de someter los sustratos colonizados por el hongo a diferentes choques térmicos presentaron una actividad lipolítica superior a la de los conidios no expuestos (tabla 1), comportamiento que sugiere que el nivel basal de esta enzima aumentó debido a la condición de estrés utilizada durante el proceso de fermentación. Una alta producción y acumulación de esterasas es importante en el proceso de infección, ya que dicha enzima es la responsable de degradar los ésteres grasos que son constituyentes importantes de la epicutícula, o primera capa de la cutícula del insecto (Pedrini et al., 2007), siendo éste el primer paso enzimático en el proceso de infección y penetración del hongo entomopatógeno sobre el insecto plaga (Ali et al., 2009b).
Para la actividad N-acetilglucosaminidasa (actividad quitinolítica), los conidios sin exposición a choques térmicos (tratamiento control) presentaron una actividad enzimática de 7,58 UE, valor que no fue significativamente diferente (F=2,65, gl=4, p= 0,0571) a las actividades enzimáticas de los conidios obtenidos bajo los diferentes choques térmicos (tabla 1). (F=2,65, gl=4, p= 0,0571). Este resultado evidenció que la exposición a los choques térmicos no tuvo ningún efecto sobre la producción de esta enzima. De acuerdo a St Leger et al. (1986), una alta producción de la enzima N-acetilglucosaminidasa en hongos entomopatógenos puede estar relacionada con los requerimientos fisiológicos del microorganismo, ya que éstas participan en procesos como la ramificación micelial y la conidiogénesis, por lo que su nivel basal en las células fúngicas es alto (Duo-Chuan, 2006; Seidl, 2008). También se ha evidenciado que aislamientos de hongos entomopatógenos que tengan una alta producción de quitinasas pueden presentar una alta actividad biológica, sin embargo, la correlación entre un aumento de esta actividad enzimática con la virulencia debe determinarse para cada hongo entomopatógeno (Bertholdo et al., 2003).
La actividad biológica de los conidios obtenidos de las fermentaciones con y sin choques térmicos se describe en la tabla 1, en donde se puede observar que la eficacia de los conidios del tratamiento control fue del 86,67%. Este valor no fue significativamente diferente de los obtenidos con los conidios provenientes de las fermentaciones implementadas con choques térmicos a 5 °C y 45 °C, mientras que los conidios provenientes de las fermentaciones con choques térmicos a 15 °C y 35 °C presentaron mortalidades y eficacias significativamente inferiores (F=14,00, gl=4, p=0,0004) en comparación con el tratamiento control. Los resultados obtenidos permiten sugerir que la virulencia y la eficacia del hongo están directamente relacionadas con la viabilidad y la capacidad de producir las enzimas que participan en el proceso de infección, como lo reportaron Safavi et al. (2007).
Con las variables que presentaron un efecto significativo cuando se implementaron los choques térmicos (eficacia, germinación y la actividad β-esterasa), se realizó un análisis de correlación y los coeficientes de correlación de Pearson para cada una de las interacciones se describen en la tabla 2. El análisis de correlación demostró que existe una correlación positiva de 0,8988 (p=0,0001) entre las variables respuesta germinación y eficacia, resultado que concuerda con lo descrito por diferentes autores (Petlamul & Prasertsan, 2012; Talaei-Hassanloui et al., 2007; Tang & Hou, 2001). En ese sentido, Altre et al. (1999), demostraron que existe una alta correlación entre la germinación y la virulencia de ocho aislamientos de P. fumosoroseus. Estos autores sugirieron que la alta germinación beneficia el proceso de infección, ya que con una mayor velocidad de germinación hay una mayor probabilidad de infectar al hospedero. En el presente estudio se evidenció una baja correlación lineal (r =-0,1043 y p=0,0114) entre la eficacia y la actividad β-esteresa, lo que indica que esta enzima no tuvo un efecto positivo sobre la actividad biológica. Aunque las lipasas son importantes en el proceso de infección (Pedrini et al., 2007), es posible que la alta producción de lipasas no sea un factor de virulencia determinante para N. rileyi Nm006. Este resultado es similar al reportado por Bertholdo et al. (2003), para cinco aislamientos de N. rileyi, para los cuales los autores no encontraron una correlación entre la actividad lipolítica y la virulencia, comportamiento que si ha sido evidenciado en otros hongos entomopatógenos como M. anisopliae (Villamizar et al., 2001) y B. bassiana (Kaur & Padmaja, 2009).
Choques de irradiación (Luz UV-B): La implementación de choques de irradiación durante la fermentación de N. rileyi disminuyó el crecimiento y la esporulación del hongo. El tratamiento control presentó un rendimiento de 1,48 x 109 conidios/g, valor que fue significativamente mayor (F= 17,5, gl=20, p=0,0000) que el obtenido con los conidios producidos utilizando choques de irradiación con tiempos superiores a 30 minutos (tabla 3), lo que sugiere un efecto negativo sobre el desarrollo de N. rileyi. Esto contrasta con los rendimientos de las fermentaciones sometidas a los choques de irradiación entre 5 y 15 minutos, que no fueron significativamente diferentes al tratamiento control.
Tabla 3 Características microbiológicas, enzimáticas y biológicas de los conidios del hongo N. rileyi Nm006 producidos en fermentación sólida expuestos a choques de luz ultravioleta UV-B.

El análisis estadístico se realizó de forma independiente para cada variable. Tratamientos con la misma letra no presentan diferencias significativas según prueba de Tukey (95%).
**Unidad Enzimática UE (mmoles de p-nitrofenol liberados por minuto por mililitro a 35 °C).
En N. rileyi, se demostró que la esporulación es altamente influenciada por la luz blanca (Boucias et al., 2000), siendo esencial en el proceso de producción masiva. Por ejemplo, (Boucias et al., 2000), evidenciaron que la esporulación del aislamiento F1-63 de N. rileyi se inhibió significativamente en oscuridad, mientras que cuando las cajas de Petri con el microorganismo se expusieron a luz constante se obtuvieron esporulaciones significativamente superiores. Lo anterior se denomina proceso de fotoesporulación, en donde la exposición a diferentes longitudes de luz durante un tiempo determinado induce la esporulación del microorganismo por medio de unas proteínas conocidas como fotorreceptores (Olmedo, 2013). Es posible que el comportamiento de N. rileyi frente a los choques de estrés con luz UV esté regulado por fotorreceptores, ya que cuando se implementaron los choques de irradiación UV-B se evidenció un descenso en la esporulación a medida que aumentó el tiempo de exposición. La luz ultravioleta posiblemente inhibió las respuestas de protección de los fotorreceptores, comportamiento observado por Corrochano & Garre (2010), quienes determinaron que tiempos de exposición a la luz UV-B superiores a 4 horas, disminuyen la producción de la enzima fotoliasa en Phycomices sp. y por lo tanto, la viabilidad y esporulación del hongo.
Para la variable germinación, los conidios obtenidos de la fermentación realizada sin la implementación de choques de irradiación, presentaron una germinación del 90,41% a las 48 horas de incubación. Cuando se implementaron los choques con tiempos de irradiación entre 5 y 30 minutos, los conidios presentaron germinaciones no significativamente diferentes de la obtenida con el tratamiento control, mientras que los conidios provenientes de las fermentaciones expuestas a la luz UV por tiempos superiores a 60 minutos presentaron germinaciones significativamente inferiores (F=8,17, 6, p=0,0006) (tabla 3). Estos resultados sugieren que la irradiación con Luz UV-B tiene un efecto negativo sobre la capacidad de germinación de los conidios producidos, el cual está directamente relacionado con el tiempo de exposición.
La reducción de la germinación posiblemente se debió a que estas dosis de luz UV pueden causar daños en la maquinaria celular de los hongos entomopatógenos debido a la formación de fotoproductos como los dímeros de ciclobutano-pirimidina que afectan directamente la estructura del ADN y de varias proteínas (Rodriguez et al., 2010). También se ha evidenciado que la luz ultravioleta induce la formación de especies reactivas de oxígeno (ROS) que interrumpen la respiración celular, ya que afectan la estabilidad de la membrana celular y de las mitocondrias (Murdoch et al., 2013; Rodriguez et al., 2010).
La actividad quimoelastasa proteasa (Pr1) no se detectó en ningún extracto enzimático de los conidios de N. rileyi producidos, cuando se implementaron los choques de luz UV ni en el tratamiento control, comportamiento evidenciado anteriormente cuando se implementaron los choques térmicos. Este resultado sugiere que el medio de producción masiva utilizado no induce la expresión de dicha enzima, posiblemente por un bajo contenido proteico. Sin embargo, fue adecuado para el crecimiento y la esporulación de N. rileyi (tabla 3).
Para la actividad lipolítica (enzima β-esterasa) los conidios no irradiados (tratamiento control) presentaron una actividad de 0,26 UE, valor significativamente inferior (F=15,7, gl=6, p=0,0000) a la actividad β-esterasa obtenida con los conidios irradiados durante 5 minutos, lo que sugiere que este choque indujo la expresión y acumulación de esta enzima. Los conidios de las fermentaciones con choques de irradiación entre 15 y 60 minutos, presentaron una actividad lipolítica que no fue significativamente diferente de la actividad obtenida con los conidios no irradiados. El único choque de irradiación que causó un efecto significativamente deletéreo sobre la actividad β-esterasa fue el tiempo de irradiación de 90 minutos con un valor de 0,11 UE (tabla 3). La exposición de los conidios desarrollados sobre el sustrato de producción masiva durante 5 minutos a la luz UVB aumentó 3,6 veces la actividad lipolítica con respecto a la de los conidios no expuestos a ningún choque, lo que sugiere que el nivel basal de esta enzima fue inducido por esta condición de estrés. Este resultado es interesante considerando que la alta producción de enzimas lipolíticas influye en el proceso de infección sobre el insecto plaga, donde la enzima β-esterasa actúa como iniciador en el proceso de infección sobre el insecto plaga degradando los ésteres grasos de la epicutícula (Pedrini et al., 2007).
Para la actividad N-acetilglucosaminidasa (quitinasas), los conidios provenientes de la fermentación no irradiada presentaron una actividad enzimática de 7,58 UE, valor que fue significativamente superior (F=6,28, gl=6, p= 0,0001) a las actividades enzimáticas de los conidios obtenidos de las fermentaciones con tiempos de irradiación superiores a 15 minutos (tabla 3). Como se describió anteriormente, la producción de las enzimas quitinolíticas es regulada mediante la represión catabólica, pero su nivel basal en la célula fúngica es alto debido a que también participan en procesos fisiológicos como el crecimiento micelial o la conidiogénesis (Dhar & Kaur, 2009). Sin embargo, cuando se implementaron los choques de irradiación con tiempos superiores a 15 minutos se observaron actividades enzimáticas inferiores a las del tratamiento control, lo que sugiere que estos tiempos afectaron directamente la producción de dicha enzima y por lo tanto también pudieron afectar algunos procesos fisiológicos como la esporulación.
El comportamiento de la actividad biológica de los conidios expuestos a los choques de irradiación fue similar al comportamiento de las variables rendimiento, germinación y actividades β-esterasa y N-acetilglucosaminidasa, ya que a medida que aumentó el tiempo de irradiación, se presentó una disminución en la eficacia (tabla 3). Con las variables eficacia, germinación y actividades β-esterasa y N-acetilglucosaminidasase realizó un análisis de correlación de Pearson cuyos coeficientes de correlación para cada una de las interacciones se presentan en la tabla 4. El análisis demostró que existe una correlación positiva de 0,8788 (p=0,0450) entre las variables respuesta germinación y eficacia, resultado que concuerda con lo descrito cuando se implementaron los choques térmicos (tabla 2) y con lo descrito por otros autores (Altre et al., 1999; Safavi et al., 2007; Talaei-Hassanloui et al., 2007).
Tabla 4 Coeficientes de correlación de Pearson entre las variables respuestas (germinación, eficacia y actividades β-esterasa y N-acetilglucosaminidasa) de los conidios del hongo N. rileyi Nm006, producidos en fermentación sólida expuesta a choques de irradiación con luz UV-B.

El análisis estadístico se realizó de forma independiente para cada variable. Tratamientos con la misma letra no presentan diferencias significativas según prueba de Tukey (95%).
**Unidad Enzimática UE (mmoles de p-nitrofenol liberados por minuto por mililitro a 35 °C)
En el presente estudio no se evidenció una correlación lineal entre la eficacia y la actividad β-esteresa (r=0,0519 y p=0,9339), ni N-acetilglucosaminidasa (r=0,3242 y p=0,5946), lo que sugiere que el nivel basal de estas enzimas no está relacionado con la actividad biológica de los conidios de este aislamiento. Este resultado confirma que, aunque las lipasas son importantes en el proceso de infección de los hongos entomopatógenos (Pedrini et al., 2007), es posible que su expresión no sea un factor determinante de la virulencia de los conidios del aislamiento de N. rileyi objeto del presente trabajo, resultado similar al observado cuando se implementaron los choques de temperatura.
La implementación de choques con luz UV-B durante el proceso de fermentación en el hongo N. rileyi no mejoró las características microbiológicas, enzimáticas y biológicas del microorganismo. Por esta razón, este factor de estrés no fue seleccionado para ser implementado en el proceso de producción masiva. Por otro lado, los choques térmicos, a las temperaturas de 5 °C y 45 °C, se seleccionaron porque no afectaron negativamente ninguna característica del microorganismo y aumentaron las actividades enzimáticas β-esterasa y N-acetilglucosaminidasa de los conidios. Dicha inducción enzimática podría mejorar la actividad insecticida del microorganismo sobre larvas de S. frugiperda y su estabilidad bajo condiciones de almacenamiento















