La identificación y reporte de eventos adversos a los medicamentos a través de programas de farmacovigilancia aportan información valiosa acerca del uso de estos en "la vida real" 1,2. Esta información debe ser especialmente buscada con los nuevos principios activos después de ser autorizados para su comercialización, debido a que un gran número de personas empiezan a utilizarlos en la vida diaria, por lo que aquellas reacciones adversas raras o desconocidas hasta el momento pueden ser detectadas y procesadas 2; posteriormente con la suficiente evidencia, las agencias sanitarias reguladoras, principalmente la Food and Drug Administration de los Estados Unidos (FDA) y la European Medicines Agency (EMA) 3-9, emiten alertas que pueden restringir su uso o retirarlas del mercado 10.
En la actualidad conocer oportunamente las alertas reportadas por estas agencias y poder realizar recomendaciones a los diferentes prestadores de salud, basados en relaciones riesgo/beneficio siempre en búsqueda de un uso racional y seguro de los medicamentos, es uno de los objetivos de trabajo del Grupo de Investigación en Farmacoepidemiología y Farmacovigilancia 11-13, siendo este proceso liderado por AUDIFARMA S.A, empresa líder en distribución de medicamentos en Colombia. Se planteó como objetivo realizar la notificación y verificar el seguimiento de cinco alertas sanitarias de medicamentos a un grupo de prestadores de salud en Colombia entre el 2013 y 2014.
METODOLOGÍA
Se realizó un estudio cuasiexperimental, prospectivo, antes y después, sin grupo control, donde se llevó a cabo una intervención en médicos que atendieran pacientes que fueran usuarios de los siguientes cinco medicamentos, para los cuales fue realizada una notificación de fármaco-vigilancia, que informaba para cada caso:
Ketoconazol oral (fecha de emisión alerta: septiembre/2013): Mayor riesgo de daño hepático severo y adrenal. (suspensión con uso mayor a 15 días) 3.
Metoclopramida (julio/2013): Eventos adversos neurológicos en niños a corto plazo y discinecia tardía o síndrome neuroléptico maligno en adultos a dosis altas por periodos largos de tiempo (suspensión en niños y en adultos con uso mayor a cinco días) 7.
Nimesulida (febrero/2013): Riesgo de falla hepática fulminante, uso máximo por 15 días (suspensión con uso mayor a 15 días) 6.
Diacereina (abril/2014): Reacciones adversas gastrointestinales y alteraciones hepáticas, restricción de uso en mayores de 65 años. (suspensión con uso mayor a 30 días) 8.
Ranelato de estroncio (marzo/2012): Riesgo aumentado de eventos cardiovasculares agudos. (suspensión con uso mayor a 30 días) 9.
Se tomó como población universo a los afiliados al régimen contributivo del Sistema General de Seguridad Social en Salud (SGSSS) en 13 entidades promotoras de salud (EPS) de Colombia, la alerta uno y dos se realizó en 13 EPS, la tres en siete EPS y la cuatro y cinco en seis EPS.
Se detectaron inicialmente pacientes con dispensaciones de los medicamentos objetivo en el periodo comprendido entre 1 de febrero del 2013 y el 31 de mayo del 2014, dependiendo de la fecha de publicación de la alerta. Siendo todos estos pacientes objetivos de la intervención.
Periodo de estudio
En la fase pre-intervención se identificaron los pacientes con prescripciones de medicamentos incluidos en las alertas, definiendo el número de casos para llevar a cabo la acción educativa mes a mes. Los resultados fueron evaluados durante diciembre del 2014, buscando disminución en la proporción de pacientes con estas prescripciones.
Intervenciones
La intervención consistió en tres estrategias principales:
Reuniones con directores de EPS, médicos líderes de los programas de atención primaria para hipertensión arterial y profesionales auditores: informando al encargado de la supervisión de la prescripción mediante reuniones presenciales y envío de correos electrónicos un informe individualizado de cada paciente que recibía algún medicamento con alerta de riesgo, recomendando la suspensión del mismo.
Adicionalmente, envío de literatura en referencia a la alerta realizada por las agencias reguladoras y el uso de estos medicamentos: mediante correos electrónicos con artículos científicos e información basada en la evidencia acerca del uso racional y seguro.
Variables estudiadas
- Variables sociodemográficas: edad, sexo.
- Variables farmacológicas: número mensual de pacientes en tratamiento con los medicamentos notificados al inicio y final del seguimiento.
Fuentes de información
La información de la prescripción de cada medicamento de interés, se obtuvo de la base de datos de dispensación de medicamentos de la empresa Audifarma S.A, que dispensa fármacos a una población de 6,5 millones de colombianos que corresponde aproximadamente al 14,1% de la población del país. La detección de los pacientes en terapia con estos fármacos la realizó un médico epidemiólogo del área de farmacoepidemiología de esta empresa y la información fue auditada por otro médico farmacólogo.
Análisis de datos
La información obtenida se recogió en una base de datos en Excel 2010. Se establecieron frecuencias y proporciones.
RESULTADOS
Se realizaron en total unas 26 actividades diferentes a partir de febrero de 2013, que incluyeron 16 reuniones con los directores médicos y los auditores de las EPS y 10 sesiones de capacitación a un total de 500 médicos prescriptores responsables de la formulación de estos medicamentos. Además se enviaron informes electrónicos a los directores médicos justificando la importancia de la suspensión de estos medicamentos.
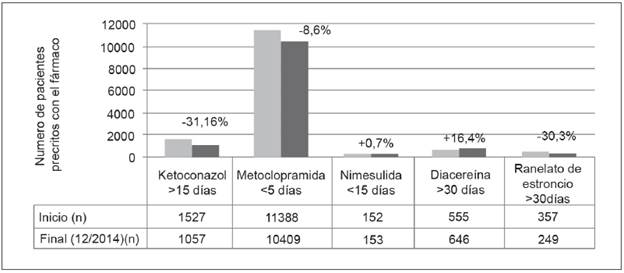
Se halló una población total en las EPS para el inicio de la intervención 3 772 791 afiliados que incrementó a 4 121 954 para diciembre de 2014 (crecimiento 9,2%). La intervención se hizo para conseguir modificar la utilización de estos medicamentos en 13 979 pacientes/mes en 2013, logrando reducir el número de sujetos a 12 509 mensuales a finales del 2014, lo que equivale a una reducción de la prescripción tras la notificación de las alertas del 10,5% (n=1470). El medicamento con el que se consiguió la mayor reducción fue con ketoconazol, seguido de ranelato de estroncio y metoclopramida. Para nimesulida y diacereina no se obtuvieron resultados favorables (Figura 1). El 55% de los pacientes eran de sexo masculino y las edades medias de los que tomaban ketoconazol fue 37,7±16,1 años, para los de metoclopramida 42,4±16,4 años, para los de nimesulida 45,1 ± 12,0 años, mientras que para diacereina de 61,2±12,5 años y finalmente para aquellos con ranelato de estroncio de 64,2±13,9 años.
DISCUSIÓN
Con esta intervención educativa y basada en la farmacovigilancia, dirigida a médicos prescriptores en temas de interés de seguridad de los medicamentos se logró reducir en promedio un 10,5% las prescripciones de riesgo por su pobre perfil de riesgo/beneficio, que debe favorecer a un importante número de pacientes en los que se evitarían las complicaciones que llevaron a que las agencias reguladoras tomaran medidas para disminuir su utilización 1,2,5,14-16.
Es de interés observar cómo se presentó una gran variabilidad en la respuesta a las intervenciones realizadas para cada medicamento, alcanzando reducciones considerables en las precripciones con ranelato de estroncio, metoclopramida y ketoconazol oral, lo cual está dentro del rango obtenido por otras intervenciones similares para otros fármacos que han estado cercanas al 30% 17. Sin embargo, las recomendaciones en general no fueron aceptadas por lo clínicos ni en un tercio de casos y de hecho, para dos fármacos se continuó con aumento en la prescripción, situación que hace evidente la falta de educación médica continua y la falta de interés que debe despertar la socialización de las alertas de farmacovigilancia realizadas por las agencias sanitaras y en este caso replicadas por el responsable de la dispensación de medicamentos.
A pesar de la gran variabilidad en la respuesta es importante resaltar como una intervención de estas características puede influir en la suspensión de medicamentos con alto riesgo de eventos adversos o con una pobre evidencia de efectividad, resaltando el potencial que tiene llevar a cabo actualizaciones, seguimiento e intervenciones a las prescripciones potencialmente inapropiadas, abriendo las puertas para una participación activa de las autoridades sanitarias, los programas de farmacovigilancia, los tomadores de decisiones como las EPS y los médicos prescriptores, promoviendo de esta manera el uso correcto, racional y seguro de los medicamentos 2,18,19.
Es además trascendente involucrar al paciente activamente en el tratamiento de sus patologías, entregando la suficiente y actualizada información por parte del clínico respecto a los riesgos y beneficios a los que se expone con cada terapia, lo que puede conseguir que se tomen decisiones más acertadas, garantizando una mejor relación médico-paciente y una mayor efectividad y seguridad de los tratamientos 1.
Las limitaciones consideradas en este estudio corresponden a los sesgos propios de una base de datos como fuente de información. Tampoco es posible asegurar que en todos los casos en que se dio la suspensión de los fármacos fue debido a la intervención realizada y por el mismo diseño del estudio no es posible estimar qué otros factores pudiesen haber influido.
Se puede concluir que en la actualidad se mantienen prescripciones potencialmente riesgosas en pacientes de Colombia, aunque con intervenciones basadas en la farmacovigilancia posterior al reporte de alertas por las agencias reguladoras sanitarias se puede disminuir la proporción de pacientes que utilizan estos medicamentos, llegando en un corto a mediano plazo reducir potencialmente los eventos adversos asociados a estos fármacos 1