Introducción
El género de cangrejos de agua dulce Neostrengeria Pretzmann, 1965 incluye 27 especies endémicas de la cordillera Oriental de Colombia distribuidas en un intervalo altitudinal entre 300 y 3000 m s.n.m. (Campos, 2017). Neostrengeria sketiRodríguez, 1985, ha sido registrada exclusivamente para ambientes hipogeos, por lo tanto es considerada una especie troglobia, mientras que para N. charalensis hay registros de ambientes epigeos e hipogeos, de tal manera que es considerada una especie troglófila. Algunas de las adaptaciones de los cangrejos asociados a cuevas y cavernas son: a) pereópodos más largos y angostos, b) reducción en la longitud de los pedúnculos oculares, de tal forma que no ocupan completamente la órbita, c) reducción de la córnea, en algunos casos puede llegar a ser vestigial, d) despigmentación del caparazón y los pereópodos.
Neostrengeria charalensis fue descrita por Campos y Rodríguez (1985), con base en especímenes provenientes de Charalá y Moniquirá, Santander, los cuales se caracterizaban por tener los ojos pequeños y no ocupar completamente la órbita, los pedúnculos oculares cónicos distalmente, la córnea reducida y parcialmente despigmentada. Estas características sugieren que provienen de hábitos hipogeos, no obstante estos especímenes fueron colectados en ambientes epigeos, mientras que un espécimen proveniente de una cueva de La Paz, Santander, no presentaba adaptaciones en los ojos. Las cuevas son definidas aquí como ambientes subterráneos o hipogeos con varios salones y galerías de hasta 1 km de longitud, mientras que las cavernas van de 1 a 10 km (Nuñez-Jiménez, 1970). A continuación se muestran los resultados del estudio sobre las variaciones morfológicas detectadas a nivel del caparazón, pereópodos, exognato del tercer maxilípedo y gonópodo de especímenes de Neostrengeria charalensis, registrados en ambientes exo y endocársticos (cuevas y cavernas) de Colombia, con el objeto de determinar si hay algún tipo de respuesta adaptativa de las poblaciones hipogeas en estos ambientes cavernícolas, así como considerar datos bioecológicos de las poblaciones cavernícolas del municipio de El Peñón, Santander (Figura 1).
Materiales y métodos
Capturas. Los especímenes fueron capturados manualmente o con redes de mano en la entrada de las cavernas y en la zona endocárstica, tanto en zonas de penumbra como de total oscuridad, y se preservaron en etanol 70 %. En campo fueron medidos (ver material examinado) y pesados con una balanza de precisión Lexus Xtar (d =0,1 g). Se tomaron igualmente fotografías en el medio natural.
Material examinado. El material examinado se encuentra depositado en la colección de Crustáceos del Instituto de Ciencias Naturales (ICN-MHN-CR) y en la colección del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt (IAVH). Para el estudio de la variabilidad de los pereópodos, se escogió el segundo pereópodo por ser el más largo de los cinco. Se tomaron las siguientes medidas: longitud total T2, longitud del isquio I2 y del mero M2; ancho (cb) y largo (cl) del caparazón. Para el análisis estadístico se utilizó el programa Past versión 3.15 (https://folk.uio.no/ohammer/past/).
Santander: Aguada. Vereda Santa Rosa, cueva Clara, carretera La Paz-Aguada, 2000 metros de altitud., 21 de septiembre de 1988, leg. M. R. Campos, 5 machos, 2 hembras, ICN-MHN-CR 0903. - Vereda San Martín, El Chorro, finca Quebraditas, carretera La Paz-Aguada, 2025 metros de altitud., 21 de septiembre de 1988, leg. M. R. Campos, 2 machos, 3 hembras, ICN-MHN-CR 0904. - Vereda Santa Rosa, finca El Tunito, quebrada El Tunito, carretera La Paz-Aguada, 2000 metros de altitud, 21 de septiembre de 1988, leg. M. R. Campos, 4 machos, 8 hembras, 4 juveniles, ICN-MHN-CR 0902. - Vereda Santa Sofía, finca La Ceiba, cueva Cuetri, 1900 metros de altitud, 03 de agosto de 2008, leg. Y. Muñoz, 2 machos, 1 hembra, ICN-MHN-CR 2505. - Curití. Vereda El Carmen, finca La Ceiba, cueva El Carmen. - El Hoyo, 1590 metros de altitud 04 de julio de 2007, leg. Y. Muñoz, 2 machos, 1 hembra, ICN-MHN-CR 2449. - Charalá. Corregimiento Virolín, 1700 metro de altitud., 29 de abril de 1983, leg. G. Galvis, 1 macho holotipo, 2 hembras paratipos, ICN-MHN-CR 0481. - Corregimiento Virolín, 1700 metros de altitud, 22 de abril de 1983, leg. R. Restrepo, 2 hembras, ICN-MHN-CR 0447. - Corregimiento Virolín, río Luisito, 1720 metros de altitud, 7 mar 1981, leg. I. Arévalo, 2 machos, 3 hembras, ICN-MHN-CR 0503. - Vereda El Resguardo, cueva Aida, 1480 metros de altitud, 11 de julio de 2001, leg. M. Rodríguez, 1 macho, ICN-MHN-CR 2085. - Vereda El Salitre, finca El Mirador, 1300 metros de altitud, 5 de julio de 2001, leg. A. Camargo, 1 hembra, ICN-MHN-CR 2070. - Vereda Grima Alta, finca La Campiña, cueva El Tigre, 1500 metros de altitud, 10 julio de 2001, leg. A. Camargo, 2 hembras, ICN-MHN-CR 2084. - Chipatá. Vereda El Salitre, cueva El Platanal, 1750 metros de altitud, 01 de agosto 2008, leg. D. Casallas, 1 macho, ICN-MHN-CR 2512. - Vereda Papayo Bajo, quebrada La Lajita, carretera Chipatá-La Paz, 1800 metros de altitud, 19 de septiembre de 1988, leg. M. R. Campos, 4 machos, 1 juvenil, ICN-MHN-CR 0897. - El Peñón. vereda Agua Fría, cueva La Tronera, 06°05’21.3”N 73°48’40.8”O, 2115 metros de altitud, 15 de junio de 2016, leg. C. A. Lasso, 1 macho, ICN-MHN-CR 3215. - Misma localidad, 1 hembra, IAVH 1003. - Cueva Los Carracos, 06°05’11.7”N 73°50’07.9”O, 2445 metros de altitud, 16 de junio de 2016, leg. C. A. Lasso, 1 macho, 1 hembra, ICN-MHN-CR 3212. - Misma localidad, 1 macho, 1 hembra, IAVH 1001. - Cueva Los Carracos, 06°05’11.7”N 73°50’7.9”O, 2445 metros de altitud, 22 de agosto de 2016, leg. C. A. Lasso, C. Chica, 2 machos, ICN-MHN-CR 3213. - Misma localidad, 1 macho, IAVH 1002. - Cueva El Caracol, 06°05’14.3”N 73°49’54.3”O, 2378 metros de altitud, 25 de agosto de 2016, leg. C. A. Lasso, C. Chica, M. García, 3 machos, 2 hembras, ICN-MHN-CR 3216. - Misma localidad, 2 machos, 2 hembras, IAVH 1004. - Vereda El Venado, cueva Las Sardinas, 06°05’35.2”N 73°49’43.2”O, 2228 metros de altitud, 26 de agosto de 2016, leg. C. A. Lasso, C. Chica, M. García, 2 machos, 2 hembras, 1 juvenil, ICN-MHN-CR 3217. - Misma localidad, 2 machos, 2 hembras, IAVH 1005. - Cueva Las Gallinas, 06°04’7.4”N 73°49’1.5”O, 2502 metros de altitud, 27 de agosto de 2016, leg. M. García, 1 hembra, ICN-MHN-CR 3214. - Guadalupe. Vereda Solferino, finca Maravilla, 1800 metros de altitud, 9 de octubre de 1998, leg. M. R. Campos, 5 machos, 3 hembras, 3 juveniles, ICN-MHN-CR 1727. - La Paz. Kilómetro 6 carretera La Paz-Mirabueno, 1700 metros de altitud, 20 de septiembre de 1988, leg. M. R. Campos, 1 macho, 1 hembra, ICN-MHN-CR 0900. - Vereda Linternita, quebrada por carretera Paz-Mirabueno, 1450 metros de altitud, 20 de septiembre de 1988, leg. M. R. Campos, 1 macho, 2 hembras, ICN-MHN-CR 0898. - Vereda San Pablo, La Curva del Fical, carretera La Paz-Aguada, 1900 metros de altitud, 20 de septiembre de 1988, leg. M. R. Campos, 6 machos, 3 hembras, ICN-MHN-CR 0901. - Puente Nacional. Quebrada en la carretera central, 1400 metros de altitud, 31 de octubre de 1996, leg. E. Guerra, 2 machos, ICN-MHN-CR 1652. - Suáita. Corregimiento San José de Suáita, Fundación San Cipriano, quebrada La Tata, 1500 metros de altitud, 3 de octubre de 1998, leg. M. R. Campos, 17 machos, 6 hembras, 1 juvenil, ICN-MHN-CR 1725. - Corregimiento San José de Suáita, vereda Neftalí, quebrada La Cascada, 1400 metros de altitud, 10 Oct 1998, leg. M. R. Campos, 12 machos, 1 hembra, ICN-MHN-CR 1728. - Corregimiento San José de Suaita, vereda Neftalí, finca San Roque, 1450 metros de altitud, 8 de octubre de 1998, leg. M. R. Campos, 3 machos, 2 hembras, 1 juvenil, ICN-MHN-CR 1726. - Vélez. Quebrada afluente del río Suárez, 1700 metros de altitud, 2 de noviembre de 1996, leg. E. Guerra, 1 macho, ICN-MHN-CR 1653. - Vereda Tabavita, quebrada Malpaso, finca El Chircal, carretera Vélez-Chipatá, 2150 metros de altitud, 19 de septiembre de 1988, leg. M. R. Campos, 15 machos, 8 hembras, ICN-MHN-CR 0896.
Boyacá: Moniquirá. Vereda Colorado, 1800 metros de altitud, 11 de noviembre de 1986, leg. M. R. Campos, 5 machos, 1 hembra, ICN-MHN-CR 0674. - Vereda Jordán Alto, 1800 metros de altitud, 12 de noviembre de 1986, leg. M. R. Campos, 8 machos, 7 hembras, 1 juvenil, ICN-MHN-CR 0675. - Vereda La Laja, 1600 metros de altitud, 11 de noviembre de 1986, leg. M. R. Campos, 1 macho, 3 hembras, 3 juveniles, ICN-MHN-CR 0673. - Vereda Las Monjas, quebrada Peñitas, 1950 metros de altitud, 13 de noviembre de 1986, leg. M. R. Campos, 17 machos, 32 hembras, 19 juveniles, ICN-MHN-CR 0676, 0677. - Otanche. Vereda La Cunchala, La Grilla, 1350 metros de altitud, 23 de septiembre de 1996, leg. M. R. Campos, 3 machos, 5 hembras, ICN-MHN-CR 1619. - Togüi. Vereda Carare, quebrada en el Acueducto, 1850 metros de altitud, 13 de noviembre de 1986, leg. M. R. Campos, 3 machos, 6 hembras, 1 juvenil, ICN-MHN-CR 0678. - Vereda El Funcial, quebrada Las Lajas, 1650 metros de altitud, 14 de noviembre de 1986, leg. M. R. Campos, 11 machos, 4 hembras, 1 juvenil, ICN-MHN-CR 0679. - Vereda Gachanzucá, 1800 metros de altitud, 11 de noviembre de 1986, leg. M. R. Campos, 4 machos, ICN-MHN-CR 0672. - Vereda Manga, 1650 metros de altitud, 10 de noviembre de 1986, leg. M. R. Campos, 5 machos, 1 hembra, ICN-MHN-CR 0670. - Quebrada Lavapatas, 1600 metros de altitud, 10 de noviembre de 1986, leg. M. R. Campos, 2 machos, 1 hembra, ICN-MHN-CR 0671.
La información bioecológica fue obtenida durante las expediciones realizadas a las cavernas del municipio de El Peñón, Santander, en el 2016, e incluye datos sobre las cavernas de La Tronera, Los Carracos, El Caracol, Las Sardinas y Las Gallinas (Figura 1).
Análisis de datos. Dadas las variaciones morfológicas presentes en cangrejos cavernícolas, se realizó una comparación morfológica entre especímenes epigeos e hipogeos, tomando como referencia cuatro diferentes partes: caparazón, tercer maxilipedo, segundo pereópodo y gonópodo. Se tomaron las siguientes medidas: ancho de caparazón (cb), largo de caparazón (cl), longitud total del segundo pereópodo (T2), longitud del isquio del segundo pereópodo (I2), longitud del mero del segundo pereópodo (M2), relación de la longitud del exognato con respecto al isquio del endognato del tercer maxilípedo.
La hipótesis principal es que la proporción entre la longitud de los pereópodos y el tamaño del caparazón es diferente entre especímenes de hábitos epigeos e hipogeos.
A través de un análisis de componentes principales se identificaron las variables más informativas, se trasformaron en radios (T2/cb). La hipótesis se sometió a prueba mediante un análisis de Mann-Whitney (p <0,05), dado que los datos no presentan una distribución normal. Este análisis estadístico se realizó en el programa Past versión 3.15 (https://folk.uio.no/ohammer/past/).
Resultados
Se examinaron 333 especímenes, 187 machos y 146 hembras, 62 provenientes de ambientes endocársticos (cuevas y/o cavernas: 34 machos y 28 hembras) y 271 de ambientes exocársticos o epigeos (153 machos y 118 hembras).
Al examinar el material de Neostrengeria charalensis de las colecciones de Crustáceos del Instituto de Ciencias Naturales y del Instituto Alexander von Humboldt, se encontraron una serie de variaciones morfológicas a nivel del caparazón, pereópodos y relación de la longitud del exognato con respecto al isquio del endognato del tercer maxilípedo. Estas variaciones se describen a continuación.
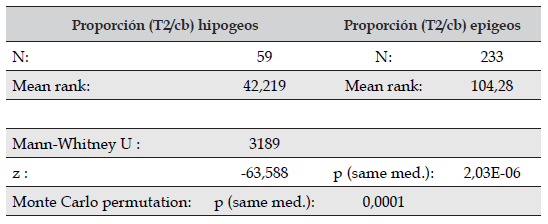
Caparazón, tercer maxilípedo y apéndices. A nivel del caparazón se observaron diferencias significativas en la relación entre la longitud total del segundo pereópodo y el ancho del caparazón (test de Mann-Withney), entre los especímenes provenientes de ambientes epigeos e hipogeos; las cuales se discuten más adelante. La coloración usual de los especímenes adultos es marrón oscuro; sin embargo, en algunos especímenes se observó una ligera despigmentación a marrón claro, sin que se lograra establecer un patrón de coloración más clara en los ambientes hipogeos. Los pereópodos en los especímenes provenientes de ambientes de caverna son más largos y angostos, en particular se destaca el segundo par, de mayor longitud a los demás (Figura 2A). La relación de la longitud del exognato respecto al isquio del endognato del tercer maxilípedo presenta un promedio de 0,55 para los especímenes de origen epigeo y 0,59 para los de origen hipogeo (Figura 2B).
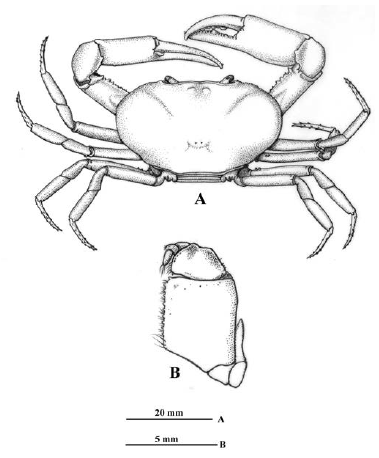
Figura 2 Neostrengeria charalensisCampos y Rodríguez, 1985, macho, ICN-MHN-CR 3216. A. Vista dorsal del caparazón y pereopodos. B. Tercer maxilípedo izquierdo, vista externa.
Gonópodos
Diagnosis. Primer gonópodo curvado en dirección caudo-cefálica, lado mesial convexo, porción subdistal ligeramente sinuosa o con pequeña protuberancia, distal sinuoso; lado lateral amplio basal, borde convexo, depresión media amplia, somera; margen caudal convexo o casi recto, con porción media a subdistal festoneada, proyectándose en forma de expansión distal, dirigida distal o lateralmente, lóbulo basal redondeado con setas largas, conspicuas; lóbulo lateral semicircular con el extremo apical agudo o redondeado e insertado en ángulo agudo con respecto al eje del gonópodo; lóbulo accesorio elongado, distal redondeado, fuertemente curvado en dirección caudo-cefálica, más corto que el lóbulo lateral, usualmente con receso en forma de V entre ellos en vista lateral; contorno del ápice oval elongado en vista distal, con borde caudo-lateral expandido, proyectado distalmente, con espina aguda en porción media del borde cefálico, dirigida mesialmente; lóbulo mesial subtriangular; proyección mesocaudal del canal espermático en forma de lezna, con una espínula interna. Tercer maxilípedo con exognato 0,5 a 0,6 con respecto a la longitud del isquio.
Los especímenes provenientes de ambientes de cavernas presentan a nivel del primer gonópodo una serie de variaciones morfológicas frente a la diagnosis previamente descrita. Lado mesial del primer gonópodo: con una depresión angular subdistal, seguida de una porción recta y reborde distal (Figura 3A), con protuberancia de forma irregular subdistal, seguida de uno o doble reborde distal (Figuras 4A, 5A), con pequeña protuberancia redondeada subdistal, seguida de porción cóncava y reborde distal (Figura 6A), o con protuberancia semiaguda subdistal y reborde distal (Figura 7A). Margen caudal: convexo, porción media sinuosa o recta y proyección muy prominente, aguda distalmente, orientada perpendicular al eje del gonópodo (Figuras 3A, 4A), o recto con prominente proyección distal, aguda o redondeada distalmente y dirigida en ángulo agudo respecto al eje del gonópodo (Figuras 5A, 6A), sinuoso con proyección, aguda distalmente, dirigida perpendicular al eje del gonópodo (Figura 7A). Lóbulo lateral: folioso, semicircular, depresión media en borde interno o recto, redondeado externamente, insertado en ángulo perpendicular al eje del gonópodo (Figuras 3A, B; 4A, B; 5A, B.), amplio, folioso, ligeramente semicircular, sinuoso en borde interno, redondeado externamente, insertado en ángulo perpendicular, con un ángulo mayor a los anteriores (Figura 6A, B.), elíptico, distal redondeado, insertado en ángulo perpendicular, con un ángulo mayor a Figura 6A, B, con respecto al eje del gonópodo (Figura 7A, B.). Lóbulo accesorio: espatulado con borde externo redondeado, fuertemente curvado en dirección caudo-cefálica, más corto que el lóbulo lateral y con receso en forma de V entre ellos en vista lateral (Figura 3A, C), alargado, extremo distal semiagudo o redondeado, fuertemente curvado en dirección caudo-cefálica, más corto que el lóbulo lateral y con receso en forma de U entre ellos en vista lateral (Figuras 4A, C, 6A, C), alargado, extremo distal redondeado, ligeramente curvado en dirección caudo-cefálica, mucho más corto que el lóbulo lateral y con receso en forma de V entre ellos en vista lateral (Figura 5A, C), o alargado, extremo distal semiagudo, curvado en dirección caudo-cefálica, casi tan largo como el lóbulo lateral y con amplio receso entre ellos en vista lateral (Figura 7A, C). Lóbulo mesial semicircular, con espina muy conspicua, aguda, dirigida cefálicamente (Figuras 3B, D; 4B, D; 7B, D), subtriangular (Figura 5B, D), o semicircular, sin espina (Figuras 6B, D). Contorno del ápice: oblongo en vista distal, con borde caudo-lateral fuertemente proyectado distalmente, con espina pequeña (angulosa) de base amplia y semiaguda en extremo proximal de borde cefálico, dirigida mesialmente (Figuras 3D, 4D, 6D, 7D), el contorno del ápice similar a las figuras 3D y 4D, pero la porción distal está curvada en dirección caudal (Figura 5D). Proyección mesocaudal del canal espermático: subtriangular con una espínula en porción media interna (Figura 3D), o bífida con una papila prominente, redondeada interna y una proyección subtriangular externa (Figura 4D), con papilas prominentes, redondeadas (Figura 5D), o con una papila ovalada o redondeada interna y una proyección semiaguda externa (Figuras 6D, 7D).
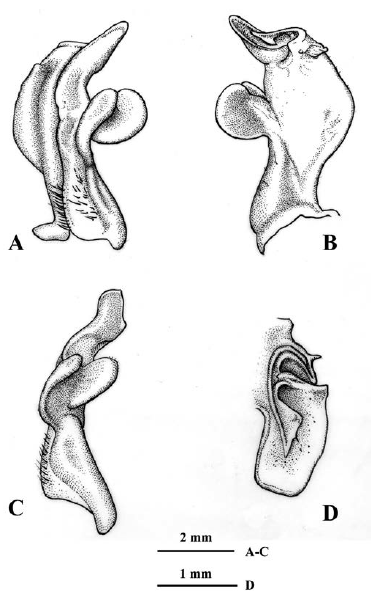
Figura 3 Neostrengeria charalensisCampos y Rodríguez, 1985, macho, ICN-MHN-CR 3215. A. primer gonópodo izquierdo, vista caudal. B. Mismo, vista cefálica. C. Mismo, vista lateral. D. Mismo, ápice, vista distal. Ejemplar de ambiente hipogeo (caverna La Tronera, Santander).

Figura 4 Neostrengeria charalensisCampos y Rodríguez, 1985, macho, ICN-MHN-CR 3215. A. primer gonópodo izquierdo, vista caudal. B. Mismo, vista cefálica. C. Mismo, vista lateral. D. Mismo, ápice, vista distal.

Figura 5 Neostrengeria charalensisCampos y Rodríguez, 1985, macho, ICN-MHN-CR 3212. A. primer gonópodo izquierdo, vista caudal. B. mismo, vista cefálica. C. Mismo, vista lateral. D. Mismo, ápice, vista distal.
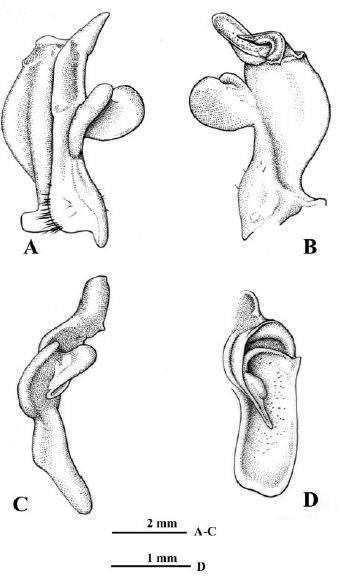
Figura 6 Neostrengeria charalensisCampos y Rodríguez, 1985, macho, ICN-MHN-CR 3216. A. Primer gonópodo izquierdo, vista caudal. B. Mismo, vista cefálica. C. Mismo, vista lateral. D. Mismo, ápice, vista distal.

Figura 7 Neostrengeria charalensisCampos y Rodríguez, 1985, macho, ICN-MHN-CR 3216. A. Primer gonópodo izquierdo, vista caudal. B. Mismo, vista cefálica. C. Mismo, vista lateral. D. Mismo, ápice, vista distal.
Variaciones morfométricas. Al examinar los especímenes registrados para ambientes hipogeos frente a los epigeos, se encontró una mayor longitud de los pereópodos de ambientes de cuevas frente a los epigeos, por lo cual se procedió a analizar desde el punto de vista morfométrico los especímenes.
A través del análisis de componentes principales (Figura 8) se identificó que las variables más informativas son el ancho del caparazón y la longitud total del segundo pereópodo, por lo cual se analizó la proporción de estas dos variables (T2/cb).
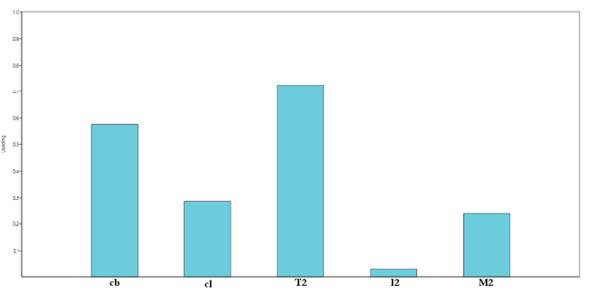
Figura 8 Loading plot, análisis de componentes principales. cb, ancho caparazón; cl, largo caparazón; T2, segundo pereópodo, longitud total; I2, el mismo, longitud isquio; M2, el mismo, longitud mero.
La hipótesis inicial se ajustó acorde a los resultados del análisis de componentes principales. La nueva hipótesis es que las proporciones de la longitud total del segundo pereópodo versus el ancho del caparazón varían dependiendo del hábitat, siendo mayor la proporción en los especímenes de hábitos hipogeos frente a los de hábitos epigeos. Con el fin de corroborar dicha hipótesis se realizó un análisis de MannWhitney (valor significativo p<0,05) (Tabla 1), dado que los datos son no paramétricos y las trasformaciones realizadas no permitieron la normalización de los mismos.
Con un valor p de 2,03E-06, se rechaza la hipótesis nula, lo que implica que existen diferencias significativas en la relación de tamaño entre el caparazón y el segundo pereópodo entre los especímenes de hábitos epigeos e hipogeos. Con base en lo anterior se calcularon las estadísticas básicas de las proporciones para cada grupo de especímenes (hipogeos y epigeos), donde se evidencia una diferencia menor entre el promedio (0,90). Esta diferencia entre el promedio de las proporciones significa una variación de aproximadamente 2 mm en la longitud total del segundo pereópodo, respecto a tamaños iguales en ambientes diferentes (Tabla 2).
Tabla 2 Resumen estadístico de las proporciones calculadas.
| Hábitos hipogeos | Hábitos epigeos | |
|---|---|---|
| N | 59 | 233 |
| Mínimo | 0,95 | 0,74 |
| Máximo | 1,46 | 1,40 |
| Suma | 71,23 | 259,89 |
| Promedio | 1,21 | 1,12 |
| Error estándar | 0,01 | 0,00 |
| Varianza | 0,01 | 0,00 |
| Desviación estándar | 0,11 | 0,07 |
| Mediana | 1,20 | 1,12 |
| 25 percentil | 1,14 | 1,07 |
| 75 percentil | 1,29 | 1,16 |
| Obliciudad | -0,15 | -0,56 |
| Curtosis | -0,16 | 4,21 |
| Promedio geométrico | 1,20 | 1,11 |
| Coeficiente de variación | 8,80 | 6,21 |
Descripción de los ambientes hipogeos y aspectos bioecológicos de Neostrengeria charalensis
Hábitat. Las cavernas y cuevas donde habita Neostrengeria charalensis se encuentran entre los 2228 y 2378 m s.n.m en el municipio de El Peñón, departamento de Santander, este de los Andes colombianos (Figura 1) y están asociadas a una matriz de ecosistemas conformada principalmente por bosques secundarios, cultivos, pastos, potreros y en menor medida por parches muy reducidos de bosques andinos relativamente bien conservados. Entre todo este mosaico hay extensiones cársticas importantes con muchas rocas pertenecientes a la Formación Rosa Blanca (Mendoza-Parada et al., 2009) (Figura 9). En la entrada de las cavernas y zonas de penumbra hay dos grupos de plantas que corresponden a especies dispersadas por guácharos (Steatornis caripensis) y murciélagos (varias familias), que generalmente son árboles o arbustos de frutos carnosos y epífitas rupícolas, e incluyen varias especies de la familia Solanaceae, Lauraceae, palmas y varias especies del género Piper (IAvH, 2016). En el Macizo de El Peñón, las rocas solubles han experimentado procesos de carstificación con formación de cuevas, cavernas, acuíferos y ríos subterráneos. La red hidrológica subterránea se organiza de manera heterogénea y jerárquica al igual que la red hidrográfica superficial. Estos acuíferos y ríos subterráneos recogen el agua de infiltración proveniente fundamentalmente de las lluvias y conforman un sistema de drenaje subterráneo en sentido horizontal y vertical que transporta las masas de agua las cuales pueden fluir y salir a través de surgencias o manantiales dentro o en la periferia del macizo, por lo general en la parte más baja del terreno. En estos tipos de carst, descritos por Galán y Herrera (2017) y de acuerdo con la litología del material parental, hay una zona vadosa o de aireación por encima del nivel piezométrico, así como una zona freática (saturada o inundada), por debajo del mismo. Las quebradas o ríos subterráneos son de aguas cristalinas (turbias en lluvias por arrastre de sedimentos arcillosos), frías (T = 14,6 °C, promedio); básicas (pH = 8, promedio); TDS = 132 ppm (promedio) y con conductividad muy elevada (235 u/cm, promedio) (C. A. Lasso, datos no publicados) (Figura 10). Las cavernas de El Peñón están probablemente interconectadas a través de esta red hídrica subterránea.

Figura 9 A. Vista general del ambiente exocárstico y las formaciones rocosas. B. Caverna Las Sardinas. C. Caverna La Tronera. D. Caverna Los Carracos. Fotos: A-D. (Carlos A. Lasso). B-C. (Sofía Oggioni).
Los cangrejos fueron colectados en la entrada de las cavernas y en la zona endocárstica, tanto en zonas de penumbra como de total oscuridad. Mediante marcaje y observaciones con rotuladores in situ, se ha podido evidenciar que los cangrejos se desplazan dentro de la zona de total oscuridad (C. A. Lasso y J. Fernández-Auderset obs. pers.). Neostrengeria charalensis ha sido observada y/o colectada en diferentes partes, dependiendo de las cavernas. Por ejemplo, en la caverna El Caracol a lo largo de una sección de aproximadamente 20 m del río a 50 m de la entrada, que luego desaparece en un sumidero; en La Tronera en un río a 500 m de distancia de la entrada; en Los Carracos y Las Gallinas a 100 m de la entrada y en Las Sardinas a lo largo de todo su recorrido (entrada-zona de total oscuridad). Los cangrejos adultos se encuentran en oquedades en los bancos arcillosos que bordean los ríos, entre lajas rocosas, en el suelo y la sección parietal de las cavernas, en diaclasas y asociados a diferentes espeleotemas parietales y/o pavimentarios, incluyendo los gours (Figura 11). Los cangrejos habitan aquí, dentro y fuera del agua.

Figura 11 A. Neostrengeria charalensis, caverna Las Sardinas. B. Neostrengeria charalensis, caverna Los Carracos. Fotos: A. (Sofía Oggioni), B. (Felipe Villegas).
Aspectos bioecológicos. Aunque no se cuenta con un patrón de referencia poblacional previo para cangrejos cavernícolas, las poblaciones de esta especie aparentan ser de baja densidad de acuerdo a los recorridos en las cavernas evaluadas con mayor esfuerzo estandarizado (conteo desde la entrada hasta el último punto de acceso en la caverna). En Los Carracos (1550 m largo-85 m profundidad) y en La Tronera (1520 m largo-165 m profundidad), se contaron menos de 15 especímenes en cada una, mientras que en Las Sardinas (250 m largo) mantiene una población aparentemente alta (> 50 especímenes) (C. A. Lasso y J. Fernández-Auderset obs. pers. 2015, 2016, 2017 y 2018). Esto puede estar relacionado con la intermitencia de las corrientes de agua y mayor impacto antrópico en las primeras, versus la presencia de ríos subterráneos permanentes y con menor impacto en Las Sardinas. De acuerdo con el patrón de distribución de los cangrejos en la red hidrogeológica entre las cavernas interconectadas, es muy posible que la dispersión de larvas y juveniles tenga lugar mediante procesos de deriva a través de los drenajes y sumideros. Se han colectado juveniles o larvas (> 5 mm cb) en aguas corrientes de la caverna La Tronera a principios de abril, mediados de mayo, mediados de junio y finales de agosto de 2016; en Caracol a mediados de agosto, y hembras ovígeras (maduras) en la caverna La Tronera a mediados de junio de 2016 (cb: 32,7 mm; cl: 18,1; peso: 6,9 g; fecundidad absoluta: 12 huevos) (Figura 12). También en la caverna El Caracol se observaron hembras ovígeras a finales de julio y agosto de 2016 (cb: 35,4 mm; cl: 19,2; peso: 8,25 g; fecundidad absoluta: 22 huevos). Recientemente (marzo 2018) se colectó una hembra adulta (cb: 41 mm; cl: 25 mm; peso: 10,1 g) dentro del agua con 16 cangrejos juveniles (>5 mm) recogidos en los segmentos abdominales, que abandonaron la madre al momento de la captura (Figura 13). De esta forma, el periodo reproductivo de esta especie debe extenderse desde marzo hasta agosto. Las larvas o juveniles muestran un patrón de coloración (transparentes a blanquecinos) distinto a los adultos, que mantienen el característico color marrón oscuro (Figura 13a, b).

Figura 12 Neostrengeria charalensis: hembra ovígera, caverna La Tronera (junio 2016). Foto: Carlos A. Lasso.

Figura 13 A. Juvenil, caverna Las Sardinas. Foto: Sofía Oggioni. B. Neostrengeria charalensis: hembra madura con juveniles, caverna Las Sardinas (marzo 2018). Foto: Carlos A. Lasso.
En algunos casos muchos ejemplares presentan procesos de calcificación avanzados con depósitos de carbonato de calcio en sus caparazones que les dan una coloración amarillenta (Figura 14).

Figura 14 Neostrengeria charalensis con depósitos iniciales de carbonato de calcio y arcillas. Caverna Las sardinas. Foto: Felipe Villegas.
Las hembras en ambientes endocársticos o hipogeos alcanzan una talla y peso mayor (48 mm cb y 14,4 g; n = 16) que los machos (43, 5 mm cb y 13,05 g; n = 16) (C. A. Lasso, datos no publicados) (Figura 15). En ambientes exocársticos de otras localidades de los Andes colombianos, el macho mayor midió 35,22 mm cb (n = 150) y la hembra 39,52 mm cb (n = 118) (datos basados en colecciones ICN; no hay datos de peso).

Figura 15 Relación talla (ancho del caparazón-cb)-peso en Neostrengeria charalensis cavernícolas. Machos (n = 16), hembras (n = 16).
Los cangrejos adultos se alimentan tanto en la entrada de las cavernas como en la zona de penumbra y de total oscuridad, de excrementos y cadáveres de guacharos, murciélagos (guano) y de restos de frutos y semillas de palmas que se le caen a estas especies o que son regurgitadas por las mismas (C. A. Lasso, obs. pers.).
En los ríos subterráneos de las cuevas de El Caracol y Las Sardinas, N. charalensis coexiste con una especie de bagre troglobio recién descrita, Trichomycterus rosablanca (Mesa et al., 2018).
Discusión
Cumberlidge et al. (2014) registran 24 especies neotropicales de cangrejos de agua dulce cavernícolas, 22 pseudotelfusidos y 2 tricodactilidos. 12 corresponden a especies cavernícolas de México, 5 de América Central (Belize-1 sp., Guatemala-3, Costa Rica-1), 2 del Caribe (Cuba-1, Puerto Rico y Santa Cruz-1) y 5 para Suramérica (Venezuela-3, Colombia-2). Actualmente hay registros de 6 especies de cangrejos cavernícolas en Colombia: Neostrengeria charalensisCampos y Rodríguez, 1985 cuevas del municipio El Peñón, cueva de Los Indios, La Paz, Santander; Neostrengeria sketi Rodríguez, 1985 de la cueva Hoyo del Aire, Hoyo Colombia, La Paz, Santander; Neostrengeria lassoi Campos, 2017 de la cueva Los Aviones, La Guadalupe, Santander; Neostrengeria fernandeziCampos, 2017 de la cueva Las Cacas, Pauna, Boyacá. Recientemente (2017), se han descubierto especímenes de Hypolobocera bouvieri (Rathbun, 1898) de las cavernas de El Nitro y La Alsacia, Zapatoca, Santander y Sylviocarcinus piriformis (Pretzmann, 1968) de la Cueva El Indio, Becerril, sierra de Perijá, Cesar (Lasso, Campos y Fernández-Auderset, obs. pers.).
Neostrengeria sketiRodríguez, 1985, ha sido registrada exclusivamente para ambientes hipogeos, por tanto es considerada una especie troglobia (Campos y Lasso, 2015), al igual que N. fernandeziCampos 2017, mientras que para N. charalensis, Hypolobocera bouvieri y Silviocarcinus piriformis, hay registros de ambientes epigeos e hipogeos, de tal manera que son consideradas especies troglófilas. Algunas de las adaptaciones de los cangrejos asociados a cuevas y/o cavernas son: a) pereópodos más largos y angostos, b) reducción en la longitud de los pedúnculos oculares, de tal forma que no ocupan completamente la órbita, c) reducción de la córnea, en algunos casos puede llegar a ser vestigial, d) despigmentación del caparazón y los pereópodos.
Aunque las diferencias a nivel morfológico no son mayores, se puede evidenciar la existencia de una respuesta adaptativa por parte de los especímenes de hábitos hipogeos a su ambiente. Estos resultados concuerdan con las adaptaciones ya conocidas de los cangrejos a ambientes endocársticos, que tienen pereópodos más largos y angostos (Rodríguez, 1985).
Se considera entonces que N. charalensis es una especie troglófila donde los machos alcanzan una mayor talla y peso que las hembras en estos ambientes, en relación a la sección exocárstica, aunque las hembras no presentan diferencias entre ambos ambientes.
Esta especie muestra una fecundidad relativamente baja (12-22 huevos) en relación a otros pseudotelphusidos exocársticos, como es el caso de Hypolobocera bouvieri con registros en la colección de Crustáceos (ICN-MHN-CR) de 96 a 202 huevos.
Por último, es importante señalar algunos aspectos sobre la conservación de esta especie. Desde mediados del siglo pasado, el municipio de El Peñón ha sido objeto de una intensa actividad agrícola (fundamentalmente cultivo de moras y hortalizas, entre otros) y pecuaria (cría de vacas para producción de leche), lo que ha traído consigo la deforestación de gran parte del bosque natural, así como el uso de agroquímicos (particularmente pesticidas) que representan una amenaza para la conservación de N. charalensis y toda la espeleofauna. A esto se suma la presión actual de la minería por la explotación de los carst (C. A. Lasso y J. Fernández-Auderset, obs. pers.).
Conclusiones
En este estudio sobre poblaciones de Neostrengeria charalensis provenientes de ambientes exo y endocársticos, se observaron variaciones morfológicas a nivel del caparazón, pereópodos, exognato del tercer maxilípedo y gonópodo, lo que sugiere la existencia de una gran plasticidad genética como respuesta adaptativa de estos organismos al hábitat hipogeo. La información sobre los aspectos bioecológicos de Neostrengeria charalensis, que ha sido recopilada durante expediciones a diferentes cuevas, representan un aporte novedoso al conocimiento de estos organismos y muestran sus adaptaciones y preferencias ecológicas a estos ambientes extremos.