Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales
Print version ISSN 0370-3908
Rev. acad. colomb. cienc. exact. fis. nat. vol.39 no.152 Bogotá July/Sept. 2015
https://doi.org/10.18257/raccefyn.203
doi: http://dx.doi.org/10.18257/raccefyn.203
1 Grupo de Investigación en Limnología Básica y Experimental y Biología y Taxonomía Marina, Universidad de Antioquia, Medellín, Colombia. *Correspondencia: Silvia Lucía Villabona González, silvillabo81@gmail.com
2 Grupo de Investigación en Gestión y Modelación Ambiental, Universidad de Antioquia, Medellín, Colombia
3 Departamento de Biología, Programa de Pos graduación en Ecología de Ambientes Acuáticos Continentales, Núcleo de Pesquisas en Limnología Ictiología y Acuicultura, Universidad Estadual de Maringá- UEM, Av. Colombo, Maringá, PR, Brazil
Recibido: 26 de febrero de 2015. Aceptado: 17 de junio de 2015
Resumen
En la zona fótica del embalse Riogrande II se analizó la distribución de la biomasa zooplanctónica en las escalas espacial (longitudinal - vertical) y temporal en función de los gradientes de estado trófico, de biomasa algal y de la precipitación. Los cladóceros dominaron la biomasa, debido a la alta contribución de Bosmina freyi, seguidos de los copépodos y rotíferos. La biomasa de especies de microcrustáceos se asoció a la estación de muestreo eutrófica y de mayor biomasa algal, mientras que la biomasa de especies de rotíferos estuvo ligada a las estaciones de menor estado trófico. La mayor biomasa de microcrustáceos fue en la temporada de mayor estado trófico y la de rotíferos en la de mayor precipitación. En el gradiente vertical, la menor biomasa de todos los grupos fue en subsuperficie, zona que tendió a ser evitada por la mayoría de especies, durante los periodos de muestreo. La expresión de biomasa zooplanctónica en el eje longitudinal y en la escala temporal, respondió principalmente al gradiente de estado trófico y de biomasa algal, y en el eje vertical posiblemente a depredación. Aunque esta respuesta no dependió del hábito trófico de las especies, probablemente por la oferta trófica diversa del embalse y por la plasticidad alimenticia de las especies, sí fue diferente entre microcrustáceos y rotíferos.
Palabras clave: rotíferos, microcrustáceos, biomasa, estado trófico, Bosmina freyi.
Abstract
The distribution of the zooplankton biomass in the spatial (longitudinal- vertical) and temporal scales based on the gradients of trophic status, algae biomass and the rainfall was analyzed in the photic zone of the reservoir Riogrande II. Cladocerans dominated the biomass due to the large contribution of Bosmina freyi, followed by copepods and rotifers. Biomass of species of microcrustaceans was associated to the most eutrophic sampling station related to highest algae biomass, whereas biomass of species of rotifers was linked to stations of lower trophic status. Highest biomass of microcrustacean was in the season of greatest trophic status whereas highest biomass of rotifer was related to the strongest rainfall season. In the vertical gradient, lowest biomass of all groups occurred in the subsurface. This zone tended to be avoided by most species during the sampling seasons. The expression of zooplankton biomass in the longitudinal axis and the temporal scale mainly responded to the gradient of trophic status and algae biomass, and in the vertical axis possibly responded to predation. Although, this response did not depend on the trophic habit of the species probably due to the diverse trophic offer of the reservoir and the alimentary plasticity of these species, it was clearly different between microcrustaceans and rotifers.
Key words: Rotifers, microcrustaceans, biomass, trophic state, Bosmina freyi.
Introducción
La biomasa de las poblaciones de zooplancton es una variable fundamental para entender el papel ecológico de cada grupo de esta comunidad y es considerada una estimación más realista y precisa que la densidad en estudios de estructura, debido al amplio rango de tamaño de las especies zooplanctónicas (Matsumura-Tundisi, Rietzler & Tundisi, 1989). Mientras grupos como rotíferos y protozoarios contribuyen significativamente en densidad, pero tienen una baja representatividad en biomasa, los de mayor tamaño, copépodos y cladóceros, pueden contribuir en forma importante a la biomasa (Bonecker, Nagae, Bletller, Machado & Lansac-Tôha, 2007).
Teniendo en cuenta que un gradiente ambiental es un cambio gradual en los factores bióticos y abióticos a través del tiempo y el espacio y que la ocurrencia o abundancia de una especie a lo largo de éste, sigue la ley de tolerancia de Shelford (Odum, 1971), la expresión de biomasa del zooplancton estará determinada por la existencia de los gradientes ambientales dentro de un ecosistema, en especial de estado trófico (Corgosinho & Pinto-Coelho, 2006; Echaniz, Vignatti, Cabrera & José de Paggi, 2012). Estudios sobre el impacto que causa la eutrofización en la abundancia y composición del zooplancton son frecuentes en limnología (Pinto-Coelho, Pinel-Alloul, Méthot& Havens, 2005; Corgosinho & Pinto-Coelho, 2006; Bonecker, Nagae, Bletller, Machado & Lansac-Tôha, 2007). Sin embargo, pocos trabajos analizan la respuesta de la biomasa al gradiente de eutrofización en las escalas longitudinal y temporal.
El gradiente longitudinal en los embalses, creado por los procesos de transporte, está influenciado por el régimen de precipitación y las actividades antropogénicas en las cuencas y puede generar diferencias en el estado trófico y por ende en la dominancia de grupos y / o de especies tanto de fitoplancton como de zooplancton (Sampaio, Rocha, Matsumura-Tundisi, Tundisi, 2002). De acuerdo con Marzolf (1990), los cambios graduales de la biomasa zooplanctónica a lo largo del eje longitudinal de los embalses están relacionados con la velocidad de los flujos de agua y el ingreso de materiales (arcilla, nutrientes, carbono orgánico disuelto y microflora) y según el factor preponderante, las poblaciones se concentrarán en determinada zona.
Debido a que esta dinámica también genera gradientes ambientales en el eje vertical de estos sistemas (Santos, 2009), frecuentemente las especies exhiben patrones heterogéneos de segregación a lo largo del gradiente lumínico en la zona fótica. En esta zona, con la mayor producción algal, el zooplancton exhibe su patrón típico de localización vertical (Alvarez, 2002). El efecto combinado del clima lumínico, la temperatura, el oxígeno disuelto, la disponibilidad de alimento y la depredación, puede ser el principal factor de fuerza en la estructuración vertical de esta comunidad (Wissel & Ramacharan, 2003).
Diversos estudios han indicado el efecto de la estaciona- lidad de los factores ambientales sobre el zooplancton en los embalses (Simões & Sonoda, 2009; Merayo & González, 2010). De acuerdo con Tundisi & Matsumura-Tundisi (2008) en los sistemas tropicales, las variaciones temporales de sus poblaciones dependen principalmente de las lluvias y del viento. Sin embargo, es probable que la influencia de las variaciones climáticas reportada por estos autores no sea generalizable para el zooplancton de todos los sistemas tropicales.
Desde la década de los setenta la construcción de embalses en Colombia se aceleró considerablemente (Gaviria, 1992; Roldán & Ramírez, 2008). Sin embargo, hoy en día se dispone de muy poca información sobre la dinámica horizontal y temporal de la biomasa del zooplancton en estos ecosistemas en Colombia (Herrera, 1993; Estrada-Posada, 1999; Monroy, 2008; Guevara, Lozano, Reinoso & Villa, 2009), e incluso no hay información sobre la dinámica vertical de la biomasa zooplanctónica de embalses colombianos.
En la presente investigación se plantearon las siguientes preguntas y sus respectivas hipótesis
1) ¿Cómo se estructura la comunidad zooplanctónica del embalse Riogrande II en las escalas espacial (longitudinal) y temporal en relación con el gradiente de estado trófico, biomasa fitoplanctónica y pluviosidad? Si la expresión de biomasa y la dominancia de especies del zooplancton de acuerdo con su hábito trófico responden al gradiente de estado trófico, biomasa fitoplanctónica y pluviosidad, entonces en las estaciones eutróficas y de mayor biomasa fitoplanctónica y en las temporadas de mayor precipitación y caudal esta comunidad presenta su máxima biomasa y está dominada por rotíferos detritívoros y depredadores, cladóceros microfiltradores y copépodos depredadores. En las estaciones oligo y mesotróficas y con menor biomasa algal y en épocas de menor pluviosidad y caudal, la biomasa de la comunidad se reduce y se incrementa la dominancia de rotíferos, cladóceros y copépodos filtradores.
2) ¿Cómo es la distribución vertical de la biomasa zooplanctónica a lo largo de la zona fótica del embalse Riogrande II? Si la selección de profundidad por el zooplancton dentro de la zona fótica responde a la disponibilidad de luz, oxígeno disuelto y biomasa algal, entonces la acumulación de biomasa zooplanctónica es menor en la subsuperficie (0,2 m aproximadamente), donde predominan rotíferos y cladóceros de pequeño tamaño; mientras que al 10 y al 1% de irradiación (Io) es mayor y está dominada por cladóceros y copépodos de gran tamaño.
Materiales y métodos
El embalse Riogrande II se sitúa al Nor-oriente de Colombia en la cuenca del río Grande (6° 33' 50''- 6° 28' 07'' N y los 75° 32' 30''- 75° 26' 10'' O). Tiene un volumen total hasta la cota de vertedero (2270 m) de 240 millones de m3, un área media de 1214 ha, profundidades máxima y media de 42,0 y 37,9 m, longitud máxima de 10 km y su tiempo de retención es de 72,8 días en promedio. Su aprovechamiento múltiple incluye generación hidroeléctrica y suministro de agua potable (Loaiza-Restano, Ramírez-Restrepo, Echenique, Vallejo & Ortíz, 2011).
El embalse está formado por el represamiento de las aguas de los ríos Grande y Chico y por la quebrada Las Ánimas (Figura 1). El río Grande entra al embalse repartiendo su volumen principalmente sobre el brazo del río Chico, aumentando el tiempo de residencia del agua y demorando el paso de los aportes hacia el interior del embalse (Franco, 2011).

Desde septiembre de 2011 a abril de 2012, se realizaron muestreos mensuales en cinco estaciones localizadas en las áreas de influencia de los tres afluentes más importantes del embalse. El estudio incluyó periodos con niveles de precipitación altos (septiembre, noviembre-diciembre 2011; marzo-abril 2012), medios (octubre 2011) y bajos (enero-febrero 2012) (Figura 1). La numeración de las estaciones de muestreo sigue la codificación fijada por el programa "Estudio de la problemática ambiental de tres embalses de empresas públicas de Medellín para la gestión integral y adecuada del recurso hídrico" (Palacio-Baena, Herrera- Loaiza, López-Muñoz, Palacio-Betancourt & Rodríguez, 2013; Toro, Moreno, Chalarca & Grajales, 2013).
En cada una de las estaciones seleccionadas se midieron in situ la transparencia (profundidad del disco de Secchi) y la temperatura del agua, la conductividad eléctrica y el % de saturación de oxígeno disuelto, con un perfilador CTD SBE 25 SeaBird Electronics. Se tomaron muestras de agua en la subsuperficie, al 10 y al 1% de irradiación para análisis en laboratorio de los ortofosfatos (mg P-PO4-3/L) mediante el método colorimétrico-ácido ascórbico (4500-P-E, APHA-AWWA-WEF 2005), y la clorofila a se midió por medio un FluorómetroFluoroProbe bbe-Moldaenke.
La información de la precipitación (estos datos corresponden al promedio de los valores registrados una semana anterior al muestreo y en la semana de muestreo), los caudales de los tributarios, los vertidos y captados, las variables físicas y químicas y de la clorofila a, fue generada por el programa "Estudio de la problemática ambiental de tres embalses de empresas públicas de Medellín para la gestión integral y adecuada del recurso hídrico" (Tabla 1) (Palacio-Baena et al., 2013; Toro et al., 2013).

El estado trófico de las estaciones y de las temporadas, se estableció con base en el índice de estado trófico promedio ponderado de Carlson (IET) modificado por Toledo, Talarico, Chinez & Agudo (1983):

Ds = transparencia Secchi, Cl.a = clorofila a, PT = fósforo total, PSR = fósforo soluble reactivo. La regla de decisión es: IET ≤ 44 = oligotrófico; 44 < IET<54 = mesotrófico e IET ≥ 54 = eutrófico.
Mediante arrastres verticales con una red de zooplancton de 40 mm de luz de malla, en la zona fótica (0,10 - 5,90 m) se tomaron muestras para análisis de biovolumen y peso seco, que fueron fijadas con formaldehido al 4% (v/v, concentración final) (Azevedo, Dias, Magalhães & Bonecker, 2012). Para el análisis de densidades, se filtraron 35 litros de agua proveniente de tres profundidades (subsuperficie, 10 y 1% de Io) a través de un tamiz de 40 mm de luz de malla. Estas muestras se preservaron con solución Transeau en proporción 1:1 (Estrada-Posada, 2007) y fueron depositadas en la colección de Limnología de la Universidad de Antioquia, CLUA 035. Usando un microscopio óptico y una cámara de Sedgwick-Rafter se contaron tres submuestras de 2 ml que contenían cada una como mínimo 80 individuos adultos (Bottrell et al., 1976).
El biovolumen de las especies de rotíferos se calculó con base en las fórmulas geométricas más semejantes a la forma del cuerpo de cada especie (Ruttner-Kolisko, 1977). Con una cámara SAMSUNG PROFESIONAL SCC-130B/131B se fotografiaron aleatoriamente 30 individuos de cada especie. Estas fotografías se analizaron con el programa MICRO-MANAGER-1.4, en el cual se tomaron las medidas de longitud y ancho del cuerpo, sin tener en cuenta los apéndices, pues estos se establecieron usando ecuaciones específicas para ellos. Los valores de biovolumen fueron convertidos en peso húmedo, suponiendo que 106 mm3 equivalen a 1 mg de peso húmedo (Bottrel et al., 1976) y el peso seco fue estimado como el 10% del peso húmedo (Pace & Orcutt, 1981), excepto para las especies de Asplanchna (3,9%; Dumont, Van De Velde & Dumont, 1975).
La biomasa de microcrustáceos se estimó a partir del método del peso seco (Dumont et al., 1975). Para establecer los modelos de regresión longitud-peso se pesaron en una balanza analítica (aproximación 1 mg) un número variable de individuos de las especies que presentaron mínimo 5 mg para un conjunto de individuos de cada clase (Dumont et al., 1975). El intervalo entre clases de tamaño se estimó de acuerdo con las recomendaciones de Bird & Praire (1985) y del número de individuos en las muestras. Antes del pesaje se removieron huevos, embriones y envolturas gelatinosas
(Dumont et al., 1975). Los individuos fueron lavados en agua destilada durante 1 hora y posteriormente transferidos a moldes de papel aluminio (secados previamente a 60°C por 30 minutos) y pesados. Posteriormente, el material de los moldes se expuso a 60°C durante 24 horas y luego, se dejó enfriar en un desecador durante una hora antes del pesaje final por triplicado para obtener un promedio. El peso seco se determinó mediante la diferencia entre el peso final y el peso inicial de la muestra y este valor se dividió por el número de organismos, con el fin de determinar el peso seco de un individuo promedio de la especie o grupo seleccionado (Blettler & Bonecker, 2006).
El tamaño de los cladóceros se tomó desde la extremidad inicial de la cabeza hasta la porción final del caparazón, usando una retícula micrométrica de 10 mm de precisión, adaptada al ocular del microscopio (aumento de 100x). Los copépodos se midieron desde la margen anterior de la cabeza hasta la porción final del urosoma y los nauplios desde la margen anterior hasta la margen posterior del cuerpo (largo total, sin considerar la setas furcales). En la medición de los cladóceros no se incluyeron ni el yelmo, ni los apéndices, ni las espinas (Bottrell et al. 1976).
El peso seco de las especies que no fueron pesadas se estimó mediante ecuaciones de regresión longitud-peso seco propuestas en la literatura (Castilho & Arcifa, 2007; Azevedo et al. 2012; Rodríguez-Zambrano & Aranguren-Riaño (com. pers.), seleccionando al azar 30 individuos de cada especie para medir su longitud (Mc Cauley, 1984). Las especies que no alcanzaron los 30 individuos fueron medidas conforme a su ocurrencia. La biomasa (mg/L) se calculó multiplicando la densidad (ind/L) por el peso individual (mg-peso seco).
La significancia de las diferencias de biomasa total y de cada grupo entre estaciones, profundidades y periodos se evaluó con los datos transformados con ln, mediante análisis de varianza ANOVA de una vía y de Kruskal y Wallis cuando no se cumplieron los supuestos de normalidad de residuos y homogeneidad de varianzas. Cuando se encontraron dife- rencias significativas, se aplicaron las pruebas de Tukey y de U de Mann Whitney para la comparación de las medias y las medianas, respectivamente. Inicialmente se realizaron ANOVAs de dos vías (fecha-estación, fecha-profundidad, profundidad-estación); sin embargo, las interacciones no fueron significativas. Los análisis se realizaron con el software R.x64 2.15.2 (R Development Core Team, 2008).
Para estimar la longitud del gradiente de la biomasa del zooplancton se empleó un Análisis de Correspondencia Sin Tendencia (Detrended Correspondence Analysis, DCA, por sus siglas en inglés) por segmentos (Hill & Gauch, 1980) con la biomasa de 23 especies. De acuerdo con los resultados de este análisis, se decidió realizar una ordenación de gradiente directo por Análisis de Redundancia (Redundancy Analysis, RDA, por sus siglas en inglés) como el método más robusto para establecer las variables ambientales determinantes en los patrones de distribución de la biomasa de especies y se utilizó la prueba de Monte Carlo con 999 permutaciones para determinar la significancia de los 15 predictores analizados (p< 0,05) (Lepš & Šmilauer 2003). Todos los datos fueron transformados con (log (1Y + 1)). Las ordenaciones se realizaron con el programa CANOCO versión 4.5 (Ter Braak & Šmilauer, 2002).
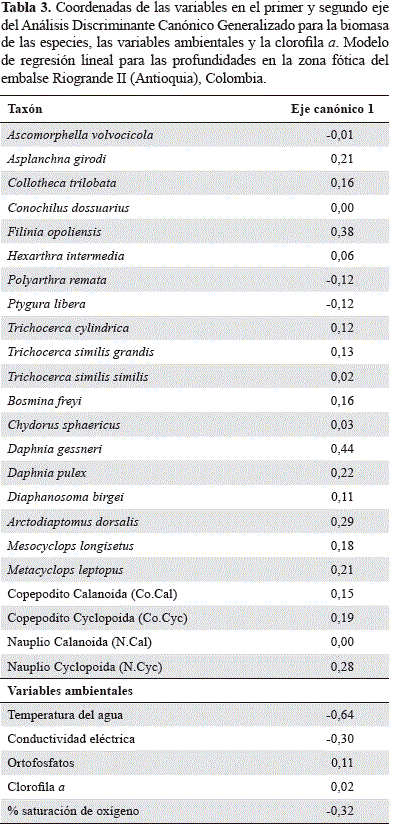
Mediante el paquete "candisc" para R se realizó un Análisis Discriminante Canónico Generalizado con la biomasa de las especies entre profundidades. Se calcularon las pun- tuaciones y los vectores canónicos para la representación gráfica de las funciones discriminantes canónicas más importantes en términos de varianza explicada, permitiendo así la interpretación más simple en el espacio canónico de diferenciación entre la biomasa de las especies y la matriz ambiental (Friendly, 2007).
Resultados
La biomasa total de zooplancton alcanzó un valor medio de 257,43 mg/L y varió ampliamente (CV = 141,13%), entre 1,12 mg/L en la subsuperficie de la estación 4 en diciembre 2011 y 2325,63 mg/L en el 10% Io de la estación 1 en marzo 2012. Mientras los cladóceros con el 78,09% (0,70-1812,37 mg/L) dominaron la biomasa, los copépodos alcanzaron el 15,41% (0,29-320,87 mg/L) y los rotíferos el 6,50% (0,13-266,17 mg/L) (Tabla 1S, http://www.raccefyn.co/index.php/raccefyn/article/downloadSuppFile/203/1012 y Figura 2).


Bosmina freyi (De Melo y Hebert, 1994) contribuyó en un alto porcentaje (60,57%) a la biomasa, Daphnia gessneri (Herbst, 1967) aportó el 10,79%, Asplanchna girodi (de Guerne, 1888) el 5,64%, Arctodiaptomus dorsalis (Marsh, 1907) el 5,33%, los copepoditos de Calanoida el 4,79%, Chydorus sphaericus (Müller, 1776) el 3,21%, los nauplios de Calanoida el 3,18% y Diaphanosoma birgei (Korinek, 1981) solo el 2,51%. Las demás especies contribuyeron con menos del 1% de la biomasa.
Independiente de la profundidad, los cladóceros dominaron la biomasa y los rotíferos presentaron el menor aporte (Tabla 1S y Figura 2). Adicionalmente, la relación entre cada uno de los grupos y la biomasa fitoplanctónica fue menor en la subsuperficie que en el 10 y 1% de Io, al igual que las relaciones biomasa de copépodos adultos: biomasa nauplios, y biomasa de cladóceros de gran porte (D. gessneri, Daphnia ambigua (Scourfield, 1947) y Daphnia cf. pulex (Leydig, 1860)): biomasa de cladóceros de pequeño porte (B. freyiy C. sphaericus) (Figura 3).

De acuerdo con las pruebas de Kruskal y Wallis y de U, la biomasa total mostró diferencias significativas entre estaciones. Mientras en la estación 1 (ribereña) la biomasa presentó el mayor valor, en las estaciones 4 y 5 (cercanas a la quebrada Ánimas) se cuantificaron los valores mínimos. El ANOVA y la prueba de Tukey mostraron diferencias de la biomasa a través del eje vertical de la zona fótica,
debido a valores medios significativamente menores en la subsuperficie (144,90 mg/L) que en el 10% (298,92 mg/L) y en el 1% de Io (328,46 mg/L). Aunque el promedio de la biomasa fue menor en diciembre 2011 (137,97 mg/L) y mayor en septiembre 2011 (373,34 mg/L) y marzo 2012 (485,45 mg/L), no se registraron diferencias significativas (Figura 4).

La biomasa de cladóceros mostró un patrón similar al de la biomasa total en el tiempo y en el espacio, debido a su notable dominancia durante todo el periodo de estudio y en consecuencia, mostró solo diferencias significativas entre estaciones y profundidades y no en el tiempo (Figura 4). Esta patrón fue fundamentalmente el resultado del comportamiento de la biomasa de B. freyi, la especie dominante.
De acuerdo con las pruebas de Kruskal y Wallis y de U, la biomasa de los copépodos también presentó diferencias significativas entre estaciones. En las estaciones 1 y 7 (ribereñas) las biomasas de copépodos fueron muy superiores a las encontradas en las demás e incluso, los elevados valores en la estación 1 generaron diferencias significativas con la 7. Los resultados del análisis de Kruskall y Wallis mostraron diferencias significativas en la biomasa de los copépodos entre las profundidades y la prueba de U indicó que los menores promedios en la subsuperficie (17,41 mg/L) difieren de los promedios en el 10 % (55,55 mg/L) y en el 1% de Io (46,03). Aunque entre muestreos la biomasa promedio fluctuó entre 14,47 mg/L en diciembre 2011 y 64,40 mg/L en septiembre 2011, la variación no fue significativa (Figura 4).
Aunque la biomasa de rotíferos tendió a ser mayor en las estaciones 1 y 7 (ribereñas), no se diferenció significativamente entre estaciones. Los resultados del ANOVA y de la prueba de Tukey indicaron diferencias significativas del promedio de la biomasa de rotíferos entre las tres profundidades en la zona fótica, debido a valores menores en la subsuperficie (4,75 mg/L) que en el 10% (24,32 mg/L) y en el 1% de Io (21,26 mg/L). Adicionalmente, el pico promedio de biomasa en marzo 2012 (59,41 mg/L), asociado al incremento de A. girodi, fue significativamente diferente de las biomasas de septiembre de 2011 y enero, febrero y abril de 2012 (Figura 4).
Los dos primeros ejes del Análisis de Correspondencia Sin Tendencia (DCA) presentaron autovalores de l = 0,18 y l = 0,14, respectivamene y explicaron 29,40% de la varianza. La longitud del gradiente en el primer eje fue 2,23 D.E y en el segundo 2,20 D.E. De acuerdo con la prueba de Monte Carlo (499 interacciones), el Análisis de Redundancia Canónica (RDA) fue significativo para todos los ejes canónicos (F = 5,78, p = 0,002, n =117).
De los 15 predictores analizados, el pH, el oxígeno disuelto, los caudales del río Grande y del río Chico y cuatro relacionados con los caudales vertidos y captados, fueron no significativos y presentaron inflación de la varianza (VIFs) > 20 (excepto el pH), por lo que fueron excluidos del análisis.
En el RDA, el primer (l = 0,11) y segundo eje (l = 0,07) explicaron un 17,10% de la varianza total de la biomasa de las especies de zooplancton y un 63,20% de la varianza total entre la biomasa de las especies y el ambiente. El coeficiente de determinación (r2), tanto para el eje 1 (0,76) como para el eje 2 (0,82), mostró alta correlación entre el ambiente y la biomasa de especies, que estuvo explicada significativamente (p < 0,05) por la temperatura del agua, la conductividad eléctrica, los ortofosfatos, la precipitación, el IET, la transparencia y la clorofila a (Tabla 2).

El primer eje del RDA reveló que la distribución de la biomasa de las especies entre las zonas del embalse estuvo determinada principalmente por la transparencia, relacionada de forma negativa al eje, y por el índice de estado trófico (IET), los ortofosfatos y la clorofila a, relacionados de forma positiva. El eje 1 del gráfico bidimensional del RDA (Figura 5 a) muestra un gradiente de estado trófico, dentro del cual en el cuadrante positivo se ubican las especies que más aportan a la biomasa como B. freyi, A. dorsalis, los nauplios y copepoditos de Calanoida, D. gessneri, C. sphaericusy D. birgei, junto con los copepoditos de Cyclopoida, Metacyclops leptopus(Kiefer, 1927), Trichocerca similis grandis(Hauer, 1965), T. similis similis(Wierzejski, 1893) y Daphnia cf. pulex que se asociaron a la estación ribereña del río Chico (1), de condiciones eutróficas y mayor biomasa fitoplanctónica.

En la mitad del gradiente se encuentran los rotíferos A. girodi, Ascomorphella volvocicola(Plate, 1886), Conochilus dossuarius(Hudson, 1885), Polyarthra remata (Skorikov, 1896), Ptygura libera (Myers, 1934), el copépodo Mesocyclops longisetus(Thiébaud, 1912) y los nauplios de Cyclopoida, que se relacionaron con las estaciones de carácter mesotrófico, la estación ribereña del río Grande (7) y la zona media del río Chico (3). En el cuadrante negativo se ubican los rotíferos Hexarthra intermedia (Wiszniewski, 1929), Filinia opoliensis(Zacharias, 1898), Collotheca trilobata(Collins, 1872) y Trichocerca cylindrica(Imhof, 1981), de baja contribución a la biomasa, que se asociaron con las estaciones oligo-mesotróficas (4 y 5), de menor biomasa algal y transparencia máxima (Figura 5 a).
La precipitación no fue determinante en la dinámica temporal del estado trófico del embalse, pues sólo en septiembre 2011 se presentan condiciones eutróficas, mientras en los demás periodos fueron mesotróficas. Sin embargo, es el predictor más importante de la biomasa de especies en el segundo eje del RDA, al cual se asocia de forma negativa y el que se denominó "gradiente climático". El aumento en la biomasa de la mayoría de las especies de rotíferos, en especial de C. dossuarius, C. trilobata, A. girodiy P. remata, del copépodo M. leptopusy los nauplios de Cyclopoida, se relacionó con el incremento de la lluvia, y la disminución de la temperatura y la transparencia en noviembre y diciembre 2011 y marzo 2012 (Figura 5 b).
En contraste con lo anterior, en los muestreos con menor precipitación (octubre 2011, enero y febrero 2012), las aguas más cálidas y la mayor transparencia favorecieron los rotíferos de poca contribución a la biomasa (T. cylindrica, P. libera y H. intermedia ), los cladóceros D. birgeiy D. pulex, el copepodo Mesocyclops longisetusy los copepoditos de Cyclopoida. Pocos cladóceros y copépodos fueron influenciados por los picos máximos y mínimos de la pluviosidad y la mayoría, incluyendo la especie dominante en biomasa, B. freyi, se asoció a valores mayores del estado trófico y de clorofila a en septiembre 2012 (Figura 5 b).
El análisis discriminante canónico agrupado por profundidades arrojó un porcentaje de clasificación de 88,03% y de validación cruzada de 66,67%. El primer eje explica el 81,13% de la variación, y el segundo el 18,87%. Aunque no hay una discriminación clara entre las profundidades, el análisis tiende a diferenciar la subsuperficie, donde la biomasa zooplanctónica es mínima, y sólo está asociada parcialmente la biomasa de los rotíferos P. remata y P.libera, favorecidos principalmente por la mayor temperatura de esta zona.
La biomasa de los demás taxones se asocia al 1 y al 10% de Io, donde hubo una mayor concentración de ortofosfatos. Dentro de estos, F. opoliensis, los nauplios de Cyclopoida, A. girodiy especies de gran porte como D. gessneri, A. dorsalis, D. pulexy Metacyclops leptopus, se relacionaron principalmente con el 1% de Io. La clorofila a presentó una baja variabilidad entre profundidades y no se asoció a la biomasa de ninguna de las especies analizadas. El oxígeno disuelto tuvo alta disponibilidad a lo largo de la zona fótica (% saturación: mínino = 78,94 %; máximo = 92,48%; CV = 8,41%), con una tendencia de mayor saturación en la subsuperficie y el 10% de Io (Tabla 3 y Figura 6).

Discusión
Los microcrustáceos, principalmente los cladóceros, dominaron la biomasa zooplanctónica del embalse Riogrande II, y en particular B. freyiaportó más del 60% de la biomasa total. B freyitolera un amplio rango de turbidez y posee una amplia plasticidad trófica, pues consume detritos, algas unicelulares, y bacterias entre 0,5-20 mm (Kerner, Ertl & Spitzy, 2004). De acuerdo con Acharya, Kyle & Elser (2004) Bosmina puede diferenciar la calidad alimenticia de las partículas, lo que le confiere una ventaja particular cuando una alta turbidez mineral interfiere con el pastoreo de especies menos selectivas.
Por lo anterior, es esperable la ventaja competitiva y amplia tolerancia de B. freyien un ambiente como Riogrande II, altamente turbio (Loaiza-Restano et al., 2011; Zabala, 2013), con una biomasa algal constituida por ítems poco apetecibles para la mayoría de especies zooplanctónicas como Staurastrum (Hansson & Tranvik, 1996; Palacio-Baena et al., 2013) y con alta presencia de cianobacterias coloniales como Microcystis wesenbergii(Komárek) Komárek ex Komárek in Joosen 2006: 209 y filamentosas como Dolichospermum sp. (Palacio, 2014). En un embalse eutrófico dominado por las cianobacterias Cylindrospermopsis raciborskii (Woloszynska, 1912) y Microcystis aeruginosa (Kützing) Kützing 1846: 6, Bonecker et al., (2007) también encontraron que predominaban pequeños cladóceros en la biomasa del zooplancton.
Según estudios previos (Estrada-Posada, 2007; Zabala, 2013) y los valores del índice de estado trófico (Toledo et al., 1983), Riogrande II es un sistema predominantemente eutrófico, pero con un gradiente de estado trófico que evidencia la influencia espacial de los tres tributarios. Mientras el sector cercano al ingreso de la quebrada Ánimas presenta menor enriquecimiento, la zona ribereña del río Grande muestra condiciones intermedias de estado trófico. Por su parte, en la cola del río Chico se registran condiciones eutróficas, que van disminuyendo hacia la zona media.
El valor medio de biomasa zooplanctónica en Riogrande II (257,4 mg/L) fue similar al reportado por Hart (2011) en el embalse eutrófico subtropical de Hartbeespoort (292,6 mg/L) y ligeramente superior a los valores registrados por González, Matos, Peñaherrera& Merayo (2011) en el embalse eutrófico La Pereza en Venezuela (121,8 mg/L) y por Sendacz, Caleffi & Santos-Soares (2006) y Bonecker et al., (2007) en los reservorios de agua brasileros de Guarapiranga (218,8 mg/L) e Iraí (105,6 mg/L), respectivamente.
No obstante, tal como lo señalan Guevara et al., (2009) para un embalse eutrófico colombiano, la biomasa total del zooplancton varió ampliamente, con valores desde típicos de embalses oligotróficos en la estación 4, hasta similares a los registrados en embalses hipereutróficos en la estación 1 (González et al., 2011).
En especial para los microcrustáceos, varios autores han encontrado que el zooplancton de embalses tropicales es afectado por el proceso de eutroficación y que los mayores valores de biomasa se registran en los sitios y periodos con mayor concentración de nutrientes y biomasa fitoplanctónica (Pinto-Coelho, Pinel-Alloul, Méthot& Havens, 2005; Corgosinho & Pinto-Coelho, 2006; Sendacz et al., 2006; Bonecker et al., 2007). Estrada-Posada (2007) también halló una distribución heterogénea del zooplancton en relación con el gradiente de estado trófico en Riogrande II, con mayores densidades hacia la zona ribereña del río Chico (Estación 1). Sin embargo, al considerar la densidad y no la biomasa, los rotíferos dominaron en la zona más eutrófica y de mayor biomasa algal.
En Riogrande II, la biomasa de los microcrustáceosmicrofiltradores como los estadios larvales de copépodos, B. freyi (Kerner et al., 2004) y C. sphaericus-que también es raspador (Ventelä et al., 2002)-, de microcrustáceosmacrofiltradores, como D. gessneri, D. pulex, D. birgeiy A. dorsalis (Locascio de Mitrovich, Villagra de Gamundi, Juárez & Ceraolo, 2005), de microcrustáceosraptoriales como M. leptopus leptopus (Andrade, com. pers.), y de los rotíferos raptoriales T. similis similis y T. similis grandis (Paggi, 1995), estuvo relacionada con la estación de muestreo y las epocas más calidas, de mayor estado trófico y con mayor biomasa algal.
De acuerdo con Melão (1999), el aumento de la temperatura afecta directamente el metabolismo de los organismos, disminuye los tiempos de desarrollo e incrementa las tasas de crecimiento poblacional. En cuanto a la biomasa algal, Amarasinghe, Vijverberg & Boersma (1997) reportan que en numerosos lagos y embalses templados, subtropicales y tropicales, los microcrustáceos también exhiben una correlación positiva con esta. No obstante, la gama amplia de hábitos tróficos muestra que además de las algas, otros componentes como los detritos, las bacterias y el zooplancton pequeño pudieron favorecer la acumulación de biomasa de las especies (Corgosinho & Pinto, 2006), pues en estas condiciones no existe limitación de alimento para el zooplancton (González, Matsumura-Tundisi & Tundisi, 2008).
A diferencia de los microcrustáceos, la biomasa de los rotíferos se relacionó con las zonas de menor estado trófico y biomasa algal. Los hábitos tróficos de la mayoría de estas especies no están restringidos al consumo de algas, pues pueden ser detritívoros como P. libera, C. dossuarius, H. intemedia y F. opoliensis (Nogrady, Wallace & Snell, 1993), depredadores como T. cylindrica (Paggi, 1995) y C. trilobata (Meksuwan, Pholpunthin & Segers, 2013) y forrajeros óptimos como A. girodi (Giraldo, 2010).
En algunos sistemas se ha encontrado que los detritos pueden ser una forma importante de alimento para el zooplancton (Pinto Coelho et al., 2005) y en particular para los rotíferos cuando el fitoplancton se encuentra en menores concentraciones (Merayo & González, 2010), pues no solo las algas satisfacen todos sus requerimientos nutricionales (Marzolf, 1990).
En general, el zooplancton no respondió a las reglas de operación del embalse ni a los caudales y solo la biomasa de los rotíferos fue influenciada por las condiciones climáticas, tal como lo reportaron Reyes & Monroy (com. pers.) en el embalse de Betania. En Riogrande II las mayores biomasas de especies como T. cylindrica, P. libera y H. intermedia se registraron durante los periodos secos y de mayor temperatura del agua. En contraste, otras especies, como C. dossuarius y el rotífero de mayor aporte a la biomasa, A girodi, tuvieron un pico máximo en periodos de alta precipitación, baja transparencia y menor biomasa algal. En los embalses, los pulsos de origen natural provenientes de las precipitaciones afectan sustancialmente las condiciones físicas, químicas y biológicas (Roldán & Ramírez, 2008). De esta manera, es posible que además de la influencia directa de los ritmos de la precipitación sobre la actividad reproductiva de los organismos (Odum, 1971), exista una relación indirecta entre la precipitación y la biomasa de los rotíferos en Riogrande II. Esta relación puede estar ligada a la dinámica de condiciones como la estructura térmica, los patrones de circulación, el tiempo de retención y en especial la disponibilidad de recursos alimenticios como las bacterias, el detrito, los protozoarios y la materia orgánica provenientes del seston, cuya descarga se relaciona claramente con los pulsos de las precipitaciones (Calijuri, 1988).
En estudios previos, se encontró que la biomasa de A. girodi en Riogrande II se incrementó en la epoca de mayor pluviosidad, gracias probablemente a su capacidad de alimentarse de ítems muy abundantes durante esta época como las bacterias y el detrito (Villabona-González, Buitrago-Amariles, Ramírez-Restrepo & Palacio-Baena, 2014). La mayor disponibilidad de estos recursos también pudo favorecer la biomasa de C. dossuarius, ya que este rotífero puede alimentarse tanto de detritos (Nogrady, Wallace & Snell,1993), como de bacterias (De Manuel, 2000).
Este estudio evidencia un gradiente heterogéneo en la expresión de biomasa del zooplancton a lo largo de tres estratos lumínicos dentro de la zona fótica, que es la zona donde investigaciones previas en el embalse (Estrada-Posada, 2007) y en otros embalses colombianos han reportado mayor concentración de esta comunidad en relación a la hallada en la zona afótica (Alvarez, 2002; Guevara et al., 2009). A diferencia de lo esperado y de lo hallado en otras investigaciones (Bini, Bonecker & Lansac-Tôha, 2001; Cassiano & Rodrigues, 2004; Villabona-González, Gavilán- Díaz & Estrada-Posada, 2007), la distribución vertical de la mayoría de especies de zooplancton no dependió de la disponibilidad de oxígeno y de alimento (biomasa algal), que tendió a ser homogénea entre las profundidades analizadas.
Sólo los rotíferos filtradores P. remata y P. libera, que también puede ser detritívoro (Nogrady et al., 1993; De Manuel, 2000), se favorecieron por la mayor temperatura en el estrato subsuperficial. Este estrato tendió a ser evitado por las demás especies de rotíferos y por todas las especies de microcrustáceos, por lo que la mayor acumulación de biomasa total y de los tres grupos se dio en los estratos más profundos de la zona fótica (10 y 1% de Io).
Wissel & Ramacharan (2003) sugieren que si los factores ambientales no son determinantes en la distribución vertical del zooplancton, la depredación por peces puede dirigir la selección de la profundidad por parte de las especies hacia capas más profundas o remover selectivamente a las especies de mayor tamaño en capas superficiales. Esta afirmación fue corroborada en este estudio por la asociación de la biomasa de las especies más grandes, D. gessneri, D. pulexy A. dorsaliscon la zona más profunda (1% de Io) y por las menores relaciones biomasa de organismos de gran porte: biomasa de organismos de pequeño porte en la subsuperficie (Jeppesen, Lauridsen, Mitchell, Christoffersen & Burns, 2000). Además, la menor relación entre la biomasa de todos los grupos y la biomasa fitoplanctónica indicaría un fuerte control de depredación y menores tasas de pastoreo hacia el fitoplancton, como ha sido documentado por Jeppesen et al., (2004).
Conclusiones
Los resultados soportan parcialmente la primera hipótesis, al mostrar que la estructuración del zooplancton basada en biomasa presenta una distribución longitudinal y temporal heterogénea, que responde principalmente al gradiente de estado trófico y de concentración de biomasa algal y en menor medida de la pluviosidad. Aunque dicha estructuración no dependió de los hábitos tróficos de las especies, como se esperaba, debido posiblemente a la oferta trófica diversa del embalse (algas, detrito, bac- terias, zooplancton) y a la plasticidad alimenticia de los rotíferos, sí fue diferente entre los grupos de zooplancton, microcrustáceos y rotíferos (Figura 7).

Se concluye que existe el gradiente vertical de la biomasa en la zona fótica postulado en la segunda hipótesis. Sin embargo, a diferencia de lo esperado y a pesar de que en este estudio no se evaluó directamente la depredación, se hipotetiza que este gradiente es consecuencia de una estrategia adoptada para evadir la presión de depredación y no una ubicación en función del oxígeno disuelto y la biomasa algal, pues a lo largo de esta zona, las especies encuentran un ambiente oxigenado y tienen acceso permanente al alimento fitoplanctónico.
Agradecimientos
Los autores agradecen a Empresas Públicas de Medellín y a los integrantes del programa "Estudio de la problemática ambiental de tres embalses de Empresas Públicas de Medellín para la gestión integral y adecuada del recurso hídrico", realizado conjuntamente entre los grupos de investigación de la Universidad de Antioquia: GAIA, GDECON y Productos naturales y el posgrado de recursos hidráulicos de la Universidad Nacional, Sede Medellín. A Santiago Gaviria (Viena, Austria), Daniel Monroy (Bogotá) y Patricia Pelayo (Medellín) por sus valiosos aportes al estudio.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Bibliografía
(No se incluyen referencias de los autores taxonómicos)
Acharya, K., Kyle, M. & Elser, J. J. (2004). Effects of stoichiometric dietary mixing on Daphnia growth and reproduction. Oecologia, 138: 333-340. [ Links ]
Alvarez, J. P. (2002). Estimación de la composición y abundancia del zooplancton durante la fase de llenado del embalse Amaní, Norcasia, (Caldas). (Trabajo de grado) (66 pp). Universidad Nacional de Colombia. Bogotá [ Links ].
Amarasinghe, P. B., Vijverberg, J. & Boersma, M. (1997). Production biology of copepods and cladocerans in three south-east Sri Lankan low-land reservoirs and its comparison to other tropical freshwater bodies. Hydrobiologia, 350: 145-62. [ Links ]
Azevedo, F., Dias, J., Magalhães, L. & Bonecker, C. (2012). Length-weight regressions of the microcrustacean species from a tropical floodplain. Acta Limnologica Brasiliensia, 24 (1): 01 - 11. [ Links ]
Bini, L. M., Bonecker, C. C. & Lansac-Tôha, F. A. (2001). Vertical Distribution of rotifers on the Upper Paraná River Floodplain: the role of thermal stratification and chlorophyll-a. Studies on Neotropical Fauna and Environment, 36 (3): 1241-1246 [ Links ]
Bird, D. F. & Praire, Y. T. (1985). Practical guidelines for the use of zooplankton length-weight regression equations. Journal of Plankton Research, 7: 955-960. [ Links ]
Blettler, M. & Bonecker, C. (2006). Avaluação da biomassa de microcrustáceosem ambientes aquáticoscontinentais. Interciencia, 31 (8): 591-597. [ Links ]
Bonecker, C. C., Nagae, M. Y., Bletller, M. C., Machado, L. F. & Lansac-Tôha, F. A. (2007). Zooplankton biomass in tropical reservoirs in southern Brazil. Hydrobiologia, 579 (1): 115-123. [ Links ]
Bottrell, H. H., Duncan, A., Gliwicz, Z. M., Grygierek, E., Herzig, A., Hillbricht-Ilkowska, A., et al. (1976). A review of some problems in zooplankton production studies. Norwegian Journal Of Zoology, 24 (24): 419-456. [ Links ]
Calijuri, M. N. C. (1988) Respostas fisioecológicas da comunidade fitoplanctônica e fatores ecológicos em ecossistemas com diferentes estágios de eutrofização. (Tesis de grado). PPG- Hidráulica e saneamento, SHS, EESC, Universidad de São Paulo, Brasil. En: Roldán, P. G. & Ramírez, J. J. (2008). Fundamentos de limnologíaneotropical. Segunda edición. Medellín, Colombia: Editorial Universidad de Antioquia. 440 pp. [ Links ]
Cassiano, E. & Rodrigues, E. (2004). Vertical distribution of zooplankton in the wáter column of lago Amapá, Rio Branco, Acre, Brasil. Revista Brasileira de Zoologia, 21 (2): 169-177. [ Links ]
Castilho-Noll, M. S. M. & Arcifa, M. S. (2007). Length-weight relationships for zooplanktonic species of a tropical Brazilian lake: Lake Monte Alegre. Acta Limnologica Brasiliensia, 19 (1): 93-100. [ Links ]
Corgosinho, P. H. C. & Pinto-Coelho, R. M. (2006). Zooplankton biomass, abundance and allometric patterns along an eutrophic gradient at Furnas Reservoir (Minas Gerais, Brazil). Acta Limnologica Brasiliensia, 182: 213-224. [ Links ]
De Manuel, J. (2000). The rotifer of Spanish reservoirs: ecological, systematical and zoogeographical remarks. Limnética, 19: 91-167. [ Links ]
Dumont, H. J., Van De Velde, I., & Dumont, S. (1975). The dry weight estimate of biomass in a selection of Cladocera, Copepoda and Rotifera from the plankton, periphyton and benthos of continental waters. Oecologia, 19 (1): 75-97. [ Links ]
Echaniz, S. A., Vignatti, A. M., Cabrera, G. C. & José de Paggi, S. B. (2012). Zooplankton richness, abundance and biomass of two hypertrophic shallow lakes with different salinity in central Argentina. Biota Neotropical, 12 (2): 41-48. [ Links ]
Estrada-Posada, A. L. (1999). Variação espacial e temporal da comunidade zooplanctônica do Reservatório"La Fé", Antioquia, Colombia. (Tesis de maestría) (78 pp). Universidade de São Paulo. Sao Paulo, Brasil. [ Links ]
Estrada-Posada, A. L. (2007). Variación de la estructura y la distribución del zooplancton en función de los gradientes longitudinales en el embalse Ríogrande II, Antioquia Colombia. (Tesis de doctorado) (94 pp). Instituto de biología, Universidad de Antioquia. Medellín, Colombia. [ Links ]
Franco, J. D. (2011). Modelación de la estructura térmica de un embalse ramificado mediante el análisis de los procesos físicos gobernantes. Aplicación al embalse multipropósito Riogrande II. (Tesis de maestría) (83 pp). Facultad de Minas, Universidad Nacional de Colombia. Medellín, Colombia. [ Links ]
Friendly, M. (2007). HE plots for multivariate general linear models. Journal of Computational and Graphical Statistics, 16: 421 - 444. [ Links ]
Gaviria, S. (agosto, 1992). Situación de la limnología en Colombia y sus perspectivas. En: Troja, J. Memorias Primer Simposio de Limnología Hispanoamericana, Sevilla. Manuscrito sin publicar [ Links ]
Giraldo, M. (2010). Composición de la dieta del rotífero Asplanchna girodi(De Guerne, 1888) y su variación temporal y espacial en el embalse Riogrande II (Antioquia, Colombia). (Trabajo de grado) (80 pp). Instituto de Biología, Universidad de Antioquia. Medellín, Colombia. [ Links ]
González, E. J., Matsumura-Tundisi, T. & Tundisi, J. G. (2008). Size and dry weight of main zooplankton species in Bariri reservoir (SP, Brazil). Brazilian Journal of Biology, 68: 69-75. [ Links ]
González, E., Matos, M., Peñaherrera, C. & Merayo, S. (2011). Zooplankton abundance, biomass and trophic state in some Venezuelan reservoirs. En: Dr. Islam Atazadeh (Eds.).Biomass and Remote Sensing of Biomass, ISBN: 978-953-307-490-0, InTech. Recuperado de: http://www.intechopen.com/books/biomass-and-remote-sensing-of-biomass/zooplankton-abundance-biomass-and-trophic-state-in-some-venezuelan-reservoirs. [ Links ]
Guevara, G., Lozano, L., Reinoso, G. & Villa, F. (2009). Horizontal and seasonal patterns of tropical zooplankton from the eutrophic Prado Reservoir (Colombia). Limnologica, 39: 128-139. [ Links ]
Hansson, L. A. & Tranvik, L. J. (1996). Quantification of invertebrate predation and herbivory in food chains of low complexity. Oecologia, 108: 542 - 551. [ Links ]
Hart, R. C. (2011). Zooplankton biomass to chlorophyll ratios in relation to trophic status within and between ten South African reservoirs: Causal inferences, and implications for biomanipulation. Water SA, 37 (4): 513-522. [ Links ]
Herrera, Y. (1993). Estudio del zooplancton del embalse de Betania, Huila. (Trabajo de grado) (61 pp). Departamento de Biologia, Universidad Nacional de Colombia. Bogotá, Colombia). [ Links ]
Hill, M. O., Gauch, H. G. (1980). Detrended correspondence analysis, an improvised ordination technique. Vegetation, 42: 47-58. [ Links ]
Jeppesen, E., Lauridsen, T. L., Mitchell, S. F., Christoffersen, K. & Burns, C. W. (2000). Trophic structure in the pelagial of 25 shallow New Zealand lakes: changes along nutrient and fish gradients. Journal of Plankton Research, 22 (5), 951-968. [ Links ]
Jeppesen, E., Jensen, J. P., Søndergaard, M., Fenger-Grøn, M., Bramm, M. E., Sandby, K., et al., (2004). Impact of fish predation on cladoceran body weight distribution and zooplankton grazing in lakes during winter. Freshwater Biology, 49: 432-447. [ Links ]
Kerner, M., Ertl, S. & Spitzy, A. (2004). Trophic diversity within the planktonic food web of the Elbe Estuary determined on isolated individual species by 13C analysis. Journal of Plankton Research, 26 (9): 1039-1048. [ Links ]
Lepš, J. & Šmilauer, P. (2003). Multivariate analysis of ecological data using CANOCO. New York (U. S. A.): Cambridge University Press, 283 pp.
Loaiza-Restano, A. M., Ramírez-Restrepo, J. J., Echenique, R. O., Vallejo, A. & Ortíz, L. (2011). Dinámica espacio-temporal de cuatro especies de Staurastrum (Meyen, 1829, emend Ralfs 1848) en un embalse eutrófico colombiano. OecologíaAustralis, 15 (3): 726-746. [ Links ]
Locascio de Mitrovich, C., Villagra de Gamundi, A., Juárez, J. & Ceraolo, M. (2005). Características limnológicas y zooplancton de cinco lagunas de la Puna - Argentina. Ecología en Bolivia, 40 (1): 1-14. [ Links ]
Marzolf, G. R. (1990). Reservoirs as environments for zooplankton. En: Thornton, K. W., Kimmel, B. L. & Payne, F. E. (eds.). Reservoir Limnology: Ecological perspectives. (pp. 195-208). Nueva York (U.S.A): Wiley. [ Links ]
Matsumura-Tundisi, T., Rietzler, A. C. & Tundisi, J. G. (1989). Biomass (dry weight and carbon content) of plankton Crustacea from Broa reservoir (SãoCarlos, SP, Brasil) and its fluctuations across one year. Hydrobiology, 179 (3): 229-236. [ Links ]
Mc Cauley, E. (1984). The estimation of the abundance and biomass of zooplankton in samples, pp 228-261. En Dowing, J. A. & Rigler, F. H. (eds.) A manual on methods for the assessment of secondary productivity in fresh waters. Londres, Reino Unido: Blackwell. [ Links ]
Meksuwan, P., Pholpunthin, P. & Segers, H. (2013). The Collothecidae (Rotifera, Collothecacea) of Thailand, with the description of a new species and an illustrated key to the Southeast Asian fauna. ZooKeys, 315: 1-16. [ Links ]
Melão, M. G. (1999). Desenvolvimento e aspectos reprodutivos de cladóceros e copépodos de águas continentais brasileiras. En: Pompêo, M. L. M. org (eds.). Perspectivas da Limnologia no Brasil. (pp 45 - 57). São Luís: Gráfica e Editora União. [ Links ]
Merayo, S. & González, E. (2010). Variaciones de abundancia y biomasa del zooplancton en un embalse tropical oligo-mesotrófico del norte de Venezuela. Revista de Biología Tropical, 58 (2): 603-619. [ Links ]
Monroy, D. (2008). Expresión del zooplancton (excepto Protozoos) en función de las variables de un embalse tropical (La Esmeralda-Colombia). (Tesis de maestría) (74 pp). Facultad de Ciencias, Universidad de Los Andes. Bogotá, Colombia: [ Links ]
Nogrady, T., Wallace, R. & Snell, T. (eds.). (1993). Rotifera. Vol. 1: Biology, Ecology and Systematics. En: Dumont, H. (Coord. Ed.) Guides to the Identification of the microinvertebrates of the continental waters of the world. The Hague, The Netherlands: SPB Academic Publishing, 298 pp. [ Links ]
Odum, E. (1971). Ecología. Tercera edición. Georgia: Editorial Interamericana, 639 pp. [ Links ]
Pace, M. L. & Orcutt, J. D. Jr. (1981). The relative importance of protozoans, rotifers and crustaceans in a freshwater zooplankton community. Limnology and Oceanography, 26 (5): 822-830. [ Links ]
Paggi, J. C. (1995). Crustacea Cladocera. En: Lopretto, E. & Tell, G. (eds.) Ecosistemas de aguas continentales: Metodología para su estudio. (pp. 909-951). La Plata, Argentina: Ediciones Sur. [ Links ]
Palacio, H. (2014). Dinámica espacio-temporal de las ciano- bacterias en el embalse Riogrande II. (Tesis de doctorado) (175 pp). Instituto de Biología, Universidad de Antioquia. Medellín, Colombia: [ Links ]
Palacio-Baena, J., Herrera-Loaiza, N., López-Muñoz, M., Palacio-Betancourt, H. & Rodríguez, M. (2013). Limnoecología de los embalses Riogrande II, La Fe y Porce II. En: Estudio de la problemática ambiental de tres embalses de empresas públicas de Medellín ESP para la gestión integral y adecuada del recurso hídrico. Medellín (Colombia): Universidad de Antioquia y Universidad Nacional sede Medellín. Informe técnico, embalse Riogrande II. pp. 444-528. [ Links ]
Pinto-Coelho, R., Pinel-Alloul, B., Methot, G. & Havens, K. E. (2005). Crustacean zooplankton in lakes and reservoirs of temperate and tropical regions: variation with trophic status. Canadian Journal of Fisheries and Aquatic Sciences, 62: 348-361. [ Links ]
R Development Core Team. (2008). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL. Recuperado de http://www.R-project.org. [ Links ]
Roldán, P. G. & Ramírez, J. J. (2008). Fundamentos de limno-logíaneotropical. Segunda edición. Medellín, Colombia: Editorial Universidad de Antioquia, 440 pp. [ Links ]
Ruttner-Kolisko, A. (1977). Suggestions for biomass calculations of plankton rotifers. Archiv fürHydrobiologie Beiheft Ergebnisse der Limnologie, 8: 71-76. [ Links ]
Sampaio, E., Rocha, O., Matsumura-Tundisi, T. & Tundisi, J. (2002). Composition and abundance of zooplankton in the limnetic zone of seven reservoirs of the Paranapanema river. Brazilian Journal of Biology, 62: 525-545. [ Links ]
Santos, R. (2009). Estrutura das comunidades fitoplanctônica e zooplanctônica, com ênfasena produção secundária do zooplancton, e fatores ambientais relacionados nos reservatórios do baixo Rio Tietê. (Tesis de doctorado) (68 pp). Programa de Posgraduación en ecología y recursos naturales, Universidad de San Carlos. São carlos, Brasil. [ Links ]
Santos, F., Lansac-Toha, F. & Bonecker, C. (2011). Estrutura das assembléias de cladóceros em reservatorios nos estados de São Paulo E Paraná: Gradientes espaciais e grau de trofía. Oecologia Australis, 15 (3): 494-510. [ Links ]
Sendacz, S., Caleffi, S., Santos-Soares, J. (2006). Zooplankton biomass of reservoirs in different trophic conditions in the State of Sao Paulo, Brazil. Brazilian Journal of Biology, 66: 337-350. [ Links ]
Simões, N. & Sonoda, S. (2009). Estrutura da assembléia de microcrustáceos (Cladocera e Copepoda) em um reservatorio do semi-árido Neotropical, Barragem de Pedra, Estado da Bahia, Brasil. Acta Scientarium Biological Sciences, 31 (1): 89-95. [ Links ]
Ter Braak, C. & Šmilauer, P. (2002). CANOCO reference manual and CanoDraw for Windows user guide software for canonical community ordination versión 4.5.
Toledo, A. P., Talarico, M., Chinez, S. J. & Agudo, E. G. (1983). A aplicação de modelos simplificados para a avaliação de procesos de eutrofizaçãoem lagos e reservatóriostropicais. XIX Congreso interamericano de Engenharia e ambiental. Camboriú, Brasil. [ Links ]
Toro, M., Moreno, A., Chalarca, D. & Grajales, H. (2013). Dinámica ambiental de los nutrientes (especies químicas del nitrógeno, fósforo y sílice) en los embalses La Fe, Riogrande II y Porce II a través de modelos conceptuales y matemáticos, como herramienta de gestión de la calidad de agua en los tres sistemas, pp 242-297. En: Palacio J. (eds.), Informe técnico embalse Riogrande II "Estudio de la problemática ambiental de tres embalses de Empresas Públicas de Medellín para la gestión integral y adecuada del recurso hídrico."Universidad de Antioquia, Universidad Nacional sede Medellín, Empresas Públicas de Medellín. Medellín. [ Links ]
Tundisi, J. & Matsumura-Tundisi, T. (2008). Limnología. São Paulo (Brasil): Oficina de Textos, 631 pp. [ Links ]
Ventelä, A. E., Wiackowski, K., Moilanen, M., Saarikari, V., Vourio, K. & Sarvala, J. (2002). The effect of small zooplankton on the microbial loop and edible algae during a cyanobacterial bloom. Freshwater Biology, 47: 1807-1819. [ Links ]
Villabona-González, S., Gavilán-Díaz, R. & Estrada-Posada, A. (2007). Cambios nictemerales en la distribución vertical de algunos microcrustáceos en un lago artificial del neo- trópico (Colombia). Limnética, 26 (1): 75-88. [ Links ]
Villabona-González, S., Buitrago-Amariles, R., Ramírez- Restrepo, J.J. & Palacio-Baena, J. A. (2014). Biomasa de rotíferos en dos embalses con diferentes estados tróficos (Antioquia, Colombia) y su relación con algunas variables limnológicas. Actualidades Biológicas, 36 (101): 149-162. [ Links ]
Wissel, B. & Ramacharan, C. (2003). Plasticity of vertical distribution of crustacean zooplanckton in lakes with varying levels of water colour. Journal of Plankton Research, 25 (9): 1047-1057. [ Links ]
Zabala, A. M. (2013). Evaluación del estado trófico del embalse Riogrande II (Antioquia, Colombia) a través del comportamiento espacial y temporal de los nutrientes. (Trabajo de grado) (108 pp). Instituto de Biología, Universidad de Antioquia. Medellín, Colombia. [ Links ]













