1. INTRODUCCIÓN
Los radicales libres y las especies reactivas del oxígeno tienen la capacidad de interactuar químicamente con las macromoléculas del cuerpo humano, generando enfermedades como el cáncer, obesidad, diabetes, enfermedad de Alzheimer, enfermedades oculares, lupus entre otras1-3. Estas especies pueden estar presentes en el organismo humano como producto de un metabolismo normal, y pueden ser usadas para la producción de energía, incluso, en algunas células pueden ser utilizadas como defensas para destruir virus y bacterias; pero cuando el cuerpo genera o se expone a cantidades excesivas, ya sea por factores externos o por un factor genotípico, su energía extremadamente alta puede dañar los tejidos normales4. El organismo puede contrarrestar estas alteraciones mediante enzimas antioxidantes endógenas, pero cuando no es suficiente, se hace necesario suministrar antioxidantes naturales o sintéticos, tales como el hidroxianisol butilado (BHA) e hidroxitolueno butilado (BHT)5. Sin embargo, el uso de compuestos sintéticos ha sido restringido en muchos países debido a los efectos producidos en la salud6.
Los compuestos naturales parecen ser una alternativa para su uso como antioxidantes. Los metabolitos secundarios de las plantas reúnen una gran cantidad de polifenoles, antocianinas, entre otros compuestos, que están implicados en la defensa contra el ataque de los radicales libres y el oxígeno singulete; por lo que recibe atención al considerarse como factores de protección contra las enfermedades crónicas degenerativas y enfermedades cardiovasculares7. Una de las especies vegetales que evidencia que tiene actividad antioxidante es laSyzygium cumini(Eugenia Jambolana)8. Sin embargo, se desconoce el efecto de estos extractos contra el oxígeno singulete. En este trabajo se evaluó la actividad antioxidante contra el oxígeno singulete a partir del extracto etanólico de la cáscara del fruto deSyzygium cumini.
2. DESARROLLO DEL ARTÍCULO
2.1 Obtención del extracto etanólico por percolación
Para la obtención de la muestra se recolectó 500 g de la frutaS. cuminien condiciones óptimas de maduración, en la ciudad de Valledupar (Cesar), Colombia, de coordenadas 10°27′37″N 73°15′35″O, altitud media de 168 msnm, durante la última semana del mes de marzo se marca el inicio de la temporada de lluvias en esta zona del país. Las uvas frescas de la especieSyzygium cuminise lavaron con agua destilada, posteriormente se secaron en un horno a 45 °C por un período de 5 días. Se pesó periódicamente hasta que este permaneció constante. Una vez obtenida la muestra deshidratada se procedió a homogeneizar la piel, con el fin de aumentar el área de contacto con el solvente. Se pesó 100 g del material macerado y se depositó en un percolador. Se adicionó etanol:agua en proporción volumétrica 1:2. Luego de (72) horas se procedió a recoger las fracciones obtenidas. Se concentró el extracto en un rotaevaporador por 10 minutos y una temperatura de 60 °C, retirando el solvente.
2.2 Caracterización del extracto por UV- Visy HPLC
Para el análisis de las antocianinas presentes en el extracto etanólico se utilizó un espectrofotómetro UV-vis(Thermo Fisher Scientific, modeloGenesys10S UV-Vis), y se caracterizó por determinación analítica, utilizando un cromatógrafo líquido UHPLCUltimate3000 (Dionex-Thermo Fisher Scientific, Inc.) equipado con una bomba cuaternaria de alta presión y un detector de diodos (DAD, UV/Vis). El resultado fue la separación de antocianinas mediante una columna Capce-ll- Pak® C18 UG120 S-5 (120 Å, 5 μm) (250 mm x 4,6 mm I.D, Shiseido Co, Tokio). Los datos fueron adquiridos y procesados por elsoftware Chromeleon® 7Chromatography Data System(Versión 7.2.1.5833,Thermo Fisher Scientific, Inc.).
El resultado se expresó en μg/mL de antocianinas totales equivalentes al estándar de referencia cloruro de delfinidina (TAEDC). Esta metodología se basó en la estandarización externa utilizando una curva de calibración, que se obtuvo de las diferentes soluciones del estándar Cloruro de Delfinidina (1,0 μg/mL y 100,0 μg/mL). Condiciones cromatográficas: Caudal: 0,6 mL/min, volumen de inyección: 15 μL, temperatura del horno: 25 °C, longitud de onda de detección: 255 nm, 285 nm, 325 nm, 525 nm, fase móvil (agua / ácido fórmico / acetonitrilo): A (83:10:7) y B (40:10:50), Gradiente elución - 0 min - 2 min (95% - 93% A), 4.5 min (93% A), 5.5 min (92% A), 6.5 min - 7.5 min (88% A), 7.8 min - 8 min (86% A), 8.5 min - 13 min (84% A), 13.5 min (80% A), 15 min (75% A), 20 min (70% A), 30 min (65% A), 40 min (95% A).
2.3 Contenido total de fenoles
El reactivo de Folin-Ciocalteu (FC) se preparó a una concentración 1 N a partir del reactivo comercial (2,0 N) disolviéndolo en agua destilada. Se protegió de la luz para evitar su degradación y se guardó en refrigeración hasta su uso. Adicionalmente, se preparó una solución al 20% de carbonato de sodio.
2.4 Estudio del quenching del oxígeno singulete por el extracto
El oxígeno singulete fue generado siguiendo la metodología propuesta por Aubry9, por medio del sistema Na2MoO4/H2O2, en la oscuridad y en presencia de rubreno (0.02 M). Se preparó una mezcla de 4,7 g (0,016 moles) de dodecil sulfato de sodio (SDS) con 9,4 g (0,13 moles) de 1-butanol y se agregó a 60 mL (0,93 moles) de diclorometano formando la fase continua de la microemulsión. Luego se adicionó a esta microemulsión 6 mL de una solución 0,2 M de Na2MoO4.2H2O (1,2x10-3 moles), gota a gota con agitación constante hasta obtener una emulsión transparente (pH=10)10. La microemulsión originada corresponde a una micela tipo (W/O) o micela invertida. Para la generación de oxígeno singulete se adicionó 100 μL de H2O2.
El seguimiento de la reacción se hizo a 522 nm. El porcentaje de desactivación (%Q) se determinó por medio de la siguiente ecuación:
Donde el ΔA ao corresponde a un cambio de la absorbancia en presencia del extracto y ΔA c , es el cambio de la reacción control, es decir, en ausencia del extracto.
3. RESULTADOS
3.1 Caracterización del extracto por UV-VisyHPLC
La solución del extracto etanólico deS. cuminipresentó un color púrpura intenso, característico de los extractos que contienen antocianinas11. Las antocianinas exhiben un espectro de absorción de referencia con bandas aproximadas a 290, 380 y una banda ancha entre 500-545 nm (Fig. 1). Las dos primeras señales corresponden a las transicionesπ→ π* la última a la transición n → π*, esto permite la confirmación preliminar de la existencia de un grupo cromóforo fuertemente conjugado, como son las antocianinas12.
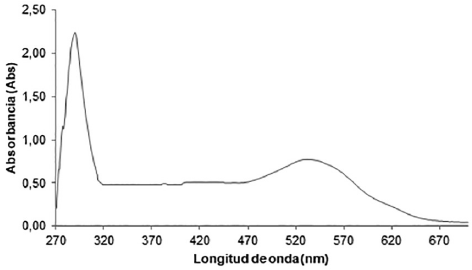
Fuente: Los autores
Fig. 1 ESPECTRO DE ABSORCIÓN UV-Vis DE LA SOLUCIÓN ETANÓLICA DEL EXTRACTO DE S. CUMINI
El contenido total de antocianinas presente en el extracto etanólico deS. cuminifue de 31 ± 5 μg ATECD/mL de extracto. El perfil cromatográfico por HPLC-DAD (λ 525 nm) para el extracto de frutos deS. cuminise presenta en la Fig. 2. De acuerdo con la metodología planteada, se caracterizó la presencia de más de 15 antocianinas, tres de ellas más abundantes, las cuales fueron, la malvidina 3,5-diglucósido (44%), la delfinidina 3,5-diglucósido (28%) y la petunidina 3,5-diglucósido (9%)13.
3.2 Determinación del contenido total de fenoles
Por cada 100 gramos de fruta fresca se obtuvo 1,58 g de extracto seco. El contenido total de fenoles reportado para las partes comestibles de la frutaS. cuminies de: 0,569 (piel) y 0,235 (pulpa) mg/g AGE PF (peso fruta), y para esta metodología fue de 8,55 mg/g AGE PF.
3.3 Desactivación del oxígeno singulete
El rubreno (color naranja) es oxidado a un endoperóxido (incoloro), a través de una cicloadición [4π+ 2π] del oxígeno singulete, Fig. 3 14. Cuando el extracto está presente en el medio, la reacción de oxidación es inhibida.
En la Fig. 4 se puede apreciar el espectro visible de la oxidación del rubreno en ausencia y en presencia del extracto. Después de 10 min de reacción, con una concentración de extracto de 0.39 mg/mL, la oxidación del rubreno por el oxígeno singulete es inhibida aproximadamente en un 60%. En la tabla 1 se muestran los porcentajes de desactivación del oxígeno singulete para diferentes concentraciones de extracto; es posible evidenciar que a menores concentraciones del extractoS. cuminise presentan menores valores de dicho porcentaje, esto es debido a que disminuye la cantidad de moléculas capaces de desactivar el oxígeno singulete. En presencia de azida de sodio no se observó oxidación del rubreno.
La oxidación del rubreno en ausencia o presencia del extracto siguió una cinética de seudo-primer orden (Fig. 5). La constante de velocidad para la reacción control (ausencia de extracto) presenta una constante de velocidad de 1x10-3 s-1, mientras que la constante de velocidad en presencia del extracto es de 3x10-4 s-1, esto indica que el proceso de oxidación de la molécula modelo (rubreno) es más lento en presencia del extracto, lo que le confiere propiedades antioxidantes contra el oxígeno singulete.
4. CONCLUSIONES
Los resultados obtenidos en este estudio muestran que el fruto de la especieSyzygium cuminies una posible fuente de compuestos con potencial actividad antioxidante contra el oxígeno singulete. El extracto mostró cantidades apreciables de grupos fenólicos (alrededor de 8,55 AGE mg/g peso fruta). La caracterización por HPLC-DAD muestra por lo menos 3 antocianinas de mayor abundancia relativa (la malvidina 3,5-diglucósido, la delfinidina 3,5-diglucósido y la petunidina 3,5-diglucósido). Se evidencia un 60% de desactivación del oxígeno singulete, a una concentración de 0,39 mg/mL a 10 minutos de reacción.




















