Introdução
O Brasil é muito diverso e abrange a região mais rica do mundo em táxons animais (MITTERMEIER, 1988; MARQUES e LAMAS, 2006). Diante disso, há a necessidade urgente de melhor conhecer a imensa riqueza biológica do planeta, em especial, às crescentes ameaças provenientes do crescimento populacional desordenado que leva à degradação ambiental, a perda e fragmentação de hábitats (LEWINSOHN, 2006). As coleções científicas possuem papel fundamental para o conhecimento da biodiversidade, por proporcionarem informações básicas sobre as espécies e a região, em favor da diversidade e extensão territorial da região amazônica (MAGALHÃES et al., 2001).
As coleções zoológicas são importantes fontes de informações para todos os que trabalham com o estudo da biodiversidade animal, pois proporcionam o avanço do conhecimento que pode ser aplicado em diferentes maneiras na sociedade, tanto para a atuação governamental, quanto para a gestão ambiental. É nas coleções científicas que encontramos espécies da fauna já extinta, formando uma base de dados fundamental para os estudos de caracterização e impacto ambiental (ZAHER e YOUNG, 2003).
Historicamente, a primeira coleção científica que surgiu no Brasil foi fundada pelo imperador Dom João VI, no ano de 1818 e foi denominada Casa dos Pássaros, instituição ao qual deu origem ao Museu Nacional do Rio de Janeiro. Em seguida, entre os anos de 1866 e 1886, foram criadas as coleções científicas do Museu Paraense Emílio Goeldi (MPEG), em Belém no Pará, e do Museu de Zoologia da Universidade de São Paulo, em São Paulo capital, respectivamente. Atualmente, estas três instituições resguardam o maior acervo da nossa diversidade biológica nacional (ZAHER e YOUNG, 2003).
Na região Amazônica, distinguem-se dois grandes centros de pesquisas: O MPEG e o Instituto Nacional de Pesquisas da Amazônia (INPA). E compete a essas duas instituições, estudar a biodiversidade amazônica em todos os seus aspectos. No entanto, os estudos da herpetofauna amazônica ainda são poucos (AZEVEDO-RAMOS e GALATTI, 2001), deixando assim uma enorme lacuna no que diz respeito ao conhecimento desta fauna.
A aceleração do desenvolvimento econômico na região oeste do Pará causou alterações nos ambientes naturais, transformando grandes áreas de florestas contínuas em um mosaico de paisagens, com fragmentos de florestas isoladas por diferentes tipos de hábitats, como áreas de crescimento de vegetação secundária, pastagens e lavouras (DIEGUES,1993 e MARGULIS, 2003).
Dessa forma, os inventários herpetológicos oferecem uma ampla visão sobre a distribuição de um grande número de espécies, melhorando a compreensão dos padrões de distribuição das espécies, em função de diversas variáveis ambientais (GASCON, 1991). Contudo, a criação e manutenção de coleções científicas é uma prática pouco utilizada por instituições, devido (a) falta de especialistas, (b) o baixo ou inexistente investimento por parte de agências financiadoras e, (c) logística deficitária, o que dificulta o deslocamento, alojamento das equipes, pesquisadores e a aquisição de instrumentos científicos (MAGALHÃES e BONALDO, 2003).
No entanto, por limitações financeiras, logística e de pessoal, a região oeste do Pará ficou por muito tempo necessitada de conhecimento sobre os aspectos da sua biodiversidade, em especial a Herpetofauna, sendo conhecida aos poucos através de trabalhos pontuais (CHALKIDIS, 2000; FROTA, 2000; FROTA e YUKI, 2001; SANTOS JÚNIOR e FROTA, 2002; FROTA e SANTOS JÚNIOR, 2002; FROTA e YUKI, 2005; FROTA e SANTOS JÚNIOR, 2005; SANTOS JUNIOR e FROTA et al., 2007; STURARO et al., 2010; CALVETE et al., 2011; RIBEIRO et al., 2014; GANANÇA et al., 2014; SABAJ-PÉREZ, 2014; SOUSA et al., 2015 ).
E na contramão dos fatos, foi que em meados de 1999, iniciou-se os trabalhos da Coleção Herpetológica nas Faculdades Integradas do Tapajós, hoje Faculdades Integradas do Tapajós/Faculdade da Amazônia (FIT/UNAMA), que surgiu diante da necessidade de melhor conhecer a região oeste do Pará e amostrá-la cientificamente, sobretudo com a abertura de fronteiras agrícolas no norte do país, que culminou com um dos maiores índices de desmatamento da Amazônia, com cerca de 28.000 km2 (COHENCA, 2005). A região Oeste do Pará compreende 25 municípios (IBGE, 2007), distribuídos por 722.358 km2 com regiões fitogeográficas distintas, como a Floresta de Terra Firme, Várzea e Igapó (SIOLI, 1983; FUGLER, 1986).
Diante do exposto, este estudo objetiva descrever os exemplares depositados na coleção Herpetológica do Laboratório de Pesquisas Zoológicas, das Faculdades Integradas do Tapajós/Faculdade da Amazônia (FIT/UNAMA), com intuito de expor sua procedência e divulgar o acervo para a comunidade.
Materiais e métodos
Para este trabalho foi utilizado o banco de dados da coleção herpetológica, do Laboratório de Pesquisas Zoológicas (LPZ), das Faculdades Integradas do Tapajós/Faculdade da Amazônia (FIT/UNAMA). Verificou-se a natureza, as cidades com maior número de coletas e os anos com maior número de tombamentos de indivíduos na coleção.
Os procedimentos de triagem, morte, fixação, conservação, tombamento, colecionamento e curadoria seguem os descritos em literatura (CARAMASCHI, 1987; COOPER et al., 1989; FRANCO e SALOMÃO, 2002). Após o recebimento, os espécimes passaram pela triagem onde é verificado se todas as informações estão completas. Todos os exemplares foram mortos, fixados em posição anatômica e receberam uma etiqueta de acrônimo LPHA (Linha de Pesquisa em Herpetologia da Amazônia). Em seguida foi realizada a biometria e a identificação. Formulários com os dados dos espécimes foram preenchidos e armazenados em arquivos físicos e digitais. Por fim, os exemplares foram alocados em recipientes de vidro submersos em álcool a 70% com rótulo contendo as informações: Família, Gênero, Espécie, número-tombo, local da coleta, coletor, data e coordenadas geográficas.
Neste trabalho os espécimes foram identificados ao menor nível taxonômico possível e listados apenas aqueles que possuíam dados completos. Não consideramos o nível taxonômico de subespécie.
Resultados
A Coleção possui 3.349 espécimes de Répteis com dados completos, distribuídos em 26 famílias, organizadas de acordo com a abundância de espécimes coligidos, onde as cinco primeiras famílias somadas representam mais de 60% do total de espécimes de répteis (Tabela 1).
Tabela 1: Famílias de Répteis representadas na coleção herpetológica das Faculdades Integradas do Tapajós/Faculdade da Amazônia - FIT/UNAMA.
| Família | Espécimes | (%) |
|---|---|---|
| Dipsadidae | 609 | 18,18 |
| Teiidae | 508 | 15,17 |
| Sphaerodactylidae | 347 | 10,36 |
| Viperidae | 343 | 10,24 |
| Gymnophthalmidae | 257 | 7,67 |
| Colubridae | 248 | 7,41 |
| Dactyloidae | 181 | 5,40 |
| Boidae | 125 | 3,73 |
| Podocnemididae | 115 | 3,43 |
| Amphisbaenidae | 112 | 3,34 |
| Phyllodactylidae | 108 | 3,22 |
| Tropiduridae | 93 | 2,78 |
| Mabuyidae | 73 | 2,18 |
| Elapidae | 53 | 1,58 |
| Alligatoridae | 43 | 1,28 |
| Iguanidae | 36 | 1,07 |
| Gekkonidae | 31 | 0,93 |
| Anilidae | 29 | 0,87 |
| Testudinidae | 14 | 0,42 |
| Typhlopidae | 10 | 0,30 |
| Chelidae | 4 | 0,12 |
| Kinosternidae | 3 | 0,09 |
| Leiosauridae | 3 | 0,09 |
| Geomydidae | 2 | 0,06 |
| Polychrotidae | 1 | 0,03 |
| Leptotyphlopidae | 1 | 0,03 |
| N = | 3.349 | 100 |
As espécies foram distribuídas em 3 grupos: Testudines (quelônios), Squamata (lagartos fossoriais, lagartos e serpentes) e Crocodylia (crocodilianos) e suas respectivas famílias, gêneros e espécies (Tabela 2).
Tabela 2 Lista de espécies de Répteis coligidas na coleção herpetológica das Faculdades Integradas do Tapajós/Faculdade da Amazônia (FIT/UNAMA), Santarém, Pará, Brasil.
| Táxon | Autor & Ano | Registros |
|---|---|---|
| CHELIDAE | 4 | |
| Chelus fimbriata | (Schneider, 1783) | 1 |
| Mesoclemmys gibba | (Schweigger, 1812) | 2 |
| Mesoclemmys nasuta | (Schweigger, 1812) | 1 |
| GEOMYDIDAE | 2 | |
| Rhinoclemmys punctularia | (Daudin, 1801) | 2 |
| KINOSTERNIDAE | 3 | |
| Kinosternon scorpioides | (Linnaeus, 1766) | 3 |
| PODOCNEMIDIDAE | 115 | |
| Peltocephalus dumerilianus | (Schweigger, 1812) | 3 |
| Podocnemis erythrocephala | (Spix, 1824) | 5 |
| Podocnemis expansa | (Schweigger, 1812) | 68 |
| Podocnemis sextuberculata | Cornalia, 1849 | 19 |
| Podocnemis unifilis | Troschel, 1848 | 20 |
| TESTUDINIDAE | 14 | |
| Chelonoidis carbonarius | (Spix, 1824) | 10 |
| Chelonoidis denticulatus | (Linnaeus, 1766) | 4 |
| AMPHISBAENIDAE | 112 | |
| Amphisbaena alba | Linnaeus, 1758 | 18 |
| Amphisbaena brasiliana | (Gray, 1865) | 57 |
| Amphisbaena fuliginosa | Linnaeus, 1758 | 33 |
| Amphisbaena mitchelli | Procter, 1923 | 4 |
| DACTYLOIDAE | 181 | |
| Norops auratus | Daudin, 1802 | 58 |
| Dactyloa philopunctatus | Rodrigues, 1988 | 2 |
| Dactyloa punctata | (Daudin, 1802) | 17 |
| Norops fuscoauratus | (D’orbigny, 1837) | 48 |
| Norops ortonii | (Cope, 1868) | 26 |
| Norops tandai | (Avila-Pires, 1995) | 1 |
| Norops trachyderma | (Cope, 1875) | 29 |
| GEKKONIDAE | 31 | |
| Hemidactylus agrius | Vanzolini, 1978 | 1 |
| Hemidactylus mabouia | (Moreau de Jonnès, 1818) | 30 |
| GYMNOPHTHALMIDAE | 257 | |
| Arthrosaura reticulata | O’Shaughnessy, 1881 | 24 |
| Bachia flavescens | (Bonnaterre, 1789) | 2 |
| Bachia panoplia | Thomas, 1965 | 2 |
| Cercosaura argula | Peters, 1863 | 1 |
| Cercosaura ocellata | Wagler, 1830 | 41 |
| Gymnophthalmus underwoodi | Grant, 1958 | 71 |
| Iphisa elegans | Gray, 1851 | 53 |
| Loxopholis osvaldoi | (Avila-Pires, 1995) | 23 |
| Loxopholis percarinatum | (Müller, 1923) | 4 |
| Neusticurus ecpleopus | Cope, 1875 | 1 |
| Ptychoglossus brevifrontalis | Boulenger, 1912 | 35 |
| IGUANIDAE | 36 | |
| Iguana iguana | (Linnaeus, 1758) | 36 |
| LEIOSAURIDAE | 3 | |
| Enyalius leechii | (Boulenger, 1885) | 3 |
| MABUYIDAE | 73 | |
| Copeoglossum nigropunctatum | (Spix, 1825) | 67 |
| Varzea bistriata | (Spix, 1825) | 6 |
| PHYLLODACTYLIDAE | 108 | |
| Thecadactylus rapicauda | (Houttuyn, 1782) | 108 |
| POLYCHROTIDAE | 1 | |
| Polychrus marmoratus | (Linnaeus, 1758) | 1 |
| SPHAERODACTYLIDAE | 347 | |
| Chatogekko amazonicus | (Andersson, 1918) | 121 |
| Gonatodes humeralis | (Guichenot, 1855) | 225 |
| Lepidoblepharis heyerorum | Vanzolini, 1978 | 1 |
| TEIIDAE | 508 | |
| Ameiva ameiva | (Linnaeus, 1758) | 160 |
| Ameivula ocelifera | (Spix, 1825) | 6 |
| Cnemidophorus cryptus | Cole & Dessauer, 1993 | 10 |
| Cnemidophorus lemniscatus | (Linnaeus, 1758) | 234 |
| Dracena guianensis | Daudin, 1802 | 2 |
| Kentropyx altamazonica | (Cope, 1875) | 11 |
| Kentropyx calcarata | Spix, 1825 | 70 |
| Kentropyx striata | (Daudin, 1802) | 9 |
| Tupinambis teguixin | (Linnaeus, 1758) | 6 |
| TROPIDURIDAE | 93 | |
| Plica plica | (Linnaeus, 1758) | 23 |
| Plica umbra | (Linnaeus, 1758) | 31 |
| Tropidurus hispidus | (Spix, 1825) | 7 |
| Tropidurus oreadicus | Rodrigues, 1987 | 4 |
| Uranoscodon superciliosus | (Linnaeus, 1758) | 28 |
| ANILIIDAE | 29 | |
| Anilius scytale | (Linnaeus, 1758) | 29 |
| BOIDAE | 125 | |
| Boa constrictor | Linnaeus, 1758 | 60 |
| Corallus batesii | (Gray, 1860) | 2 |
| Corallus caninus | (Linnaeus, 1758) | 6 |
| Corallus hortulanus | (Linnaeus, 1758) | 27 |
| Epicrates cenchria | (Linnaeus, 1758) | 8 |
| Eunectes deschauenseei | Dunn & Conant, 1936 | 3 |
| Eunectes murinus | (Linnaeus, 1758) | 19 |
| COLUBRIDAE | 248 | |
| Chironius carinatus | (Linnaeus, 1758) | 7 |
| Chironius exoletus | (Linnaeus, 1758) | 14 |
| Chironius foveatus | Bailey, 1955 | 2 |
| Chironius fuscus | (Linnaeus, 1758) | 2 |
| Chironius multiventris | Schmidt & Walker, 1943 | 1 |
| Chironius quadricarinatus | (Boie, 1827) | 1 |
| Chironius scurrulus | (Wagler, 1824) | 24 |
| Dendrophidium dendrophis | (Schlegel, 1837) | 1 |
| Drymarchon corais | Boie, 1827 | 3 |
| Drymoluber dichrous | (Peters, 1863) | 3 |
| Leptophis ahaetulla | (Linnaeus, 1758) | 25 |
| Mastigodryas bifossatus | (Raddi, 1820) | 2 |
| Mastigodryas boddaerti | (Sentzen, 1796) | 65 |
| Oxybelis aeneus | (Wagler, 1824) | 13 |
| Oxybelis fulgidus | (Daudin, 1803) | 38 |
| Phrynonax poecilonotus | (Günther, 1858) | 5 |
| Rhinobothryum lentiginosum | (Scopoli, 1785) | 3 |
| Spilotes pullatus | Linnaeus, 1758 | 14 |
| Spilotes sulphureus | (Wagler, 1824) | 3 |
| Tantilla melanocephala | (Linnaeus, 1758) | 22 |
| DIPSADIDAE | 609 | |
| Apostolepis quinquelineata | (Peters, 1869) | 2 |
| Atractus snethlageae | Cunha & Nascimento, 1983 | 2 |
| Clelia clelia | (Daudin, 1803) | 1 |
| Clelia plumbea | (Wied-Neuwied, 1820) | 1 |
| Dipsas catesbyi | (Sentzen, 1796) | 22 |
| Dipsas pavonina | Schlegel, 1837 | 2 |
| Drepanoides anomalus | (Jan, 1863) | 1 |
| Erythrolamprus aesculapii | (Linnaeus, 1758) | 19 |
| Erythrolamprus almadensis | (Wagler, 1824) | 1 |
| Erythrolamprus breviceps | (Cope, 1861) | 3 |
| Erythrolamprus cobella | (Linnaeus, 1758) | 3 |
| Erythrolamprus festae | (Peracca, 1897) | 1 |
| Erythrolamprus miliaris | (Linnaeus, 1758) | 8 |
| Erythrolamprus poecilogyrus | (Wied-Neuwied, 1825) | 25 |
| Erythrolamprus reginae | (Linnaeus, 1758) | 43 |
| Erythrolamprus typhlus | (Linnaeus, 1758) | 2 |
| Erythrolamprus viridis | (Günther, 1862) | 1 |
| Helicops angulatus | (Linnaeus, 1758) | 62 |
| Helicops leopardinus | (Schlegel, 1837) | 14 |
| Helicops polylepis | Günther, 1861 | 54 |
| Hydrodynastes bicinctus | (Herrmann, 1804) | 1 |
| Hydrodynastes gigas | (Duméril, Bibron & Duméril, 1854) | 21 |
| Hydrops martii | (Wagler, 1824) | 6 |
| Hydrops triangularis | (Wagler, 1824) | 6 |
| Imantodes cenchoa | Linnaeus, 1758 | 21 |
| Lygophis lineatus | (Linnaeus, 1758) | 2 |
| Oxyrhopus formosus | (Wied-Neuwied, 1820) | 2 |
| Oxyrhopus melanogenys | (Tschudi, 1845) | 14 |
| Oxyrhopus petolarius | (Linnaeus, 1758) | 6 |
| Oxyrhopus trigeminus | Duméril, Bibron & Duméril, 1854 | 2 |
| Philodryas argentea | (Daudin, 1803) | 3 |
| Philodryas olfersii | (Lichtenstein, 1823) | 92 |
| Philodryas viridissimus | (Linnaeus, 1758) | 6 |
| Pseudoboa coronata | Schneider, 1801 | 16 |
| Pseudoboa neuwiedii | (Duméril, Bibron & Duméril, 1854) | 17 |
| Pseudoboa nigra | (Duméril, Bibron & Duméril, 1854) | 12 |
| Pseudoeryx plicatilis | (Linnaeus, 1758) | 54 |
| Sibon nebulata | (Linnaeus, 1758) | 1 |
| Siphlophis cervinus | (Laurenti, 1768) | 8 |
| Siphlophis compressus | (Daudin, 1803) | 6 |
| Siphlophis worontzowi | (Prado, 1940) | 11 |
| Taeniophallus brevirostris | (Peters, 1863) | 1 |
| Taeniophallus brevirostris | (Peters, 1863) | 2 |
| Taeniophallus occipitalis | (Jan, 1863) | 14 |
| Thamnodynastes pallidus | (Linnaeus, 1758) | 4 |
| Xenodon merremi | (Wagler, 1824) | 1 |
| Xenodon rabdocephalus | (Wied-Neuwied, 1824) | 9 |
| Xenodon severus | (Spix, 1825) | 2 |
| Xenopholis scalaris | (Wucherer, 1861) | 2 |
| ELAPIDAE | 53 | |
| Micrurus filiformis | (Günther, 1859) | 7 |
| Micrurus hemprichii | (Jan, 1858) | 18 |
| Micrurus ibiboboca | (Merrem, 1820) | 1 |
| Micrurus lemniscatus | (Linnaeus, 1758) | 8 |
| Micrurus paraensis | (Cunha & Nascimento, 1973) | 2 |
| Micrurus spixii | Wagler, 1824 | 14 |
| Micrurus surinamensis | (Cuvier, 1817) | 3 |
| LEPTOTYPHLOPIDAE | 1 | |
| Siagonodon septemstriatus | (Schneider, 1801) | 1 |
| TYPHLOPIDAE | 10 | |
| Amerotyphlops brongersmianus | (Vanzolini, 1976) | 6 |
| Amerotyphlops reticulatus | (Linnaeus, 1758) | 4 |
| VIPERIDAE | 343 | |
| Bothrops atrox | (Linnaeus, 1758) | 295 |
| Bothrops bilineatus | (Wied-Neuwied, 1821) | 3 |
| Bothrops neuwiedii | Wagler, 1824 | 2 |
| Bothrops taeniatus | Wagler, 1824 | 10 |
| Crotalus durissus | Linnaeus, 1758 | 29 |
| Lachesis muta | (Linnaeus, 1766) | 4 |
| ALLIGATORIDAE | 43 | |
| Caiman crocodilus | (Linnaeus, 1758) | 25 |
| Melanosuchus niger | (Spix, 1825) | 3 |
| Paleosuchus palpebrosus | (Cuvier, 1807) | 14 |
| Paleosuchus trigonatus | (Schneider, 1801) | 1 |
| Total Geral | 3.349 |
As cidades do Pará, Brasil com maior representatividade foram: Santarém (52,07%), Belterra (29,90%), Itaituba (6,48%), Aveiro (2,20%), Oriximiná (2,05%), Monte Alegre (1,14%), Prainha (1,00%), Coreaú (0,71%), Almeirim (0,54%), Tiriós (0,51%). As demais localidades somadas representam (3,4%) (Figura1).

Figura 1 As 10 cidades do Pará, Brasil com maior representatividade de espécimes de Répteis na coleção Herpetológica das Faculdades Integradas do Tapajós/Faculdade da Amazônia - FIT/UNAMA.
Entre os espécimes colecionados, 2% dos registros não tinham informações sobre a natureza da coleta. Os 29% são espécimes oriundos de doações feitas pela população da região e 69% representam espécimes coletados em expedições decorrentes de projetos científicos (Figura 2).
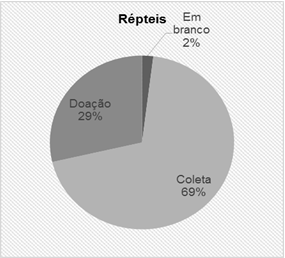
Figura 2 Representação da natureza dos espécimes de répteis depositados na coleção Herpetológica das Faculdades Integradas do Tapajós/Faculdade da Amazônia - FIT/UNAMA, Pará, Brasil.
O período de acúmulo de espécimes de répteis na coleção abrangeu dois momentos importantes, entre os anos de 1999 e 2002 e entre 2006 e 2014 (Figura 3).
Discussão
A coleção Herpetológica da FIT/UNAMA abriga em suas dependências desde de 1999, grande parte da herpetofauna local que por si só é muito diversa (FROTA et al., 2006). A herpetofauna sofreu mudanças significativas após a abertura de fronteira agrícola na região de Santarém, na qual possibilitou a instalação de grandes produtores rurais, causando desmatamentos recordes (COHENCA, 2005) e aumento considerável nas coletas de campo e nas doações.
A cidade de Santarém foi a melhor amostrada, mas observamos um aumento significativo nos últimos anos de espécimes coletados na região de Belterra. Em parte, se devem às coletas realizadas através de projetos oriundos dos convênios institucionais com o Instituto Butantan e PPBio (Programa de Pesquisas em Biodiversidade).
Entre os anos de 1999 e 2002, houve expressiva quantidade de espécimes depositados na coleção por ocasião da criação da coleção herpetológica que passou a receber doações (Figura 3). Nos anos de 2006 a 2014 os dados mostram os resultados dos esforços de coletas cientificas, realizados durante a implementação de projetos de pesquisas na Flona do Tapajós e os Encontros Butantan Amazônia - evento realizado pelo Instituto Butantan em parceria com as instituições de Ensino Superior de Santarém (JORGE, 2006; RIBEIRO, 2012).
Quanto à natureza dos espécimes, registramos 2% dos exemplares que foram doados ou coletados sem que suas informações tivessem sido coligidas. Acredita - se que esses espécimes já estavam na instituição antes da criação da coleção, os quais estavam com seus dados incompletos e passaram a fazer parte da coleção didática.
A alta representatividade da família de serpentes Dipsadidae já era esperada, provavelmente seja reflexo da grande radiação e adaptação deste grupo pelas Américas e algumas ilhas do Caribe (ZAHER et al., 2009; VIDAL et al., 2010; GRAZZIOTIN et al., 2012).
A formação e manutenção de coleções regionais é um procedimento pouco frequente, pois faltam recursos, interesse, tempo, profissionais qualificados e/ou orientação para que se organizem boas coleções. Falta apoio financeiro oriundo de agências de fomento, política em longo prazo de formação e manutenção de coleções no Brasil. A maior parte das coleções brasileiras foi criada através de esforços isolados de um ou alguns pesquisadores e instituições, movidos pela necessidade de criar fontes próprias de consulta e informação (ZAHER e YOUNG, 2003). Logo, a criação e manutenção de coleções científicas regionais é de suma importância, pois nelas se reúnem espécies de diferentes biomas.
A centralização de informações científicas possui pontos positivos - através do rápido acesso e a possibilidade de utilização de informações oriundas dos mais diversos locais - e pontos negativos, quando muitos espécimes coletados deixam de ser conservados por dificuldade de acesso a coleções de outros estados (ZAHER e YOUNG, 2003). Além disso, há problemas de manutenção na infraestrutura das instituições que abrigam as coleções científicas.
Conclusão
A coleção herpetológica da FIT/UNAMA possui acervo com representação de natureza regional, encontra-se informatizada e que apresenta lista das espécies que ocorrem na região Oeste do Pará, comprovando a alta diversidade de espécies e colocando os exemplares à disposição da comunidade. As representatividades temporal, geográfica e taxonômica da coleção atestam sua importância, assim como o incremento constante de seu acervo, faz dela um registro dinâmico dos estudos herpetofaunísticos regionais.















