Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Entomología
Print version ISSN 0120-0488
Rev. Colomb. Entomol. vol.38 no.1 Bogotá Jan./June 2012
Interacciones entre hembras de Protandrena evansi (Hymenoptera: Andrenidae), una abeja de nidificación comunal
Interactions between females of Protandrena evansi (Hymenoptera: Andrenidae), a communal nesting bee
LUIS FLORES-PRADO1, ELIZABETH CHIAPPA2 y MÓNICA MANTE3
1 Doctor en Ciencias. Instituto de Entomología, Universidad Metropolitana de Ciencias de la Educación, Av. José Pedro Alessandri 774, Ñuñoa, Santiago, Chile. luis.flores@umce.cl. Autor para correspondencia.
2 Magíster en Ciencias. Universidad de Playa Ancha, Avenida Playa Ancha 850, Valparaíso, Casilla 34 V, Chile.
3 Profesora de Biología. Facultad de Ciencias, Universidad de Playa Ancha, Avenida Playa Ancha 850, Valparaíso, Casilla 34 V, Chile.
Recibido: 28-jun-2011 - Aceptado: 6-mar-2012
Resumen: Se realizó un estudio de comportamiento en hembras de Protandrena evansi llevado a cabo en Farellones, Región Metropolitana, Chile. Las conductas tolerantes e intolerantes fueron observadas en una arena experimental donde fueron puestas pares de hembras provenientes de un mismo nido (interacción intra-nido) o de nidos diferentes (interacción inter-nido). Las conductas tolerantes y las intolerantes no fueron diferentes entre las hembras del mismo nido y de nidos distintos. En un segundo experimento, fueron evaluadas las respuestas conductuales presentadas por las hembras hacia extractos de compuestos cuticulares provenientes de sus compañeras de nido y de hembras de diferentes nidos. Ambos bioensayos mostraron que las hembras de P. evansi no exhiben un patrón de discriminación conductual entre compañeras de nido y no compañeras de nido. Además, las conductas tolerantes fueron las más frecuentes en ambas interacciones experimentales (intra-nido e inter-nido). Estos resultados sugieren que esta especie tiene una estructura social comunal.
Palabras clave: Comportamiento tolerante. Especie comunal. Hymenoptera. Chile.
Abstract: This paper reports the results of a behavioral study carried out at Farellones, Metropolitan Region, Chile, using females of Protandrena evansi. Tolerant and intolerant behaviors were observed in an experimental arena where pairs of females from the same nest (intra-nest interaction) or from different nest (inter-nest interaction) were placed. Neither tolerant nor intolerant behaviors were different between intra-nest and inter-nest females. In a second experiment the behavioral responses performed by females towards cuticular extracts from nestmate and from non-nestmate females were evaluated. Both bioassays showed that P. evansi females do not exhibit a discriminative behavioral pattern between nestmate and non-nestmate females. Additionally, tolerant behaviors were the most frequent in both experimental interactions (intra and inter-nest interactions). These results suggest that this species has a communal social structure.
Key words: Tolerant behaviour. Communal species. Hymenoptera. Chile.
Introducción
Las especies de Hymenoptera pueden ser categorizadas en distintos niveles de sociabilidad, desde la ausencia de tal fenómeno (vida solitaria), hasta la presencia del nivel más avanzado de sociabilidad (eusociablidad), los cuales están asociados, en términos generales, con un sistema de nidificación particular (Michener 1969, 1974, 2007). Es así como en especies solitarias las hembras construyen su nido sin la presencia de otras hembras, ovipositan, lo aprovisionan y cada individuo se desarrolla dentro de celdas aislado de sus hermanos y de su madre. En las especies comunales, las hembras comparten un sustrato de nidificación y, aunque los nidos son independientes, puede existir contacto entre las hembras que los construyen y aprovisionan. En especies eusociales, aún cuando existe división de labores, varias hembras obreras participan en el proceso de construcción del nido, aprovisionando constantemente a los individuos inmaduros, de modo que existe contacto permanente entre éstos y las obreras, y entre las hembras obreras (Michener 1969, 1974).
Dada la biología de la nidificación característica de los diferentes niveles sociales, se espera que los patrones de comportamiento agonístico, como las conductas intolerantes o de evitación, y tolerante varíen entre las especies dependiendo de su grado de sociabilidad. En tal sentido, un rasgo distintivo de las especies eusociales de Hymenoptera, es la capacidad de reconocimiento de hembras compañeras y no compañeras de nido, lo cual es evidenciado conductualmente por la tendencia a discriminar entre hembras que provienen del mismo nido y hembras provenientes de otros nidos (Breed 1998; Boulay y Lenoir 2001). Al respecto, en especies eusociales de abejas, las hembras que interaccionan conductualmente en la entrada de sus nidos, o en ensayos en laboratorio, son más agresivas entre sí cuando provienen de nidos distintos, en comparación a cuando son de un mismo nido (Breed 1983; Inoue et al. 1999; Beekman et al. 2002). Por el contrario, las especies solitarias de abejas no presentan tal patrón de discriminación conductual; habitualmente son intolerantes hacia conespecíficos del mismo sexo (Hólldobler y Michener 1980; Kukuk 1992; Field 1992; Packer 2000). Las especies comunales no exhibirían ninguno de los dos patrones, debido a que son habitualmente tolerantes entre conspecíficos, independiente del nido de procedencia (Danforth 1991; Kukuk 1992).
La capacidad de reconocimiento y discriminación conductual, entre compañeras y no compañeras de nido, está mediada por compuestos cuticulares que pueden tener un origen endógeno (producidos por el individuo) o exógeno (adquiridos desde el ambiente) (Smith y Breed 1995). La gran mayoría de los estudios efectuados respecto de tales estímulos químicos se han efectuado en especies eusociales, o con cierto grado de sociabilidad, (ver revisión en Hólldobler y Michener 1980; Howard y Blomquist 1982; Getz 1991; Jaisson 1991; Smith y Breed 1995; Singer 1998; Howard y Blomquist 2005), pero no en especies solitarias ni comunales. Una excepción corresponde a los estudios efectuados en Manuelia postica (Spinola) (Apidae, Xylocopinae), una especie de abeja solitaria en la que existe evidencia de reconocimiento entre hembras compañeras de nido en un contexto natural (Flores-Prado et al. 2008a) y experimental, mediado por hidrocarburos cuticulares (Flores-Prado et al. 2008b), los cuales bien podrían estar involucrados en la capacidad de reconocimiento de parentesco exhibida por las hembras (Flores-Prado y Niemeyer 2010). Los descubrimientos efectuados en Manuelia (Vachal) han llevado a preguntarnos si en especies de abejas no eusociales (solitarias y/o comunales), las hembras poseen la capacidad de reconocimiento y discriminación conductual, tal como se ha demostrado en especies eusociales, y si el reconocimiento entre hembras provenientes de un mismo nido podría estar relacionado con la posibilidad de contacto entre los individuos dentro de los nidos.
Protandrena evansi (Ruz y Chiappa, 2004) (Andrenidae, Panurginae) es una especie de abeja no eusocial cuyos nidos, cuando menos en la primera parte de su estructura, son ocupados comunitariamente por las hembras. Las abejas comparten el nido aunque cada una construye las celdas en forma independiente. Existe tolerancia entre ellas y no exhiben conductas agonísticas. Este hecho es demostrativo de una etapa de sociabilidad temprana, que implicaría el reconocimiento e identificación de los individuos del mismo nido (Chiappa et al. 2005). Así, el sistema de nidificación de P. evansi es comunal (Chiappa y Castro 2006). Los nidos son excavados en el suelo, con túneles ramificados que terminan en celdas independientes entre sí, lo cual sugiere que las hembras de P. evansi, tienen una vida solitaria dentro de las celdas (Chiappa y Castro 2006). En este contexto, resulta interesante explorar la capacidad de reconocimiento y discriminación conductual de P. evansi cuya nidificación puede ser considerada comunal, dado que un grupo de hembras nidifica en un mismo sustrato, aunque cada una construye en forma independiente las celdas donde se desarrolla su progenie, lo cual es característico de especies solitarias. Por lo tanto, las hembras de P. evansi podrían exhibir el patrón de comportamiento agonístico característico de las especies solitarias o de las especies comunales.
Este trabajo tiene como objetivo general conocer si existe reconocimiento entre hembras de P. evansi, lo cual fue evaluado por medio de bioensayos en los que se registró la respuesta conductual de hembras provenientes del mismo nido y de nidos diferentes. Además se exploró una asociación de las respuestas conductuales de hembras compañeras de nido y no compañeras de nido, con estímulos químicos provenientes de tales hembras. Ambos bioensayos fueron efectuados en el ambiente natural donde se localizan los nidos de P. evansi.
Materiales y Métodos
El estudio fue realizado en un área de nidificación de P. evansi, ubicada en Farellones, Región Metropolitana, Chile central 33°2'71"S 70°18'13"W, 2.300 msnm en la Cordillera de Los Andes. Más detalles sobre la zona se encuentran en Chiappa et al. (2005) y en Chiappa y Castro (2006).
Bioensayo de reconocimiento y discriminación conductual entre compañeras de nido y no compañeras de nido.
Se adaptó un sistema experimental (Kukuk 1992; Pabalan et al. 2000; Grixti et al. 2004; Flores-Prado et al. 2008b) con el propósito de cuantificar las conductas de tolerancia y agresividad desarrolladas entre pares de hembras de P. evansi. Se montó una arena de observación consistente de una manguera de silicona transparente, de 20 cm de longitud y 5 mm de diámetro. En ambos extremos de la manguera se introdujeron simultáneamente dos hembras del mismo nido (tratamiento intranido) y dos hembras de diferente nido (tratamiento internido) (Fig. 1A). Los extremos de las mangueras se unieron con un trozo de tubo de silicona para formar un círculo. Las mangueras se eliminaron una vez utilizadas para evitar la contaminación que podían provocar los aromas de las hembras.
La colección de las abejas se efectuó en la salida de cada sistema de nidificación (o nido) por medio de una trampa que consistió en un cono de un género transparente (visillo). Cada trampa fue utilizada en un solo nido. Una vez que una abeja ingresaba a la trampa se retiraba con pinzas entomológicas las cuales se lavaban con pentano previo a cada colecta, y se mantenía en un frasco de vidrio, a temperatura ambiente y en oscuridad. Cada frasco de vidrio fue previamente lavado con detergente neutro y secado en horno a 140°C, en el laboratorio, y fue utilizado sólo una vez durante el experimento. Mientras un investigador colectaba abejas, otros dos efectuaban las manipulaciones experimentales.
En febrero del año 2009 se llevó a cabo una experiencia preliminar, consistente de cinco repeticiones intranido y cinco internido, con el objeto de poner a prueba la metodología, cuyos datos no se incluyeron en los análisis. En febrero de 2010, se realizaron quince repeticiones intranido y quince repeticiones internido, cuyos datos obtenidos fueron analizados para este estudio.
Cada interacción (o repetición) duró 20 minutos y el registro de conductas fue discontinuo, cada un minuto, de modo que por cada interacción se obtuvo un total de veinte conductas. Las conductas fueron definidas de acuerdo con observaciones efectuadas en estudios experimentales efectuados en diversas especies de Apoidea (Brothers y Michener 1974; Breed et al. 1979; Kukuk 1980, 1992, Buckle 1982; Packer 1986; Mason 1988; Smith y Weller 1989, Wcislo y Danforth 1997; McConnell y Kukuk 1997; Pabalan et al. 2000; Packer 2000; Flores-Prado et al. 2008b).
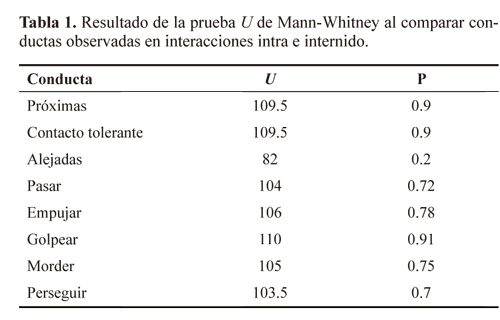
Las conductas intolerantes registradas fueron las siguientes: Golpear; una hembra toca a otra con la cabeza o con las patas. Empujar; una hembra empuja a otra con el extremo terminal de su abdomen. Morder; una hembra muerde con sus mandíbulas generalmente el cuello, alas, antenas u otra parte del cuerpo de otra hembra. Alejarse; una hembra se aleja o permanece alejada más de dos longitudes corporales cuando la otra hembra se acerca (evitan interacción). Perseguir; una hembra camina detrás de la otra, sin llegar a producirse contacto físico (evitan interacción). Las conductas tolerantes correspondieron a las siguientes: Próximas; las hembras permanecen a menos de dos longitudes corporales, pero no en contacto físico. Contacto tolerante; las hembras se encuentran en contacto físico sin que se registre ninguna de las conductas intolerantes descritas anteriormente. Pasar; una o ambas hembras se desplazan en sentido opuesto contactando ambas regiones ventrales.
Se registró además la temperatura ambiente y la humedad relativa al comienzo y al finalizar cada interacción del bioensayo de reconocimiento y discriminación conductual, entre compañeras de nido y no compañeras de nido, las cuales fueron promediadas para obtener un valor de cada variable por interacción. Se midió la longitud alar anterior, desde el punto de inserción del ala en el pronoto hasta el ápice alar, con el objeto de tener un estimador del tamaño corporal de cada hembra (Smith y Weller 1989; Hogendoorn y Leys 1993).
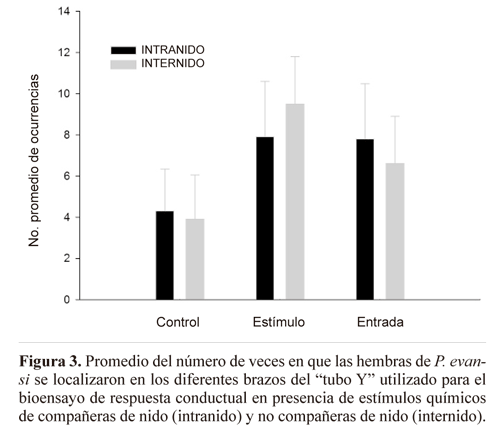
Bioensayo de respuestas conductuales de las hembras en presencia de estímulos químicos de compañeras y no compañeras de nido. En febrero de 2010 se colectaron parejas de hembras del mismo nido (N = 15) y parejas de hembras de distinto nido (N = 15), utilizando el mismo procedimiento de captura descrito previamente, para efectuar bioensayos de respuesta conductual de una hembra frente a estímulos químicos provenientes de otra hembra, adaptando los procedimientos de Flores-Prado et al. (2008b). Los extractos cuticulares de una hembra de cada pareja se obtuvieron al introducir la abeja en un frasco de vidrio donde se agregó 150 ml de pentano (P.A.) para cubrir su cuerpo por completo. Transcurridos 20 minutos, se retiró a la hembra del frasco y el extracto que quedó se retiró con una jeringa Hamilton® y fue utilizado para impregnar un tapón de algodón que fue colocado en un brazo del "tubo Y". En el extremo del brazo opuesto, se ubicó un tapón de algodón con pentano puro, que representó el "brazo control". En el tubo central, o brazo de ingreso, se puso una hembra recién colectada y luego un tapón de algodón, sin ningún líquido, para encerrarla (Fig. 1B). Para el tratamiento intranido, se puso un tapón de algodón con extracto de una hembra del mismo nido. En el tratamiento internido se utilizó el extracto de una hembra de distinto nido al de la hembra puesta en el brazo de ingreso. Se utilizó en total 60 hembras para realizar todas las repeticiones. Tanto los "tubos Y" como los frascos utilizados para efectuar las extracciones de compuestos cuticulares, fueron lavados con detergente neutro y secados en horno a 140°C, en el laboratorio, antes de comenzar el experimento en terreno. Al finalizar cada interacción se eliminaron los tubos y los tapones de algodón. Las jeringas se limpiaron con pentano previamente a cada interacción. En ambos tratamientos (intranido e internido) se registró la posición que ocupaba la abeja en uno de los tres brazos del "tubo Y" durante 20 minutos, cada un minuto.
Análisis estadístico. Se efectuaron pruebas de normalidad y homocedasticidad, para seleccionar las pruebas estadísticas a utilizar (Siegel y Castellan 1988; Sokal y Rohlf 1995). El conjunto de conductas tolerantes, y también el total de conductas intolerantes, resultantes del bioensayo de reconocimiento y discriminación conductual entre compañeras y no compañeras de nido, mostraron distribución normal y homogeneidad de varianza. Se usaron pruebas ANDEVA (análisis de varianza) para comparar conductas tolerantes e intolerantes entre interacciones intra e internido. Debido a que cada una de las conductas particulares, tolerantes e intolerantes, no mostraron distribución normal ni homocedasticidad, se empleó la prueba U de Mann-Whitney para efectuar comparaciones entre interacciones intra e internido. Se aplicó la prueba de correlación de Spearman para correlacionar tanto las conductas tolerantes como las intolerantes, con: i) la temperatura promedio registrada en cada interacción, ii) la humedad relativa promedio registrada en cada interacción, y iii) las diferencias entre la longitud alar de los pares de hembras utilizadas en cada interacción. Debido a que los datos obtenidos del bioensayo de respuesta conductual de las hembras en presencia de estímulos químicos de compañeras y no compañeras de nido, no mostraron distribución normal, se utilizaron pruebas de U de Mann-Whitney para efectuar comparaciones, entre los tratamientos intra e internido, del número de veces en que las abejas ocuparon las diferentes posiciones dentro del tubo de observación.
Resultados
No existe diferencia significativa entre las interacciones intra e internido en las conductas tolerantes (F1,28= 0.148; P = 0.70) e intolerantes (F1,28= 0.148; P = 0.70) (Fig. 2) de las compañeras de nido y no compañeras de nido. Al comparar las conductas tolerantes por separado (próximas, contacto tolerante y pasar), entre interacciones intra e internido, no se encontraron diferencias significativas (Tabla 1). Tampoco se obtuvieron diferencias al comparar las conductas intolerantes por separado (alejarse, empujar, golpear, morder y perseguir) entre interacciones intra e internido (Tabla 1). Como se observa en la tabla 2, la frecuencia de comportamiento tolerante e intolerante de las hembras no está asociado con el tamaño de las alas, ni con las variables abióticas (Temperatura y Humedad Relativa) registradas en el área de estudio.
Con respecto a los resultados del bioensayo de respuesta conductual de las hembras en presencia de estímulos químicos de compañeras de nido y no compañeras de nido, no hubo diferencia significativa entre interacciones intra e internido, en cuanto al número de veces en que las hembras se dirigen hacia el brazo control (U = 45.5; P = 0.73), hacia el brazo estímulo con extracto cuticular (U = 42.5; P = 0.57), o permanecen en el tubo de entrada (U = 48.5; P = 0.9) (Fig. 3).
Discusión
La nidificación en las distintas especies de abejas es muy variable pues está estrechamente asociada con su nivel de sociabilidad. Tradicionalmente, y dado su sistema de nidificación, las especies solitarias muestran altos grados de agresividad, pues sus nidos están aislados de otras hembras, y deben cuidarlos de posibles usurpadores (Breed 1998). Sin embargo, existen excepciones, como en M. postica, en que las hembras muestran un patrón de comportamiento agonístico similar al de las especies eusociales (Flores-Prado et al. 2008a,b). Las hembras de especies eusociales presentan mayor agresividad hacia no compañeras de nido, que hacia compañeras de nido, con las cuales son más tolerantes. Este patrón de reconocimiento y discriminación conductual está estrechamente vinculado con el sistema de nidificación; las hembras interactúan tolerantemente dentro de la colmena, ya sea entre obreras, y entre reinas y obreras. Dicho patrón de discriminación conductual permite el mantenimiento de la estructura y jerarquía social de una colonia (Hólldobler y Michener 1980; Hólldobler y Wilson 1990; Crozier y Pamilo 1996), reduce la endogamia entre parientes (Pusey y Wolf 1996) o permite un balance entre la endogamia y la exogamia, y posibilita el nepotismo o conductas favorables hacia parientes cercanos (Keller 1997). A diferencia de las anteriores, las abejas comunales comparten un sustrato de nidificación, es decir, elaboran un nido en común en que cada abeja construye su propia celda y de forma individual la aprovisiona (Michener 1974). Además, no poseen jerarquía en su estructura social, predominando el trabajo individual dirigido a la reproducción (Brothers y Michener 1974) y, aunque las hembras construyen y cuidan su propio nido, cada hembra debe interactuar con otra para acceder al sistema de nidificación común. Por esta razón, es frecuente que los niveles de tolerancia sean mayores en especies comunales de abejas.
Frente a lo anterior, en nidos comunales de Eulaema nigrita (Lepeletier, 1841) (Apidae), se ha evidenciado que las hembras son mutuamente tolerantes y sólo exhiben conductas agresivas cuando una hembra invade una celda de otra hembra (Pereira-Martins 1991). Observaciones efectuadas dentro de nidos de Perdita portalis (Timberlake, 1954), una especie comunal de la familia Andrenidae, sugieren que los individuos son tolerantes entre sí y exhiben bajo nivel de agresividad (Danforth 1991). Esta misma tendencia se presenta en hembras reproductivamente activas de Lasioglos-sum hemichalceum (Cockerell, 1923), una especie comunal de la familia Halictidae, sometidas a un experimento similar al efectuado en este estudio (Kukuk 1992). En hembras reproductivamente activas de Andrena scotica (Perkins, 1916) y Panurgus calcaratus (Scopoli, 1763) (Andrenidae), dos especies comunales que han sido sometidas al mismo tipo de experimento efectuado en este estudio, no se registró discriminación conductual entre conespecíficos (Paxton et al. 1999), toda vez que en ambas especies las hembras no mostraron un comportamiento diferencial, tolerante o intolerante, hacia compañeras de nido en comparación con no compañeras de nido. Adicionalmente, las hembras de P. calcaratus mostraron un comportamiento altamente cooperativo o tolerante, similar al evidenciado en L. hemichalceum (Kukuk 1992) y, aunque las hembras de A. scotica desplegaron menores niveles de cooperación, en ambas especies los grados de agresividad entre las hembras son muy bajos (Paxton et al. 1999), patrón que coincide con los resultados de este trabajo para P. evansi. Por otra parte, por medio del análisis de microsatélites se ha determinado un bajo nivel de parentesco entre las hembras compañeras de nido de Andrena jacobi (Perkins, 1921), una especie comunal de Andrenidae, lo cual ha permitido proponer que existe amplia tolerancia en abejas pertenecientes a especies comunales hacia compañeras de nido que no son parientes (Paxton et al. 1996).
En cuanto a los antecedentes de las especies nativas de Andrenidae filogenéticamente cercanas a P. evansi, se han llevado a cabo muy pocos trabajos sobre la biología de nidificación de especies de Panurginae en territorio chileno (Rozen, 1966, 1989; Ruz y Rozen 1993), ninguno de los cuales ha descrito conductas de nidificación comunal en esta subfamilia, aún cuando se han reconocido muchos casos de este tipo de comportamiento en las tribus Perditini, Melitturgini y Panurgini (Custer 1928; Michener 1963, 2007). En P. evansi la dualidad entre vida solitaria y comunal podría reflejarse en su patrón de comportamiento agonístico, como el descrito previamente en especies solitarias o comunales. De acuerdo con los resultados de este estudio, las hembras exhiben altos grados de tolerancia y no existe discriminación conductual, lo que coincide con las especies categorizadas como comunales. En consecuencia, los patrones de nidificación y conductuales que se presentan entre hembras de P. evansi sometidas a integrado de sociabilidad de éstas. Al respecto podemos afirmar que esta especie tiene una estructura social de tipo comunal. Adicionalmente, los niveles de comportamiento agonístico de las hembras no son atribuibles a su tamaño corporal estimado a partir de la longitud de las alas, ni a las características abióticas existentes en el área de nidificación, pues no existe asociación entre las conductas tolerantes o intolerantes de las hembras, el tamaño de sus alas y las condiciones abióticas del lugar de estudio.
En un nido comunal coexisten hembras activas reproductivamente, las que han construido su nido, o están en etapa de construcción, por lo cual ingresan frecuentemente con polen, por lo que es muy probable que se produzca un intercambio de compuestos químicos entre las hembras dentro de los nidos. Estos compuestos podrían representar señales y patrones del fenotipo que posibilitarían el reconocimiento en situaciones posteriores, como por ejemplo en los experimentos en los que se confrontan dos o más hembras. Al respecto, se ha observado que las hembras de L. hemichalceum pueden moverse de nido en nido en la naturaleza (Abrams y Eickwort 1981). Estos antecedentes permiten hipotetizar que en hembras de nidos comunales se produce reconocimiento entre conespecíficos mediado por el intercambio de compuestos químicos, aún cuando no se evidencie discriminación conductual.
En este sentido, al igual que muchas especies de Panurginae, P. evansi es oligoléctica (Munster-Swendsen 1968; Tengö et al. 1988; Michener 2007). La nidificación previamente estudiada mostró una asociación estrecha con una población de Senecio polygaloides Phil. (Asteraceae, Compositae), planta endémica de Los Andes, cuya distribución se extiende desde el Aconcagua hasta Talca en la zona central de Chile (Hoffmann et al. 1998). La fuerte asociación entre P. evansi y S. polygaloides se caracteriza porque dicha especie vegetal representa el principal recurso donde las abejas forrajean. Es posible que las hembras de P. evansi no se reconozcan por los compuestos químicos de origen endógeno presentes en su cutícula. Dado lo reducido del lugar donde nidifican, las hembras están constantemente en contacto y reconocerían los olores presentes en la agregación de nidos provenientes desde los aromas de las flores que visitan para forrajear, como ha sido documentado en otras especies de abejas (Breed et al. 1988). Estos datos explicarían la ausencia de preferencia exhibida por las hembras hacia extractos cuticulares de compañeras de nido, lo cual fue reflejado por la igualdad de respuestas en el bioensayo de reconocimiento químico, entre interacciones intra e internido.
En consecuencia concluimos que, i) P. evansi es una especie comunal, dado su sistema de nidificación y patrón de comportamiento exhibido en interacciones entre pares de hembras, y ii) en especies con nidificación comunal como en P. evansi, el ambiente social en el que se desenvuelven las hembras constituye un factor fundamental en la ausencia de discriminación conductual agonística y tolerante, observada entre abejas de un mismo nido y de nidos distintos.
Agradecimientos
Agradecemos a los dos jurados anónimos por sus valiosos comentarios y sugerencias. A la Dirección General de Investigaciones de la Universidad de Playa Ancha, proyecto CNEI 0409. Al Proyecto Fondecyt de Inserción 79100013.
Literatura citada
ABRAMS, J.; EICKWORT, G. C. 1981. Nest switching and guarding by the communal sweat bee Aapostemon virescens (Hymenoptera: Halictidae). Insectes Sociaux 28: 105-116. [ Links ]
BEEKMAN, M.; WOSSLER, T.; MARTIN, S.; RATNIEKS, F. 2002. Parasitic Cape honey bee workers(Apis mellifera capensis) are not given differential treatment by African guards (A. m. scutellata). Insectes Sociaux 49: 216-220. [ Links ]
BOULAY. R.; LENOIR, A. 2001. Social isolation of mature workers affects nestmate recognition in the ant Camponotus fellah. Behaviour Process 55: 67-73. [ Links ]
BREED, M. D. 1983. Nestmate recognition in honeybees. Animal Behaviour 31: 86-91. [ Links ]
BREED, M. D. 1998. Recognition pheromones of the honey bee. The chemistry of nestmate recognition. BioScience 48: 463470. [ Links ]
BREED, M.; SILVERMAN, J.; BELL, W. 1979. Agonistic Behavior, Social Interactions, and Behavioral Specialization in a Primitively Eusocial Bee. Insectes Sociaux 25: 351-364. [ Links ]
BREED, M. D. FEWELL, J. H.; WILLIAMS, K. R. 1988. Comb wax mediates the acquisition of nestmate recognition cues in honey bees. Proceedings of the National. Academy of Sciences U.S.A. 85: 8766-8769. [ Links ]
BROTHERS, D. J.; MICHENER, C. D. 1974. Interactions in colonies of primitively social bees. Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology 90 (2): 129-168. [ Links ]
BUCKLE, G. R. 1982. Queen-Worker Behavior and Nesmate Interactions in Young Colonies of Lasioglossum zephyrum. Insectes Sociaux 29: 125-137. [ Links ]
CHIAPPA, E.; RUZ, L.; GARCÍA, V. 2005. Biología de machos de Protandrena evansi Ruz y Chiappa (Hymenoptera: Andrenidae) (Farellones, Región Metropolitana, Chile). Acta Entomológica Chilena 29: 15-22. [ Links ]
CHIAPPA, E.; CASTRO, R. 2006. Comportamiento de nidificación comunal y de abastecimiento de Protandena evansi Ruz y Chiappa (Hymenoptera: Andrenidae: Panurginae) en Farellones, Región Metropolitana, Chile. Acta Entomológica Chilena 31: 7-14. [ Links ]
CROZIER, R. H.; PAMILO, P. 1996. Evolution of social insect colonies. Oxford University Press. 306 p. [ Links ]
CUSTER, C. P. 1928. The bee that works in stone: Perdita opuntiae Cockerell. Psyche 35: 67-83. [ Links ]
DANFORTH, B. N. 1991. Female foraging and intranest behavior of a communal bee, Perdita portalis (Hymenoptera: Andrenidae). Annals of the Entomological Society of America 84: 537548. [ Links ]
FIELD, J. 1992. Intraespecific parasitism as an alternative reproductive tactic in nest-building wasp and bees. Biological Reviews 67: 79-126. [ Links ]
FLORES-PRADO, L.; CHIAPPA, E.; NIEMEYER, H. M. 2008a. Nesting biology, life cycle, and interactions between females of Manuelia postica, a solitary species of the Xylocopinae (Hymenoptera: Apidae). New Zealand Journal of Zoology 35: 93-102. [ Links ]
FLORES-PRADO, L.; AGUILERA, D.; NIEMEYER, H. M. 2008b. Nest-mate recognition in Manuelia postica (Apidae: Xylocopinae): an eusocial trait is present in a solitary bee. Proceedings of the Royal Society, B. 275: 285-291. [ Links ]
FLORES-PRADO, L.; NIEMEYER, H. M. 2010. Kin Recognition in the largely solitary bee, Manuelia postica (Apidae: Xylocopinae). Ethology 116: 466-471. [ Links ]
GETZ, W. M. 1991. The honey bee as model kin recognition system. pp. 358-412. In: Hepper, G. P. (Ed.). King recognition. Cambridge University Press. Cambridge. 457 p. [ Links ]
GRIXTI, J., ZAYED, A.; PACKER, L. 2004. Behavorial interactions among females of Acamptopoeum submetallicum (Spinola) and Nolanomelissa toroi Rozen (Hymemoptera: Andrenidae). Journal of Hymenoptera Research 13: 48-56. [ Links ]
HOFFMANN, A.; ARROYO, M.; LIBERONA, F.; MUÑOZ, M..; WATSON, J. 1998. Plantas altoandinas en la flora silvestre de Chile. Ediciones Fundación Claudio Gay, Santiago de Chile.281 p. [ Links ]
HOGENDOORN, K.; LEYS, R. 1993. The superseded female's dilemma: factors that influence guarding behaviour of the carpenter beeXylocopapubescens. Behavioral Ecology and Sociobiology 33: 371-381. [ Links ]
HÖLLDOBLER, B.; MICHENER, C. 1980. Mechanisms of identification and discrimination in social Hymenoptera. pp. 35-58. In: Markl, H. (Ed.). Evolution of social behavior: Hypotheses and empirical tests. Weinheim: Verlag Chemie. [ Links ]
HÖLLDOBLER, B.; WILSON, E. O. 1990. The Ants. Harvard University Press, Cambridge. 548 p. [ Links ]
HOWARD, R. W.; BLOMQUIST, G.J. 1982. Chemical ecology and biochemistry of insect hydrocarbons. Annual Review of Entomology 27: 149-172. [ Links ]
HOWARD, R. W.; BLOMQUIST, G.J. 2005. Ecological, behavioural and biochemical aspects of insect hydrocarbons. Annual Review of Entomology 50: 371-393. [ Links ]
INOUE, T.; ROUBIK, D. W.; SUKA, T. 1999. Nestmate recognition in the stingless bee Melipona panamica (Apidae, Meliponini). Insectes Sociaux 46: 208-218. [ Links ]
JAISSON, P. 1991. Kinship and fellowship in ants and social wasps, pp. 61-93. In: Hepper, G. P. (Ed.). King recognition. Cambridge University Press. Cambridge. 457 p. [ Links ]
KELLER, L. 1997. Indiscriminate altruism: unduly nice parents and siblings. Trends in Ecology and Evolution 12: 99-103. [ Links ]
KUKUK, P. 1980. Diurnal Activity of a Primitively Eusocial Bee, Lasioglossum zephyrum, within the Nest. Journal of the Kansas Entomological Society 53 (1): 149-156. [ Links ]
KUKUK, P. 1992. Social interactions and familiarity in a communal Halictine bee Lasioglossum (Chilalictus) hemichalceum. Ethology 91: 291: 300. [ Links ]
McCONNELL-GARNER J.; KUKUK, P. F. 1997. Behavioral Interactions of two solitary Halictine bees with comparisons among solitary, communal and eusocial species. Ethology 103: 19-32. [ Links ]
MASON, C. A. 1988. Division of labor and adult interactions in eusocial colonies of two allodapines bee species (Hymenoptera: Anthophoridae). Journal of the Kansas Entomological Society 61: 477-491. [ Links ]
MICHENER, C. D. 1963. Observations on bionomics of a colonial bee of the genus Perdita (Hymenoptera: Apoidea: Panurginae). Journal of the Kansas Entomological Society 36: 114-118. [ Links ]
MICHENER, C. D. 1969. Comparative social behavior of bees. Annual Review of Entomology 14: 299-342. [ Links ]
MICHENER, C. D. 1974. The social behavior of the bees. A comparative study. Harvard Univ. Press. Cambridge, M.A. 404 p. [ Links ]
MICHENER, C. D. 2007. The Bees of the world. Johns Hopkins University Press, Baltimore, Maryland. 953 p. [ Links ]
MUNSTER-SWENDSEN, M. 1968. On the biology of the solitary bee Panurgus bankasianus Kirby (Hymenoptera: Apidae), including some ecological aspects. Arsskrift Kongelige Veterinaer Og Landbohojskole 51: 215-241. [ Links ]
PABALAN, N.; DAVEY, G.; PACKER, L. 2000. Escalation of Aggressive Interactions During Staged Encounters in Halictus ligatus Say (Hymenoptera: Halictidae), with a Comparison of Circle Tube Behaviors with Others Halictine Species. Journal of Insect Behavior 13: 627-650. [ Links ]
PACKER. L. 1986. Multiple-foundress associations in a temperate population of Halictus ligatus (Hymenoptera; Halictidae). Canadian Journal of Zoology 64: 2325-2332. [ Links ]
PACKER, L. 2000. The Biology of Trincohalictus prognathus (Perez) (Hymenoptera: Halictidae: Halictini). Journal of Hymenoptera Research 9: 53-61. [ Links ]
PAXTON, R. J.; THOREN, P. A.; TENGÖ, J.; ESTOUP, A.; PAMILIO, P. 1996. Mating structure and nestmate relatedness in a communal bee, Andrena jacobi (Hymenoptera: Andrenidae), using microsatellites. Molecular Ecology 5: 511-519. [ Links ]
PAXTON, R. J.; KUKUK, P. F.; TENGÖ, J. 1999. Effects of familiarity and nestmate number on social interactions in two communal bees, Andrena scotica and Panurgus calcaratus (Hymenoptera, Andrenidae). Insectes Sociaux 46: 109-118. [ Links ]
PEREIRA-MARTINS, S. R. 1991. Biología de Eulema nigrita. 2. Atividades nidais. Papéis Avulsos de Zoología 37: 237-243. [ Links ]
PUSEY, A. E.; WOLF, M. 1996. Inbreeding avoidance in animals. Trends in Ecology and Evolution 11: 201-206. [ Links ]
ROZEN, J. 1966. Systematics of the larvae of North American panurgine bees (Hymenoptera: Apoidea). American Museum Novitates 2259: 1-22. [ Links ]
ROZEN, J. G. 1989. Life history studies of the "primitive" panurgine bees (Hymenoptera: Andrenidae: Panurginae). American Museum Novitates 2692: 1-27. [ Links ]
RUZ, L.; ROZEN, J., JR. 1993. South American Panurginae bees (Apoidea: Andrenidae: Panurginae), part I. Biology, mature larva, and description of a new genus and species. American Museum Novitates 3057: 1-12. [ Links ]
SIEGEL, S.; CASTELLAN, JR. N.J. 1988. Nonparametric statistics for the behavioral sciences, 2a Ed. McGraw-Hill International Editions. 399 p. [ Links ]
SINGER, T. L. 1998. Roles of hydrocarbons in the recognition systems of insects. American Zoologist 38: 394-405. [ Links ]
SMITH, B.; WELLER, C. 1989. Social competition among gynes in Halictine bees: The influence of bee size and pheromones on behavior. Journal of Insect Behavior 2: 397-411. [ Links ]
SMITH, B. H.; BREED M. D. 1995. The Chemical Basis for Nestmate Recognition and Mate Discrimination in Social Insect, pp. 387-317. In: Carde, R. T.; Bell, W. J. (Eds.). Chemical Ecology of Insects 2, Chapman y Hall, New York. 433 p. [ Links ]
SOKAL, R. R.; ROHLF, F. J. 1995. Biometry. The principles and practice of statistics in biological research. 3a Ed. W.H. Freeman and company, New York. 887 p. [ Links ]
TENGÖ, J. J.; ERICKSON, A. K.; BORG-KARLSON, B. H.; SMITH H. D. 1988. Mate-locating strategies and multimodal communication in male mating behavior of Panurgus bankasianus and P. calcaratus (Apoidea, Andrenidae). Journal of the Kansas Entomological Society 61: 388-395. [ Links ]
WCISLO, W.; DANFORTH, B. 1997. Secondarily solitary: the evolutionary loss of social behavior. Trends in Ecology and Evolution 12: 468-474. [ Links ]