Introducción
Colombia es uno de los cinco países con mayor producción de aguacate Persea americana Mill. (Lauraceae) en el mundo (Faostat 2017). En la actualidad el país cuenta con un área establecida de 55.777 ha, una producción estimada de 544.993 t.año-1 y un rendimiento aproximado de 9,77 t.ha-1 (Agronet 2019). Estas áreas de producción están distribuidas en 26 departamentos, con Antioquia, Bolívar, Caldas, Huila, Quindío, Risaralda, Santander, Tolima y Valle del Cauca que aportan más del 80 % de la producción nacional (Agronet 2019).
La producción de aguacate en el Caribe colombiano se estima en 49.503 t.año-1 con un área de cultivo aproximada de 5.904 ha (Agronet 2019). Esta producción está concentrada básicamente en los núcleos o regiones productoras de Montes de María, Sierra Nevada de Santa Marta y Serranía del Perijá (Bernal y Díaz 2013; Burbano-Figueroa et al. 2020). Los sistemas de producción en estas regiones presentan escasa tecnificación y mínima utilización de recursos externos al punto que los productores pueden jugar un papel de recolectores de los frutos más que agricultores (Yabrudy 2012; Burbano-Figueroa 2019). Una característica adicional representativa de estas regiones es que la producción de aguacate está asociada a la producción de otras especies vegetales en lo que se conoce como los sistemas agroforestales (Burbano-Figueroa 2019). En estos sistemas agroforestales predomina el uso de variedades locales o landraces de aguacate de la raza Antillana (Persea americana var. americana) (Yabrudy 2012; Burbano-Figueroa 2019).
Las plantaciones de aguacate en la región Caribe generalmente son utilizadas como sombrío en cultivos de café (Coffea arabica L.) o también se pueden encontrar asociados con otras especies de interés agrícola como: cacao (Theobroma cacao L.), yuca (Manihot esculenta Crantz), maíz (Zea mays L.) y ñame (Dioscorea spp.); aunque para algunas zonas, caso particular Montes de María, su producción se ha convertido en un cultivo de primera necesidad debido al arraigo cultural y económico que ha tenido este frutal en la población campesina (Yabrudy 2012; Burbano-Figueroa 2019).
Hace tres décadas, la región Caribe era el principal productor de aguacate del país. A modo de ejemplo, la región pasó de aportar un poco menos de la mitad (45,4 %) de la producción nacional de aguacate en el año 1992 a menos del 10 % para el año 2018 (Agronet 2019). Esta pérdida en el liderazgo en la producción nacional es atribuida a una combinación de factores económicos, sociales y ambientales. El factor social de mayor relevancia en la pérdida de la capacidad de producción es el desplazamiento forzado y el abandono de los cultivos a mediados de los años 90 como consecuencia del “Conflicto Armado Colombiano” (Yabrudy 2012). La producción regional también ha sido afectada por disminuciones en área y rendimiento de los cultivos de aguacate, entre estos factores se destaca la muerte de árboles por problemas sanitarios, principalmente por pudrición radical causada por Phytophthora cinnamomi Rand y Verticillum spp. (Tofiño et al. 2012; Osorio-Almanza et al. 2017) y muerte descendente de ramas asociada con hongos de ambrosía, son causas para la pérdida de áreas del cultivo (Burbano-Figueroa et al. 2018, 2020), mientras que los bajos rendimientos son explicados por la avanzada edad de las plantaciones (más de 50 años) (Yabrudy 2012). Finalmente, el aumento significativo de áreas de cultivo en otras regiones del país principalmente de aguacate cv. ‘Hass’ y una preferencia en el mercado por frutas de esta variedad ha disminuido la participación de la región en el mercado nacional (Yabrudy 2012; Osorio-Almanza et al. 2017; Agronet 2019; Burbano-Figueroa 2019).
Los trabajos de investigación relacionados con insectos de importancia económica para el cultivo de aguacate están concentrados en las regiones productoras del centro del país, especialmente en los departamentos de Antioquia, Caldas, Quindío, Risaralda, Tolima y Valle del Cauca (Saldarriaga 1977; Rubio et al. 2009; Kondo et al. 2011; 2013; Cruz, et al. 2016; Kondo y Muñoz 2016; Mira y Yepes 2019). Estos trabajos describen especies de importancia económica como trips (Thysanoptera: Thripidae), larvas rizófagas y/o escarabajos marceños (Coleoptera: Melolonthidae), chinches (Hemiptera: Pentatomidae), escamas (Hemiptera: Diaspididae, Coccidae, Pseudococcidae), mosca blanca (Hemiptera: Aleyrodidae), enrolladores de hojas (Lepidoptera: Tortricidae) y especies de importancia cuarentenarias como los barrenadores de frutos, ramas y tallos (Coleoptera: Curculionidae; Lepidoptera: Elachistidae) que limitan la exportación (Caicedo et al. 2010; Manrique et al. 2014; Diaz-Grisales et al. 2017).
Para la región Caribe colombiana, por el contrario, no existen estudios que permitan conocer cuáles son las especies de insectos que limitan el establecimiento, producción y comercialización de esta fruta. La mayor parte de los reportes previos han concentrado sus esfuerzos en el entendimiento de las enfermedades que afectan los cultivos de aguacate (Tofiño et al. 2012; Osorio-Almanza et al. 2017; Burbano-Figueroa et al. 2018) y en explicar los factores socioeconómicos que afectan la productividad del cultivo (Yabrudy 2012; Méndez-Prada 2016; Ramírez y Pérez 2018; Burbano-Figueroa 2019).
Los insectos fitófagos forman comunidades biológicas que se encuentran con frecuencia en sistemas naturales y agroecosistemas (Mattson y Addy 1975). Ocasionalmente algunas de estas especies insectiles incrementan su abundancia (explosión poblacional) al punto de amenazar la estabilidad del sistema productivo al causar eventos masivos de defoliación o destrucción de los árboles (Mattson y Addy 1975). En este sentido, el presente trabajo forma parte del primer estudio faunístico realizado con el objetivo de conocer las especies de insectos fitófagos asociados a plantaciones de aguacate, en los tres principales núcleos productores en la región Caribe colombiana, de modo tal que se convierta en un instrumento básico para el reconocimiento de las plagas asociadas y la conservación del buen estado fitosanitario, así como para el mejor aprovechamiento y rentabilidad de estas plantaciones.
Materiales y métodos
Área de estudio.
La región Caribe colombiana está localizada al norte del país, entre los 7°42′ y los 12°27′ de latitud norte y entre los 76°25′ y los 71°06′ de longitud oeste, con un área de 1.141.748 km2 que representa el 11,6 % del territorio nacional (Meisel y Pérez 2006). El clima de esta región está determinado por el efecto de los vientos alisios del norte y del nordeste, la proximidad al mar Caribe y la presencia de sistemas montañosos como la Sierra Nevada de Santa Marta que ejercen un efecto de regulación climática. Estos elementos generan heterogeneidad en el paisaje y dan como resultado la presencia de climas con una amplia variación en la precipitación anual, desde climas desérticos hasta sabanas húmedas (Aguilera 2013). La precipitación anual promedio es de 1.000 mm, con valores mínimos en el norte del departamento de La Guajira y máximos en algunas zonas de la Sierra Nevada de Santa Marta y el sur del departamento de Bolívar y Córdoba. El patrón de lluvias es bimodal, con mayores registros en los meses de mayo a junio y de septiembre a noviembre. La temperatura ambiental en la región varía entre 24 °C a 30 °C con una humedad relativa entre 75 % y 85 % (IDEAM 2019).
Trabajo de campo.
Este trabajo se desarrolló entre junio de 2013 y diciembre de 2014 en los tres principales núcleos productores de aguacate de la región Caribe: Montes de María (MM), Sierra Nevada de Santa Marta (SNSM) y Serranía del Perijá (SP) (Figura 1). Los 26 municipios donde se llevó a cabo el muestreo fueron priorizados a partir de una encuesta previa de caracterización del sistema productivo (Tabla 1).
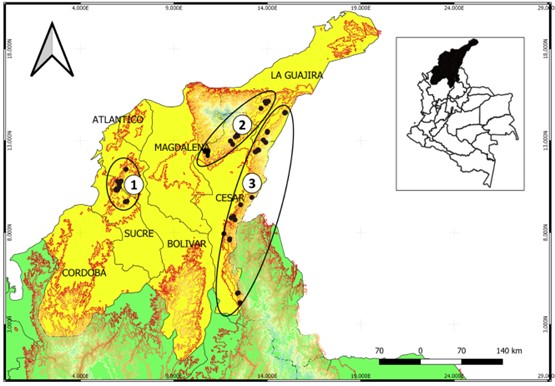
Figura 1 Principales núcleos productores de aguacate para la región Caribe colombiana. (1) Montes de María (MM), (2) Sierra Nevada de Santa Marta (SNSM), (3) Serranía del Perijá (SP). Los puntos negros indican los sitios de muestreo.
Tabla 1 Municipios productores de aguacate priorizados para el muestreo de insectos fitófagos en la región Caribe Colombiana.
| Núcleo Productor | Departamento | Municipio |
|---|---|---|
| Montes de María (MM) | Bolívar | Carmen de Bolívar |
| Bolívar | San Jacinto | |
| Bolívar | San Juan de Nepomuceno | |
| Sucre | Ovejas | |
| Sierra Nevada de Santa Marta (SNSM) | Cesar | El Copey |
| Cesar | Valledupar | |
| Cesar | Pueblo Bello | |
| Guajira | Distracción | |
| Guajira | San Juan del Cesar | |
| Guajira | Riohacha | |
| Serranía del Perijá (SP) | Guajira | Barrancas |
| Guajira | Urumita | |
| Guajira | Villa Nueva | |
| Guajira | La Jagua del Pilar | |
| Guajira | Fonseca | |
| Cesar | Manaure | |
| Cesar | San Martín | |
| Cesar | Curumaní | |
| Cesar | La Jagua de Ibirico | |
| Cesar | La Paz | |
| Cesar | San Diego | |
| Cesar | San Alberto | |
| Cesar | Pailitas | |
| Cesar | Chiriguaná | |
| Cesar | Becerril | |
| Cesar | Codazzi |
Con la finalidad de obtener el mayor número de muestras e insectos de diferentes hábitos, se emplearon métodos de recoleta directa e indirecta. Se priorizaron los métodos que garantizaran la captura de especímenes de especies previamente reportadas de importancia económica en este cultivo y aquellas que se observaron directamente en campo causando daños. En cada municipio productor se seleccionaron tres fincas con árboles en edad productiva (mayor a 5 años) y con predios superiores a una hectárea. En las fincas productoras de Sierra Nevada de Santa Marta y Serranía del Perijá el muestreo directo (captura manual) se realizó sobre cuatro árboles seleccionados al azar; mientras que Montes de María el muestreo se realizó sobre seis árboles por finca, esto con el propósito de aumentar el número de registros para el núcleo productivo, debido al reducido número de municipios que lo conforman (4 municipios).
El muestreo directo incluye el método de captura manual y el indirecto los métodos de captura con trampas de luz y trampas atrayentes Ecoiapar.
Captura manual.
Los insectos se capturaron manualmente por árbol realizando inspección visual de hojas, tallos, ramas, flores, frutos y raíces por punto cardinal en búsqueda de insectos o daños mecánicos ocasionados por los mismos. Los individuos encontrados se recolectaron con pinceles o pinzas suaves y se preservaron en viales con etanol al 70 % debidamente rotulado. Las partes de ramas que presentaron perforaciones o señales de presencia de insectos barrenadores se cortaron y almacenaron en bolsas herméticas marcadas con el nombre de la finca y árbol muestreado. Para la detección de larvas rizófagas se excavó el suelo hasta 10 cm de profundidad en un cuadrante de 30 x 30 cm a una distancia mínima de 2 m de cada árbol ubicando la zona de mayor desarrollo de raíces; los especímenes encontrados se recolectaron y almacenaron en recipientes plásticos con solución Pampel (560 ml etanol 70 %, 300 ml agua purificada, 120 ml formol al 10 % y 20 ml ácido acético). Posteriormente estos se preservaron en etanol al 70 %. Las evaluaciones fueron realizadas por dos personas con esfuerzo de muestreo de 20 minutos por árbol.
Trampa de luz.
Se utilizaron trampas de luz para capturar insectos voladores como polillas, escarabajos marceños (Melolonthidae) y barrenadores de ramas (Curculionidae), insectos que han sido registrados previamente como plagas en plantaciones de aguacate (Kondo et al. 2013). Para esto, se instaló una trampa de luz de color blanco por municipio a una altura de 1,5 m con relación al suelo en el interior de cada predio, que permaneció activa durante 12 horas desde las 18:00 hasta las 06:00 horas por una sola vez. A las trampas se le adicionó una solución de etanol al 70 % para la preservación de muestras.
Trampa atrayente.
Se instaló una trampa tipo Ecoiapar en cada finca a una altura de 1,5 m del suelo para la captura de coleópteros de la subfamilia Scolytinae (Curculionidae) (Barrera et al. 2008). Esta consistió en una botella plástica de 2 litros de volumen con una abertura de 20 x 11 cm a 8 cm de la base. En su interior se colocó un recipiente de 10 ml relleno de algodón humedecido con una mezcla de alcohol etílico + metílico en una proporción de 3:1 como atrayente (Barrera et al. 2008). Las trampas permanecieron activas durante 48 horas y se emplearon una sola vez.
En la Tabla 2 se presenta el número de árboles muestreados y número de trampas instaladas para cada núcleo productor y municipios. Un listado de los municipios de muestreo se presenta en la Tabla 1.
Tabla 2 Esfuerzo de muestreo por núcleo productor para el muestreo de insectos fitófagos de Persea americana Mill. en región la Caribe colombiana.
| Muestreo directo | Muestreo indirecto* | |||
|---|---|---|---|---|
| Núcleo productor | Número de Municipios | Árboles muestreados | Trampas de luz | Trampas atrayentes (Ecoiapar) |
| Montes de María (MM) | 4 | 72 | 4 | 12 |
| Sierra Nevada de Santa Marta (SNSM) | 6 | 72 | 6 | 18 |
| Serranía del Perijá (SP) | 16 | 192 | 16 | 48 |
*Se instaló una trampa de luz color blanco por municipio y una trampa atrayente tipo Ecoiapar por finca (3 fincas por municipio).
Análisis de datos.
Las muestras de insectos obtenidas en campo fueron separadas por árbol, método de captura, finca y núcleo productor y depositadas en el laboratorio de Entomología del Centro de Investigación Caribia de Agrosavia (Magdalena, Colombia) para su posterior procesamiento e identificación hasta la categoría taxonómica más detallada.
La identificación de los especímenes se realizó a partir de claves taxonómicas (Stehr 1991; Wood et al. 1991; Constantino 1999, 2000 2002a; Marvaldi y Lanteri 2005; Triplehorn y Johnson 2005; Wood 2007; Pérez-de la Cruz et al. 2009), revisión de material de referencia o consulta con especialistas en casos donde hubo dificultades para su identificación, por ej. Dr. Takumasa Kondo (para Coccomorpha) y Reginaldo Constantino (para Termitidae). Los especímenes curados se depositaron en la colección entomología del Centro de Investigación Caribia de Agrosavia, la cual se encuentra anexa a la Colección Taxonómica Nacional de Insectos ‘Luis María Murillo’ (CTNI) Agrosavia, C.I. Tibaitatá (Mosquera, Cundinamarca).
Se elaboraron matrices de presencia-ausencia de especie por núcleo productor. Se construyeron curvas de acumulación de especies y se utilizaron los valores medios de los estimadores de riqueza Chao-2 y Jacknife-1 con 100 aleatorizaciones en el programa EstimateS 9.1 (Colwell 2013), para determinar la representatividad de los muestreos. Estos estimadores no paramétricos reducen el sesgo en muestras pequeñas y son adecuados para datos de presencia-ausencia (Moreno 2001). También se elaboraron matrices de abundancia por sitio teniendo en cuenta la frecuencia de captura de una especie empleando como unidad de muestreo cada árbol. Solo se aplicó para aquellos insectos capturados mediante el método manual.
Para determinar diferencias en la composición de especies entre los núcleos productivos, los datos de muestreo directo (captura manual) se analizaron empleando la técnica no paramétrica Multi Response Permutation Procedure (MRPP) con el programa PC-ORD® versión 4,0 (McCune y Mefford 1999). Este procedimiento permite probar la hipótesis de no diferencia entre dos o más grupos (definidos a priori) con base en variables múltiples, de la misma forma que un análisis discriminante, pero sin que los datos tengan que cumplir con supuestos de normalidad multivariada y homogeneidad de varianzas. El estadístico A (Acuerdo intragrupal sin el efecto del azar), reportado por este análisis describe la homogeneidad intragrupal comparada con lo que se esperaría al azar (McCune y Mefford 1999). Posteriormente, se aplicó análisis de especies indicadoras (Dufrêne y Legendre 1997) para indicar las especies características por núcleo productivo. Los valores del indicador (IV) obtenidos fueron sometidos a prueba empleando la técnica de Monte Carlo.
Resultados y discusión
Se registraron 573 muestras de insectos fitófagos asociados a los árboles de aguacate para los tres núcleos productivos. Se identificaron 42 especies agrupadas en siete órdenes y 12 familias (Tabla 3). Las muestras estuvieron compuestas principalmente por termitas, escamas y barrenadores de ramas, que en conjunto constituyeron el 79 % de las especies encontradas (Figura 2).
Tabla 3 Insectos fitófagos asociados a tres núcleos productores de Persea americana Mill. en la región Caribe colombiana. (MM) Montes de María, (SNSM) Sierra nevada de Santa Marta, (SJ) Serranía del Perijá, (CM) Captura manual, (TL) Trampas de luz, (TA) Trampas atrayentes tipo Ecoiapar.
| Taxón | Núcleo productor | Método de muestreo | ||
|---|---|---|---|---|
| MM | SNSM | SP | ||
| Blattodea (Isoptera) | ||||
| Termitidae | ||||
| Amitermes foreli Wasmann, 1902 | 1* | 0 | 1 | CM |
| Anoplotermes sp. 1 | 3 | 0 | 5 | CM |
| Anoplotermes sp. 2 | 1 | 0 | 3 | CM |
| Cornitermes walkeri Snyder, 1929 | 1 | 0 | 0 | CM |
| Grigiotermes sp. | 0 | 1 | 0 | CM |
| Microcerotermes arboreus Emerson, 1925 | 10 | 3 | 15 | CM |
| Nasutitermes corniger (Motschulsky, 1855) | 3 | 0 | 1 | CM |
| Nasutitermes ephratae (Holmgren, 1910) | 0 | 0 | 1 | CM |
| Nasutitermes guayanae (Holmgren, 1910) | 0 | 0 | 6 | CM |
| Nasutitermes nigriceps (Haldeman, 1854) | 1 | 0 | 2 | CM |
| Nasutitermes sp. | 8 | 0 | 0 | CM |
| Nasutitermes similis Emerson, 1935 | 0 | 0 | 2 | CM |
| Rhynchotermes bulbinasus Scheffrahn, 2010 | 0 | 1 | 1 | CM |
| Termes sp. | 1 | 0 | 0 | CM |
| Rhinotermitidae | ||||
| Coptotermes crassus Snyder, 1922** | 1 | 2 | 6 | CM |
| Heterotermes tenuis (Hagen, 1858) | 0 | 0 | 4 | CM |
| COLEOPTERA | ||||
| Curculionidae | ||||
| Heilipus sp. | 0 | 1 | 0 | CM |
| Micrapate sp. | 0 | 1 | 0 | CM |
| Pagiocerus punctatus Eggers, 1928c | 1 | 0 | 0 | CM |
| Pagiocerus sp. | 2 | 0 | 0 | CM |
| Premnobius ambitiosus Wood & Bright, 1992 | 0 | 0 | 1 | CM |
| Premnobius cavipennis Eichhoff, 1878b | 0 | 0 | 1 | CM |
| Xyleborus ferrugineus Wood & Bright, 1992 | 2 | 3 | 1 | CM, TA |
| Xyleborus sp. | 0 | 0 | 1 | CM |
| Xyleborus volvulus (Fabricius, J.C., 1794) | 0 | 0 | 1 | CM |
| Xylosandrus morigerus Reitter, 1913 | 1 | 9 | 2 | CM, TA, TL |
| Melolonthidae | ||||
| Phyllophaga sp. | 1 | 3 | 8 | CM, TL |
| HEMIPTERA | ||||
| Diaspididae | ||||
| Chrysomphalus aonidum (Linnaeus, 1758) | 37 | 26 | 67 | CM |
| Chrysomphalus dictyospermi (Morgan, 1889) | 1 | 0 | 0 | CM |
| Hemiberlesia lataniae (Signoret, 1869) | 2 | 2 | 4 | CM |
| Hemiberlesia palmae (Cockerell, 1893) | 0 | 0 | 1 | CM |
| Mycetaspis personata (Comstock, 1883) | 1 | 0 | 0 | CM |
| Pseudischnaspis acephala Ferris, 1941 | 5 | 2 | 4 | CM |
| Selenaspidus articulatus (Morgan, 1889) | 36 | 35 | 87 | CM |
| Coccidae | ||||
| Ceroplastes rubens Maskell, 1893 | 1 | 0 | 0 | CM |
| Protopulvinaria pyriformis (Cockerell, 1894) | 11 | 0 | 7 | CM |
| Cicadellidae | ||||
| Agrosoma cruciata (Signoret, 1853) | 0 | 0 | 1 | CM |
| Pyrrhocoridae | ||||
| Dysdercus (Dysdercus) obscuratus Distant, 1883 | 2 | 0 | 2 | CM, TL |
| LEPIDOPTERA | ||||
| Tortricidae | ||||
| Platynota sp. | 2 | 1 | 5 | CM |
| Megalopygidae | ||||
| Megalopyge lanata Stoll, 1780 | 3 | 5 | 0 | CM |
| HYMENOPTERA | ||||
| Formicidae | ||||
| Atta sp. | 7 | 2 | 21 | CM |
| Apidae | ||||
| Melipona sp. | 0 | 0 | 1 | CM |
* Número de árboles sobre el cual fue registrado el insecto fitófago. **En este estudio registramos a Coptotermes crassus, sin embargo, de acuerdo con Scheffrahn et al. (2015), para Colombia solo se registra C. testaceus.

Figura 2 Porcentaje de ocurrencia por grupos de especies de insectos fitófagos asociados a Persea americana Mill. en la región Caribe colombiana.
El método que contribuyó con un mayor número de especies fue la captura manual, el cual permitió registrar el 100 % de las especies citadas, mientras que las trampas de luz solo capturaron tres especies (Dysdercus obscuratus Distant, 1883; Phyllophaga sp.; Xylosandrus morigerus Reitter, 1913 y las trampas tipo Ecoiapar dos especies (Xyleborus ferrugineus Wood & Bright 1992; X. morigerus).
La mayor riqueza de especies se observó en la Serranía del Perijá (30 especies), esto debido posiblemente al mayor número de municipios y árboles muestreados para este núcleo productor, seguido por Montes de María (26 especies) y Sierra Nevada de Santa Marta (16 especies) (Figura 3). La riqueza estimada también fue mayor para Serranía del Perijá y Montes de María comparado con Sierra Nevada de Santa Marta (Tabla 4).

Figura 3 Curvas de acumulación de especies de insectos fitófagos para tres núcleos productores de Persea americana Mill. en la región Caribe colombiana. (MM) Montes de María, (SP) Serranía del Perijá, (SNSM) Sierra Nevada de Santa Marta.
Tabla 4 Riqueza estimada (Chao-2, Jacknife-1) de insectos fitófagos para tres núcleos productores de aguacate en la región Caribe colombiana. (MM) Montes de María, (SP) Serranía del Perijá, (SNSM) Sierra Nevada de Santa Marta.
| Centro Productor | Número de especies observadas | Riqueza de especies estimada | |
|---|---|---|---|
| Chao-2 | Jacknife-1 | ||
| MM | 26 | 41 (63,4 %)* | 38 (68,4 %) |
| SNSM | 16 | 19 (84,2 %) | 22 (72,27 %) |
| SP | 30 | 43 (69,7 %) | 41 (73,1 %) |
( )* Porcentaje de especies observadas con respecto al número predicho por el estimador.
El inventario de insectos fitófagos alcanzó a registrar entre el 63,4 % y el 84,2 % de la riqueza de especies estimada para cada núcleo productivo. El estimador de riqueza Chao-2 mostró que la mayor representatividad de especies de insectos fitófagos se obtuvo en Sierra Nevada de Santa Marta (84,2 %) y la menor en Montes de María (63,4 %); mientras que el estimador Jacknife-1 mostró mayor representatividad en Serranía del Perijá (73,1 %) y menor en Montes de María (68,4 %).
El grado de riqueza de especies fitófagas asociadas a los tres sistemas agroforestales de aguacate para la región Caribe colombiana fue relativamente bajo en comparación con lo informado por Saldarriaga (1977) y Kondo et al. (2013), en estudios desarrollados en monocultivos de aguacate de la región Andina colombiana, quienes registraron 77 y 49 especies fitófagas, respectivamente. Gonzáles-Herrera (2003), en un estudio exploratorio realizado en plantaciones de aguacate nativo de las regiones del Pacífico Central y Pacífico Norte de Costa Rica registró 127 especies, donde el 69 % de las muestras evaluadas pertenecieron a los órdenes Coleoptera y Lepidoptera. Equihua et al. (2007) para el estado de Michoacán en México reportaron 72 especies, siendo los barrenadores de ramas (Coleoptera) y los trips (Thysanoptera) los grupos de mayor frecuencia. En contraste, este estudio más allá de presentar un listado taxonómico de especies explora cómo la riqueza y composición de especies está estructurada por núcleo productor.
Las especies más frecuentes para los tres sitios fueron las escamas Chrysomphalus aonidum (Linnaeus, 1758) y Selenaspidus articulatus (Morgan 1889) (Diaspididae) (Tabla 2). Estas altas frecuencias pueden obedecer más al método de muestreo (presencia/ausencia por árbol) y no a la presencia de altos tamaños poblacionales que puedan estar ocasionando daños considerables. Estas escamas se registraron asociadas a hojas y a primordios apicales. Najarro y Sánchez (2016), encontraron que C. aonidum se asociaba al haz de las hojas, preferiblemente en aquellas ubicadas en el tercio medio de la copa en árboles de aguacate. Kondo y Muñoz (2016), también registraron a S. articulatus en el haz de las hojas en cultivos de aguacate Lorena y Santana en el Valle del Cauca (Colombia).
El análisis MRPP reveló diferencias altamente significativas en la composición de especies entre los tres núcleos productivos (MRPP; A = 0,021; p = 0,0003). Esto permite inferir que en las matrices estudiadas puede existir un marcado efecto de sitio, lo cual indicaría que la riqueza y composición de insectos fitófagos en los núcleos productores podría estar influenciada por la historia de manejo de las plantaciones, los reguladores naturales (depredadores, parasitoides y entomopatógenos) y/o las características climáticas locales, como por ej. la precipitación. Burbano-Figueroa et al. (2020), en un estudio realizado en las mismas localidades de muestreo, encontraron que, el núcleo productor de Sierra Nevada de Santa Marta y Serranía del Perijá presentan límites inferiores de 100 mm de precipitación en el trimestre más seco del año, mientras que Montes de María recibe lluvias trimestrales por encima de este umbral, esto a pesar de que los tres núcleos pertenecen a la misma zona de vida de Bosque Seco Tropical (BST), lo cual podría indicar que la precipitación sea un factor ambiental importante que condicione la riqueza y abundancia de las especies fitófagas asociadas a cada sitio.
Los núcleos productivos con mayor similitud en cuanto a la composición de especies fueron Montes de María y Sierra Nevada de Santa Marta, con 11 especies compartidas; mientras que el más disímil fue Serranía del Perijá donde se registró el mayor número de especies exclusivas (9 especies) (Figura 4). Esta exclusividad puede estar determinada por una mayor dispersión geográfica de los puntos de muestreo para este núcleo productor.

Figura 4 Dendrograma de similitud para la composición de especies de insectos fitófagos para tres núcleos productores de Persea americana Mill. en la región Caribe colombiana (Distancia Euclideana y método de agrupamiento de varianza mínima de Ward). (MM) Montes de María, (SP) Serranía del Perijá, (SNSM) Sierra Nevada de Santa Marta.
El análisis de especies indicadoras mostró que, de las 42 especies analizadas, tres obtuvieron valores de indicador (IV) que difirieron significativamente de los esperados al azar. Estas especies fueron: Xylosandrus morigerus para la Sierra Nevada de Santa Marta, Nasutitermes sp. para Montes de María y Atta sp. para la Serranía del Perijá (Tabla 5). Estas especies al tener valor de indicador (VI) y al encontrarse altamente correlacionadas con condiciones ambientales particulares pueden ser muy sensibles a los cambios que favorezcan el crecimiento deliberado de sus poblaciones (Dufrêne y Legendre 1997). En consecuencia, su monitoreo es un instrumento fundamental en el manejo de un potencial incremento poblacional.
Tabla 5 Resultado de análisis de especies indicadoras Dufrêne y Legendre (1997) para insectos fitófagos asociados a Persea americana Mill. en los tres núcleos productores de la región Caribe colombiana. (MM) Montes de María, (SP) Serranía del Perijá, (SNSM) Sierra Nevada de Santa Marta.
| Especie | Núcleo productor | Valor indicador (IV) | p ≤ 0,05 |
|---|---|---|---|
| Nasutitermes sp. | MM | 28,3 | 0,0004 |
| Xylosandrus morigerus | SNSM | 25,2 | 0,0032 |
| Atta sp. | SP | 14,7 | 0,0065 |
Los insectos perforadores de tallos y ramas (Coleoptera: Curculionidae) son considerados un grupo de insectos que causan daños de importancia económica en plantaciones de aguacate debido principalmente a su difícil control, a la propagación de enfermedades y finalmente a la muerte de árboles (Saldarriaga 1977; Equihua et al. 2007, Rubio et al. 2009; Moreno 2018). Nueve especies de barrenadores de ramas (Coleoptera: Curculionidae), todas ellas pertenecientes a la subfamilia Scolytinae se encuentran en la región Caribe. La especie más frecuente fue X. morigerus, la cual ataca principalmente ramas apicales jóvenes menores a 2 cm de diámetro, por lo que puede comprometer el estado productivo de los árboles. El aspecto externo del daño ocasionado por X. morigerus en aguacate es muy similar al daño provocado por esta especie en plantas de café (Saldarriaga 1977) y al provocado por cuatro especies del género Xyleborus en plantaciones de Acacia mangium Willd. (Lores y Pinzon-Florian 2011). El daño se detecta por perforaciones en la corteza con presencia de aserrín o de un anillo necrótico alrededor del orificio de entrada del insecto.
Los curculiónidos de la subfamilia Scolytinae contiene especies que cultivan y consumen hongos, una simbiosis nutricional altamente evolucionada llamada simbiosis ambrosía. Varios reportes en cultivos de aguacate y otros cultivos en Colombia describen simbiosis de este tipo. La simbiosis X. morigerus con el hongo Ambrosiaemyces zeylanicus fue reportada como causante de muerte de ramas en cultivos de café (Vélez 1972). Xyleborus ferrugineus Wood & Bright 1992, en asociación con el hongo Ceratocystis fimbriata ha sido descrito como la causa de muerte de árboles aparentemente sanos en cultivos de cacao (Cibrián et al. 1995). Xyleborus volvulus (Fabricius 1794), al igual que X. ferrugineus son considerados como vectores potenciales del patógeno causante de la marchitez de las lauráceas Raffaelea lauricola (Carrillo et al. 2014). En la zona productora de la Serranía del Perijá en Colombia se reportó la asociación de X. volvulus y Premnobius sp. con el hongo Bionectria pseudochroleuca causante de muerte de ramas de aguacate (Burbano-Figueroa et al. 2018, 2020).
Este estudio reveló la presencia 16 especies de termitas colonizadoras de tejidos muertos en fuste, ramas, y raíces de aguacate. Dentro de este grupo, los géneros Amitermes, Coptotermes y Heterotermes son los de mayor importancia debido al hábito subterráneo (hipógeos) de sus nidos, lo que dificulta su manejo (Constantino 2002b; Arcila et al. 2013). La colonización de termitas en aguacate puede ser facilitada por el debilitamiento previo de los árboles ante el ataque de enfermedades, presencia de heridas, estrés hídrico, deficiencias nutricionales y daños mecánicos y en muchas ocasiones la magnitud del daño solo es apreciable posterior a la caída de árboles (Constantino 2002b; Arcila et al. 2013).
Evidencia previa sugiere una conexión entre los daños por termitas en las raíces y la pudrición radical causada por P. cinnamomi (Keast y Walsh 1979). Las heridas provocadas por la termita Nasutitermes exitiosus (Hilla, 1925) en plantas de Eucalyptus marginata favorece la entrada de clamidosporas viables de P. cinnamomi a través de su tracto digestivo (Keast y Walsh 1979). La abundancia y riqueza de las termitas del género Nasutitermes reportadas en este estudio, y la presencia de, P. cinnamomi en los tres núcleos productores (Yabrudy 2012; Tofiño et al. 2012; Osorio-Almanza et al. 2017; Burbano-Figueroa 2019), sugiere que podría existir un nexo entre estas dos limitantes sanitarias que explicarían el rápido declive y muerte de árboles observado en las últimas décadas en las regiones productoras de aguacate del Caribe colombiano. Sin embargo, esta connotación debe ser corroborada.
Los insectos defoliadores también representan un problema económico en los núcleos productivos, especialmente los ataques por hormiga arriera (Atta sp.). Estos insectos pueden causar defoliaciones de tallos y hojas reduciendo el potencial productivo de árboles durante la aparición de botones florales (Howard 1988; Arcila et al. 2013; Kondo et al. 2013). Se observó durante las evaluaciones de campo que las hormigas arrieras pueden ocasionar defoliaciones completas de los árboles de aguacate. Defoliaciones de esta magnitud reducen la capacidad fotosintética y aumentan la posibilidad de muerte en periodos de bajas precipitaciones (Howard 1988).
Otras especies de insectos también fueron observadas, pero su frecuencia y magnitud de daño no sugieren importancia económica. Daños esporádicos y limitados de insectos chupadores, larvas defoliadoras del órden Lepidoptera y larvas rizófagas fueron observados en los tres núcleos productores durante la época en que se llevó a cabo el estudio.
Conclusiones
El grado de heterogeneidad presente en los sistemas agroforestales de aguacate para la región Caribe colombiana puede ser un factor determinante en la regulación de las poblaciones de insectos fitófagos que se asocian a estos sistemas de producción.
Los tipos de hábitat que existen en las matrices de estudio pueden ser muy importantes para el desplazamiento de organismos benéficos a través de ellas y determinan la probabilidad de que ciertas especies registradas en otros estudios como plaga mantengan sus poblaciones por debajo del nivel de daño económico.
Los ataques ocasionados por termitas, hormiga arriera y barrenadores de ramas en los sitios estudiados, son motivo de atención por las consecuencias directas sobre la productividad y sobre las plantaciones de aguacate, ya que se desconoce cómo puede ser el comportamiento posterior de la especie en cuanto a su tolerancia a problemas insectiles, debido a la escasa información con que se cuenta actualmente.















