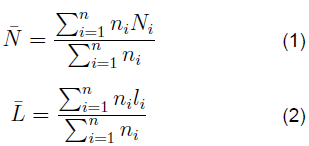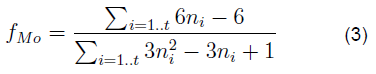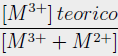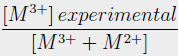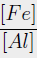Introducción
La conferencia climática de París en 2015 (COP21) se enfocó en establecer nuevas regulaciones más estrictas para la emisión de gases de efecto invernadero, sin embargo, estas emisiones continúan aumentando año tras año tras la alta demanda de energía [1].
Por otro lado, los óxidos de las hidrotalcitas calcinadas pudieran ser buenas candidatas para ser usadas como catalizadores o soportes de catalizadores debido a sus propiedades especiales, tales como: alta área específica, alta y buena dispersión metálica, presencia de micro y mesoporos, formación de óxidos mixtos homogéneos, etc. Las propiedades ácido-base de las hidrotalcitas pueden ser modificadas según los cationes constituyentes de las hidrotalcitas. Por lo tanto, una combinación adecuada de estas propiedades ácido-base de las hidrotalcitas deben ser formuladas cuando se van a sintetizar catalizadores de hidrotratamiento (HDT). Los sitios ácidos mejoran la conversión de las reacciones de hidrotratamiento, pero ellos pudieran acelerar la formación de coque y la desactivación del catalizador. Mientras, que los sitios básicos mejoran la selectividad hacia la reacción de desulfuración directa (DSD) sobre las de hidrogenación (HID), es decir, la proporción DSD/HID, pero disminuyen la actividad de los catalizadores de hidrotratamiento (HDT). Algunos autores han mostrado que la selectividad hacia la desulfuración directa está relacionada con la longitud y la dispersión de los cristalitos de MoS2 [2-4].
Por otro lado, los catalizadores másicos NiMoAl de hidrotalcitas calcinadas, fomentan un crecimiento de la actividad hacia la ruta HID en la reacción de hidrodesulfuración (HDS) de dibenzotiofeno (DBT) [5]. Estos resultados fueron contradictorios y no pudieron ser explicados usando el modelo "Rim-Edge" de Chianelli et al. [6], donde los sitios activos de HID se encuentran en los sitios Rim localizados exclusivamente en la posición de borde y esquina de los apilamientos individuales de MoS2. En cambio, los resultados obtenidos pudieran estar correlacionados a factores de interacción entre los metales involucrados. Recientemente, López et al. [7], mostraron que los sitios básicos en los catalizadores pueden contribuir al enriquecimiento de la densidad electrónica de los apilamientos MoS2 soportados y, por lo tanto, contribuir al incremento de la ruta de HID [7]. Así, cambiando las propiedades ácido-base de los óxidos mixtos, es posible direccionar las reacciones de hidrodesulfuración hacia la ruta esperada. La elección adecuada de los constituyentes metálicos de la hidrotalcita es una vía para modificar las propiedades ácido-base de estos materiales.
El propósito de este artículo fue evaluar los óxidos mixtos provenientes de hidrotalcitas terciarias calcinadas constituidas por Fe3+ y Al3+ y un catión divalente, tal como: Co2+, Ni2+, Zn2+ o Mg2+ como soporte de catalizadores sulfurados de CoMo. Las propiedades electrónicas (Co2+ y Ni2+), estructurales (Zn2+) y ácido-base (Mg2+) fueron consideradas para estudiar estos efectos en la reacción de hidrodesulfuración [8-10]. Por otro lado, el Fe3+ no sólo ha mostrado propiedades como promotor electrónico para reacciones de HDT, sino también puede modificar las propiedades ácido-base de los óxidos provenientes de los materiales tipo-hidrotalcita [11,12]. Finalmente, en orden de determinar la actividad catalítica y selectividad de estos catalizadores, estos catalizadores fueron probados en la reacción de hidrodesulfuración de dibenzotiofeno.
Parte Experimental
Síntesis de hidrotalcitas terciarias y precursores catalíticos
Se sintetizaron cinco hidrotalcitas terciarias conteniendo Fe3+ y Al3+(M3+) y Mg2+, Co2+, Zn2+ o Ni2+ (M2+) como cationes divalentes. Se mantuvo una relación molar [M+3/(M3++M2+)] de 0,22 y [Fe3+/Al3+] de 0,66. Para determinar la influencia del hierro en las propiedades catalíticas, se sintetizó una hidrotalcita de magnesio adicional, duplicando el contenido de hierro en el gel, es decir, una relación molar [Fe3+/Al3+] de 1,32. Se seleccionó el método de coprecipitación como método de síntesis [13]. Se prepararon dos soluciones: una solución A y una solución B. La solución A se formuló disolviendo las cantidades adecuadas de las sales de: Al(NO3)3.9H2O (Riedel-de Haên, 98 %) y Fe(NO3)3.6H2O (Riedel-de Haên, 98 %>), y Mg(NO3)2.6H2O (Riedel de Haen, 97 %>) o Co(NO3)2.6H2O (BDH Chemical Ltd, 97 °%) o Ni(NO3)2.6H2O (Riedel-de Haên, 97 °%) o Zn(NO3)2.6H2O (Riedel-de Haên, 97 °%) en agua destilada. La solución B se preparó usando carbonato de sodio (Loba Chemie, 98 %) e hidróxido de sodio (Riedel de Haen 99,5 °%) disueltos en agua destilada. Entonces, la solución A fue lentamente añadida a la solución B bajo agitación constante a temperatura ambiente y presión atmosférica hasta la formación del gel. El pH se mantuvo próximo a 11, y se envejeció durante 24 h. Luego fue filtrado y lavado con abundante agua destilada hasta pH cercano a 7. Los sólidos obtenidos fueron secados en un horno a 333 K por 24 h y calcinados en mufla. Los sólidos fueron etiquetados como: MeAlFe donde: Me2+ es: Mg2+, Co2+, Ni2+ o Zn2+. Las muestras con cantidades diferentes de Fe fueron identificadas usando su relación molar (Fe3+/Al3+). Los óxidos de estas hidrotalcitas calcinadas fueron impregnados, mediante el método de humedad incipiente, con molibdeno en proporción de 15 °%p como MoO3, usando heptamolibdato de amonio (Riedel-de Haên, 98 °%). Luego, las muestras se dejaron secar a temperatura ambiente por 24 h para ser impregnadas con una solución de nitrato de cobalto (BDH Chemical Ltd, 97 °%) en proporción atómica 3 Mo:Co. A modo de comparación, se sintetizó el catalizador de referencia CoMo/y-Al2O3 (proporción molar Co/Mo= 0,43 y área específica de 204 m2.g-1). Durante la calcinación, algunas muestras cambiaron de color debido a la formación de óxidos mixtos (Tabla 1).
Caracterización de las hidrotalcitas sintetizadas, precursores catalíticos y catalizadores sulfurados
Análisis químico por fluorescencia de rayos-X. Se utilizó un equipo S4 Explorer para determinar la composición química de los catalizadores. Este aparato fue operado usando un tubo de rayos-X con un ánodo de rodio y un detector de centelleo operando en una corriente de 20 mA y 50 kV de voltaje para obtener el espectro de las muestras.
Medidas de superficie (área superficial específica BET, diámetro y volumen de poro). Las medidas de superficie fueron llevadas a cabo en un equipo Tristar 3000, usando gas nitrógeno N2 como molécula de prueba absorbente. Previamente, las muestras fueron calentadas a 473 K por 12 h bajo un sistema de vacío.
Difracción de rayos-X (DRX). Los difractogramas de difracciones de rayos-X fueron determinados en un equipo Philipp PW3442 usando una longitud de onda CuK (a) de 1,54060. Las muestras fueron molidas hasta obtener un fino polvo para su análisis. La identificación de las fases fue hecha usando archivos PDF.
Desorción de CO2 a temperatura programada (TPD-CO2). Se utilizó un equipo micromeritics Autochem II 2920. Las muestras fueron colocadas en una celda de cuarzo y activadas a presión atmosférica desde temperatura ambiente hasta los 623 K a una rampa de calentamiento de 10 K.min-1 (velocidad de flujo de helio: 20 mL.min-1). Las muestras fueron mantenidas a 623 K por 30 min, entonces, fueron enfriadas a 213 K por 30 min bajo un flujo de helio. Después, estas muestras fueron saturados con una mezcla de gases 10 %v CO2/He, durante 30 min a 213 K (flujo de gas: 20 mL.min-1) y luego se pasó una corriente de helio por dos horas a fin de eliminar el CO2 fisisorbido. Luego, las muestras se calentaron con una rampa de calentamiento de 10 K.min-1 hasta los 873 K bajo una corriente de helio puro a fin de registrar el CO2 quimisorbido.
Reducción de H2 a temperatura programada (TPR-H2). Las mediciones fueron hechas en un equipo micromeritic Autochem II 2920. Las muestras fueron colocadas en la celda de cuarzo y activadas a presión atmosféricas por calentamiento hasta los 573 K bajo una rampa de calentamiento de 10 K.min-1 (velocidad de flujo de helio: 20 mL.min-1). Las muestras fueron mantenidas a 573 K por 30 min, entonces fueron enfriadas a 298 K por 30 min bajo un flujo de helio. Los experimentos de reducción térmica fueron conducidos a una rampa de calentamiento de 5 K.min-1 hasta los 1 273 K partiendo de temperatura ambiente bajo una mezcla de gas 10 %v H2/He (flujo de gas: 20 mL.min-1). Las señales obtenidas fueron colectadas en una computadora con un software especializado.
Análisis Elemental. Se utilizó un equipo CE NA2100 Protein para determinar la composición de N, C, S, H y O en los catalizadores sulfurados. Estos análisis permiten determinar el grado de sulfuración.
Microscopia electrónica de transmisión de alta resolución (HRTEM). Estos estudios se llevaron a cabo en un microscopio Jeol 2010. Los catalizadores sulfurados fueron ultrasónicamente dispersados en heptano y la suspensión fue colectada en rejillas recubiertas de carbono. Las distribuciones de las longitudes de las losas y el grado de apilamiento de capas de cristalitos de MoS2 de cada muestra se establecieron a partir de la medición de al menos 500 cristalitos tomados de diferentes partes de la misma muestra dispersada en la rejilla del microscopio. El número de apilamiento promedio por losa (¯N) y la longitud de losa promedio (¯L) fueron determinados como sigue:
Donde N i y l i representan respectivamente el número de apilamiento y la longitud de una losa MoS2, según se determina a partir de las micrografías y n es el número de partículas medido en un rango de tamaño o número de apilamiento de índice i.
La dispersión de MoS2 (f M ) se evaluó estadísticamente dividiendo el número total de átomos de Mo utilizando los tamaños de losa determinados a partir de las micrografías usando la siguiente formula:
Siendo n i el número de átomos de Mo a lo largo de un lado de la losa de MoS2 determinado a partir de su longitud y siendo t el número total de losas.
Evaluación de la Actividad Catalítica. El reactor fue cargado con 500 mg de catalizador con tamaño de partículas entre 250 a 315 um diluidos en carborundum (tamaño de partícula entre 300 a 400 μm) para mantener un volumen del lecho catalítico de 2 mL. Los catalizadores fueron sulfurados in situ empleando un reactor de flujo dinámico a alta presión (longitud: 40 cm y diámetro interno: 1,26 cm) usando una solución de dimetil disulfuro (DMDS) (5,8 %p, Aldrich > 99 °%) disuelto en tolueno. Bajo una presión de 4 MPa, la solución sulfurante (DMDS e H2) fue inyectada a una temperatura inicial de 423 K. Después de 1 h, la temperatura se incrementó a 623 K, a una rampa de calentamiento de 5 K/min y se mantuvo a esta temperatura por 14 h. Posteriormente, la temperatura descendió a la temperatura de reacción de HDS de DBT a 613 K, 4 MPa de presión total y proporción volumétrica de H2/alimentación = 475 NL/L. La alimentación estuvo constituida por dibenzotiofeno (DBT, 500 ppm de S, Lancaster 98 %) y dimetil disulfuro (9 500 ppm de S, Aldrich 98 %) disuelto en tolueno (Aldrich > 99 %). Los tiempos de contacto o residencia fueron: 5, 10 y 20 min. Los productos de reacción fueron condensados y se tomó e inyectó una muestra cada hora, hasta lograr el estado estacionario, en un cromatógrafo 450 Varian-GC equipado con una columna capilar DB-1 (30 m, 0,250 mm de diámetro y 0,25 μm de película) acoplado a un detector de ionización de llama. Las condiciones del método utilizado en el cromatógrafo fueron las siguientes: Temperatura del puerto de inyección= 50 °C, temperatura de la columna= 200 °C, temperatura del detector= 250 °C, tiempo de corrida de 30 min para la reacción de HDS de DBT. Los productos fueron identificados usando los patrones apropiados: bifenilo, ciclohexilbenceno, biciclohexil y dibenzotiofeno. En cuanto al hexahidrodibenzotiofeno y tetrahidrodibenzotiofeno, se identificaron usando un cromatógrafo de gases acoplado a un espectrómetro de masas El factor de respuestas fue previamente determinado y fue igual a 1 para todos los casos. Entonces, las áreas determinadas por el cromatógrafo de gases fueron directamente relacionadas a la concentración molar de los componentes.
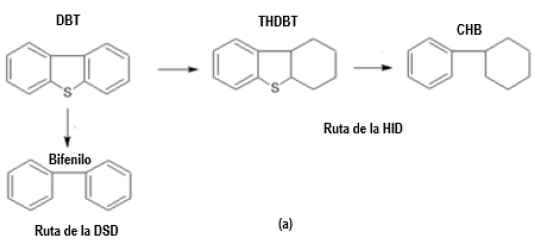
Los principales productos de la HDS de DBT fueron bifenilo, ciclohexilbenceno y tetrahidrodibenzotiofeno. El bifenilo, es el producto de la ruta de la desulfuración directa (DSD), mientras que los productos de la hidrogenación: tetrahidrodibenzotiofeno y ciclohexilbenceno, fueron llamados los productos de la ruta de hidrogenación (HID). Estas medidas de DSD y HID fueron determinados una vez que se logró el estado estacionario bajo las condiciones de reacción establecidas.
Resultados y Discusiones
Caracterización de las hidrotalcitas sintetizadas y de los precursores catalíticos
Análisis químicos y parámetros texturales.
Las propiedades químicas y texturales fueron determinadas para las hidrotalcitas sintetizadas y los precursores catalíticos (Tabla 1y2). Los análisis químicos muestran que los valores experimentales de la relación molar [M3+/(M3++M2+)] fueron bastante concordante con el valor teórico para las hidrotalcitas de Zn y Ni, mientras que, para las hidrotalcitas de Mg, esta proporción fue más alta que el valor teórico (Tabla 1). Sato et al. [14] demostraron que la solubilidad de compuestos similares a las hidrotalcitas se ve muy disminuida cuando el Mg2+ es reemplazado por Ni2+ o Co2+. El Kps de las hidrotalcitas de Mg es mayor que las de Ni (o Co) lo que impide una menor incorporación del Mg en la hidrotalcita, resultado en una mayor relación [M3+/(M3++M2+)].
Tabla 1 Detalles de la síntesis de las hidrotalcitas terciarias sintetizadas, composición nominal y experimental.
a) M3+: Al3+ y Fe3+, M2+: Mg2+, Co2+, Ni2+ o Zn2+.
b) Los valores en paréntesis corresponden a la proporción molar (Fe3+/Al3+).
Por otra parte, no se encontraron diferencias notables, cuando se intercambia un ion metálico trivalente (por ejemplo, Fe3+ o Al3+). Estudios teóricos llevados a cabo por Bravo-Suárez et al. [15] señalaron que la energía libre total de disolución de M2+ disminuye en el siguiente orden Mg2+ > Co2+ > Ni2+. Este orden se debe a que cuanto mayor es el valor negativo de la energía libre de la reacción de disolución, más soluble es la hidrotalcita. En este sentido, estos resultados pudieran explicar la baja incorporación del Mg2+ en el gel para formar un sólido similar a la hidrotalcita. Sin embargo, la incorporación de metales trivalentes (Fe3+ y Al3+) no es afectada por la solubilidad de la hidrotalcita, en ese caso la relación molar experimental [Fe3+/Al3+] concuerda con la relación teórica. Este comportamiento es observado, inclusive, duplicando el contenido de hierro en el gel de reacción. Una excepción se observó para la hidrotalcita de Ni, donde la relación molar [Fe3+/Al3+] fue más alta en comparación con el valor teórico, lo cual pudiese estar asociado a errores experimentales.
Por otro lado, las mediciones de área superficial de los óxidos mixtos y los precursores catalíticos pueden ser vistas en la Tabla 2. Los resultados muestran áreas específicas BET relativamente bajas para los óxidos mixtos que pudieran estar asociadas a la formación de fases densas como los óxidos mixtos. La posterior impregnación y calcinación disminuye, en general, aún más el área de los óxidos mixtos, relacionado con el taponamiento de los poros de los óxidos por para de los óxidos de Mo o Co impregnado, excepto para los precursores soportados sobre hidrotalcitas de MgFeAl, este hecho no está claro el por qué y requiere más estudios que permitan dar con una explicación satisfactoria. Asimismo, las isotermas de adsorción/desorción de N2 de los precursores catalíticos fueron tipo IV con diámetro de poros tipo mesoporoso, como los demuestra la literatura [16].
Tabla 2 Propiedades Texturales y Mediciones de TPD-CO2 de los precursores CoMo soportados sobre hidrotalcitas terciarias calcinadas y los soportes (hidrotalcitas calcinadas).
| Precursor catalítico | Área específica BET de los óxidos (± 1 m2.g-1) | Área específica BET del precursor catalítico (± 1 m2.g-1) | Volumen de Poro (± 0,001cm3.g-1) | Diámetro de Poro (± 0,01 nm) | TPD-CO2 (±0,001umol.g-1) |
|---|---|---|---|---|---|
| CoMo/ү-alúmina | - | 204 | 0,502 | 10,2 | 4,0 |
| CoMo/MgFeAl(0,66) | 31 | 35 | 0,100 | 16,9 | 23,8 |
| CoMo/MgFeAl(1,32) | 35 | 44 | 0,151 | 16,2 | 34,0 |
| CoMo/CoFeAl | 50 | 43 | 0,147 | 15,8 | 1,7 |
| CoMo/NiFeAl | 86 | 42 | 0,117 | 12,7 | 2,9 |
| CoMo/ZnFeAl | 60 | 35 | 0,097 | 13,1 | 2,6 |
La primera columna hace referencia al área específica BET previo a la impregnación (soportes) y la segunda posterior a la impregnación (precursor catalítico). El resto de las columnas: volumen y diámetro de poro y TPD-CO2 corresponden a los precursores catalíticos.
Las mediciones de desorción de CO2 a temperatura programada (Tabla 2), muestran el comportamiento esperado, considerando la formación de óxidos de cationes divalentes provenientes de la calcinación de las hidrotalcitas, tales como: MgO, Co3O4, NiO y ZnO. El carácter ácido se incrementa a lo largo del grupo en la tabla periódica asociado a la electronegatividad de los metales, en este caso, del metal divalente. Una excepción a este comportamiento, pudiera ser considerado por Co3O4, el cual fue el más ácido de todos los precursores catalíticos debido a la combinación de estados de oxidación (2+ y 3+) [17]. Por otro lado, se observó un incremento de la basicidad para la muestra CoMo/MgFeAl(1,32) comparándola con la muestra CoMo/MgFeAl(0,66) que pudiera estar asociado al contenido de hierro. De hecho, estos precursores basados en MgFeAl, poseen la composición en peso de hierro más alta (7-14 %) que el resto de los precursores (alrededor de 2-4 %>). El Fe2O3 detectado por los termorreductogramas de TPR-H2 promueven la ruptura de las moléculas de agua en la estructura laminar formando especies FeO-OH que incrementan la basicidad [18]. Balsamy et al. [12] han señalado que la presencia de Fe3+ en la matriz de MgO pudieran aumentar la basicidad del material debido a la generación de nuevos sitios pares: base fuerte-ácido de Lewis en la superficie. El MgO promueve también la basicidad.
Difracción de rayos-X (DRX). Los patrones de rayos-X de las hidrotalcitas terciarias sintetizadas fueron similares entre si (Figura no mostrada).
En todos los casos, fueron observados picos simétricos y finos correspondientes a los planos (003), (006), (110) y (113). Estos picos aparecen junto a los picos amplios y asimétricos para los planos (009) y (015), correspondientes también a los materiales tipo hidrotalcita (PDF - 22700). Las intensidades de los picos entre las hidrotalcitas sintetizadas no fueron proporcionales, lo cual pudiera estar asociado al grado de cristalinidad. La cristalinidad se ve afectada por varios factores tales como: tamaño del radio iónico y/o la oxidación parcial de los cationes de metales de transición usados durante la síntesis de estas hidrotalcitas [19]. Asimismo, las diferentes intensidades observadas entre las hidrotalcitas de Mg pudiesen estar relacionadas con el contenido de hierro. El Fe3+ es más grande que el Al3+, el cual pudiera distorsionar la red atómica resultando en una menor cristalinidad. Junto con la fase hidrotalcita, otras impurezas tales como nitrato de sodio (PDF-851461) también fueron observadas para algunas hidrotalcitas. Esta fase fue resistente al lavado exhaustivo usando agua destilada.
La calcinación de las hidrotalcitas terciarias y su posterior impregnación con molibdeno y cobalto condujeron a la formación de los precursores catalíticos. Los patrones de rayos-X de estos precursores catalíticos son mostrados en la Figura 1, como pueden ser vistos, hubo cambios en los patrones de los difractogramas. Básicamente, colapsó la estructura hidrotalcita durante la calcinación resultando en la aparición de óxidos y fases tipo espinela. La presencia de diferentes fases dependió de los constituyentes metálicos de las hidrotalcitas terciarias. Para los precursores CoMo/MgFeAl(0,66) y CoMo/MgFeAl(1,32), la fase MgO fue predominante (43,5 y 63° (2Ɵ), fase periclasa, JCPDS: 98-009-5468). La presencia de algunos picos correspondiente a la hidrotalcita de origen se debe al "efecto memoria", el cual permite la reconstrucción del material original. Para los precursores CoMo/CoFeAl, se encontraron dos fases: Co3O4 (JCPDS: 98-006-9666) a: 19, 31, 37, 57, 66 y 78° (2Ɵ), y la espinela Al2CoO4 (JCPDS: 98007-7743) a: 31, 37, 57, 66 y 78° (2Ɵ). La muestra CoMo/NiFeAl mostró señales correspondientes a NiO (JCPDS: 98-002-8834) a: 36, 44, 64, 75 y 79° (2Ɵ); mientras que el precursor catalítico CoMo/ZnFeAl presentó picos correspondientes a ZnO (JCPDS: 98-005-7450) a: 33, 35, 37, 49, 57, 64, 68 y 69° (2Ɵ). Las fases correspondientes a óxidos o espinelas de hierro u óxidos de molibdeno y cobalto no fueron determinadas en los precursores catalíticos formulados. Esto pudiera asociarse a una buena dispersión de estas fases, su carácter amorfo o pequeño tamaño de los cristalitos que no lograron difractar. Sin embargo, otras especies de cobalto y molibdeno fueron encontrados para las muestras CoMo/NiFeAl y CoMo/ZnFeAl. De este modo, se encontró una sal de NaMo4O6 (JCPDS: 98-005-7450) para la muestra CoMo/NiFeAl a: 12, 29 y 37° (2 Ɵ) y una sal de molibdato de cobalto NaCo2(MoO4)2 OH (JCPDS: 98-009-3585) a: 17, 26, 29 y 30° (2 Ɵ) para la muestra de CoMo/ZnFeAl. Ambas sales pudieran disminuir la actividad de HDS de estos catalizadores debido a su baja reducibilidad.

Figura 1 Difracción de rayos-X de los precursores catalíticos: CoMo/ZnFeAl, CoMo/NiFeAl, CoMo/CoFeAl, CoMo/MgFeAl(1,32) y CoMo/MgFeAL(0,66).
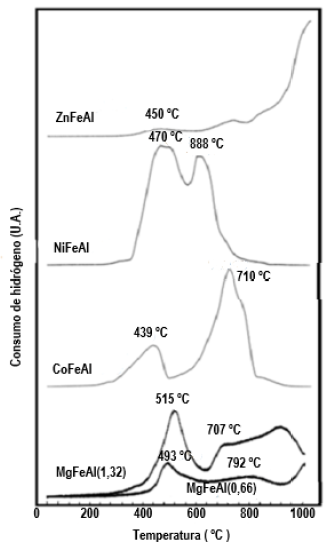
Reducción a temperatura programada (TPR-H2). Los soportes de los catalizadores fueron analizados por la técnica TPR-H2 para determinar las especies reducibles y su contribución a las reacciones catalíticas (Figura 2). En general, todos los termorreductogramas mostraron dos picos muy bien marcados. El primer pico a baja temperatura (673-773 K) es complejo debido a las diversas especies de óxido de hierro que podrían reducirse. Inicialmente, el Fe3O4 se redujo a Fe3O4, y luego a FeO [20]. Es posible que el pico alrededor a 1023 K, también pudiera estar asociado a la reducción de FeO a Fe metálico [21]. Aunque, la presencia de las especies de hierro pudo ser detectadas por TPR-H2, estas especies no fueron observadas por DRX. Por lo tanto, se podría asociar un carácter amorfo a estas especies de hierro [22].
Por otro lado, la presencia de Al3+ en todos los soportes pudiera desplazar los picos de reducción a mayores temperaturas, posiblemente asociado a las fuertes interacciones Al3+-M2+. El segundo pico observado a temperaturas más altas en los diferentes reductogramas, ha sido asignado a la reducción de las especies de Zn, Ni o Co. Para el soporte ZnFeAl, se observó un pico adicional no muy bien desarrollado a alta temperatura cercano a los 1273 K. La incorporación de especies de Zn2+ en las capas brucitas de las hidrotalcitas produce ZnO, que es fácilmente detectado por difracción de rayos-X. Sin embargo, estas especies de ZnO son difíciles de reducir a especies metálicas [23].
Así mismo, se observó un segundo pico a 873 K para la muestra NiFeAl. Este pico pudiera corresponder a especies de óxido de níquel, el cual también se determinó por DRX. Por lo general, los picos de reducción de NiO presentan un pico único ancho alrededor de 613 y 673 K. Sin embargo, la presencia de aluminio en las hidrotalcitas que contienen hierro desplaza los picos de reducción hacia temperaturas más altas. Este cambio en la temperatura de reducción para especies de óxido de Ni, pudiera mostrar una importante interacción de níquel con aluminio. La formación de las espinelas Ni-Al no es descartable [24,25].
También, se determinó un segundo pico, para la hidrotalcita que contiene Co. Este pico se asocia con la reducción de Co3O4 y de la espinela Al2CoO4. Se ha señalado, de manera similar a las hidrotalcitas de Ni, que la presencia de aluminio desplaza los picos de reducción del Co3O4 y de la espinela Co-Al a temperaturas más altas [24-27].
Análisis Elemental. Se analizaron los catalizadores sulfurados antes de reacción. Los resultados se muestran en la Tabla 3.
Tabla 3 Análisis Elemental antes de la reacción de los catalizadores sulfurados CoMo soportados sobre hidrotalcitas terciarias calcinadas y alúmina.
| Catalizadores sulfurados | N%p (±0,01) | C%p (± 0,01) | H%p (± 0,01) | S%p (± 0,01) | Grado de sulfuración (%) (± 0,01) |
|---|---|---|---|---|---|
| CoMo/γ-Al2O3 | 0,00 | 0,96 | 1,69 | 6,22 | 70,45 |
| CoMo/MgFeAl(0,66) | 0,00 | 0,86 | 0,23 | 18,94 | 101,49 |
| CoMo/MgFeAl(1,32) | 0,00 | 0,93 | 0,13 | 21,05 | 86,23 |
| CoMo/CoFeAl | 0,00 | 0,66 | 0,83 | 3,11 | 8,97 |
| CoMo/NiFeAl | 0,00 | 4,11 | 1,23 | 12,20 | 48,66 |
| CoMo/ZnFeAl | 0,00 | 0,60 | 0,12 | 25,87 | 71,40 |
Como se puede ver, el porcentaje (%p) de azufre en casi todos catalizadores sulfurados basados en hidrotalcitas es más alto en comparación al valor mostrado por el catalizador referencia (CoMo/γ-Al2O3), lo que podría indicar que otras especies diferentes a los óxidos de cobalto o molibdeno, tales como: óxidos de hierro, níquel o cinc (que provienen de la calcinación de las hidrotalcitas) pudieran ser sulfuradas también. Nosotros determinamos el grado de sulfuración de estos catalizadores. Para eso, fueron consideradas las siguientes especies como posibles especies sulfuradas: ZnS, Ni3S2 o FeS2 (pirita); sin embargo, otras especies sulfuradas de hierro y níquel también pudieron ser formadas durante la sulfuración y posterior reacción de HDS; esto es especialmente importante en aquellos casos donde la sulfuración fue superior a 100 % [23,28,29]. Las hidrotalcitas de Mg fueron las más susceptibles de sufrir sulfuración en comparación con el resto de catalizadores. La muestra CoMo/MgFeAl(1,32), con alto contenido de hierro, mostró un menor grado de sulfuración en comparación con la misma muestra con menor contenido de hierro (CoMo/MgFeAl(0,66)). Este resultado concuerda con la alta exposición de las especies sulfurables.
Por otro lado, la muestra que contiene cinc mostró un alto grado de sulfuración. El cinc reacciona fácilmente con los compuestos de azufre [23]; mientras, las muestras de Co y Ni fueron menos susceptibles a la sulfuración. Adicionalmente, el Co (o Ni) pudo tener una mayor interacción con las especies de alúmina formado por espinelas, las cuales son muy estables. Estos resultados concuerdan con los análisis de TPR-H2, donde las especies de Ni y Co son más difíciles de reducir debido a la interacción con el aluminio. Por otro lado, es probable que para la muestra que contiene Co en el soporte, la sulfuración solo ocurra en la superficie de los óxidos de cobalto y molibdeno, debido al bajo grado de sulfuración mostrado para este catalizador.
Microscopía electrónica de transmisión de alta resolución (HRTEM). Las micrografías muestran los apilamientos típicos debido a los cristalitos de MoS2 con distancias interplanares de 6,2 Å para todos los catalizadores (Figura 3) [30,31]. La longitud promedio, número de capas de apilamiento y fracción estimada f Mo de los cristalitos de MoS2, obtenidos de las imágenes de HRTEM, son presentados en la Tabla 4.
Tabla 4 Longitud de apilamiento y grado de apilamiento promedios y fracción de frecuencia estimada de Mo de los cristalitos de MoS2 presentes en los catalizadores sulfurados CoMo soportados sobre hidrotalcitas terciarias calcinadas.
| Catalizadores sulfurados | Longitud promedio (± 0,01nm) | Apilamiento promedio (± 0,02nm) | Fracción de frecuencia de Mo (f Mo ) (± 0,01) |
|---|---|---|---|
| CoMo/γ-Al2O3 | 5,03 | 1,46 | 0,25 |
| CoMo/MgFeAl(0,66) | 5,95 | 1,68 | 0,20 |
| CoMo/MgFeAl(1,32) | 7,22 | 2,26 | 0,18 |
| CoMo/CoFeAl | 7,89 | 1,12 | 0,17 |
| CoMo/NiFeAl | 8,14 | 1,38 | 0,15 |
| CoMo/ZnFeAl | 5,80 | 1,77 | 0,22 |
El catalizador referencia CoMo/y-ALO3 muestra una dispersión de los cristales MoS2 más homogéneos que aquellos catalizadores basados en óxidos mixtos que provienen de la calcinación de las hidrotalcitas. Se observaron longitud de apilamiento entre 2y80 nm, y un número de apilamiento entre 1 a 4 capas. En cambio, la formación de cristales MoS2 soportados sobre óxidos mixtos incrementa el tamaño de los apilamientos y el número de apilamientos. Adicionalmente, ambas variables: longitud de los apilamientos y el número de apilamiento parecen menos homogéneos que aquellos encontrados para el catalizador de referencia. La naturaleza de los cationes: Mg2+, Ni2+, Co2+ or Zn2+ también influyeron en estos parámetros.
La presencia de Mg en los óxidos de Fe y Al, muestra una menor longitud de apilamiento y una menor dispersión que aquellos mostrados para los cationes Ni2+, Co2+ o Zn2+ incorporados en los óxidos mixtos. El catalizador sulfurado basado en Mg produce una longitud de apilamiento entre 2 y 18 nm y un número de apilamiento entre 1 y 7 capas. La longitud de apilamiento fue superior para los óxidos mixtos formados por los cationes Ni2+, Co2+ o Zn2+ hasta alcanzar los 36 nm. Estos resultados pudieron mostrar una interacción más débil entre los óxidos mixtos y la fase activa en comparación a la alúmina como soporte [32].
La naturaleza del soporte también pudiera ser un factor clave en las longitudes de los apilamientos y en el número de capas. Al estar estos óxidos compuestos por una mezcla de diferentes óxidos, entre ellos óxidos de alúmina, estos soportes podrían tener un comportamiento de islas de óxidos metálicos; MoS2 se sitúa preferentemente en estas islas de alúmina que producen pequeños apilamientos. El resto de los cristalitos de MoS2 se situaron en los otros óxidos metálicos donde la interacción fase activa-soporte es más débil, produciendo apilamientos de mayor longitud y un mayor número de capas de MoS2. Resultados similares han sido reportados por Hensen et al. [33] para MoS2 soportados sobre sílica-alúmina amorfa. Por otro lado, la fracción estimada f Mo de los cristalitos MoS2 se determinó para todos los catalizadores sulfurados (Tabla 4). Se puede ver que el catalizador referencia mostró la fracción f Mo más alta, el cual se asoció a la longitud corta de sus apilamientos. Una fracción f Mo implica una alta actividad catalítica. Por otra parte, el contenido de hierro también tiene influencia en los apilamientos y número de capas de MoS2 en los catalizadores CoMo/MgFeAl(0,66) y CoMo/MgFeAl(1,32). Un alto contenido de hierro incrementa ambos parámetros, los cuales pudieran asociarse a una interacción más débil de los cristalitos MoS2 sobre los óxidos de hierro aislados.

Figura 3 Micrografías HRTEM de los catalizadores sulfurados a) CoMo/y-Al2O3, b) CoMo/MgFeAl(0,66), c) CoMo/MgFeAl(1,32), d) CoMo/CoFeAl, e) CoMo/ NiFeAl, f) CoMo/ZnFeAl.
Actividad Catalítica: HDS de DBT. La reacción de HDS de DBT ha sido bien documentada y como se mencionó previamente, se reconocen dos rutas de reacción paralelas para su conversión (Figura 4). La ruta de la desulfuración directa (DSD) produce bifenilo y la ruta de la hidrogenación (HID) conduce a la formación de ciclohexilbenceno (CHB), isómeros de tetrahidrodibenzotiofeno (THTDBT) y biciclohexil (BCH). Para estos catalizadores, se observaron solo dos productos en alta proporción: CHB, correspondiente a la ruta de hidrogenación y el bifenilo, correspondiente a la ruta de desulfuración directa. Los otros productos solo se observaron en cantidades trazas. Se determinaron para estos precursores catalíticos las actividades de HDS total, HID y DSD (Tabla 5). El catalizador más activo fue el de referencia CoMo/γ-Al2O3. Las actividades mostradas para estos precursores catalíticos, no pueden sólo estar asociada a algunos parámetros superficiales como el diámetro de poro o el área específica debido a que los valores presentados fueron bastante similares entre ellos. El diámetro de poro de estos materiales mesoporosos puede alojar la molécula ensayada DBT, por lo tanto, los problemas asociados a transferencia de masa no pueden estar relacionados a los resultados de actividad obtenidos. En general, estas actividades se asociaron a la fracción de Mo expuesta (Tabla 4). Por otro lado, los resultados de HRTEM están en concordancia con las actividades observadas. El catalizador referencia CoMo/y-alúmina mostró las longitudes de los apilamientos más cortos, lo cual se asocia a una alta fracción de Mo efectiva (Tabla 4) y, por lo tanto, una alta actividad catalítica de HDS de DBT (Tabla 5). Para los catalizadores soportados sobre hidrotalcitas calcinadas, las longitudes de los apilamientos son más grande que el valor reportado por el catalizador referencia: CoMo/ZnFeAl< CoMo/MgFeAl(0,66)< CoMo/MgFeAl(1,32)< CoMo/CoFeAl< CoMo/ NiFeAl, mientras que las actividades catalíticas fueron las siguientes: CoMo/MgFeAl(0,66)> CoMo/MgFeAl(1,32)> CoMo/CoFeAl> CoMo/ NiFeAl> CoMo/ZnFeAl. En muchos casos, grandes longitudes de los apilamientos implican bajas fracciones efectivas de Mo y, por lo tanto, menor actividad catalítica. Una excepción puede ser vista para el catalizador CoMo/ZnFeAl el cual mostró un tamaño de apilamiento comparable con el reportado por el catalizador referencia, pero con una baja actividad catalítica. Este resultado se asoció a otros factores los cuales son explicados más adelante. También, la naturaleza de los metales usados durante la síntesis de la hidrotalcita juega un rol importante en las actividades de estos materiales. Es importante destacar que los catalizadores formulados con MgO: CoMo/ MgFeAl(0,66) y CoMo/MgFeAl(1,32) mostraron actividades significativas en la reacción de HDS de DBT que pudiese estar relacionado a la basicidad del soporte que incrementa la dispersión de MoS2 (Tabla 2) [34]. La incorporación de Fe3+ en la matriz de la hidrotalcita, también mejora la basicidad de estos materiales (Tabla 2) [12]. Sin embargo, las bajas áreas superficiales específicas mostradas por estos catalizadores no son competitivas con el soporte de alúmina, y mayor esfuerzo debe ser hecho en esa dirección para incrementar la actividad catalítica.
El Co y el Ni se incorporaron a la síntesis de estos materiales con el fin de evaluar la función de estos promotores electrónicos, mientras que el cinc se relacionó con el efecto geométrico capaz de incrementar la actividad de estos catalizadores de hidrotratamiento.
La calcinación de la hidrotalcita de Co dio lugar a la formación de la espinela Al2CoO4 y Co3O4 según los patrones de rayos-X, previniendo la formación y promoción de la fase CoMoS, el cual se ha mostrado como la fase activa. Así mismo, estas espinelas son poco reactivas al proceso de sulfuración. La presencia de NiO, determinada por difracción de rayos X, para el catalizador CoMo/ NiAlFe, no puede considerarse como una especie aislada capaz de participar en la fase activa NiMoS. En los óxidos mixtos, la alúmina presente no sólo actúa como soporte del catalizador CoMo, sino, y según los ensayos de TPR-H2, el aluminio interacciona con el Ni presente evitando su reducción a bajas temperaturas, y por lo tanto disminuyendo la actividad catalítica. Por otro lado, la calcinación de las hidrotalcitas de Zn da lugar a la formación del ZnO y no a la esperada fase espinela ZnAl2O4. Es conocido que la presencia de las espinelas de Zn en los catalizadores soportados sobre y-alúmina (ɣ-Al2O3) evitan la formación de las espinelas Co-Al mejorando la actividad catalítica en estos catalizadores de hidrotratamiento. La fase ZnO ha sido mostrada como un adsorbente de H2S, formando la fase ZnS, pero cuando el cinc se satura de azufre, la actividad disminuye notablemente [35].
Por otra parte, es bien conocido la dependencia de la morfología de la fase activa con la selectividad hacia los productos de hidrogenación. Un modelo ampliamente aceptado para explicar la selectividad hacia la ruta de la hidrogenación o hidrogenólisis es el modelo "Rim-Edge". Este modelo muestra que los sitios de hidrogenólisis están localizados en el borde "Edge" de los apilamientos de los cristalitos de MoS2, y las reacciones de hidrogenación son llevadas en los apilamientos de los sitios "Rim". Según el modelo "Rim-Edge" [6], la relación hidrodesulfuración/hidrogenación se incrementa a medida que aumenta el número de apilamiento de MoS2. Sin embargo, otros factores también podrían afectar la relación hidrodesulfuración/ hidrogenación especialmente cuando se intenta comparar la fase MoS2 en diferentes soportes. Según Hensen et al. [33], la adsorción de DBT se produce a través de un modo de adsorción planar común a través del anillo de benceno. Esta adsorción «planar» de DBT procede a la hidrogenación del anillo aromático que aumenta con el incremento del grado de apilamiento.
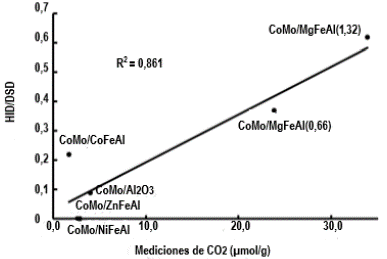
La Tabla 4 y 5 muestra los resultados correspondientes a la longitud promedio y el número de apilamientos, y la selectividad HID/ DSD de los catalizadores ensayados. Según los resultados obtenidos, no observamos una posible tendencia entre el tamaño de los apilamientos de MoS2 o el grado de apilamiento y la relación HID/DSD. Sin embargo, hay una mejor correlación entre la proporción HID/DSD y la basicidad (Figura 5). Recientemente, López et al. [7] mostró que un enriquecimiento de la densidad electrónica de las losas MoS2 inducida por un soporte básico (donante de electrones) podría explicar la correlación entre la relación HID/DSD y la basicidad. Klicpera and Zdrazˇil [36] encontraron que los catalizadores de Mo soportados sobre MgO fueron tan activos como los catalizadores de Mo soportados sobre γ-Al2O3, inclusive la selectividad HID/DSD fue ligeramente mayor al valor reportado para el catalizador referencia. Estos resultados fueron explicados considerando el efecto del Mg sobre las propiedades electrónicas de la fase sulfurada [37]. Tomando en cuenta estos resultados, el efecto del Mg sobre las propiedades de los catalizadores de hidrotratamiento parece ser controversial. Los resultados de las actividades generalmente se explican por la dispersión de la fase de Mo, morfología de los cristalitos de MoS2 y la acidez del soporte. Sin embargo, los efectos electrónicos del Mg sobre la fase sulfurada también deben ser consideradas en los catalizadores de hidrotratamiento.
Es importante destacar, que estos son resultados preliminares y se requieren realizar estudios más avanzados para verificar estos comportamientos, ya sea de caracterización como XPS antes y después de la reacción, así como de evaluación catalítica con otras modelos sonda como 4,6 DMDBT, así como estudios de cinética de reacción para encontrar una explicación más satisfactoria a estos resultados.
Tabla 5 Actividad total de HDS y actividades de las rutas (DSD e HID) de la molécula de DBT sobre los catalizadores CoMo soportados sobre hidrotalcitas terciarias calcinadas y sobre alúmina (γ-Al2O3).
| Catalizador | HDSa mmol/g/h (± 0,001) | DSDa mmol/g/h (± 0,001) | HIDa mmol/g/h (± 0,001) | Selectividad HID/DSD a (± 0,02) |
|---|---|---|---|---|
|
CoMo/γ-Al2O3) CoMo/MgFeAl(0,66) CoMo/MgFeAl(1,32) CoMo/CoFeAl CoMo/NiFeAl CoMo/ZnFeAl |
2,342 1,285 0,236 0,067 0,023 0,012 |
2,108 0,900 0,146 0,055 0,023 0,012 |
0,198 0,394 0,091 0,012 0 0 |
0,09 0,37 0,62 0,22 0,00 0,00 |
Condiciones: P = 4,0 MPa, T = 340 °C; H2/alimentación = 470 NL/L, [DBT, S] = 500 ppm [S, DMDS] = 9 500 ppm, solvente = Tolueno,
aActividad determinada a una conversión 30 % de DBT.
Conclusiones
Se sintetizaron y caracterizaron hidrotalcitas terciarias de Al, Fe y Me (Me = Mg, Ni, Co o Zn) para ser utilizados como soportes de los catalizadores sulfurados de Co y Mo en la reacción de hidrodesulfuración de dibenzotiofeno. Los resultados de la caracterización mostraron que la síntesis de las hidrotalcitas fue posible. La formación de óxidos mixtos de estas hidrotalcitas mostró áreas específicas bajas producto de la formación de fases densa de los cationes constituyentes de las hidrotalcitas sintetizadas. La impregnación con Co y Mo disminuyeron las áreas específicas aun más de estos sólidos, producto de un posible bloqueo de los poros de los óxidos de las hidotalcitas. Las mediciones de desorción de CO2 señalaron que el carácter ácido se incrementa a lo largo del grupo en la tabla periódica asociado a la electronegatividad de los metales, en este caso, del metal divalente. Estos precursores fueron activos a la reacción de HDS de DBT. Su actividad dependió de la naturaleza del metal constituyente de la hidrotalcitas sintetizadas, de su acidez y de las características de los cristalitos de MoS2. En los catalizadores soportados sobre hidrotalcitas calcinadas, las longitudes de los apilamientos fueron más grande que el valor reportado por el catalizador de referencia: CoMo/ZnFeAl< CoMo/MgFeAl(0,66)< CoMo/ MgFeAl(1,32)< CoMo/CoFeAl< CoMo/NiFeAl, mientras que las actividades catalíticas fueron las siguientes: CoMo/MgFeAl(0,66)> CoMo/ MgFeAl(1,32)> CoMo/CoFeAl> CoMo/NiFeAl> CoMo/ZnFeAl. Es importante destacar que en los catalizadores formulados con MgO: CoMo/ MgFeAl(0,66) y CoMo/MgFeAl(1,32) mostraron actividades significativas en la reacción de HDS de DBT que pudiese estar relacionado a la basicidad del soporte que incrementa la dispersión de MoS2.. Según los resultados obtenidos, no se observó una posible tendencia entre el tamaño de los apilamientos de MoS2 o el grado de apilamiento y la relación HID/DSD. Sin embargo, hay una mejor correlación entre la proporción HID/DSD y la basicidad, encontrándose que los catalizadores de Mo soportados sobre MgO fueron tan activos como los catalizadores de Mo soportados sobre y-Al2O3, inclusive la selectividad HID/DSD fue mayor al valor reportado para el catalizador de referencia.