Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de la Facultad de Medicina Veterinaria y de Zootecnia
Print version ISSN 0120-2952
Rev. Med. Vet. Zoot. vol.64 no.1 Bogotá Jan./Apr. 2017
https://doi.org/10.15446/rfmvz.v64n1.65824
Doi: 10.15446/rfmvz.v64n1.65824
BICULTIVO EN BIOFLOC DE CACHAMA BLANCA -Piaractus brachypomus-Y TILAPIA NILÒTICA -Oreochromis niloticus- ALIMENTADAS CON DIETAS DE ORIGEN VEGETAL
CACHAMA -Piaractus brachypomus- AND NILE TILAPIA -Oreochromis niloticus- BICULTURE IN BIOFLOC FED DIETS OF VEGETABLE ORIGIN
S. B. Brú-Cordero1*, V. M. Pertúz-Buelvas1, J. E. Ayazo-Genes2, V. J. Atencio-García1, S. C. Pardo-Carrasco3
1 Departamento de Ciencias Acuícolas, Facultad de Medicina Veterinaria y Zootecnia, CINPIC, Universidad de Córdoba. Carrera 6 no. 76-103. Montería, Colombia.
* Autor para correspondencia: sbbruc@unal.edu.co
2 CINPIC, Universidad de Córdoba, Carrera 6 no. 76-103. Montería, Colombia.
3 Departamento de Producción Animal, Facultad de Ciencias Agrarias, Universidad Nacional de Colombia, Sede Medellín. Calle 59a no. 63-20. Medellín, Colombia.
Artículo recibido: 24 de agosto de 2016 • Aprobado: 21 de marzo de 2017
RESUMEN
Se evaluó el desempeño productivo de cachama blanca y tilapia nilótica cultivadas en biofloc y alimentadas con dietas de origen vegetal. Se cultivaron 80 peces/m3 en proporción 1:1 (cachama : tilapia), con tres niveles de proteína bruta (PB): 16% (T16), 24% (T24) y 32% (T32), en tanques de 1.000 l, con aireación permanente durante 120 días. Se estimaron parámetros de crecimiento, rendimiento, calidad de agua, costos de producción y análisis proximal de los flóculos. El oxígeno disuelto se mantuvo con saturación por encima de 100% y los compuestos nitrogenados (NO2 = 0,4-0,5 mg/l, NO3 = 0,4-0,5 mg/l, NH3 = 0,2-0,3 mg/l, TAN = 2,2-2,4 mg/l) no presentaron diferencias entre los tratamientos (P > 0,05). Los pesos finales de la cachama (173,5-196,2 g) fueron entre dos y cuatro veces los obtenidos por la tilapia (43,0-87,9 g). El mejor rendimiento del bicultivo se obtuvo con la dieta T24 (11,4 ± 1,3 kg/m3), el cual también registró el menor FCA (0,9 ± 0,3). Producir un kilogramo de pescado costó entre COP $3.148 (T24) y COP $4.445 (T32); del cual el alimento representó entre 49,2% (T16) y 63,3% (T32) y la energía, entre 10,3% (T32) y 14,2% (T16) de los costos. El análisis proximal de los flóculos registró niveles de proteína bruta (29-36% PB) adecuados para cachama y tilapia; pero con niveles bajos de lípidos (< 1,0%). El desempeño productivo y los costos de producción permiten sugerir la viabilidad que ofrece el sistema biofloc para la producción de carne de pescado con alimento de 24% PB de origen vegetal.
Palabras clave: bromatología, calidad de agua, flóculos bacterianos, piscicultura.
ABSTRACT
The productive performance of cachama and nile tilapia reared in biofloc and fed diets of vegetal origin was evaluated. In 1000L tanks with permanent aeration, were placed 80 fish/m3, in a ratio 1:1 (cachama : tilapia); fish were fed with three levels of crude protein (CP): 16% (T16), 24% (T24) and 32% (T32) for 120 days. Parameters of growth, yield, water quality, production costs and proximal analysis of the flocs were estimated. Dissolved oxygen showed saturation above 100% and nitrogen compounds (NO2 = 0.4-0.5 mg/l, NO3 = 0.4-0.5 mg/l, NH3 = 0.2-0.3 mg/l, TAN = 2.2-2.4 mg/l) showed no statistical difference between treatments (P > 0.05). The final weight of the cachama (173.5-196.2 g) were between two and four times those obtained by tilapia (43.0-87.9 g). The tilapia recorded a better daily gain of weight in T24 (0.7 g/day); while the cachama ranged between 1.2-1.3 g/day, with no significant difference between these values (P > 0.05). The best bi-culture yield was obtained in T24 diet (11.4 ± 1.3 kg/ m3), which also recorded the lowest FCA (0.9 ± 0.3). To produce one kilogram of fish cost between COP$3.148 (T24) and COP$4.445 (T32); of which the food represented between 49.2% (T16) and 63.3% (T32) and energy between 10.3% (T32) and 14.2% (T16) of total costs. Proximal analysis of the flocs recorded crude protein levels suitable (29-36% PB) for cachama and tilapia; but with low lipid levels (< 1.0%). The productive performance and the production costs allow to suggest the viability of the biofloc system for the production of fish meat with 24% CP diet of vegetal origin.
Keywords: Bromatology, water quality, bacterial flocs, fish farming.
INTRODUCCIÓN
El Plan Nacional para el Desarrollo sostenible de la Acuicultura en Colombia (Plandas), con el propósito de incentivar la actividad acuícola en el país, priorizó la investigación en tilapias y cachamas, en aspectos tales como la elaboración de dietas y el establecimiento de sistemas de cultivo eficientes, buscando aprovechar el potencial con el que se cuenta e implementar cultivos sostenibles de estas especies. En los últimos cinco años han aparecido signos de recesión en la producción acuícola en Colombia, derivada de los altos costos de producción, y específicamente por el valor de los alimentos balanceados, los cuales representan alrededor de 70% del costo total (Merino et al. 2013).
En este orden de ideas, la tendencia del desarrollo de la piscicultura y los problemas crecientes de escasez de agua, demandan un alto grado de eficiencia y tecnificación y señalan la necesidad de implementar tecnologías de cultivo que soporten altas densidades de siembra, con mínimo consumo de agua y aprovechamiento máximo del alimento suministrado (Crab et al. 2007). Estas tecnologías ofrecen una alternativa a problemas como el deterioro de la calidad del agua causados por las altas concentraciones de metabolitos y el bajo aprovechamiento del alimento en los sistemas de producción acuícolas (Avnimelech 2007); tal ineficiencia se relaciona con que aproximadamente el 25% del nitrógeno suministrado en el alimento es asimilado por los peces y el 75% restante es excretado, principalmente bajo la forma de amonio y urea y, en menor medida, en fracciones particuladas (heces y restos de alimentos) (Ebeling et al. 2006).
En consecuencia, como una alternativa para el desarrollo de cultivos intensivos sostenibles, está la implementación de la tecnología biofloc (BFT), la cual puede ser definida como un método de control de la calidad de agua con la ventaja adicional de producir proteína de origen bacteriano (flóculos bacterianos), formados a partir de una alta relación carbono:nitrógeno en el agua, con poco o nulo recambio y alta aireación; estos flóculos pueden servir de alimento in situ para los peces (Avnimelech 2012; Crab et al. 2012; Emerenciano et al. 2014).
Entre las ventajas del sistema BFT se destaca un menor costo de montaje pues demanda menos equipos y unidades de tratamiento del agua en comparación con otros sistemas de producción superintensivos como los sistemas de recirculación o RAS (Ray et al. 2017). Además, BFT se considera un sistema amigable que ofrece un ambiente de cultivo donde se genera una abundante variedad de microorganismos que puede proporcionar beneficios nutricionales a los peces en cultivo (Ray et al. 2010). La posibilidad de una suplementación alimenticia in situ vislumbra el uso de dietas con menor contenido de proteína, en menor cantidad o con materias primas de origen vegetal, que otorga una mayor sostenibilidad a la piscicultura al disminuir el uso de harina de pescado como fuente proteica. Avnimelech (2012) definió los flóculos, como un conglomerado de microorganismos que consisten principalmente de bacterias, zooplancton, protozoos y microalgas, que se agregan a la materia orgánica del sistema. Los flóculos combinan la remoción de los nutrientes del agua con la producción de biomasa microbiana, que puede ser usada como alimento in situ por los peces objeto de cultivo (De Schryver et al. 2008); se podría decir que el sistema biofloc convierte el exceso de nutrientes en biomasa microbiana, que a su vez es consumida por los animales en cultivo (Ekasari et al. 2010).
A pesar que la tilapia y la cachama se cultivan intensivamente en Colombia (jaulas flotantes), no existe información sobre el desempeño de estas especies cultivadas conjuntamente en BFT y, considerando el costo que representa el alimento en la producción piscícola, se plantea como objetivo evaluar el bicultivo de cachama blanca y tilapia nilótica bajo el sistema BFT, alimentadas con dietas de diferentes niveles de proteína bruta de origen vegetal, además de conocer el perfil bromatológico de los flóculos generados por el sistema.
MATERIALES Y MÉTODOS
El estudio se realizó en el Instituto de Investigación Piscícola de la Universidad de Córdoba (cinpic) ubicado en Montería (Córdoba), localizado a 8°45'35"N y 75°53'08''O con una altitud de 18 msnm. Se sembraron 80 peces/m3 (equivalentes a 64 peces/tanque), 32 cachamas con peso inicial promedio de 35 g y 32 tilapias con peso inicial promedio de 4 g; la cachama blanca fue de mayor talla porque cuando fueron sembradas de similar tamaño (experimento previo no publicado) se observaron comportamientos agresivos de la tilapia nilótica hacia la cachama.
Durante 120 días de cultivo se evaluaron tres dietas con diferentes niveles de proteína bruta (PB) de origen vegetal: 16% (T16), 24% (T24) y 32% (T32). La formulación y preparación de las dietas se realizó en el Laboratorio de Nutrición Acuícola de la Universidad Nacional de Colombia, Sede Bogotá (Tabla 1). Cada tratamiento fue evaluado por triplicado (n = 3) en tanques plásticos de 1.000 litros (volumen útil 800 l), con aireación fuerte y permanente mediante blower de 1 hp (HG 750 C2®, China) y manguera polidifusora (Aerotube®, USA). No se hicieron recambios de agua durante el cultivo y únicamente se repusieron las pérdidas por evapotranspiración y cosecha de flóculos. Para proteger los peces de la toxicidad del nitrito se agregó sal marina, manteniendo una salinidad del agua de 3 g/l.
Los tanques se inocularon con biofloc preparado de acuerdo a las instrucciones de Lango (2012) y Ayazo-Genes et al. (2014). Para la adición de melaza como fuente de carbono soluble se utilizó la ecuación propuesta por Kubitza (2011):
melaza (g) = (NT)*(Vol. H2O)*(C:N)
donde NT es nitrógeno total. En el cultivo se mantuvo una relación carbono:nitrógeno (C:N) próxima a 20:1.
Amonio, nitrito y nitrógeno total amoniacal (TAN) se midieron semanalmente con un espectrofotómetro (Espectronic, Genesys 5®, USA). La alcalinidad y la dureza total se determinaron por el método de la fenolftaleína, utilizando reactivos HACH® (ácido sulfúrico, fenolftaleína y verde de bromocresol), el oxígeno disuelto, pH y porcentaje de saturación, se midieron diariamente con un oxímetro digital (YSI, 550A®, USA) y pH-metro (YSI, PH100®, USA). Para determinar el volumen de flóculos se midieron los sólidos totales sedimentables en conos Imhoff.
Se realizaron biometrías mensuales al 50% de los peces de las unidades experimentales; la longitud total (Lt) se midió con un ictiómetro y el peso total (Pt) con balanza eléctrica (OHAUS®, 2000 g, USA). Asimismo, se estimaron parámetros de crecimiento como la ganancia en peso (GP) = Pf - Pi; ganancia de peso diaria (Gpd) = GP/No. de días de cultivo; la tasa específica de crecimiento en peso (G) = (Ln Pf - Ln Pi/No. de días de cultivo)*100; el factor de condición (K) = (Wt/Ltb)*100, donde b es el coeficiente de crecimiento (Weatherley 1972; Bagenal y Tesch 1978). Para estimar el rendimiento del bicultivo se calcularon los siguientes parámetros: la biomasa (B) = No. de peces*peso promedio, la ganancia en biomasa (GB) = Bf - Bi, el factor de conversión alimenticio (FCA) = alimento suministrado/ganancia en biomasa, y la sobrevivencia (S) = (No. final de peces/ No. inicial de peces)*100. Los costos de producción por kg de pescado se estimaron con base en los parámetros de la Tabla 2.
Las muestras de los flóculos fueron tomadas mensualmente usando una malla (80 pm) y un tanque sedimentador (50 l). Se retiró la humedad con horno microondas (LG MS0748G/00®; 700 W de potencia, Corea del Sur) por ocho minutos y luego se secó al sol por 12 horas; estas muestras se empacaron, rotularon y refrigeraron, para posteriormente analizarlas en el Laboratorio de Análisis Químico y Bromatológico de la Facultad de Ciencias Agrarias de la Universidad Nacional de Colombia, Sede Medellín, conformando un pool de flóculos por cada tratamiento.
Se utilizó un diseño experimental completamente al azar (DCA). Las variables ganancia en peso (GP), ganancia en longitud (GL), ganancia de peso diaria (Gpd), tasa de crecimiento específico (G), sobrevivencia (S), factor de conversión alimenticia (FCA), factor de condición (K), volumen de flóculos y su análisis proximal, se sometieron a pruebas de normalidad (test de Kolmogorov-Smirnov) y homogeneidad de varianza (test de Levene). Una vez verificadas estas condiciones se aplicó Anova, y cuando se presentaron diferencias entre los diferentes tratamientos, se aplicó una prueba de comparación múltiple de medias de Tukey con significancia del 5%. El análisis fue realizado con ayuda del programa SAS versión 9.2® (SAS 2008).
RESULTADOS
La Tabla 3 muestra los valores promedios de calidad de agua durante el cultivo; el oxígeno disuelto (OD) en todos los tratamientos se mantuvo por encima de 8,0 mg/l con altos porcentajes de saturación (>100%). La temperatura (27,3-27,4°C) y el pH (7,7-7,4) fueron estables en todos los tratamientos. La alcalinidad total osciló entre 55,2 ± 6,0 mg CaCO3/l (T32) y 67,2 ± 4,4 mg CaCO3/l (T16), sin observarse diferencia entre estos valores (P > 0,05); por su parte, la dureza total fue mayor en T24 (254,5 ± 3,8 mg CaCO3/l) y T32 (233,4 ± 9,1 mg CaCO3/l) (P > 0,05). En ninguno de los compuestos nitrogenados analizados (TAN, amoniaco, nitrito, nitrato) se observó diferencia significativa entre los diferentes tratamientos (P > 0,05). El volumen de flóculos osciló entre 56,6 ± 20,7 ml/l (T16) y 117,6 ± 55,6 ml/l (T32) sin observarse diferencia estadística (P > 0,05).
Las Tablas 4 y 5 presentan los parámetros zootécnicos evaluados en el bicultivo de cachama blanca y tilapia nilótica en biofloc. Los menores valores de peso final y la ganancia de peso diaria de la tilapia se registraron en T24 (Pf = 43,0 ± 5,9 g; Gpd = 0,3 ± 0,0 g/día) (P > 0,05); mientras que el Pf de la cachama blanca osciló entre 173,5 ± 17,9 (T16) y 196,2 ± 20,0 g (T24) y Gpd osciló entre 1,2 ± 0,2 (T16) y 1,3 ± 0,2 g/día (T24) sin observarse diferencia entre estos valores (P > 0,05). La tasa especifica de crecimiento en peso (G) de la tilapia osciló entre 1,9 ± 0,1 (T16) y 2,5 ± 0,2 %/día (T24); mientras que en la cachama blanca osciló entre 1,3 ± 0,1 (T16) y 1,4 ± 0,2 %/día (T32), sin observarse diferencia significativa (P > 0,05). Por especie, la tilapia registró el menor rendimiento en T16 (1,7 ± 0,2 kg/día) (P > 0,05); mientras que la cachama blanca registró rendimientos que oscilaron entre 6,9 ± 0,7 kg/m3 (T16) y 7,8 ± 0,8 kg/m3 (T24) sin observarse diferencia estadística entre estos valores, aunque el rendimiento del bicultivo fue mayor en T24 (11,4 ± 1,3 kg/m3) (P > 0,05). La sobrevivencia final osciló entre 83,3 ± 28,9% (T16) y 98,4 ± 1,6% (T24), sin observarse diferencia significativa (P > 0,05).
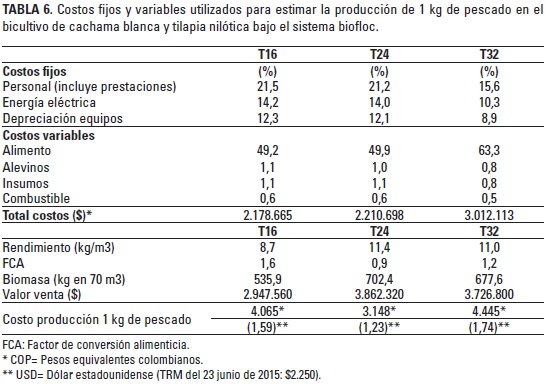
Por su parte, los parámetros económicos aparecen descritos en la Tabla 6. Entre los costos totales de producción el alimento representó entre 63,3% (T32) y 49,2% (T16), mientras que el consumo de energía eléctrica varió entre 10,3% (T32) y 14,2% (T16).
Los análisis bromatológicos realizados a las muestras de flóculos de cada tratamiento aparecen en la Tabla 7. El mayor contenido de PB en los flóculos se registró en T32 (36,0 ± 2,6%) (P > 0,05); sin embargo, los niveles de fibra (8,4-10,3%), cenizas (15,8-21,5%) y grasas (0,54-0,81%) no registraron diferencia significativa entre los diferentes tratamientos (P > 0,05).
DISCUSIÓN
La calidad del agua juega un papel fundamental en los cultivos acuícolas, más aún en los cultivos con sistemas BFT, en los cuales la renovación de agua para eliminación de metabolitos es mínima, ya que los parámetros físicos y químicos como oxígeno disuelto, pH, alcalinidad, dureza y compuestos nitrogenados, regulan el ambiente de cultivo. En los cultivos BFT la aireación continua es esencial para mantener los niveles de oxígeno disuelto requeridos por los peces y microorganismos, los cuales se encargan de la eliminación de los compuestos nitrogenados, de la descomposición aeróbica de la materia orgánica y, en algunos casos, de la nitrificación, proceso que requiere aproximadamente de 4 mg/l de O2 y 8 mg/l de HCO3 para la oxidación de 1 mg/l TAN (Azim y Little 2008). Kubitza (2011), recomendó por lo menos una saturación de oxígeno disuelto de 70,5% en cultivos de tilapias en sistema biofloc; en el presente estudio en todos los tratamientos la saturación estuvo ligeramente por encima de 100%.
Hargreaves (2006) afirmó que las temperaturas tropicales (27 a 28°C) son ideales para mantener una alta concentración de bacterias suspendidas en la columna de agua; según Lango (2012) estas temperaturas garantizan una adecuada velocidad de reacción en el proceso de remoción de compuestos nitrogenados. Entonces, en el presente estudio la temperatura promedio (27,3-27,4°C) se mantuvo en el rango adecuado para el cultivo de cachama y tilapia, lo que permitió un adecuado desarrollo de las comunidades bacterianas.
Según Oviedo et al. (2013), la tilapia presenta buen crecimiento con rangos de pH entre 6,5 y 9,0. Poleo et al. (2011) reportaron que la cachama blanca crece bien a altas densidades en RAS y BFT con pH de 7,6. En el bicultivo de este estudio el pH fue estable y con baja variación (7,4-7,7); valores dentro del rango sugerido por Kubitza (2011) para cultivo en BFT (7,0-8,0).
La dureza total (200,9-254,5 mg/l CaCO3) se mantuvo con valores por encima de 200 mg/l CaCO3. Kubitza (2011) sugirió que valores de dureza total superiores a 150 mg/l CaCO3son tolerables para el desarrollo del cultivo de tilapias en sistemas BFT, mientras que Poleo et al. (2011) reportaron valores de 458,7 mg/l CaCO3 en cultivos de cachama blanca a alta densidad sin efectos evidentes en el crecimiento. Los valores relativamente altos de dureza total reportados en el presente estudio se sugieren están asociados con la acumulación de cationes no metálicos presentes en la sal marina que se usó como medida preventiva para reducir la toxicidad del nitrito.
La alcalinidad registrada en el bicultivo (55,2-67,2 mg/l CaCO3), estuvo en el límite inferior del rango recomendado para sistema BFT (60-100 mg/l CaCO3) por Kubitza (2011), pero dentro del rango de tolerancia de las especies de cultivo 50 a 150 mg/l (Oviedo et al. 2013; Makino et al. 2009). Azim y Little (2008) observaron que el sistema biofloc disminuye su capacidad buffer, por lo que requiere adiciones frecuentes de carbono con el fin de estabilizar el sistema.
En sistemas intensivos con nulo recambio de agua las bacterias son agentes principales en el mantenimiento de la calidad del agua y lo hacen a través de dos categorías funcionales: a) la asimilación heterotrófica del amoniaco y, b) la nitrificación quimio-autotrófica de las bacterias (Ebeling et al. 2006; Hargreaves 2006). La ruta heterotrófica elimina TAN de la columna de agua para construir proteína celular, mientras que las bacterias nitrificantes adquieren energía a través de las reacciones de oxidación de TAN a nitrito y luego a nitrato; así, tanto la asimilación como la nitrificación consumen oxígeno y reducen la alcalinidad. Ebeling et al. (2006) sugieren que para estos procesos autotróficos y heterotróficos se requieren hasta 7,14 g de CaCO3 por gramo de nitrógeno amoniacal reducido a nitrato, a fin de compensar y mantener niveles adecuados de alcalinidad. En este estudio la baja alcalinidad se estima es consecuencia del desdoble y aprovechamiento de compuestos nitrogenados. Kubitza (2011) reportó hasta 12 mg/l de TAN sin efecto sobre el crecimiento de los peces, aunque Rakocy (1989) sugirió que la tilapia podría comenzar a morir cuando la concentración de NH3 alcanza 2 mg/l y los nitritos superan los 5 mg/l, aclarando que la toxicidad de amonio y nitrito varía con la especie, el tamaño de los peces y composición iónica del agua. Poleo et al. (2011), señalaron que niveles de NO2 por encima de 0,28 mg/l podrían resultar perjudiciales para el crecimiento de la cachama blanca.
Los parámetros de crecimiento de la cachama blanca (Pf, Gpd, G, K) fueron similares en los diferentes niveles de proteína bruta incorporada en el alimento de origen vegetal (16-32% PB), lo cual sugiere que en BFT la cachama crece bien con 16% PB. Los pesos finales de la cachama blanca (173,5-196,2 g) fueron entre dos y cuatro veces los obtenidos por la tilapia (43,0-87,9 g), especie que registró el menor peso final cuando se alimentó con 16% PB. Poleo et al. (2011) reportaron pesos finales (446,5 ± 10 g) y ganancia de peso diaria (2,33 ± 0,03 g/día) de la cachama blanca en sistema RAS mayores a los obtenidos en el bicultivo, pero con una menor densidad (31 peces/m3). El incremento de la densidad genera mayor competencia por espacio y alimento, además de alta generación de metabolitos que afectan la calidad del agua y, por tanto, el crecimiento (Granado 2000); sin embargo, los sistemas intensivos como BFT y RAs reducen estos efectos. En el bicultivo, la densidad de siembra (80 peces/m3), la diferencia de tallas en el momento de la siembra y la proporción de siembra (40 cachamas y 40 tilapias/m3) pudo haber incidido negativamente en el desempeño del crecimiento de las especies, especialmente de la tilapia nilótica. Gokcek (2011), en un bicultivo de himri Carasobarbus luteus y tilapia nilótica en jaulas, encontró que el crecimiento de la tilapia se afectó cuando himri alcanzó entre 25 y 50% de la población del bicultivo; por tanto, sugirió que la proporción de siembra es importante en el crecimiento de las especies involucradas en un bicultivo. Los resultados del presente estudio permiten sugerir que los sistemas superintensivos no son apropiados para cultivos mixtos o bicultivos, cuando no se tiene identificada una especie principal y una acompañante (proporción de siembra); en el bicultivo ambas especies se consideraron principales (50% tilapia nilótica, 50% cachama blanca).
En sistemas de altas densidades la tilapia nilótica presenta gran adaptación y buen desempeño, debido a su tolerancia a amplios rangos de amonio, nitrito, temperatura y bajos niveles de oxígeno, características muy frecuentes en sistemas de producción intensivos (Díaz et al. 2012). En el bicultivo, la tilapia registró el mayor Pf (87,9 g) y la mayor Gpd (0,7 g/día) cuando se alimentó con 24% PB; ello resultó ser dos veces el registro cuando se ofreció 16% PB. Sin embargo, la G no mostró diferencia significativa (1,9-2,5 %/día) en los diferentes niveles de proteínas evaluados (16-32% PB). El crecimiento de la tilapia en las condiciones del bicultivo se podría considerar adecuado si se compara con los resultados de Azim y Little (2008), quienes obtuvieron menores parámetros de crecimiento de la tilapia (G = 0,39%/ día, Gpd = 0,46 g/día) en BFT alimentada con 24% PB.
La diferencia de talla de las especies del bicultivo en el momento de la siembra también se sugiere como causa del menor crecimiento de la tilapia nilótica, la cual tenía un peso siete veces menor al de la cachama blanca, lo que ocasionó que esta última desplazara a la tilapia nilótica en el momento de la alimentación. Gullian-Klanian y Aramburu-Adame (2013) reportaron un crecimiento 31% menor en juveniles de tilapia nilótica, en sistemas RAS, cuando presentaron alta variabilidad de la talla; en consecuencia, los peces de mayor tamaño afectaron la alimentación de los más pequeños.
Por otro lado también, se plantea que el bajo desempeño podría estar asociado con un desbalance proteína/energía de la dieta. Hernández et al. (2010) afirmaron que un exceso o deficiencia en este balance, resulta en disminución del crecimiento de los peces. Tacón et al. (2004) afirmaron que, en general, los peces tienen un requerimiento de energía digestible entre 8 y 10 kcal/g de proteína. Vásquez-Torres et al. (2012) encontraron que juveniles de cachama blanca alimentados con dietas de 29,8% PB y 2.700 kcal/g (9 kcal/g de proteína) presentaban un mejor desempeño en el crecimiento. Por su parte, Escobar et al. (2006) evaluaron el efecto del nivel de energía y proteína en la dieta sobre el desempeño productivo de alevinos de tilapia nilótica y obtuvieron los mejores crecimientos cuando la relación energía/ proteína estuvo en el rango de 8,25 y 9,42 kcal/g de proteína. En el presente estudio la relación energía/proteína de las dietas experimentales evaluadas estuvo en un rango de 8,5 (T32) a 17 (T16) kcal/g. Por tanto, si se considera el bajo peso final de la tilapia nilótica cuando se alimentó con 16% PB, ello podría estar relacionado con el desbalance energía/proteína de la dieta; incluso para la cachama blanca, el peso final en esta dieta fue el más bajo, aunque no presentó diferencia significativa con la registrada con los otros tratamientos. Cuando el bicultivo fue alimentado con 24% PB se obtuvo el mejor desempeño en peso (relación 8,5 kcal/g), lo cual se ajusta a lo reportado por los autores que señalan que un adecuado balance proteína/energía es necesario para el buen crecimiento de los peces omnívoros (Escobar et al. 2006; Tacón et al. 2004; Vásquez-Torres et al. 2012).
El rendimiento del bicultivo fue mayor cuando se alimentó con 24% PB (11,4 kg/ m3); 68,5% de tal rendimiento fue aportado por la cachama blanca (7,8 kg/m3) y 31,5% (3,5 kg/m3) por la tilapia nilótica, lo que indica un incremento de casi siete veces la biomasa inicial. El rendimiento total del bicultivo (8,7 a 11,4 kg/m3), estuvo ligeramente por debajo de los registros de Poleo et al. (2011) para cachama (12,5 kg/m3) y Kubitza (2011) para tilapia (12 kg/m3), y muy por debajo del reporte de Luo et al. (2014) para tilapia nilótica (44,9 kg/m3) cultivada en BFT y RAS. Sin embargo, los resultados de rendimiento del bicultivo son mayores a los alcanzados por Azim y Little (2008), quienes reportaron rendimientos de 4,9 kg/m3 para la tilapia nilótica. Es importante resaltar que, a pesar que el rendimiento del bicultivo es relativamente bajo, de todas maneras está por encima de lo que se obtiene en los sistemas tradicionales en estanques en tierra (0,5-1 kg/m3) (Lango, 2012).
El FCA para el bicultivo se estimó por debajo de 2 cuando se alimentó con 16% PB (1,6) y 32% PB (1,2); sin embargo, cuando se alimentó con 24% PB su valor promedio se estimó en 0,9 (tabla 4). Avnimelech (2007) afirmó que características de la dieta como cantidad, calidad, palatabilidad y métodos de alimentación inducen a los peces a la búsqueda y aprovechamiento de alimento natural disponible en los flóculos, lo cual tendría un efecto importante sobre el FCA. Azim y Little (2008) obtuvieron un FCA (3,4 y 3,5) menos eficiente en un cultivo de tilapia nilótica, bajo BFT, alimentado con 24% y 35% PB, respectivamente. Mientras que Widanarni y Maryam (2012) reportaron FCA de 1,4 (25 tilapias/m3) y de 2,0 (100 tilapias/m3), conversiones similares a las obtenidas en el presente estudio.
La sobrevivencia fue alta (>80%) sin observarse diferencia significativa entre los diferentes tratamientos. Poleo et al. (2011), en sistemas superintensivos de cachama blanca, reportaron altas sobrevivencias (92 ± 7%); por su parte, Azim y Little (2008) registraron sobrevivencias de 100% en cultivo de tilapia nilótica en esos mismos sistemas. De igual forma, Luo et al. (2014) compararon el desempeño de tilapia nilótica en BFT y RAS y reportaron sobrevivencias del 100% en ambos sistemas. Los resultados de sobrevivencia del presente estudio fueron consecuencia del bienestar y adaptación de los animales al sistema de cultivo, lo que es respaldado por el K obtenido (1,9-2,2), el cual estuvo cercano a 2 en las especies del bicultivo.
Según Usgame et al. (2007), el costo promedio de producción de 1 kg de tilapia en Colombia es de COP $3.650; sin embargo, en el bicultivo, cuando se alimentó con 24% PB, se obtuvo un costo más bajo (COP $3.148/kg) influenciado por el FCA (0,9-1,6). No obstante, cuando se alimentó con 32%, se incrementó a COP $4.445/ kg, quedando por encima del costo de producción nacional. Al desglosar los costos, se observó que el alimento representó el ítem de mayor incidencia (49,2-63,3%) y la energía eléctrica solo representó entre 10,3 y 14,2% de los costos de producción. El sistema BFT se caracteriza por su dependencia de la energía eléctrica, puesto que demanda un eficiente sistema de aireación que garantice una adecuada estabilización y desarrollo de un ambiente favorable para el bienestar de los animales del cultivo. Según Kubitza (2011), la energía eléctrica podría representar hasta el 15% de los costos de producción en el sistema BFT, pero anotó que los costos pueden variar según las condiciones de cada piscicultura y los precios en cada país.
El análisis proximal de los flóculos mostró que la proteína bruta fue significativa (36%) cuando se alimentó con 32% de PB; sin embargo, en los tratamientos en los que se alimentó con 16% y 24% PB, los flóculos registraron 29% PB; por su parte, registraron un contenido de lípidos bajo, entre 0,5 y 0,8%, que se relaciona con el origen vegetal de la dieta ofrecida. Los reportes en la literatura sobre la composición proximal de los flóculos muestran notoria variabilidad en los resultados; así, Widanarni y Maryam (2012) reportaron flóculos con altos niveles de proteínas (39-48%) y lípidos (12,6-43,3%) en un cultivo de tilapia nilótica en BFT alimentada con 32% PB. Sin embargo, Luo et al. (2014) reportaron flóculos con 30,9% de PB y 1,3% de lípidos en un cultivo de tilapia nilótica alimentado con 43,6% PB y 6,5% de lípidos; además, consideraron que las tilapias cultivadas en BFT presentaron mejor FCA (1,20) que las cultivadas en RAS (1,47) debido al aporte proteico del floc bacteriano. Widanarni y Maryam (2012) señalaron que es probable contar con altos niveles de lípidos en los flóculos cuando lo integran mayoritariamente diatomeas.
Los resultados del presente estudio, y de las investigaciones citadas anteriormente, permiten inferir que la inclusión de un mayor porcentaje de proteína en la dieta no garantiza lograr mayores niveles proteicos en los flóculos, debido a que ello depende principalmente de la composición biológica de estos (Azim y Little 2008; Ju et al. 2008). Sin embargo, Sabry Neto et al. (2015) indicaron que el exceso de proteína en los flóculos puede estar asociado al suministro de fuentes de nitrógeno no proteico (urea, cloruro de amonio, nitrato de amonio, entre otros) utilizados en la activación del biofloc, lo cual puede reflejarse en el valor de la proteína bruta de los flóculos.
De Schryver y Verstraete (2009) sugirieron que el nivel de ceniza en los flóculos bacterianos depende de la fuente carbono empleada para el control del amonio. Widanarni y Maryam (2012) reportaron ceniza entre 25,1 y 28,7% utilizando melaza, mientras que Hussain et al. (2014) con harina de maíz y arroz, encontraron 18% de ceniza. Los valores de ceniza del presente estudio (15,8 y 21,5%), están en el rango de los reportes con melaza y harinas, pero difieren de flóculos formados a partir de glucosa, en los cuales el nivel de ceniza no superó 6% (Long et al. 2015). Azim y Little (2008) reportaron flóculos de 3,8 y 4,0% de fibra cruda cuando alimentaron con dieta que contenía 2,8 y 2,3% de fibra, respectivamente. Widanarni y Maryam (2012) encontraron que el nivel de fibra aumentó con la densidad del cultivo, reportando valores de 3,7% de fibra a la densidad de 25 peces/m3, mientras que a 100 peces/m3 fue de 4,5%. Los valores de fibra cruda en el bicultivo fueron altos (8,4 y10,3%) comparados con los registros anteriores. La fibra cruda en los flóculos fue 2,6 veces mayor a la del alimento, lo cual sugiere que no fue degradada y se fue acumulando en los flóculos a medida que transcurrió el tiempo de cultivo y la biomasa se incrementó. Rajkumar et al. (2015) adicionaron como fuentes de carbono melaza, harina de yuca y harina de trigo en un cultivo BFT, en los cuales obtuvieron 12,9, 15,3 y 16,5% de fibra cruda, respectivamente, confirmando el incremento de la fibra cruda en los flóculos bacterianos sin depender de la fibra en la dieta.
Millamena (2002) sugirió que los niveles de ceniza y fibra aceptables dependen del hábito alimenticio de la especie; pero que en general, para peces omnívoros, la ceniza debe ser menor a 13%, mientras que la fibra no debe superar 9,0% (Lanna et al. 2004). En general, el análisis proximal de los flóculos del presente estudio presenta niveles de proteína bruta adecuada (29-36%) para las especies en cultivo pero con niveles bajos de lípidos (<1%). Hussain et al. (2014) registraron valores de proteína de los flóculos de 39% (agua dulce) y 41% (agua salada), lo cual les permitió sugerir que la proteína microbiana podría ser una fuente de sustitución de la harina de pescado u otras fuentes de proteínas en la alimentación de peces y camarones. Azim y Little (2008) reportaron que las tilapias aprovecharon los flóculos como alimento en cultivo BFT.
El volumen de flóculos es el resultado del crecimiento microbiano, restos de ración no ingerida y heces (Melo-Filho 2013). En el presente estudio, el volumen promedio osciló entre 56,6-117,6 ml/l, sin observarse diferencia significativa entre estos valores (P < 0,05). Avnimelech (2007), señaló que el exceso de sólidos en cultivos superintensivos puede perjudicar a los peces y sugirió que los valores de sólidos sedimentables en cultivo de tilapias en BFT deben mantenerse entre 20 y 30 ml/l, ya que valores por encima pueden causar dificultades respiratorias y afectar la ingesta de alimento; sin embargo, en el bicultivo, los altos volú|menes de floc se sugiere no afectaron el crecimientos de las especies, ya que los valores de oxígeno disuelto y la saturación del mismo mantuvieron valores altos (8,0 mg/l y 103%) y el K de las especies cultivadas estuvo cercano a 2. Furtado et al. (2011) recomendaron un volumen de floc en el rango de 67-100 ml/l para el adecuado desarrollo de camarones en sistema BFT.
En el presente estudio, a pesar que se realizaron cosechas de floc de manera periódica, se observó que los volúmenes de floc se mantuvieron altos durante todo el cultivo, especialmente cuando se alimentó con 16% PB (117,6 ± 55,6 ml/l), lo cual se piensa es consecuencia de la adición de carbono soluble (melaza) y la composición de la dieta utilizada; en el tratamiento en el que se ofreció 16% PB, el nivel de almidón (35,2%) fue 1,4 (24% PB) y 1,6 veces mayor (32% PB) que las otras dietas.
CONCLUSIÓN
En las condiciones experimentales del presente estudio las especies del bicultivo registraron su mejor crecimiento cuando fueron alimentadas con dieta de 24% de PB de origen vegetal, logrando sobrevivencias de 98%, rendimiento de 11,4 kg/m3 y costo de producción de COP $3.148/ kg de pescado. El análisis proximal de los flóculos registra niveles de proteína bruta (29-36% PB) adecuada para la cachama blanca y la tilapia nilótica; pero con niveles bajos de lípidos (<1%).
AGRADECIMIENTOS
A la Universidad de Córdoba por la financiación del proyecto y al Instituto de Investigación Piscícola de la Universidad de Córdoba (cinpic) por sus apoyo con infraestructura y equipos para el desarrollo del experimento. A la Universidad Nacional de Colombia-sede Medellín por los servicios de laboratorio prestados.
REFERENCIAS
Avnimelech Y. 2007. Feeding with microbial flocs by tilapia in minimal discharge bioflocs technology ponds. Aquaculture. 264(1-4): 140-147. Doi: 10.1016/j.aquaculture.2006.11.025. [ Links ]
Avnimelech Y. 2012. Biofloc technology: a practical guide book. 2° ed. Baton Rouge (LU): World Aquaculture Society. [ Links ]
Ayazo-Genes JE, Pertuz-Buelvas VM, Bru-Cordero SB, Atencio-García VJ, Pardo-Carrasco SC. 2014. Ensayos preliminares en la preparación y estabilización de un inóculo de biofloc para cultivo de peces. En: Memorias VI Congreso Colombiano de Acuicultura; 2014 oct. 8-10; Villavicencio (CO): Unillanos. p. 57. [ Links ]
Azim M, Little D. 2008. The biofloc technology (BFT) in indoor tanks: Water quality, biofloc composition and growth and welfare of Nile tilapia Oreochromis niloticus. Aquaculture. 283(1-4): 29-35. Doi: 10.1016/j.aquacultu-re.2008.06.036. [ Links ]
Bagenal TB, Tesch FW. 1978. Age and growth. In: Bagenal T, editor. Methods for assessment of fish production in fresh waters. IBP Handbook No 3. 3° ed. Oxford, London, Edinburgh, Melboure: Blackwell Science Publications. p. 101-136. [ Links ]
Crab R, Avnimelech Y, Defoirdt T, Bossier P, Verstraete W. 2007. Nitrogen removal techniques in aquaculture for a sustainable production. Aquaculture. 270(1-4): 1-14. Doi: 10.1016/j.aquaculture.2007.05.006. [ Links ]
Crab R, Defoirdt T, Bossier P, Verstraete W. 2012. Biofloc technology in aquaculture: Beneficial effects and future challenges. Aquaculture. 356-357: 351-356. Doi: 10.1016/j.aquaculture.2012.04.046. [ Links ]
De Schryver P, Crab R, Defoirdt T, Boon N, Verstraete W 2008. The basics of bio-flocs technology: the added value for aquaculture. Aquaculture. 277(3-4): 125-137. Doi: 10.1016/j.aquaculture.2008.02.019. [ Links ]
De Schryver P, Verstraete W. 2009. Nitrogen removal from aquaculture pond water by heterotrophic nitrogen assimilation in lab-scale sequencing batch reactors. Biores Technol. 100(3): 1162-1167. Doi: 10.1016/j.biortech.2008.08.043. [ Links ]
Díaz M, Alva R, Veneros B, Dávila F, Lujan L, Plasencia W, Mendoza F. 2012. Cultivo semiintensivo de tilapia, Oreochromis niloticus, en estanques de concreto en el caserío Palo Blanco (Cascas, La Libertad-Perú). Rebiol. 32(2): 99-107. [ Links ]
Ebeling J, Timmons M, Bisogni J. 2006. Engineering analysis of the stoichiometry of pho-toautotrophic, autotrophic, and heterotrophic control of ammonia-nitrogen in aquaculture in aquaculture production systems. Aquaculture. 257(1-4): 346-358. Doi: 10.1016/j.aquaculture.2006.03.019. [ Links ]
Ekasari J, Crab R, Verstraete W. 2010. Primary nutritional content of bio-flocs cultured with different organic carbon sources and salinity. Hayati J Biosc. 17(3): 125-130. Doi: 10.4308/hjb.17.3.125. [ Links ]
Emerenciano M, Cuzon G, Arevalo M, Gaxiola G. 2014. Biofloc technology in intensive broodstock farming of the pink shrimp Farfantepenaeus duorarum: spawning performance, biochemical composition and fatty acid profile of eggs. Aquac Res. 45(10): 1713-1726. Doi: 10.1111/are.12117. [ Links ]
Escobar J, Reinoso V, Landinez M. 2006. Efecto del nivel de energía y proteína en la dieta sobre el desempeño productivo de alevinos de Oreochromis niloticus, variedad chitralada. Rev Med Vet. 12: 89-97. [ Links ]
Furtado P, Poersch L, Wasielesky Jr W. 2011. Effect of calcium hydroxide, carbonate and sodium bicarbonate on water quality and zootechnical performance of shrimp Litopenaeus vannamei reared in bio-flocs technology (BFT) systems. Aquaculture. 321(1-2): 130-135. Doi: 10.1016/j.aquaculture.2011.08.034. [ Links ]
Gokcek K. 2011. Tilapia, Oreochromis niloticus (Linnaeus, 1758) and Himri barbel, Caraso-barbus luteus (Heckel, 1843) duoculture in net cages. J Anim Vet Adv. 10(9): 1102-1105. Doi: 10.3923/javaa.2011.1102.1105. [ Links ]
Granado A. 2000. Efecto de la densidad de cultivo sobre el crecimiento del morocoto Piaractus brachypomus, Cuvier, 1818, (Pisces: Characiformes) confinado en jaulas flotantes. Saber, Universidad de Oriente, Venezuela. 12(2): 3-7. [ Links ]
Gullian-Klanian M, Aramburu-Adame C. 2013. Performance of Nile tilapia Oreochromis niloticus fingerlings in ahyper-intensive recirculating aquaculture system with low water exchange. Lat Am J Aquat Res. 41(1): 150-162. Doi: 103856/vol41-issue1-fulltext-12. [ Links ]
Hargreaves A. 2006. Photosynthetic suspended-growth systems in aquaculture. Aquac Eng. 34(3): 344-363. Doi: 10.1016/j.aquaeng.2005.08.009. [ Links ]
Hernández G, González J, Alfonso E, Salmeron Y, Pizzani P. 2010. Efecto de la relación energía proteína sobre el desempeño productivo en larvas de Coporo (Prochilodus maride). Zoot Trop. 28(2): 173-182. [ Links ]
Hussain AS, Mohammad DA, Ali EM, Sallam WS. 2014. Nutrient Optimization for the Production of Microbial Flocs in Suspended Growth Bioreactors. J Arabian Aquac Soc. 9(1): 113-129. [ Links ]
Ju ZY, Forster I, Conquest L, Dominy W. 2008. Enhanced growth effects on shrimp (Litopenaeus vannamei) from inclusion of whole shrimp floc or floc fractions to a formulated diet. Aquacult Nutr. 14(6): 533-543. [ Links ]
Kubitza F. 2011. Criação de tilapias em sistemas com bioflocos sem renovação de agua. Panorama Aquic. 21(125): 14-23. [ Links ]
Lango J. 2012. Floc bacteriano: sistemas intensivos de producción de tilapia. Caso México. En: Memorias FISH RAPCO. Jalisco (MX). p. 55. [ Links ]
Lanna EA, Pezzato L, Furuya W, Vicentini CA, Cecon PR, Barros MM. 2004. Fibra bruta e óleo em dietas práticas para alevinos de tilápia do Nilo (Oreochromis niloticus). Rev Bras Zootec. 33(6)(Supl. 3): 2177-2185. [ Links ]
Long L, Yang J, Li Y, Guan C, Wu F. 2015. Effect of biofloc technology on growth, digestive enzyme activity, hematology, and immune response of genetically improved farmed tilapia (Oreochromis niloticus). Aquaculture. 448: 135-141. Doi: 10.1016/j.aquaculture.2015.05.017. [ Links ]
Luo G, Gao Q, Wang C, Liu W, Sun D, Li L, Tan H. 2014. Growth, digestive activity, welfare, and partial cost-effectiveness of genetically improved farmed tilapia (Oreochromis niloticus) cultured in a recirculating aquaculture system and an indoor biofloc system. Aquaculture. 422-423: 1-7. Doi: 10.1016/j.aquaculture.2013.11.023. [ Links ]
Makino M, Matsuda H, Sakurai Y. 2009. Expanding fisheries co-management to ecosystem-based management: A case in the Shiretoko World Natural Heritage area, Japan. Marine Policy. 33(2): 207-214. Doi: 10.1016/j.marpol.2008.05.013. [ Links ]
Melo-Filho M. 2013. Aplicação dos processos de nitrificação e desnitrificação em um sistema de reuso direto planejado da água para cultivo superintensivos de camarão marinho [dissertação mestrado]. [Florianópolis (BR)]: Universidad Federal de Santa Catarina. [ Links ]
Merino MC, Bonilla SP, Bages F. 2013. Diagnóstico del estado de la Acuicultura en Colombia. Bogotá (CO): Autoridad Nacional de Pesca y Acuícultura-AUNAP / MinAgricultura / FAO. [ Links ]
Millamena O. 2002. Replacement of fish meal by animal by-product meals in a practical diet for grow-out culture of grouper Epinephelus coloides. Aquaculture. 204(1-2): 75-84. Doi: 10.1016/S0044-8486(01)00629-9. [ Links ]
Oviedo M, Brú S, Atencio V, Pardo S. 2013. Potencialidad de la región costera de Córdoba (Colombia) para el cultivo de tilapia nilótica. Rev MVZ Córdoba. 18(3): 3781-3789. [ Links ]
Poleo G, Aranbarrio J, Mendoza L, Romero O. 2011. Cultivo de cachama blanca en altas densidades y en dos sistemas cerrados. Pesqui Agropecu Bras. 46(4): 429-437. [ Links ]
Rajkumar M, Kumar P, Avavind R, Venilla A, Bharti V, Purushothaman C. 2015. Effect of different biofloc system on wáter quality, biofloc composition and growth performance in Lito-penaeus vannamei (Boone, 1931). Aquac Res. 47(11): 3432-3444. Doi: 10.HH/are.12792. [ Links ]
Rakocy JE. 1989. Hydroponic lettuce production in a recirculating fish culture system. Virgin Islands, Agricultural Experiment Station. Island Perspect. 3: 4-10. [ Links ]
Ray AJ, Drury T, Cecil A. 2017. Comparing clearwater RAS and biofloc systems: Shrimp (Lito-penaeus vannamei) production, water quality, and biofloc nutritional contributions estimated using stable isotopes. Aquacult Eng. 77: 9-14. Doi: 10.1016/j.aquaeng.2017.02.002. [ Links ]
Ray AJ, Seaborn G, Leffler JW, Wilde SB, Lawson A, Browdy CL. 2010. Characterization of microbial communities in minimal-exchange, intensive aquaculture systems and the effects of suspended solids management. Aquaculture. 310(1-2): 130-138. Doi: 10.1016/j.aquacultu-re.2010.10.019. [ Links ]
Sabry Neto H, Santaella ST, Nunes AJ. 2015. Bioavailability of crude protein and lipid from biofloc meals produced in an activated sludge system for white shrimp, Litopenaeus vannamei. Rev Bras Zootec. 44(8): 269-275. Doi: 10.1590/S1806-92902015000800001. [ Links ]
Tacón A, Cody J, Conquest L, Divakaran S, Forster L, Decamp O. 2004. Effect of culture system on the nutrition and growth performance of Pacific white shrimp Litopenaeus vannamei (Boone) fed different diets. Aquacult Nutr. 8(2): 121-137. Doi: 10.1046/j.1365-2095.2002.00199.x. [ Links ]
Usgame D, Usgame G, Valverde C. 2007. Agenda productiva de investigación y desarrollo tecnológico para la cadena productiva de la tilapia. Bogotá (CO): Ministerio de Agricultura y Desarrollo Rural. [ Links ]
Vásquez-Torres W, Hernández-Arévalo G, Gutiérrez-Espinosa MC, Yossa MI. 2012. Efecto del nivel de proteína sobre el crecimiento y parámetros séricos en cachama blanca Piaractus brachypomus. Rev Col Cienc Pec. 25(3): 450-461. [ Links ]
Weatherley AH. 1972. Growth and ecology of fish populations. 1° ed. London (UK): Academic Press Inc. [ Links ]
Widanarni J, Maryam S. 2012. Evaluation of biofloc technology application on water quality and production performance of Red Tilapia Oreochromis sp. cultured at different stocking densities. Hayati J Bioscience. 19(2): 73-80. Doi: 10.4308/hjb.19.2.73. [ Links ]
Article citation:
Brù-Cordero SB, Pertùz-Buelvas VM, Ayazo-Genes JE, Atencio-Garcia VJ, Pardo-Carrasco SC. 2017. Bicultivo en biofloc de cachama blanca - Piaractus brachypomus - y tilapia nilôtica - Oreochromis niloticus - alimentadas con dietas de origen vegetal. [Cachama - Piaractus brachypomus - and Nile tilapia - Oreochromis niloticus - biculture in biofloc fed diets of vegetable origin]. Rev Med Vet Zoot. 64(1): 44-60. Doi: 10.15446/rfmvz.v64n1.65824.