INTRODUCCIÓN
La Orinoquia es la segunda área hidrográfica con mayor oferta hídrica total superficial y la primera con mayor potencial inundable en Colombia, dentro de la cual la zona hidrográfica con mayor área de cuerpos de agua es el departamento del Meta, con sabanas inundables, morichales, lagunas, zuros y esteros, entre otros (Bustamante, 2019; Instituto de Hidrología, Meteorología y Estudios Ambientales [IDEAM], 2018; Moreno-Rodríguez et al., 2017). Esta región posee ecosistemas acuáticos altamente influenciados por factores geomorfológicos, ecológicos y antropogénicos, donde existen estresores ambientales derivados de las diferentes actividades productivas, que conllevan a la degradación del hábitat, alteraciones hidrológicas, procesos de eutrofización, así como a alteración en la biota acuática (Ruiz-Picos et al., 2016; Wijesiri et al., 2018). A escala de cuenca, el uso inadecuado del suelo, así como el crecimiento poblacional en áreas urbanas y rurales, son los estresores más comunes que afectan las cuencas hidrográficas (Rimoldi et al., 2018).
La ciudad de Villavicencio (Meta, Colombia) es atravesada por el río Ocoa, el cual provee diferentes servicios ecosistémicos: abastecimiento para diferentes usos como agricultura, producción pecuaria y minería, entre otros (Torres-Mora et al., 2015). También es fuente receptora de los 79 % de vertimientos de aguas residuales domésticas e industriales de la ciudad (Trujillo-González et al., 2017). Esto repercute en las diferentes afectaciones, y en consecuencia, en la respuesta ecológica de los organismos que allí habitan en las condiciones ambientales predominantes (Casanoves et al., 2011).
La comunidad de macroinvertebrados acuáticos, ha sido ampliamente usada en las evaluaciones y monitoreos de las condiciones ambientales de ríos (Li et al., 2010). Algunas métricas como la densidad, abundancias y riqueza de estos organismos acuáticos, pueden ayudar a determinar la calidad ecológica del agua (Zamora, 2015). Específicamente, la riqueza y abundancia de ordenes como Ephemeroptera, Plecoptera y Trichoptera (EPT), se han tomado como referente de diversidad taxonómica y como indicadores de buena calidad de agua (Poff et al., 2006; Roldán-Pérez, 2016).
Recientemente se ha comenzado a emplear otro enfoque de análisis de la diversidad funcional (Baker et al., 2023; Espinosa et al., 2023; Lee et al., 2023; Luiza-Andrade et al., 2023; Malacarne et al., 2023), este se basa en rasgos funcionales que son características biológicas que influyen en los procesos ecosistémicos (Córdova-Tapia y Zambrano, 2015; Díaz y Cabido, 2001Aj; Tilman, 2001), y que permiten detectar cambios en los ecosistemas debido a afectaciones ambientales (Merritt et al., 2002; Poff et al., 2006).
Por lo anterior, este trabajo tuvo como objetivo determinar la diversidad taxonómica y funcional de insectos acuáticos (EPT) en dos periodos hidrológicos contrastantes (aguas bajas y aguas ascendentes) respecto del uso del suelo (natural, agricultura, ganadería, piscicultura, urbano e industrial), en el río Ocoa en la Orinoquia colombiana.
ÁREA DE ESTUDIO
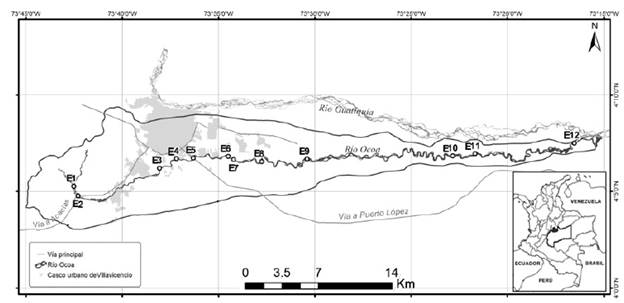
La cuenca hidrográfica del río Ocoa se encuentra localizada en el departamento del Meta, en el municipio de Villavicencio y cuenta con una extensión de 28290 ha. En la parte alta presenta pendientes medias, precipitaciones de 5000 mm/año, humedad relativa de 84 % y temperatura de 15,5 °C a 30 °C. En la parte plana baja hay precipitaciones de hasta 2.700 mm/año, humedad relativa de 79 % y temperatura de 19,5 °C a 33,5 °C. El río Ocoa nace a 1155 m de altitud en la vereda Samaria y desemboca en el río Guatiquía a 225 m de altitud. Cuenta con un recorrido de 54,89 km; la cuenca alta dominada por un sustrato de piedras y gravas en una matriz arcillo-arenosa; y relieve plano desde la cuenca media-baja con dominio de arena, gravas y guijarros en una base arenosa (Osorio-Ramírez et al., 2015).
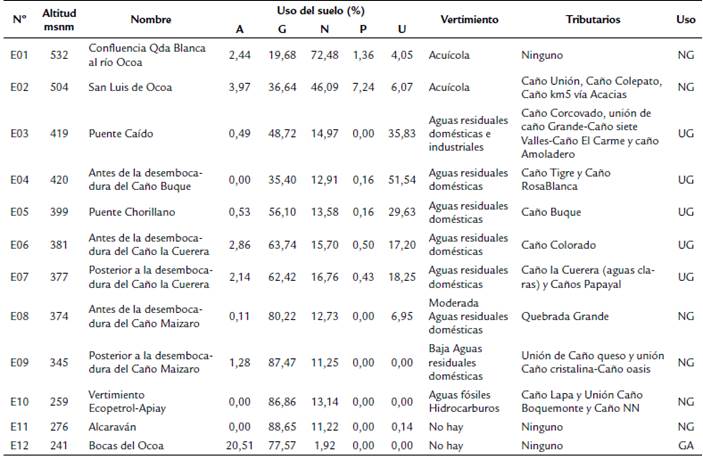
Se establecieron 12 estaciones (E01-E12) de 100 m cada una, a lo largo del gradiente de elevación del río, considerando la accesibilidad al cuerpo del agua con una distancia máxima de 19,68 km y mínima de 0,55 km (Tabla 1). Se realizaron dos muestreos en periodos hídricos de aguas bajas (AB) (3 de febrero a 9 de marzo de 2015) y aguas ascendentes (AA) (18 marzo a 9 de abril de 2015). Alrededor de cada estación se definieron los usos del suelo en un radio de 2000 m según la metodología CORINE Land Cover (IDEAM et al., 2011), mediante el procesamiento de mapas y análisis espacial en ArcGIS, cartografía de fuente del Instituto Geográfico Agustín Codazzi (IGAC); a partir de la ponderación de porcentajes de coberturas vegetales y usos del suelo, se seleccionaron cinco categorías, las cuales fueron: uso natural (N, zonas de protección, bosques de galería, arbustos, matorrales y vegetación secundaria); uso urbano e industrial (U, uso habitacional, industrial y rural); agricultura (A, cultivos, pastos y espacios heterogéneos); piscicultura (P, estanques y represas); ganadería (G, extensiva y semiextensiva). En cada estación los usos del suelo se agruparon según los dos usos más representativos, así E1-E2 y E8-E11 correspondieron al uso natural y ganadería (NG), E3-E7 al uso urbano e industrial y ganadería (UG) y E12 al uso ganadería y agricultura (GA) (Tabla 1).
MATERIAL BIOLÓGICO
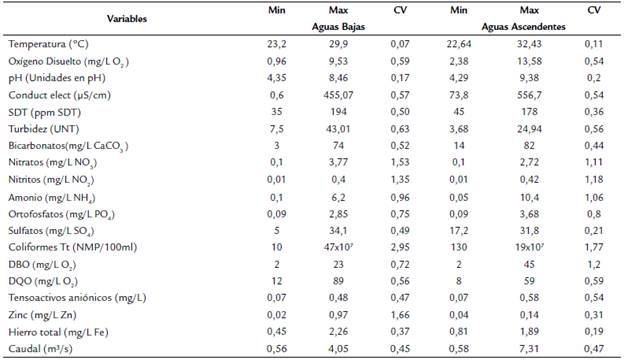
Se recolectaron siete réplicas con red surber (250 µm de abertura de malla, 900 cm2 de área) que posteriormente se integraron en una sola muestra por estación de muestreo. Los individuos se conservaron en etanol (70 %). La identificación funcional se basó en Poff et al. (2006), Schmera et al. (2015), y los grupos de alimentación funcional en Ramírez y Gutiérrez (2014), lo que permitió seleccionar 12 rasgos correspondientes a historia de vida, movilidad, morfología y ecología, con un total de 37 estados de rasgos; la agrupación se asignó a cada unidad taxonómica (género) con la codificación del estado de rasgo mediante un enfoque binario por medio de características individuales de los organismos. La identificación taxonómica se llevó a nivel de género con base en las claves de Domínguez et al. (2006), Domínguez y Fernández (2009) y Hamada et al. (2014). El material biológico fue depositado en el Museo de Historia Natural Unillanos (MHNU-MA). Adicionalmente se tomaron muestras de agua para determinación de 19 variables fisicoquímicas y microbiológicas en laboratorio (Tabla 2).
ANÁLISIS DE DATOS
La diversidad taxonómica se halló con números efectivos de géneros, con el paquete iNEXT (Hsieh et al., 2022): riqueza (0D), exponente de la entropía de Shannon (1D) e inverso de la concentración de Simpson (2D) (Jost, 2006), basados en el tamaño de muestra con intervalos de confianza del 95 %. La diversidad funcional se analizó a partir de los índices: FRic (riqueza funcional), FEve (equidad funcional), FDiv (divergencia funcional) y FDis (dispersión funcional) (Pla et al., 2011); en las estaciones con menos de dos géneros los índices arrojaron NA (No Aplica) por lo que se usó el índice RaoQ. Estos análisis se realizaron con RStudio (2020), y el paquete mFD (Magneville et al., 2022).
Se realizó un análisis de redundancia (RDA), con el paquete vegan (Oksanen et al., 2019) para determinar la relación entre la diversidad taxonómica y las variables ambientales (fisicoquímicas, microbiológicas y usos del suelo). Se realizó previamente análisis de colinealidad y correlación de Spearman (>70 %), y estandarización con puntuación z; el procedimiento forward selection permitió seleccionar las variables más importantes (Blanchet et al., 2008). Por último, se ejecutó un análisis multivariado (RLQ) para determinar la relación entre las variables ambientales (matriz R), la abundancia (matriz L) y los rasgos funcionales (matriz Q), con el paquete ade4 (RStudio, 2020).
RESULTADOS
Comportamiento de variables ambientales. Las variables ambientales que presentaron mayor dispersión en los dos periodos hídricos fueron los coliformes totales, nitratos y nitritos; el mayor valor de caudal se registró en E12 y E3. El menor valor en oxígeno disuelto se encontró en E6 en aguas bajas (AB) y E4 en aguas ascendentes (AA). Las estaciones que presentaron el mayor porcentaje de uso de suelo natural fueron E1 (72 %) y E2 (46 %); las estaciones sometidas al uso ganadería y natural con porcentajes mayores al 90 % fueron E8, E9, E10 y E11; las estaciones con mayor uso del suelo urbano e industrial fueron E4 (52 %), E3 (36 %) y E5 (29,6 %). La estación E12 presentó 98 % en uso del suelo ganadería y agricultura. Por otra parte, las variables ambientales (fisicoquímicas, microbiológicas y de uso de suelo) que registraron influencia significativa sobre la riqueza de taxones fueron la temperatura, oxígeno total, SDT, turbidez, nitritos, amonio, sulfatos, DQO, zinc, hierro total y caudal (Tabla 1).
Composición taxonómica. Las estaciones E5, E6, E7 y E10 no registraron organismos durante las colectas. El ensamblaje de insectos acuáticos (EPT) estuvo conformado por 12675 individuos. Trichoptera fue el orden más abundante (80,19 %) distribuido en cinco familias y 14 géneros; seguido por Ephemeroptera (19,50 %), distribuido en cuatro familias y 12 géneros. Plecoptera fue el menos abundante (0,31 %), con Perlidae (Anacroneuria).
En Ephemeroptera la familia Leptohyphidae fue la más abundante (46,92 %), seguida por Baetidae (39,27 %), Leptophlebiidae (13,72 %) y Caenidae (0,04 %); seis géneros representados por un individuo (Baetodes, Caenis, Cloeodes, Farrodes, Nanomis y Varipes) y los más abundantes fueron Americabaetis (681 individuos) en AB y AA (190 individuos), y Lumahyphes (1023 individuos) en AB y AA (47 individuos). En Trichoptera, la familia Hydropsychidae fue la más abundante (99,32 %), seguida por Hydroptilidae (0,53 %), Glossosomatidae (0,12 %), Helicopsychidae (0,02 %) y Philopotamidae (0,009 %); cinco géneros estuvieron representados con menos de dos individuos (Alisotrichia, Cerasmatrichia, Chimarra, Helicopsyche y Neotrichia) y los más abundantes fueron Smicridea (9932 individuos) en AB y AA (896 individuos), y Leptonema (163 individuos) en AB y AA (62 individuos).
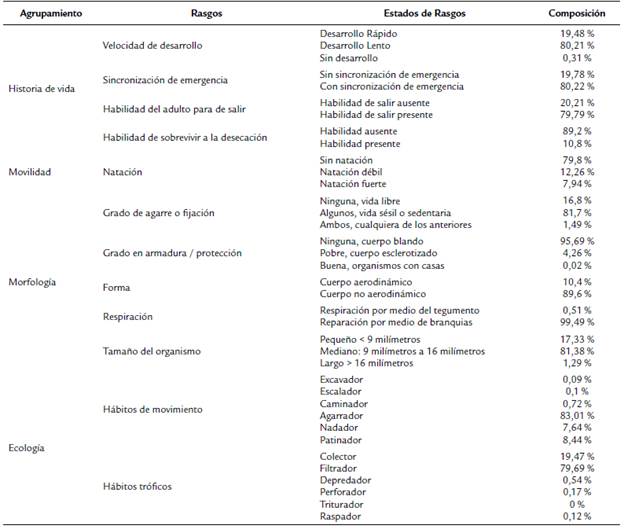
Composición funcional. En la característica de agrupamiento historia de vida se registró principalmente desarrollo lento, sincronización de emergencia, habilidad del adulto para salir y sin habilidad para sobrevivir a la desecación; en el rasgo de natación, predominó la movilidad sin natación; y en la característica de morfología, prevaleció el estado de rasgo sésil y/o sedentario, sin protección (blandos), no aerodinámicos, estado de respiración por medio de branquias y tamaño maduro de 9-16 mm (Tabla 3). El estado triturador del rasgo hábito trófico y el estado plastrón del rasgo respiración no se registraron en ninguna de las estaciones en los dos periodos hidrológicos.
Tabla 3 Rasgos funcionales aplicados a EPT del río Ocoa (Fuente: Poff, et al. (2006), Ramírez y Gutiérrez (2014), Schmera, et al. (2015)).
Diversidad taxonómica. La mayor riqueza (0D) se registró en E1 en AB con 11,8 géneros efectivos; en esta estación se registraron cuatro géneros exclusivos: Cloeodes, Nanomis, Cerasmatrichia y Rhyacopsyche. Le siguió E12 en AA con 7,8 géneros efectivos y dos géneros exclusivos Farrodes y Protoptila. En lo que respecta a 1D los mayores valores se registraron en E12 (4,2 géneros efectivos) en AB, y E3 (3,5 géneros efectivos) en AA. En cuanto a 2D, el mayor número de géneros efectivos dominantes se registraron E12 (3,5 géneros efectivos) en AB y E9 (7,5 géneros efectivos) en AA.
Las estaciones que presentaron los valores más bajos de 0D, 1D y 2D (1 género efectivo) en aguas bajas (AB) fueron: E05, E07 y E09. En aguas ascendentes (AA) los valores más bajos de 0D y 1D (1 género efectivo) se presentaron en E2, E4, E5, E8 y E10; en cuanto a 2D los valores más bajos se registraron en E2, E4 y E8 (1 género efectivo).
Diversidad funcional. La mayor riqueza funcional se registró en las estaciones E1 en AB (FRic=0,36; 11 taxones registrados) y E12 en AA (FRic=0,08; tres taxones registrados). En E1(AB), los estados de rasgos no variaron en su totalidad para los rasgos respiración, hábitos tróficos y hábitos de movimiento (no se registraron los estados de rasgo caminador y patinador). En E12 (AA) solo se registraron seis de 12 estados de rasgo en la agrupación ecología. La menor riqueza funcional se presentó en E12 en AB (FRic=0,17) y E11 en AA (FRic=0,006). Las estaciones E2, E4 y E8 presentaron NA en los dos periodos.
La mayor equidad funcional se registró en las estaciones E11 (FEve=0,78) en AA y E3 (FEve=0,45) en AB; éstas no presentaron estados del rasgo hábito trófico (colectores, filtradores), y hábito de movimiento (excavador, caminador). La menor equidad funcional se halló en E8 (FEve=0,03) en AB y E1 (FEve=0,04) en AA; ninguna presentó algunos estados de los hábitos movimiento (excavador, escalador, caminador, patinador) y tróficos (perforadores, raspadores). Por otra parte, la mayor divergencia funcional se presentó en E12 (FDiv=0,87) en AB y E11 (FDiv=0,81) en AA; la mayor dispersión funcional en E12 (FDis=0,641) en AB y E9 (0.65) en AA. El índice RaoQ obtuvo los valores más altos en E12 (RaoQ=0,06) en AB y E1 (RaoQ=0,07) en AA; las estaciones E2, E4, E8 y E10 registraron RaoQ=0 en ambos periodos y E9 en AA.
Análisis RDA. Cuatro variables fueron significativamente explicativas (49,3 %): amonio, DQO, turbidez y uso del suelo urbano e industrial (U); el primer eje (RDA1) explicó el 38,1 % de la variación, mientras que el segundo (RDA2) explicó el 7,6 % (ANOVA: F=3,88, p=0,001). En el primer eje se correlacionaron positivamente turbidez, DQO y uso del suelo urbano e industrial (U); mientras que en el segundo eje la variable amonio fue la principal responsable de la variación. Por otra parte, Americabaetis se correlacionó positivamente con turbidez y Baetodes con amonio; Smicridea se correlacionó negativamente con DQO, turbidez y uso del suelo urbano e industrial (Fig. 1).
Análisis RLQ. El análisis RLQ explicó una inercia total de 7,8 representada en los dos primeros ejes (61 % y 17,6 % respectivamente); estadísticamente no se evidenciaron relaciones significativas entre los rasgos funcionales y las variables ambientales (prueba de Monte-Carlo p=0,45), aunque el resultado de cuatro esquinas (Fourth-Corner) permitió evidenciar relaciones marginalmente significativas entre las variables turbidez (p<0,09) y zinc (p<0,07) con los rasgos funcionales. Por otra parte, se observaron algunas asociaciones como: el rasgo natación se correlacionó positivamente con las variables zinc, DQO y los géneros Baetodes, Thraulodes, Farrodes y Caenis, y de manera negativa con el rasgo forma; este último se asoció positivamente con los géneros Helicopsyche, Leptonema y negativamente con las variables zinc y DQO. El rasgo funcional hábitos de movimiento se asoció positivamente con turbidez, caudal, uso del suelo urbano e industrial y los géneros Tricorythodes y Lumahypes. Los rasgos desarrollo, agarre, tamaño del organismo maduro y hábitos tróficos se relacionaron positivamente con Smicridea, Metrichia, Orthotrichia, Neotrichia y Protoptila. Las variables ambientales amonio y usos del suelo se asociaron positivamente con el género Metrichia y negativamente con el rasgo habilidad del adulto para sobrevivir a la desecación.
DISCUSIÓN
Las altas abundancias de Ephemeroptera y Trichoptera en las estaciones de la parte baja del cauce se explicarían porque presentan varios tributarios de los cuales unos pocos se caracterizan por el exceso de materia orgánica, escaso transporte de arena, gravas y guijarros; además del microrrelieve plano con oportunidad de encharcamiento y similitudes en el mejoramiento de los valores de algunas variables fisicoquímicas, lo que permite el desarrollo y distribución característica de la biota acuática en el río (Mosquera-Restrepo y Peña-Salamanca, 2019; Zamora, 2015). Cabe señalar que en esa zona los porcentajes de uso urbano e industrial son menores al 8 %, con vertimiento de aguas residuales moderado a nulo y porcentajes mayores al 75 % en ganadería, lo que posiblemente influye positivamente en la abundancia y composición de insectos acuáticos (Horak et al., 2019) en esta zona del río Ocoa.
En cuanto a la composición funcional, varias características se asocian con el tipo de sustrato, ya que la disposición de arena y guijarros afectan la diversidad de estados de rasgos (Demars et al., 2012; Larsen et al., 2014). Por ejemplo, el estado fusiforme (aerodinámico) es vinculado con sustrato grueso donde el factor estresante es la corriente; no obstante, las asociaciones pueden incluir otros supuestos, como los usos del suelo, que afectan el sustrato del cauce y este a su vez la abundancia y/o riqueza de rasgos funcionales; así mismo, los estados del rasgo de respiración posiblemente son afectados por variables químicas (Ding et al., 2017; Lange et al., 2014) a lo largo del río.
El hábito movimiento correspondiente a agarrarse fue dominante en los diferentes tramos del río Ocoa; organismos extremadamente móviles pueden colonizar rápidamente varios microhábitats; además, debido a la deriva se posibilita una rápida reubicación e inspección de nuevos sustratos lo que les permite colonizar diferentes zonas dentro del río con diferentes usos del suelo (Wiggins y Mackay, 1978). Por otra parte, la vegetación asociada a la ganadería, uso del suelo común en varias estaciones, aporta materia orgánica disuelta (Scotti et al., 2020) que favorece la presencia de fi ltradores en la columna de agua, y colectores en el fondo del río (Cummins, 2016). La pérdida de sustratos leñosos, vegetación riparia o deforestación a lo largo del río (Torres-Mora et al., 2015) podría explicar la ausencia de trituradores, pues corresponden a aquellos organismos herbívoros recolectores, cuyos recursos alimenticios son plantas vasculares vivas, tejidos, hojarasca ribereña, algas filamentosas, entre otros (Amaral et al., 2015; Wiggins y Mackay, 1978).
Los géneros Smicridea y Leptonema (Trichoptera), generalmente se asocian a ríos relativamente veloces y cuentan con una alta capacidad de colonización de diversos sustratos (Duarte y Reinoso-Flórez, 2020). Así mismo Oxyethira y Metrichia (Hydroptilidae) fueron dominantes, semejante a lo registrado en otras regiones de Colombia (Duarte y Reinoso-Flórez, 2020; Principe et al., 2019). Las familias Glossomatidae, Helicopsychidae y Philopotamidae, posiblemente son afectadas por la influencia de contaminación orgánica, ya que se caracterizan por su sensibilidad alta a media (Chaux et al., 2018; Roldán-Pérez, 2016). Lumahyphes (Leptophlebiidae) dominante a lo largo del río, posiblemente se ve favorecido por la sedimentación del cauce (Torres-Mora et al., 2015) ya que prefieren zonas con gran cantidad de sedimento (Principe et al., 2019). El orden Plecoptera (Perlidae, Anacroneuria) está ampliamente distribuido en Colombia, sin embargo, se registró únicamente en la estación de la zona alta con predominio de uso del suelo natural en los dos periodos hidrológicos, reflejando su alta sensibilidad y preferencia por zonas poco impactadas ambientalmente (Mosquera-Restrepo y Peña-Salamanca, 2019; Roldán-Pérez, 2016).
La diversidad funcional fue afectada por los cambios físicos y químicos entre periodos hidrológicos, pues la temporada de lluvias (aguas ascendentes) afecta la ocurrencia de organismos (Horak et al., 2019). Además, la predominancia de uso de suelo natural en la zona alta favorece la diversidad funcional, mientras que ganadería en la zona media, posiblemente afecta en mayor grado la dinámica ecológica del río. Se ha encontrado que la agricultura y el uso natural del suelo favorecen la biota acuática a diferencia de otras actividades humanas (Giraldo et al., 2014), lo que permitiría que en la zona alta se presentara un nivel mayor de productividad y explotación de recursos, así como en la zona más baja del río (Scotti et al., 2020).
La baja equidad funcional está influenciada posiblemente por el escaso número de taxones, y por ende refleja un espacio de nicho subutilizado (Córdova-Tapia y Zambrano, 2015) en las estaciones dominadas por uso natural y ganadería en el río Ocoa. La divergencia funcional más alta se registró en las estaciones de la zona alta y baja con predominancia de uso del suelo natural, ganadería y agricultura, lo que favorece la variedad de rasgos funcionales y la complementariedad de nicho (Mason et al., 2013). En estas zonas las estaciones presentaron variaciones similares entre rasgos funcionales que no se evidenciaban en las demás zonas, por lo que hay mayor ocupación de nicho y redundancia funcional en las estaciones de cabecera y en la zona baja del río (England et al., 2021).
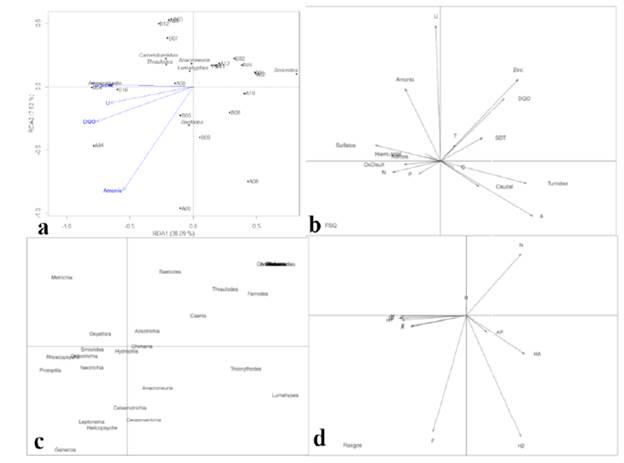
Figura 2 a. Diagrama RDA. Siglas: Demanda química de oxígeno (DQO). Abreviaturas: Aguas bajas (AB), aguas ascendentes (AA) y uso urbano e industrial (U). b. Diagrama RLQ. Matriz R: fisicoquímicos (FSQ). c. Matriz L: géneros. d. Matriz Q: rasgos. Abreviaturas: natación (N), forma (F), respiración (R), grado en armadura o protección (AP), hábitos de movimiento (HM), desarrollo (D), sincronización (S), agarre (A), tamaño del organismo maduro (T), hábitos tróficos (HT), habilidad del adulto para sobrevivir a la desecación (H2).
La mayor riqueza de géneros efectivos (0D) se presentó en la zona alta con predominancia de uso del suelo natural y en la zona baja donde predominó el uso del suelo ganadería y agricultura; el tramo alto del río presentó relieve inclinado, cauce con piedras y gravas, con fondo arcillo-arenoso, buena calidad fisicoquímica del agua que son características de una corriente conservada o de buena calidad (Torres-Mora et al., 2015; Zamora, 2015). Mientras que la estación de la parte baja, revela posibles mecanismos de autodepuración, con pH ligeramente básico, agua bien oxigenada y oligotrófica, debido al aumento en el cauce (63 %) y recuperación natural por procesos físicos, químicos y biológicos (Jaimes-Contreras y Granados-Martínez, 2016).
La baja diversidad registrada en la zona media del río posiblemente se debe a que varios tributarios (caños o arroyos) están afectados ambientalmente, y en la corriente principal hay vertimientos de aguas residuales (80 %), valores altos en bicarbonatos (Torres-Mora et al., 2015), valores bajos en oxígeno disuelto, variable fundamental para la biota (Mendoza et al., 2019) que afectan la composición y abundancia de organismos (Aguilera-Giraldo y Vásquez-Ramos, 2019). También se registraron los valores más altos en tensoactivos aniónicos, fuente importante de deterioro de calidad de agua, que junto a los ortofosfatos (>2,22 mg/LPO43-) asociados a contaminación por descargas domésticas y agrícolas señalan alta contaminación y eutrofización del sistema (Gómez-Anaya et al., 2017; Solari et al., 2013). Smicridea disminuyó drásticamente su abundancia a pesar de que ha registrado tolerancia a la contaminación (Vásquez-Ramos et al., 2014) y su preferencia alimentaria por materia orgánica particulada gruesa y fina (Álvarez-Soraca et al., 2017) ofertada ampliamente en el tramo medio del río; contrariamente, Americabaetis aumentó en estas condiciones de alta turbidez y DQO en el agua, género que ya ha sido asociado a condiciones de contaminación por materia orgánica (Rojas-Peña et al., 2021).
Dadas las características funcionales (habilidad para sobrevivir a la desecación, hábitos de movimiento adherirse o agarrarse) frecuentes a lo largo del río Ocoa se deduce el predominio de organismos con preferencia por sustratos rocosos resistentes al arrastre por caudal (Díaz-Rojas et al., 2020) que soportan variaciones en el régimen de variación de escorrentía (Ramírez et al., 2013), debido a actividades agrícolas, ganaderas y sedimentación del cauce (Salcedo et al., 2013). Por otra parte, los rasgos funcionales filtrador y colector que predominaron en las estaciones con uso del suelo ganadería, agrícola, urbano e industrial (zona intermedia del río) se han asociado a factores estresantes por altas cargas en nutrientes y sedimentos, bajo oxígeno disuelto, producto de deforestación, prácticas agrícolas y vertimientos (Tomanova et al., 2008), situaciones que conllevan adicionalmente a la disminución en la diversidad de los rasgos (Larsen et al., 2014).
El rasgo natación presentó agrupación con las variables zinc y DQO lo que podrían explicar el vínculo de la carga orgánica con la disponibilidad de oxígeno, pues el ensamblaje se constituyó 99,49 % por la presencia de branquias (Reynaga y Santos, 2012); también, son afectados por el zinc principalmente en el tamaño de sus branquias (Buchwalter y Luoma, 2005); además, los valores altos de zinc en ríos reducen el ensamblaje de insectos acuáticos (Iwasaki et al., 2018), lo que se refleja en aguas bajas en las estaciones con uso de suelo urbano e industrial.
CONCLUSIONES
Los usos del suelo no afectaron significativamente el ensamblaje de insectos acuáticos del río Ocoa (EPT), aunque se encontraron variaciones marcadas en la composición, diversidad y abundancia. Las estaciones de la zona baja relacionadas con el uso del suelo natural, ganadería y agricultura registraron la mayor abundancia y riqueza funcional en los dos periodos hidrológicos, mientras que en estaciones donde predomina la ganadería y el uso urbano e industrial no se registró un solo organismo. En las estaciones de la zona alta con uso natural y ganadería se registraron organismos del orden Plecoptera, sensible a la contaminación orgánica.
Las variables ambientales relacionadas con el ensamblaje taxonómico de insectos acuáticos (EPT) fueron turbidez, DQO, amonio y uso del suelo urbano e industrial (U), donde la abundancia de organismos fue baja. Las variables ambientales relacionadas con la diversidad funcional fueron turbidez y zinc, responsables de los cambios en el ambiente y disponibilidad de oxígeno.
La diversidad taxonómica y funcional evidenciaron las alteraciones del ecosistema relacionadas con el uso del suelo y su efecto en el ensamblaje EPT en las diferentes estaciones a lo largo del río Ocoa. Esto plantea a futuro la realización de estudios de seguimiento y evaluación continuos, y emplear toda la comunidad de macroinvertebrados acuáticos; así mismo la necesidad de determinar los rasgos funcionales en taxones a nivel neotropical para evitar variabilidad intraespecífica, que conlleve a diferencias entre valores de los rasgos en los ensamblajes.