INTRODUCCIÓN
Plecoptera, es un grupo de insectos acuáticos con gran relevancia por su alta abundancia, diversidad y su amplio uso como indicadores de calidad de agua en sistemas fluviales (Bueñaño et al., 2018; Gutiérrez-Fonseca, 2010; Sierra-Labastidas et al., 2017). En las últimas décadas, la mayor parte de los estudios realizados en este orden, se han enfocados en aspectos taxonómicos y de distribución (Shinitshenkova, 1997; Stewart y Stark, 2002; Vera y Camousseight, 2006; Vinçon et al., 2014), mientras que los trabajos ecológicos no se han realizado con la misma intensidad y existe un vacío en estudios sobre aspectos autoecológicos (Giacometti y Bersosa, 2006; Váquiro-Capera et al., 2020; Zúñiga, 2010).
Los plecópteros juegan un papel importante en el flujo de energía y reaprovechamiento de los nutrientes que son exportados al sistema terrestre y a otros niveles tróficos (Gutiérrez-Fonseca, 2010; Tamaris-Turizo, Pinilla-A et al., 2020). Una forma para evaluar dichos flujos y dinámica poblacional es a través de la producción secundaria, que estima la cantidad de biomasa generada por organismos heterótrofos por unidad de tiempo (Benke, 1993). Además, permite identificar el estado de una población, puesto que integra atributos de la estructura, densidad, biomasa, tasa de crecimiento individual, reproducción, supervivencia y tiempo de desarrollo de una especie (Benke, 1993; Dolédec y Statzner, 2010).
A nivel mundial, la mayor parte de los estudios de producción secundaria en plecópteros se han realizado en Europa y Estados Unidos (Benke et al., 1984; Benke y Huryn, 2011; Beracko et al., 2016; Bo et al., 2013; Bottová et al., 2013; Cummins et al., 2008; López-Rodríguez et al., 2009; Tierno de Figueroa et al., 2003). En las montañas del sur de los Apalaches, EE. UU, se comparó la producción de Tallaperla maria (Needham y Smith, 1916) en dos corrientes contrastantes, a través del método de frecuencias de tallas, encontrando que a pesar de que la densidad fue diferente en ambas corrientes, no hubo diferencia significativa en la producción entre las corrientes (O'hop et al., 1984). Recientemente, Al-Zanka et al. (2020) encontraron que la producción secundaria puede ser un indicador útil para medir el éxito de la rehabilitación de corrientes en Reino Unido. A pesar de esto, en el Neotrópico son pocos los estudios realizados sobre este tema (Jacobsen et al., 2008; Dos Santos Lima y Pamplin, 2016).
En Colombia, Sierra-Labastidas et al. (2017) evaluó la dinámica de la biomasa de ninfas de Anacroneuria en el río Gaira, durante 4 meses y Bohórquez et al. (2011) estudió la distribución estacional de morfoespecies de Anacroneuria en un río tropical andino, basado en la dinámica de la frecuencia de tallas, encontrando que las mayores abundancias se presentan en las etapas larvales juveniles (longitud total < 12 mm) durante la época seca.
Los estudios sobre producción secundaria en los plecópteros, son trascendentales debido a que suministran información cuantitativa del papel que cumplen estos organismos en los ecosistemas dulceacuícolas mediante la integración de aspectos de su historia de vida (Benke et al., 1984; Downing y Rigler, 1984), permiten entender la dinámica poblacional de los plecópteros en corrientes neotropicales y contribuyen al entendimiento de los flujo de energía. Por ello, el presente trabajo tuvo como objetivo estimar la producción secundaria de dos especies dominantes de plecópteros en la parte media de un río neotropical de montaña (río Gaira): Anacroneuria martaZúñiga y Stark, 2002 y Anacroneuria caraca Stark, 1995.
MATERIALES Y MÉTODOS
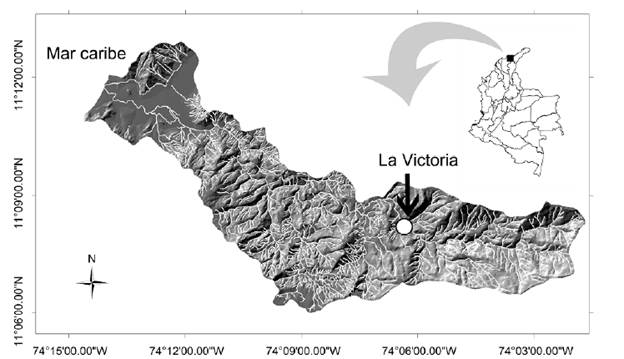
Área de estudio
La cuenca del río Gaira se localiza en el flanco noroccidental de la Sierra Nevada de Santa Marta (SNSM), con un área de recogida aproximada de 105 km2 y una longitud del cauce principal de 32 km2 (Tamaris-Turizo, Pinilla-A et al., 2020). Los muestreos se realizaron en el corregimiento de Minca, parte media del río, en un tramo de 100 m aproximadamente, entre los 11°07'44.2" N y los 74°05'35.8" W, a 900 m de altitud (Fig. 1). La zona de muestreo se encuentra rodeada de plantaciones de café, sin casas cercanas y con vegetación ribereña que se extiende entre los 70 a 100 m en el margen del río (Tamaris-Turizo, Arrieta et al., 2020). El clima es húmedo, con una precipitación promedio anual de 2249 mm y la temperatura promedio ambiental es de 21,5 °C y (Tamaris-Turizo, Arrieta et al., 2020). La temperatura promedio del agua es de 18,9 °C, el oxígeno disuelto de 7,68 mg/L-1 y el pH promedio de 7,48 (Oliveros-Villanueva et al., 2020). Además, el río presenta un caudal que varía entre 0,41 y 0,88 m3/s-1, una profundidad promedio de 0,35m, que se caracteriza por poseer una alta heterogeneidad de microhábitats como rocas, gravillas y hojarasca, siendo un ambiente propicio para el establecimiento de una gran variedad de organismos acuáticos (Tamaris-Turizo et al., 2013).
Recolecta e identificación de organismos
Los organismos de Anacroneuria utilizados en el estudio corresponden al estado de ninfa. Los muestreos se realizaron cada 20 días durante un año (14 muestreos en total), desde julio de 2014 hasta junio de 2015. La recolecta de los organismos se realizó con una red Surber de 0,09 m2 área y 250 µm de poro de malla, en los microhabitats de grava en corriente lenta (GCL) y grava en corriente rápida (GCR) (Benke y Huryn, 2011). En cada microhábitat se tomaron seis réplicas. Los organismos recolectados se separaron en campo y se preservaron en etanol al 96 %. Dado que las ninfas de Anacroneuria son difíciles de identificar a nivel de especie por la falta de estudios que asocien las ninfas con los estdios adultos de especies reconocidas, se procedió a separarlas por morfoespecies, basados en la coloración y las manchas del pronoto, y cabeza, la disposición de los tricomas en el fémur anterior derecho y los cercos (Sierra-Labastidas y Reyes, 2005; Tamaris-Turizo y Turizo, 2004). Además, se diseccionaron las ninfas preemergentes a las cuales se le extrajo la genitalia para compararlas con las descripciones de Zúñiga y Stark, (2002) y Stark, (1995).
Biomasa y producción secundaria
La biomasa de las dos especies se estimó aplicando el modelo potencial propuesto por Hurtado-Borrero, et al. (2020), para lo cual, se midió la longitud total (LT) de todos los organismos recolectados. El cálculo de la producción secundaria se realizó utilizando el método de frecuencia-talla descrito por Hynes y Coleman (1968) y modificado por Benke (1979). El cual consiste en conocer el incremento de la biomasa en el tiempo, a través del crecimiento poblacional, el cual es valorado a mediante la variación de las tallas durante un año. La producción se calculó usando la siguiente ecuación:
Donde, P = es la producción (mg/m2/a); i= es el número de clases de tallas; k= 6,5 es el intervalo de producción por cohorte (CPI); N= es la densidad (número de individuos / m2) y W = es el peso (mg).
Para los cálculos de la producción por cohorte y la producción anual se usó el CPI de 6,5 registrado previamente para A. bifasciata Pictet, 1841 (Cressa, 2003).
Teniendo en cuenta la LT, las ninfas se clasificaron en catorce clases de tallas para A. caracas y trece tallas para A. marta con intervalos de 0,5 mm. Se consideraron tallas pequeñas a los organismos menores de 6,3 mm, medianas entre 6,4 y 8,3 mm y grandes mayores de 8,4 mm. El análisis de histograma del ciclo de vida de las ninfas basado en la frecuencia de las clases de tallas, se llevó a cabo en el programa FISATT II (Gayanilo et al., 2002).
RESULTADOS
Durante el estudio se recolectaron 216 ninfas de A. marta y 229 de A. caraca. Se registraron trece clases de tallas para A. marta y catorce para A. caraca (Tabla 1). Para A. marta las tallas menores a 4 mm presentaron la mayor frecuencia entre enero y mayo, y los organismos con tallas mayores a 9 mm, dominaron en julio, septiembre, octubre, noviembre de 2014, enero, y febrero de 2015 (Fig. 2a). Las tallas más abundantes estuvieron entre las clases 4,8 y 6,7 mm y la menos abundantes para las ninfas > 8,8 mm (Fig. 2a). En A. caraca, las tallas pequeñas fueron las más abundantes e incrementaron su frecuencia desde finales de enero hasta junio de 2015; mientras que las tallas más grandes (> 8,4 mm) estuvieron presentes desde julio hasta octubre de 2014 (Fig. 2b). Ninguna de las especies mostró un patrón claro de crecimiento, dado que las tres clases de tallas estuvieron presentes durante la mayoría de los muestreos (Fig.2).
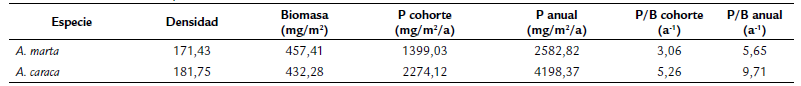
Tabla 1 Producción secundaria anual de dos especies del género Anacroneuria en el río Gaira (Sierra Nevada de Santa Marta, Colombia). N: Número total de individuos; B: Biomasa P: Producción Secundaria.
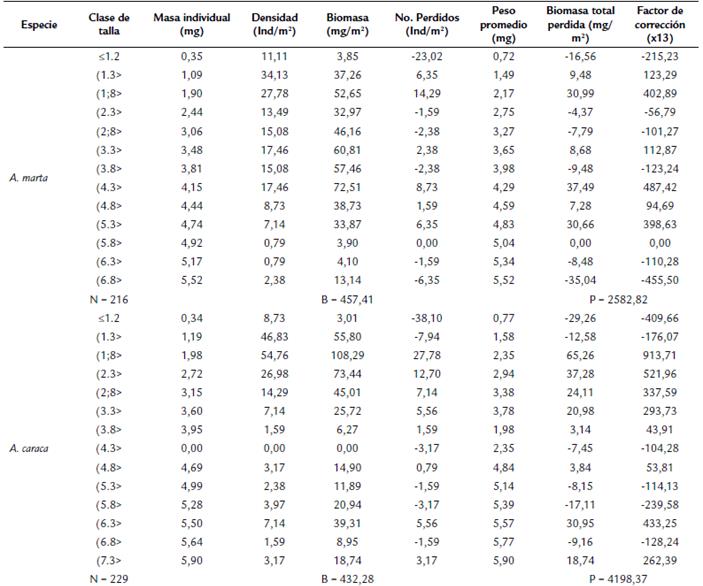
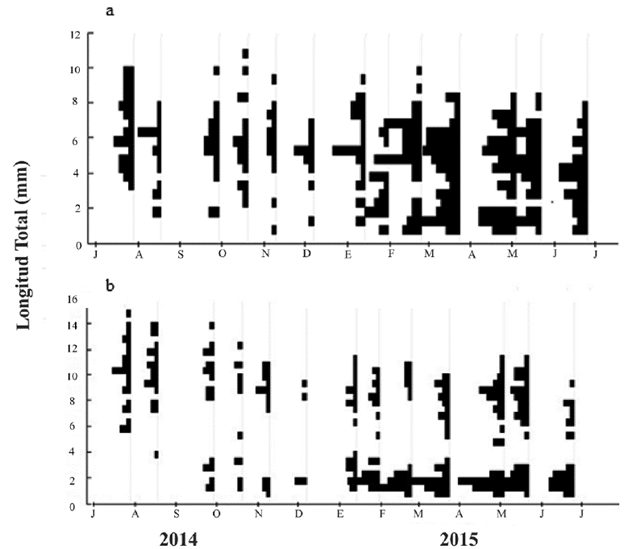
Figura 2 Frecuencia de talla de las dos especies del género Anacroneuria durante un año en la parte media del río Gaira (Sierra Nevada de Santa Marta, Colombia). a. A. marta, b. A. caraca.
Biomasa y producción secundaria
A pesar de que la biomasa anual de A. marta, fue mayor que la de A. caraca (B= 457,41 y B= 432,28 mg/m2, respectivamente), esta última obtuvo mayores valores en la producción por cohorte anual y en la relación producción / biomasa (P/B) anual (Tabla 2).
DISCUSIÓN
La alta frecuencia de tallas pequeñas menores de 6,4 mm durante la mayoría de los muestreos en las dos especies evidencia las dos especies que se reproducen en varias oportunidades durante el año, con una aparición de los primeros estadios desde noviembre hasta julio en A. marta y desde octubre hasta junio en A. caraca. Esto refleja que las ninfas son multivoltinas, no exhibieron ningún patrón de crecimiento y no existe una alternancia de generaciones. Esta tendencia similar fue observada por (Sierra-Labastidas et al., 2017) en especies no reconocidas de Anacroneuria en el río Gaira (SNSM), por lo que este trabajo puede ser considerado como un complemento de dicho estudio.
Las tallas más grandes para A. marta aparecieron en los meses de septiembre y octubre, lo cual puede indicar que las ninfas están cercanas a emerger. Mientras que en A. caraca se observaron desde julio hasta octubre, coincidiendo con lo registrado por Ballesteros (2004), en Rio Frío (Valle del Cauca, Colombia) en poblaciones de la misma especie. No se encontró evidencia de que los patrones de emergencia para el género Anacroneuria, estuviera relacionado con la estacionalidad, dado que la emergencia ocurre durante todo año, pero mostraron relación con los periodos de lluvias o la transición entre éstos y la época seca (Tamaris-Turizo et al., 2007; Zúñiga, 2010).
En una corriente ubicada en un páramo en el centro de Ecuador, estudiaron una especie no reconocida de Anacroneuria, donde la mayor frecuencia de organismos se presentó en las clases de tallas pequeñas (Turcotte y Harper, 1982); a diferencia de nuestro estudio, estos autores observaron un lento crecimiento, debido a la baja temperatura, toda vez que las especies de insectos acuáticos en ambientes tropicales tienen un rápido desarrollo y ciclos multivoltinos (Bishop, 1973; Molina y Puliafico, 2016). En otro páramo del norte de Ecuador, para el tricóptero Anomalocosmoecus illiesi Marlier, 1962, se observó una producción alta (3771,47 g/m2/a) y cohortes no reconocibles durante el año (Rios-Touma et al., 2022).
El efemeróptero Campsurus violaceus Needham y Murphy, 1924, presentó una alta biomasa de 3,350 g/m2 y producción secundaria de 16,48 g/m2/a en el río Baía (Brasil) (Takeda y Grzybkowska, 1997), lo que demuestra que algunas familias de efemerópteros también tienen alta importancia en los flujos de energía dentro de los ensamblajes de insectos acuáticos. En Costa Rica, Ramírez y Pringle (1998) estimaron por primera vez la producción secundaria en un ensamblaje de insectos bentónicos en un arroyo Neotropical de la vertiente del Caribe, donde la producción fue baja comparadas con otros estudios de regiones subtropicales y templadas, por ejemplo: Tricorythodes (Ephemeroptera) fue el más productivo con 138,80 mg PSLC/m2/a (PSLC: peso seco libre de cenizas) y una relación P/B de 19,1 a-1. Por su parte, en Los Estados Unidos de Norte América, se registró la producción anual de la familia Perlidae (> 2 g/m2/a) en un río subtropical en la llanura costera, donde el género Anacroneuria tuvo una producción baja de 0,18 g/m2/a y P/B de 11 a-1 (Benke et al., 2001), toda vez que éste género no es abundante en las regiones templadas. Los resultados de los anteriores trabajos son muy inferiores a lo encontrado en el presente estudio ( 6 g/m2/a), lo cual indica que estas poblaciones de Anacroneuria en el ríos Gaira presentan altas abundancias, tasas de crecimiento y baja ganancia de biomasa, tal como lo afirma Huryn y Wallace (2000).
En el río Camurí Grande (Venezuela), la producción secundaria de Anacroneuria bifasciata, Pictet, 1841, fue baja con respecto a la producción de otros órdenes del mismo río, siendo su producción de 94,5 mg/m2/a y una relación P/B de 6,6 a-1 (Cressa, 2003). El autor lo atribuye a que las abundancias y densidades de esta especie fueron bajas en su estudio y que el papel que cumple dentro de una comunidad está en función de la tasa de recambio y no solo en la densidad. Sin embargo, en el río Gaira (Colombia), estimaron la producción para el género Anacroneuria con 3,54 mg/m2/122d y una relación P/B de 13d, expresado en peso seco libre de ceniza (Sierra-Labastidas y Reyes, 2005; Sierra-Labastidas et al., 2017). Estos resultados fueron similares y consistentes con lo encontrado en este estudio en cuanto a la relación P/B, a pesar de que estos autores solo muestrearon cuatro meses. La relación P/B de la cohorte de las especies evaluadas estuvieron dentro del rango teórico esperado (Waters, 1987; Benke 1993). A pesar de que la producción de las dos especies fue baja en comparación con especies de USA (Benke 1993), fue mayor que otros estudios desarrollados en otras zonas templadas (Beracko et al., 2016).
Nuestros resultados muestran que las especies analizadas ofrecen un alto aporte energético en forma de "biomasa en pie" o "biomasa disponible" para los consumidores de mayor orden, tales como los megalópteros y peces del género Trichomycterus, organismos tope en estos ecosistemas (Tamaris-Turizo, 2018), por lo que pueden ser considerados como un eslabón muy importante en la red trófica del río; no obstante, se requiere ampliar este tipo de estudios a otros taxones dominantes en estos sistemas, para modelar los flujos de energía a través de los consumidores primarios e identificar posibles especies claves.
CONCLUSIONES
Los resultados comprueban que las dos especies del género Anacroneuria son multivoltinas, sus patrones de emergencia no están relacionados con la estacionalidad, presentan altas tasas de crecimiento y baja tasa de ganancia de la biomasa durante el año. No obstante, los valores de la producción secundaria fueron altos con respecto a una especie cogenérica de Venezuela y a especies de zonas templadas, pero bajo comparado con otros grupos de macroinvertebrados en el trópico. Finalmente, se evidenció que las especies en estudio, junto con los tricópteros y algunos efemerópteros, son considerados como un importante aporte de biomasa por parte de consumidores intermediaros en los ecosistemas acuáticos tropicales.