INTRODUCCIÓN
Los ecosistemas dulciacuícolas son fundamentales para nuestra supervivencia y la de muchas especies bentónicas y ribereñas asociadas, porque además de concentrar una alta biodiversidad, ofrecen múltiples bienes y servicios (Maasri et al., 2022). Sin embargo, están sometidos a presiones antropogénicas y naturales, crecientes y sostenidas; por lo que, en la actualidad se reconocen entre los sistemas ecológicos más amenazados y vulnerables a nivel global (Reid et al., 2019; Brauns et al., 2022). En gran parte de la región neotropical, la información sobre los impactos en la composición, estructura y función de la biota dulciacuícola es limitada, debido a la falta de estudios ecológicos en algunas áreas, como ocurre con los sistemas acuáticos tropicales altoandinos (Rincón et al., 2017; Ramírez et al., 2018; Ríos-Touma y Ramírez, 2019; Meza-Salazar et al., 2020; Salazar-Castellanos et al., 2020; Silva Poma y Huamantinco Araujo, 2022).
En Colombia, las actividades de importancia económica como la agricultura, ganadería y minería, concentradas sobre la región andina (Guevara, 2014; Chará-Serna et al., 2015; Villada-Bedoya et al., 2017; Meza-Salazar et al., 2020), han llevado a una reducción, y en algunos casos, al reemplazo de la vegetación ribereña nativa, que se asocia con cambios en el aporte de materia orgánica y en la calidad del agua (Villada-Bedoya et al., 2017; Ramírez et al., 2018; Torremorell et al., 2021; Jaramillo-Rodríguez et al., 2022).
En los sistemas acuáticos de bajo orden (quebradas/ arroyos), el aporte de hojarasca procedente de la vegetación ribereña representa el "combustible" que define gran parte de los procesos biogeoquímicos a nivel de sus microcuencas, con participación activa de microorganismos e invertebrados bentónicos, los cuales contribuyen con el flujo de nutrientes (C, N, P) y energía en las redes tróficas (Abelho, 2001; Graça, 2001; Ríos-Touma et al., 2009; Boyero et al., 2016; Gutiérrez-López et al., 2016).
La descomposición de la hojarasca en los sistemas acuáticos es mediada por diversos factores abióticos y bióticos, entre los que se reconocen los parámetros fisicoquímicos, calidad nutricional de las hojas, concentraciones de lignina, caudal, microorganismos (bacterias, hongos), y macroinvertebrados (Astudillo et al., 2014; Salazar-Castellanos et al., 2020).
Estos últimos fragmentan la hojarasca y transforman la materia orgánica particulada gruesa (MOPG), en partículas finas (Leite-Rossi et al., 2016). No obstante, en sistemas lóticos altoandinos, es necesario fortalecer los estudios sobre el papel que juegan los macroinvertebrados en dicho proceso (Tomanova et al., 2006; Chará et al., 2007; Rodríguez-Barrios et al., 2011). Dado lo anterior, la vegetación ribereña nativa aporta materia orgánica, que generalmente tiene diferentes tasas de descomposición, cantidad y calidad de nutrientes, y refleja patrones de colonización distintos en el ensamblaje de invertebrados bentónicos, cuando se compara con especies exóticas (Boyero et al., 2016; Leite-Rossi et al., 2016). En este contexto, es necesario comprender cómo funcionan estos procesos en zonas altamente amenazadas y poco estudiadas, que permita apoyar la toma de decisiones ambientales acertadas y su contribución al desarrollo de medidas integradas para garantizar la salud de los ecosistemas acuáticos (Eyes Escalante y Rodríguez Barrios, 2012). Por lo tanto, el objetivo del presente estudio fue determinar las tasas de descomposición de hojas de dos especies nativas en una quebrada tropical altoandina de Colombia, y su relación con la densidad y dinámica de macroinvertebrados bentónicos en dicho proceso. Esta información es relevante para establecer los factores bióticos que influyen sobre los procesos ecosistémicos como el ciclo de nutrientes, flujos de energía e interacciones tróficas en sistemas lóticos montanos (Rincón et al., 2017; Salazar-Castellanos et al., 2020).
MATERIALES Y MÉTODOS
Área de estudio
La investigación se realizó en la Quebrada Las Perlas (4°35' N, y 75°18' W; 2390 m.s.n.m.), ubicada en el municipio de Ibagué (Tolima, Colombia) sobre la vertiente oriental de la cordillera Central (Fig. 1). Esta quebrada se origina cerca del páramo de Estambul (Parque Nacional Natural Los Nevados; 5220 m.s.n.m., centro-occidente de Colombia) y presenta una temperatura que oscila entre 6-24 °C (Lozano-Bravo et al., 2018). La microcuenca presenta un perímetro de 29,97 km y un área aproximada de 3194 ha que aportan el 11,6 % del área total de la cuenca del Río Combeima; un ecosistema clave para la población rural y urbana del municipio de Ibagué (~ 600000 habitantes), ya que surte el acueducto principal con aproximadamente el 80 % de agua (Leal Villamil et al., 2018).
Fase de campo
Se recolectaron in situ hojas senescentes en buen estado, de dos especies vegetales ribereñas: Tibouchina lepidota (Bonpl.) Baill. (Sietecueros o Flor de mayo andina; recientemente tipificada como Andesanthus lepidotus (Bonpl.) P.J.F.Guim. & Michelang., comb. nov. [Guimarães et al., (2019)]) y Alnus acuminata Kunth (Aliso), las cuales se secaron a temperatura ambiente por 48 h. Se utilizaron 210 bolsas de hojarasca (malla plástica, 20 x 20 cm), 105 de poro grueso (5 mm) y 105 de poro fino (0,5 mm), para facilitar el ingreso y la exclusión de los macroinvertebrados, respectivamente (Gutiérrez-López et al., 2016). El diseño incluyó tres tratamientos: 70 bolsas con hojas de A. acuminata (en adelante Aa), 70 con A. lepidotus (Al), y 70 con una combinación (Al: Aa, 1:1; Mixto); en cada tratamiento/malla se colocaron 10 g de hojas secas senescentes de las especies seleccionadas. Las bolsas se distribuyeron aleatoriamente dentro de la quebrada en una sección longitudinal de 200 m; después se realizaron cinco extracciones (+3, 7, 15, 20, 30 días) de 4 réplicas, durante octubre y noviembre de 2019, tanto de las bolsas con malla de poro grueso como de fino, de acuerdo con las recomendaciones de Benfield et al. (2017) y Bärlocher (2020). Cada réplica fue individualizada en bolsas plásticas para evitar la pérdida de macroinvertebrados y/o fragmentos vegetales, durante el transporte al laboratorio.
Fase de laboratorio
El material vegetal se limpió cuidadosamente sobre tamices de 180 - 63 µm, dispuestos consecutivamente con el fin de recolectar los macroinvertebrados presentes, los cuales fueron preservados en alcohol al 70 % para su posterior identificación al nivel taxonómico de familia, mediante un estereomicroscopio y claves taxonómicas especializadas (Domínguez y Fernández, 2009). Posteriormente, se realizó la asignación de grupos funcionales de alimentación - GFA con base en diferentes clasificaciones, principalmente las de Cummins et al. (2005) y Ramírez y Gutiérrez-Fonseca (2014). Las hojas y fragmentos remanentes se colocaron dentro de bolsas de papel debidamente rotuladas, se secaron en un horno a 60 °C durante 24 h, y se pesaron en una balanza analítica (A. J. Tunnig-Fork S/N 12007708; 0,001 g de precisión) para obtener la masa seca final (g) de cada réplica por tratamiento.
Análisis de datos
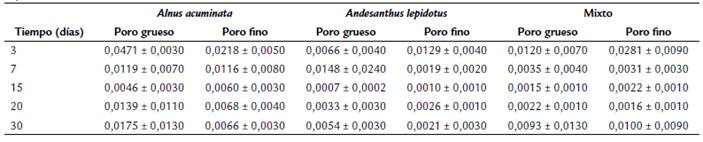
Se calculó el porcentaje de degradación promedio (n = 4) de las hojas por tratamiento y poro de malla, mediante la diferencia del peso seco inicial y peso seco final (peso remanente en g). Las tasas de descomposición de las hojas (k, días-1) por cada tiempo de extracción, tratamiento y poro de malla, se calcularon mediante el modelo exponencial negativo descrito por Benfield et al. (2017): Mt = M0 * e-kt donde Mt representa la masa seca en el tiempo t, M0 la masa seca inicial (10 g), k la tasa de descomposición y t el tiempo trascurrido desde el inicio del experimento. Adicionalmente, se calculó un valor k-global por tratamiento con base en la masa seca inicial vs. la final (30 días). Para establecer diferencias significativas entre las tasas de descomposición entre tratamientos, se realizó un análisis multivariado de la covarianza (MANCOVA), después de la verificación de los supuestos de normalidad y homocedasticidad. Los factores analizados fueron: hojas (3 niveles; Aa, Al, Mixto), el tamaño del poro (2 niveles; grueso, fino) y el tiempo de muestreo (5 niveles). El tiempo en días se utilizó como la covariable. Todos los análisis se realizaron con TIBCO Statistica versión 14 (TIBCO, 2020). Se calculó la densidad media (Individuos m-2) de los macroinvertebrados y de los GFA, que colonizaron las bolsas de hojarasca, de acuerdo con los tratamientos y tiempos de extracción. Los valores fueron extrapolados desde las dimensiones de cada una de las bolsas a 1 m2 como unidad de área base (20 x 20 cm = 0,04 m2).
RESULTADOS
Pérdida de masa y descomposición de hojas
La pérdida de masa seca siguió el patrón esperado; es decir, fue mayor en las bolsas de los tratamientos con malla de poro grueso. Alnus acuminata (Aa), presentó la menor masa seca remanente (38 %), seguido del tratamiento Mixto (57 %) y de Andesanthus lepidotus (Al, 69 %). El mayor porcentaje de masa seca remanente ocurrió en Al en la malla de poro fino (88 %), mientras que el menor porcentaje ocurrió en Aa en la bolsa con malla de poro grueso (38 %, Fig. 2a). Las tasas de descomposición se ajustaron al comportamiento de la pérdida de masa seca a pesar de presentar un patrón heterogéneo durante el estudio; la mayor variabilidad ocurrió en los primeros siete días (+ 3, 7) y al final del experimento (+ 30), tanto en los resultados de las bolsas con malla de poro grueso como fino (Fig. 2b). Se encontraron diferencias significativas entre tratamientos (MANCOVA; Lambda de Wilks = 0,803, F(10258) = 2 , 98, p = 0,001) y durante el experimento (Lambda de Wilks = 0,814, F(2,129) = 14,71, p < 0,001).

Figura 2 (a) Pérdida de masa seca (promedio ± DE) al inicio (+ 3 días) y al final (+ 30 días) del experimento, (b) tasas de descomposición (promedio ± DE) de hojas de Alnus acuminata, Andesanthus lepidotus y una mezcla de ambas especies vegetales en relación con el tamaño del poro en la Quebrada Las Perlas (Ibagué, Colombia). Aa-MG: A. acuminata bolsas con malla de poro grueso, Aa-MF: A. acuminata bolsas con malla de poro fino, Al-MG: A. lepidotus bolsas con malla de poro grueso, Al-MF: A. lepidotus bolsas con malla de poro fino, M-MG: tratamiento Mixto bolsas con malla de poro grueso, M-MF: Mixto bolsas con malla de poro fino.
El tratamiento con Aa en la bolsa con malla de poro grueso reflejó la tasa de descomposición promedio (± DE) más alta (k = - 0,019 ± 0,007), y el menor valor se presentó en Al en la bolsa con malla de poro fino (k = - 0,004 ± 0,002). Los resultados de las tasas de descomposición (Tabla S1, Material suplementario) mostraron diferencias significativas tanto en el tiempo como entre tratamientos (k días-1; tiempo, F = 18,35, p < 0,001; tratamiento, F[5130]= 5,46, p < 0,001).
Colonización por macroinvertebrados
Durante el experimento se colectaron 4202 individuos, distribuidos en nueve órdenes y 29 familias. Los órdenes más abundantes fueron Diptera, Trichoptera, Coleoptera y Ephemeroptera con nueve, seis, siete y tres familias, respectivamente (Fig. 3a). La familia más abundante fue Chironomidae con 442 organismos (± 13,82) representando el 54,94 % de la distribución, seguido de Simuliidae con 107 (± 4,81; 13,33 %) e Hydroptilidae con 45 organismos (± 2,91; 5,63 %). Los valores más altos de densidad total (Individuos m-2) se registraron en el tratamiento Mixto en las bolsas con malla de poro grueso, seguido de Aa y Mixto, ambos presentes en las bolsas con malla de poro fino. El tratamiento con la menor densidad fue Al en las bolsas con malla de poro grueso (Fig. 3b). Estos resultados mostraron diferencias significativas en todos los casos, para el tiempo de extracción (F[1,130]= 18,35, p < 0,001) y, en tratamiento, únicamente para Al en la bolsa con malla de poro grueso (Prueba de Tukey, p < 0,05; Tabla S2, Material suplementario). Con respecto a los GFA, los recolectores presentaron la mayor densidad (13710 Ind. m-2), seguidos de filtradores (3375 Ind. m-2); mientras que fragmentadores y raspadores, presentaron los valores más bajos (Fig. 3c).

Figura 3 Abundancia total (a), densidad total (b) y por grupos funcionales alimentarios (c, se muestran los valores de abundancia y su correspondencia en porcentaje) de macroinvertebrados colonizadores de hojas de Alnus acuminata (Aa), Andesanthus lepidotus (Al) y una combinación de ambas especies (Aa : Al), asociados con bolsas de malla de poro grueso y fino en la Quebrada Las Perlas (Ibagué, Colombia). Abreviaturas como en la Figura 2a.
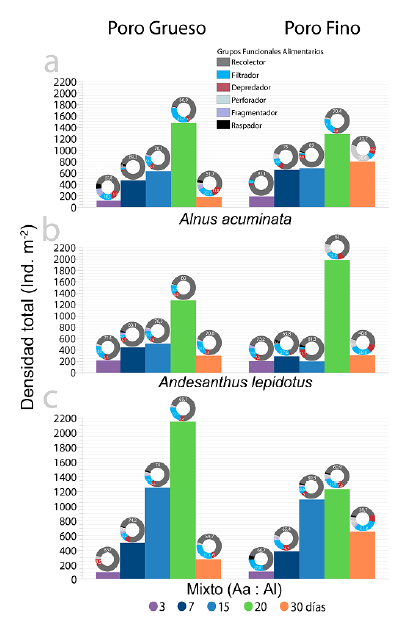
Figura 4 Densidad absoluta y por grupo funcional alimentario-GFA de los macroinvertebrados colonizadores de hojas de (a) A. acuminata (Aa), (b) A. lepidotus (Al) y (c) una combinación de ambas especies durante el experimento con bolsas de malla de diferente poro (grueso: 5 mm, fino: 0,5 mm) en la Quebrada Las Perlas (Ibagué, Colombia). En las figuras de donas, se indican los valores de densidad con los porcentajes más representativos. Note las diferencias en la densidad y en la heterogeneidad de la distribución de los GFA por tratamiento durante el estudio.
Durante el experimento, el patrón de colonización por macroinvertebrados mostró un aumento sostenido en la densidad absoluta y por GFA, en todos los tratamientos (Fig. 4a-4c), con excepción de Al en el día 15 en las bolsas con malla de poro fino (Fig. 4b). Los valores más altos de densidad se presentaron en el día 20, donde Mixto dominó en las bolsas con malla de poro grueso (2149 Ind. m-2), seguido de Al en las bolsas con malla de poro fino (1985 Ind. m-2), y Aa en las bolsas con malla de poro grueso (1470 Ind. m-2). La dinámica de los GFA fue bastante heterogénea, con una dominancia en su orden por recolectores, filtradores, depredadores y perforadores (Fig. 4a-4c). Los fragmentadores se asociaron principalmente con Aa en las bolsas con malla de poro grueso (Fig. 4a), y en Al y Mixto en las bolsas con malla de poro fino (Figs. 4b y 4c). Se observó un patrón diferenciador en el caso del tratamiento Mixto en las bolsas con malla de poro fino (Fig. 4c), donde dominaron los raspadores, depredadores, y recolectores.
DISCUSIÓN
Las mayores tasas de descomposición encontradas para Alnus acuminata, se pueden asociar con su alto contenido de nutrientes (↑N, fenol y lignina vs. ↓ relación C/N), tejido foliar blando y una mayor fragilidad (textura) de sus hojas (Graça, 2001), en comparación con Andesanthus lepidotus. Una respuesta similar fue reportada por Rincón et al. (2017), en ríos altoandinos de Ecuador, donde los valores k de A. acuminata fueron comparativamente más altos que para Miconia bracteolata (Melastomataceae), y mayores que los obtenidos en nuestra investigación. Ferreira et al. (2012), en un estudio comparativo de descomposición de hojas de especies nativas de zonas templadas y tropicales, encontraron para Alnus glutinosa valores k más bajos, como consecuencia de un menor acondicionamiento realizado por microorganismos y por la baja biomasa fúngica registrada.
Andesanthus lepidotus, presentó los valores más bajos de descomposición durante el experimento; lo cual se puede atribuir a lo indicado por Amado Ariza y Chocontá López (2016), quienes reportaron una alta cantidad y concentración de metabolitos secundarios, los cuales afectan la asimilación de los nutrientes durante la fragmentación de la hojarasca, la colonización fúngica y como consecuencia, la degradación de carbohidratos estructurales. Además, el género Andesanthus se caracteriza por presentar tricomas en las hojas (Guimarães et al., 2019), que pueden dificultar la ingestión por los macroinvertebrados. Salazar-Castellanos et al. (2020), reportaron una baja tasa de descomposición de esta especie (como Tibouchina lepidota), dada principalmente por la presencia de la venación foliar; sin embargo, en nuestra investigación las hojas se encontraban casi completas al finalizar el experimento (87 % en malla fina y 67 % en malla gruesa). Por lo tanto, la hojarasca representa un recurso orgánico que puede cumplir diferentes funciones, de acuerdo con su estado de descomposición y la presencia de los taxones de invertebrados; ya que participa como sustrato (refugio), trampa para la materia orgánica particulada fina- MOPF, contribuye con la retención de sedimentos en suspensión, y como fuente de C, N y de otros nutrientes (Mathuriau y Chauvet, 2002).
En cuanto al tamaño de los poros, a pesar de que se registró una mayor tasa de descomposición en las bolsas con malla de poro grueso, no se encontró una relación significativa de la densidad absoluta de macroinvertebrados y por GFA; sin embargo, algunos autores han destacado que un mayor tamaño del poro permite la entrada de invertebrados comparativamente más grandes (fragmentadores), los cuales participan activamente en la descomposición (Rincón et al., 2017; Zhang et al., 2019). Otros autores han resaltado que aún no se cuenta con información concluyente, ya que cuando los datos no se asocian claramente al efecto que presenta el tamaño del poro, la dinámica de la descomposición puede atribuirse a otros factores que condicionan la fragmentación de la hojarasca como la abrasión física, la cual genera partículas pequeñas que se pueden eliminar fácilmente aguas abajo, por lo que es común encontrar valores más altos (Chará et al., 2007; Ferreira et al., 2012; Boyero et al., 2016).
La alta abundancia de Chironomidae coincide con otros estudios enfocados en la descomposición de hojarasca en quebradas tropicales altoandinas de Colombia, como el de Gutiérrez-López et al. (2016), donde se reportó una abundancia del 79 %. Así mismo, Rubio-M. et al. (2016) reportaron que, aunque esta familia no presentó una diferencia significativa en los distintos sustratos utilizados, fue la más representativa durante el experimento en una quebrada altoandina del departamento de Caldas. En general, nuestros resultados también coinciden con otros estudios en quebradas de montaña neotropicales (Biasi et al., 2013; Astudillo et al., 2014), donde se ha mostrado que la adaptación que presentan los quironómidos (espiráculos y sifones), les permite colonizar diferentes ambientes y capturar partículas finas, provenientes de la fragmentación de la hojarasca (Gutiérrez-López et al., 2016). Además, estos exhiben una "plasticidad" para la colonización de diferentes hábitats, por lo que pueden representar a los principales dípteros colonizadores de sustratos artificiales, junto con la familia Simuliidae (Sanseverino y Nessimian, 2008; Zúñiga-Céspedes et al., 2018), la cual fue la segunda más numerosa en el presente estudio.
La mayor densidad de organismos se registró consistentemente en el día 20 del experimento. Este resultado se puede asociar en parte a que las hojas durante este periodo de tiempo se encuentran en una etapa intermedia de la descomposición, como resultado de un condicionamiento mediado por la colonización de microrganismos (los cuales no fueron medidos en nuestro estudio), que ocurre en la mayoría de los casos durante las dos primeras semanas, lo que permite obtener una hojarasca más asequible y asimilable para los macroinvertebrados (Abelho, 2001). Tanaka et al. (2006) reportaron la mayor abundancia de organismos en este periodo de tiempo. Por otra parte, se encontró una disminución en la densidad en el día 30, debido posiblemente a un reemplazo de los taxones dominantes, como ocurre con fragmentadores y depredadores que arriban más tarde durante la colonización (Mackay, 1992), lo cual es reportado de manera similar por Ligeiro et al. (2010). En cuanto a los tratamientos, la hojarasca Mixta fue la que presentó una mayor densidad en todo el muestreo (Fig. 3), esto puede estar relacionado con el hecho de que se trata de un sustrato más heterogéneo, lo cual puede facilitar una "mejor" oferta (alimento/refugio) para la colonización de los macroinvertebrados (Salazar-Castellanos et al., 2020). Así mismo, la alta abundancia de macroinvertebrados que se presentó en el tratamiento con A. acuminata puede estar relacionada con la calidad de la hoja, ya que presenta mayor contenido de nutrientes y una menor cantidad de metabolitos secundarios (Amado Ariza y Chocontá López, 2016), lo que puede llevar a una mayor biomasa fúngica y posteriormente, a una alta colonización de invertebrados (Mathuriau y Chauvet, 2002).
En el presente estudio, la mayor densidad de GFA se asoció principalmente con recolectores, y filtradores, lo que coincide con en el estudio realizado por Díaz Rojas et al. (2020), donde la alta densidad de este grupo se relacionó con una mayor facilidad y disponibilidad de la MOPF derivada de las bolsas de hojarasca y aquella que es transportada a lo largo y ancho del cauce. Asimismo, este grupo es altamente frecuente en varios sistemas acuáticos neotropicales, en donde se destacan los quironómidos (Rodríguez-Barrios et al., 2011; Ferrú y Fierro, 2015; Motta Díaz et al., 2016; Rubio-M. et al., 2016). Los depredadores también presentaron un valor relativamente alto, principalmente en el tratamiento Mixto, que se asociaron con la disponibilidad de presas potenciales en las bolsas de hojarasca (Ligeiro et al., 2010). La baja densidad de fragmentadores ha sido corroborada por diferentes estudios (Ferrú y Fierro, 2015), que muestran que la densidad de este grupo funcional disminuye hacia las zonas tropicales (Mathuriau y Chauvet, 2002; Ligeiro et al., 2010). No obstante, en algunos lugares del Neotrópico, puede alcanzar valores superiores al 50 % en términos de biomasa (Wantzen y Wagner, 2006; Rodríguez-Barrios et al., 2011; Zúñiga-Céspedes et al., 2018).
Por otra parte, es necesario considerar que tanto la densidad (y/o biomasa) total de macroinvertebrados colonizadores como la distribución de sus GFA, y su papel en la descomposición local de hojarasca, pueden estar asociados con otros factores no evaluados en nuestra investigación, como la incidencia de las variables fisicoquímicas (caudal, sedimentación), estequiometria foliar (una especie caducifolia vs. una perenne), movilidad de los invertebrados (deriva, natación, rastreo y vuelo), textura del sustrato y aportes de alimento o recursos asociados, competencia y depredación (Mackay, 1992). La colonización de macroinvertebrados en sistemas lóticos, generalmente, responde a una secuencia o reemplazo de los grupos funcionales. Los raspadores y filtradores pueden utilizar los recursos disponibles sobre o bajo las rocas lisas, los recolectores colonizan a medida que se acumulan los detritos finos, los ramoneadores aumentan a medida que se establece el perifiton, y los fragmentadores y depredadores tienden a llegar más tarde (Mackay, 1992).
CONCLUSIONES
Nuestros resultados muestran que un sustrato más heterogéneo puede garantizar una mayor densidad de macroinvertebrados durante el proceso de colonización y dinámica de la masa seca remanente de la hojarasca. Sin embargo, es común que en algunas etapas de la descomposición ocurran picos de densidad (altos/bajos) que se asocian con una potencial preferencia sobre los sustratos individuales de Alnus acuminata y Andesanthus lepidotus. Este comportamiento también es sostenido cuando se compara la dinámica de los GFA, a pesar de la predominancia de los dípteros recolectores. Se confirma la mayor densidad de la familia Chironomidae en procesos de colonización de hojarasca en quebradas altoandinas tropicales. Las larvas de esta familia presentaron la mayor abundancia en todos los tratamientos, de manera similar a lo encontrado por otros estudios realizados en Colombia y otros países neotropicales. El GFA recolector, reflejó una dominancia en los diferentes tratamientos con una tendencia generalizada desde el inicio del experimento y a través del tiempo. El comportamiento de los demás GFA no mostró un patrón claro, al ser comparativamente, más heterogéneo. En futuros estudios es importante tener en cuenta que las características intrínsecas de la hojarasca (estequiometria) así como de la microcuenca (usos del suelo, vegetación ribereña, comportamiento del cauce), y microorganismos participantes, juegan un papel clave en el aporte, disponibilidad y descomposición de la materia orgánica autóctona y alóctona, donde el caudal y el contenido de lignina, pueden ser los más relevantes. Sin embargo, esta predicción estuvo fuera del alcance del presente estudio.