Introducción
El mundo se encuentra enfrentando una transición epidemiológica acelerada hacia poblaciones más ancianas y con una mayor prevalencia de demencia 1. El trastorno neurocognitivo mayor (o demencia) abarca diversas etiologías que afectan los dominios cognitivos y la funcionalidad de forma progresiva e irreversible 2.
Las personas mayores con demencia tienen una mayor probabilidad de presentar multimorbilidad y polifarmacia 2. En esta población, la prevalencia de polifarmacia alcanza el 62 %, la prescripción de medicación potencialmente inapropiada el 43 % 1 y la prevalencia de eventos adversos asociados a la medicación llega al 19 % 2, lo cual configura un problema de salud pública global debido a la falta de información y entrenamiento en prevención cuaternaria (3). Esta hace referencia al conjunto de medidas disponibles para evitar, disminuir o paliar el daño producido por las actividades sanitarias 4. Un ejemplo de prevención cuaternaria en población geriátrica es la deprescripción de antidepresivos tricíclicos o benzodiacepinas, usados por periodos prolongados en adultos mayores con insomnio, por el aumento del riesgo de sedación, confusión, pérdida de equilibrio y caídas; o la deprescripción de memantina en adultos mayores con demencia y epilepsia conocida, debido al riesgo aumentado de crisis epilépticas 5. En contraparte, continuar su prescripción, retardando el ajuste y la adecuación de la terapia, es un fenómeno conocido como inercia terapéutica, también llamado inercia clínica 3,6.
Los medicamentos son el principal recurso terapéutico empleado en la atención geriátrica, sin embargo, cada intervención requiere de un abordaje centrado en el paciente, para limitar el riesgo de iatrogenia 3. Por esta razón, cada intervención farmacológica requiere de estrategias de seguimiento y monitorización, tanto en la fase de prescripción, como en deprescripción 3. El adulto mayor con demencia representa un reto clínico para el médico de atención primaria y el no experto en demencia (es decir, aquel que no pertenece a las especialidades de neurología, psiquiatría o geriatría), no solo por el problema de diagnosticar y estadificar la enfermedad, sino por la difícil tarea de establecer objetivos, a menudo cambiantes, que guíen la toma de decisiones en cuanto a prescripción y deprescripción 7.
La deprescripción ha sido definida como "el proceso de retirada de un medicamento inadecuado, supervisado por un profesional sanitario, con el objetivo de gestionar la polifarmacia y mejorar los resultados" 8. Con frecuencia, debido a la ausencia de directrices basadas en evidencia científica, los médicos no entrenados en deprescripción suelen experimentar tensiones éticas en torno a la decisión de deprescribir y lo llegan a percibir como una acción intencional para limitar esfuerzos terapéuticos 3,9-10.
El reto es aún mayor cuando se trata de la deprescripción de medicamentos para síntomas cognitivos y manifestaciones neuropsiquiátricas en adultos mayores con demencia, especialmente en estadios avanzados de la enfermedad 9-10. Por lo anterior, se decidió construir un documento de actualización donde se sinteticen las principales recomendaciones para deprescribir potenciadores cognitivos y psico-fármacos en la persona mayor con demencia.
Síntomas cognitivos
Para el manejo de síntomas cognitivos de la demencia se utilizan los medicamentos denominados "potenciadores cognitivos", los cuales incluyen a los inhibidores de acetilcolinesterasa (lAChE: donepezilo, galantamina y rivastigmina) y un antagonista del receptor de NMDA (memantina) 4. Los lAChE están indicados en pacientes con demencia por enfermedad de Alzheimer, desde los estadios leves de la enfermedad, aunque también es una opción en casos de deterioro cognitivo leve (DLC) 7. La memantina se reserva para casos de trastorno neurocognitivo mayor, de moderado a severo, ya sea en monoterapia o en combinación con lAChE 7. El beneficio de lAChE en demencia de otras etiologías, como el caso de la demencia vascular y la demencia por cuerpos de Lewy, se encuentra en controversia 10-13. La estrategia de prescripción y deprescripción de potenciadores cognitivos se encuentra disponible en la tabla 1.
Tabla 1 Protocolo de prescripción y de deprescripción de potenciadores cognitivos en ancianos con demencia
| Prescripción | |||||
|---|---|---|---|---|---|
| Potenciadores cognitivos | Ajuste | Dosis inicial | Dosis de ajuste | Dosis de mantenimiento | Deprescripción*,** |
| Galantamina (oral) | Mensual | 8 mg/día | 16 mg/día | 24 mg/día | Reducción del 50 % de la dosis cada cuatro semanas hasta lograr la dosis inicial recomendada. Luego de cuatro semanas, se podría suspender el potenciador cognitivo. Con posterior monitorización y vigilancia de síntomas con periodicidad mensual durante los primeros tres meses postsuspensión de la medicación. |
| Rivastigmina (parche transdérmico) | Mensual | 4,6 mg/día | 9,5 mg/día | 13,3 mg/día | |
| Donepezilo (oral) | Mensual | 2,5 mg/día | 5 mg/día | 10 mg/día | |
| Memantina (oral) | Semanal | 5 mg en la mañana | 5 mg cada 12 horas | 10 mg en la mañana y 5 mg en la tarde | 10 mg cada 12 horas |
Notas: * La deprescripción debe ser gradual, a menos que haya efectos adversos u otro motivo de seguridad, en cuyo caso se puede hacer inmediatamente, sin embargo, en presencia de psicosis, agitación o agresividad, se debe esperar hasta la estabilización de los síntomas antes de iniciar la deprescripción y se deberá monitorizar hasta seis meses después de esta.
** En caso de empeoramiento durante el proceso de deprescripción (mayor aislamiento social y apatía, disminución inexplicable de actividades de la vida diaria, empeoramiento del patrón de sueño o cambios conductuales como irritabilidad, agresividad o alucinaciones), se recomienda reiniciar el tratamiento con los potenciadores cognitivos a dosis usuales. La deprescripción se podrá realizar en el futuro, de una forma más lenta y bajo estricta vigilancia.
Durante los primeros tres meses de inicio de lAChE, el seguimiento clínico debe ser mensual para guiar el aumento progresivo de la dosis, basado en la tolerancia, adherencia y respuesta a la medicación, hasta llegar a la meta de mantenimiento 7. Posteriormente, se continúa el seguimiento hasta completar seis meses de tratamiento, momento en el cual se debe evaluar la respuesta cognitiva, funcional y comportamental 7.
La respuesta adecuada a los potenciadores cognitivos se evalúa a los seis meses del comienzo del tratamiento y su medición se realiza en tres dominios: 1) cognitivo, mediante la aplicación del MMSE (Mini-Menta/ State Evaluation); 2) funcional, mediante el índice de Barthel; y, 3) conductual, mediante la aplicación del NPI (Neuropsychiatrie Inventory). Al partir de una puntuación inicial (antes), se considerará una respuesta adecuada al potenciador cognitivo cuando la puntuación a los seis meses (después) aumente o se reduzca < 2 puntos para MMSE; aumente o se reduzca < 10 % del índice de Barthel, y disminuya o aumente < 4 puntos para el NPl. Caso contrario, se considerará una respuesta inadecuada y se deberá considerar cambiar a otro lAChE (segunda línea de tratamiento) o adicionar memantina (tercera línea de tratamiento) 7,11-12.
Una vez agotadas las tres líneas de tratamiento sin alcanzar una respuesta terapéutica adecuada o en caso de identificar criterios de demencia avanzada, se deberá considerar la implementación del protocolo de deprescripción de potenciadores cognitivos por ausencia de utilidad 7,11-14. Las preferencias del paciente o cuidador, la falta de adherencia no corregible, la presencia de eventos adversos intolerables asociados a la terapia farmacológica y la ausencia de indicación, como el caso de la demencia fronto-temporal, también deberán sugerir el comienzo de la deprescripción 11-12. Según los criterios STOPP/ START en su versión 3, los lAChE son medicamentos potencialmente inapropiados en personas mayores con bradicardia persistente (< 60 rpm), bloqueos cardiacos o síncopes recurrentes, al igual que la memantina en pacientes con antecedentes de epilepsia conocida 5. Otras indicaciones de deprescripción descritas en la literatura hacen referencia a la presencia de interacciones medicamento-medicamento, para el caso de donepezilo y betabloqueantes, por el riesgo de bradicardia o la presencia de interacciones medicamento-enfermedad, para el caso de galantamina en pacientes con antecedentes de epilepsia 15.
Demencia avanzada
El diagnóstico de demencia avanzada puede ser realizado mediante la detección de criterios clínicos, cognitivos, funcionales o de pronóstico 14. A nivel clínico se determina por la presencia de infecciones recurrentes, múltiples úlceras por presión, trastorno moderado-severo de la deglución, incapacidad progresiva para comunicarse o incontinencia urinaria/ fecal severa; a nivel cognitivo por una clasificación de 7 en la GDS (Global Deterioration Scale) o de 3 en el CDR (Clinical Dementia Rating); a nivel funcional por un estadio de 7 en la escala de FAST; a nivel de pronóstico por tener criterios NECPAL positivos con estadio ≥ 1, o ≥ 16 puntos en la herramienta ADEPT (The Advanced Dementia Prognostic Tool) 14.
Manifestaciones neuropsiquiátricas
Los fenómenos neuropsiquiátricos se presentan en cerca del 90 % de pacientes diagnosticados con demencia, tienen escasa tendencia a la remisión espontánea, producen gran sufrimiento al paciente y a su entorno, especialmente en casos graves como psicosis, agresión y agitación 7,16. La primera y segunda línea de manejo de las manifestaciones neuropsiquiátricas secundarias al trastorno neuro-cognitivo mayor incluyen estrategias no farmacológicas y potenciadores cognitivos, respectivamente 7,16. Dado que muchos de los síntomas pueden desencadenarse por falta de sueño, dolor, estreñimiento, desnutrición o cambios en el medio ambiente 7,16, las recomendaciones para el manejo se centran en intervenciones no farmacológicas con enfoques psicológico, psicosocial y ambiental, así como el ajuste de los potenciadores cognitivos 7,16, sin embargo, en algunas situaciones se pueden considerar otros grupos farmacológicos, como en el caso de la agitación, la depresión o el insomnio 7,17-18.
Agitación secundaria a demencia
Pacientes con trastorno neurocognitivo mayor y cambios comportamentales graves, como agresión verbal o física, pueden beneficiarse del uso de antip-sicóticos como olanzapina, risperidona o aripiprazol 14,17,19-20.
En población geriátrica, los antipsicóticos requieren de un mayor tiempo para ser efectivos y presentan un mayor riesgo de susceptibilidad a efectos secundarios, por lo cual, deben iniciarse a dosis bajas con ascensos progresivos cada 5-7 días hasta lograr la dosis mínima efectiva, con un tiempo de cambio de fármaco de 2-4 semanas en ausencia de respuesta clínica adecuada 5,17.
Debido a la ausencia de evidencia, el riesgo de pérdida de su eficacia con el uso prolongado y el aumento de riesgo cerebrovascular, el ciclo de tratamiento con antipsicóticos recomendado está limitado a 12 semanas 5,17. Una vez completado el ciclo terapéutico, se sugiere iniciar su protocolo de deprescripción, el cual consiste en realizar una disminución del 25 % de la dosis cada dos semanas, hasta lograr la suspensión total a los dos meses, con un seguimiento de al menos tres meses posterior a la suspensión de la medicación 17,19. Si la duración del tratamiento fuese menor a seis semanas, se podría considerar la suspensión inmediata del antipsicótico 5,17,19.
Depresión secundaria a demencia
Para el manejo de síntomas afectivos se recomienda el uso de escitalopram, sertralina o mirtazapina (menor efecto anticolinérgico) por un periodo de tratamiento que no debe superar los seis meses 5,7-18. Una vez finalizado el ciclo terapéutico, la deprescripción puede ser inmediata y requerirá solo de un mes de vigilancia posterior a la suspensión de la medicación 7,18,20. Se debe tener precaución con el riesgo de recaída por abstinencia asociada al uso de venlafaxina e insomnio en el caso del manejo con mirtazapina 5,18.
lnsomnio secundario a demencia
El anciano con trastorno neurocognitivo mayor puede requerir de ayudas farmacológicas para la conciliación del sueño, entre las cuales se encuentra la melatonina y la mirtazapina por un periodo de tratamiento no mayor a los seis meses 5,7,18. La suspensión debe ser progresiva, por lo cual, se recomienda un retiro gradual del 25 % cada 1-2 semanas 9,18 y un seguimiento durante al menos tres meses posterior a su suspensión. En la medida de lo posible, se debe evitar el uso de benzodiacepinas e hipnóticos Z, los cuales en caso de ser necesarios, deben limitarse a un ciclo de no más de 2-4 semanas de duración, tras lo cual la suspensión puede ser inmediata; sin embargo, en casos de prescripción prolongada, se considera instaurar una deprescripción gradual del 25 % cada dos semanas 7,17,21-22.
Herramientas para deprescripción
Los fundamentos científicos en los que se apoya el empleo de terapias farmacológicas en ancianos con demencia están limitados, debido a escasos ensayos clínicos realizados en psicogeriatría 7-10, por lo cual, aunque una prescripción no sea necesariamente inapropiada, en algunos casos se realiza sin suficiente respaldo científico y más bien apoyada por recomendaciones de expertos 15-16. Para facilitar la identificación de medicación potencialmente inapropiada en el adulto mayor, se han desarrollado herramientas como los criterios Beers 20 y los criterios STOPP/START 5. En los adultos con edades > 65 años con demencia avanzada, al tener una enfermedad en fase terminal 7,23-24, cobra valor la aplicación de estrategias de deprescripción como el STOPP-Frail, también conocido en español como STOPP-Pal 23,25. STOPP-Frail sugiere comenzar un protocolo de deprescripción ante cualquier prescripción concomitante de dos fármacos de la misma clase (con excepción de las prescripciones a demanda) como dos lSRS, neurolépticos o potenciadores cognitivos. También se sugiere deprescribir ISRS en presencia de hiponatremia significativa o reciente (sodio sérico < 130 mmol/l) o en presencia de sangrado significativo concurrente o reciente. Adicionalmente, se deberían deprescribir los nootró-picos como Ginkgo biloba, piracetam, metilfenidato, fosfatidilserina, modafinilo y ácidos grasos omega-3, por contradicciones en la evidencia disponible sobre su eficacia 23.
Para el caso del trastorno neurocognitivo mayor, también se disponen de estrategias cuya aplicación puede contribuir a la potencial deprescripción de medicamentos en pacientes con demencia avanzada 26 , como el caso de las desarrolladas por Parsons 27 y Holmes 15; sin embargo, a pesar de la necesidad de reducir eventos adversos prevenibles y aumentar la calidad de vida de pacientes con demencia grave mediante la deprescripción de medicación potencialmente inapropiada, la evidencia es limitada para recomendaciones o criterios específicos, así como es reducida la replicabilidad de estrategias de consenso, lo cual pone en evidencia la necesidad imperiosa de más investigaciones donde se evalúe de forma rigurosa la presencia de eventos adversos asociados a la medicación y los desenlaces específicos posteriores a la deprescripción a través del tiempo, los cuales permitan la construcción de consensos nacionales e internacionales 26-28.
Deprescripción y seguimiento interdisciplinario
El proceso de prescripción y deprescripción es dinámico a lo largo de la evolución de una enfermedad que suele requerir ajustes constantes. La aplicación de herramientas y criterios de deprescripción complementarios, así como el seguimiento y la monito-rización de recaídas posdeprescripción, son componentes valiosos en el enfoque de atención centrado en el paciente que debe aplicarse en el anciano con demencia 9-10,24; sin embargo, la deprescripción de fármacos en demencia avanzada no solo depende del estadio de la demencia, sino también del resultado de su valoración interdisciplinaria, en la cual se consideren las comorbilidades, el soporte familiar y la calidad del cuidado recibido por el adulto mayor, incluyendo a familiares y cuidadores en procesos de tomas de decisiones 9,16,29.
Las intervenciones no farmacológicas son indispensables para mejorar la cognición, los síntomas, el bienestar del paciente y su entorno; por ello, incluir la terapia de estimulación cognitiva (grupal o individual), participar de organizaciones amigables para pacientes con demencia y sus cuidadores, tener herramientas para gestionar la prestación de servicios, médicos y sociales, hace parte indispensable durante cada etapa de la demencia, incluyendo las avanzadas, donde se implementa la deprescripción 30-31. lncluso en estadios iniciales se debe buscar el control de factores de riesgo, mediante actividad física (grupal o individual de ejercicio aeróbico o entrenamiento de resistencia de intensidad moderada a severa) y estrategias nutricionales (dieta mediterránea, alto nivel de consumo de ácidos grasos mono y poliinsaturados, mayor ingesta de frutas y verduras) 30-31. Adicionalmente, en caso de ser necesario, se requiere de procesos de rehabilitación auditiva, visual y optimización del patrón de sueño 28-31.
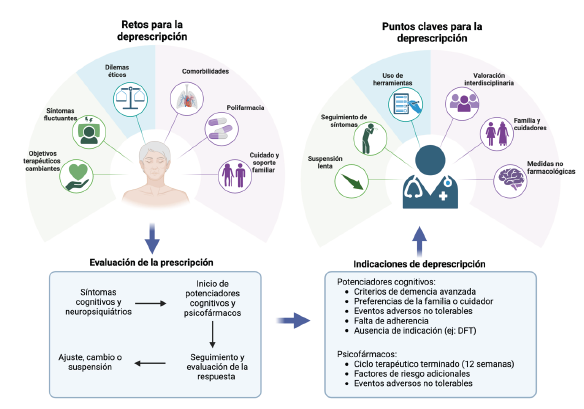
Por otra parte, se recomienda la aplicación de intervenciones psicoeducativas para cuidadores (educación, asesoramiento, mejora de habilidades de atención, resolución de problemas y desarrollo de estrategias), enfocadas en el desarrollo de estrategias de afrontamiento y resolución de problemas (especialmente en el manejo de las emociones) 30-31. En la figura 1 se identifican retos y puntos claves para el proceso de deprescripción en pacientes con demencia.
Conclusiones
En el adulto mayor con demencia se debe evitar la futilidad y la medicación potencialmente inapropiada, para lo cual se deben conocer las pautas de prescripción y deprescripción de las medicaciones utilizadas en el paciente con deterioro cognitivo. La decisión final de deprescripción debe ser tomada mediante un enfoque centrado en el paciente adulto mayor, donde la aplicación de escalas o criterios de deprescripción juega un papel complementario. La evidencia actual sugiere que para combatir el fenómeno de la polifarmacia y reducir la alta prevalencia de medicación potencialmente inapropiada y eventos adversos asociados a la medicación, se requiere de la implementación de programas de educación médica continua para estudiantes y profesionales en ejercicio, así como un mayor número de investigaciones, que sin perder su rigurosidad, se caractericen por un enfoque práctico y sencillo sobre procesos de deprescripción que incluyan pautas de deprescripción, seguimiento y desenlaces, tales como frecuencia de hospitalización, carga de los cuidadores, costos financieros y calidad de vida.
El mundo se encuentra enfrentando a la pandemia ignorada del adulto mayor con demencia, lo cual hace necesario reflexionar sobre la preparación de los servicios de atención primaria en salud en el abordaje y gestión del enorme problema de salud pública que se allega, especialmente en áreas rurales o dispersas, donde el acceso a medicina especializada es limitado.