Introducción
El Virus de la Inmunodeficiencia Humana (VIH) es un retrovirus que altera el sistema inmunológico del huésped, se transmite a través de fluidos corporales y tiene tropismo en linfocitos T CD4 donde se replica y a su vez, depleta la población de los mismos induciendo un estado de inmunosupresión secundaria1. En la actualidad, el pilar del tratamiento es la terapia antirretroviral con la que se busca suprimir la replicación viral, detener la progresión de la enfermedad y reducir la carga viral. A medida que la enfermedad avanza, se desarrolla un Síndrome de Inmunodeficiencia Adquirida (SIDA) en el que el huésped es susceptible a infecciones por patógenos que en el paciente inmunocompetente suelen ser inofensivos, conocidos como patógenos oportunistas los cuales incluyen bacterias, virus, parásitos y hongos1,2.
La Histoplasmosis es una micosis producida por el hongo dimórfico Histoplasma capsulatum, el cual se encuentra en forma de micelio filamentoso, con micro y macroconidias en terrenos contaminados con materia fecal de aves y murciélagos3,4. Presenta una distribución mundial siendo endémica en zonas tropicales y templadas como gran parte de Latinoamérica, África y Asia orientad 4. Tiene gran variedad de manifestaciones clínicas y pueden ser de presentación aguda y crónica. En el curso clínico de la enfermedad se presentan síntomas dados por fiebre, pérdida de peso, dolor torácico retroesternal, disnea progresiva y lesiones mucocutáneas; estas últimas caracterizadas por una presentación tardía y heterogénea. En adición a lo anterior, la histoplasmosis diseminada progresiva puede provocar manifestaciones severas incluyendo disfunción hepática, encefalopatía, pancitopenia, coagulación intravascular diseminada y shock séptico2,3,4.
El diagnóstico de histoplasmosis se puede confirmar mediante cultivo, serología y detección en patología. A pesar de haber múltiples métodos, el diagnóstico continúa siendo un reto; los cultivos son de crecimiento lento, con baja sensibilidad y requieren laboratorios de alto nivel para su procesamiento. La serología con anticuerpos suele ser útil para el diagnóstico subagudo y crónico al detectarse desde las 4 a 8 semanas posteriores a la infección, pero suele ser negativa en pacientes con VIH. La detección de antígeno tiene la ventaja de ser rápido, sensible y específico; no obstante, con la desventaja de que puede presentar reacción cruzada con otras infecciones fúngicas4,5. La histopatología es, hasta el momento, el gold standard para el diagnóstico de histoplasmosis. El tratamiento se va a fundamentar en dos clases de antimicóticos: en primer lugar, se encuentran los azoles que actúan inhibiendo la síntesis de ergosterol, sustancia esencial en las membranas celulares de los hongos; y por otro lado, los polienos que van a formar un complejo con el ergosterol provocando una ruptura de la membrana y con ello, la muerte celular4.
Las personas que presentan compromiso de la inmunidad mediada por células tienen un mayor riesgo de presentar histoplasmosis diseminada, cuya severidad aumenta en cuanto a mayor sea el deterioro inmunológico3. En relación a lo anterior, se ha descrito que la causa más común de histoplasmosis diseminada es la enfermedad avanzada debida al VIH lo que llevó a incluir a esta enfermedad como marcadora del SIDA3,4.
Los pacientes con infección por VIH/SIDA con reciente inicio de la terapia antirretroviral tienen mayor riesgo de presentar agravamiento de infecciones oportunistas subyacentes o la reactivación de infecciones previamente enmascaradas. Este riesgo es secundario al desarrollo del Síndrome Inflamatorio de Reconstitución Inmune (IRIS), el cual se ha descrito como un síndrome clínico secundario a la restauración inmunitaria antígeno específica inducida por la terapia antiretroviral6. Este síndrome se explica por la presencia de una alteración en la respuesta inmune celular mediada por las diferentes subpoblaciones de linfocitos T relacionada con un desequilibrio entre sus funciones proinflamatorias y antiinflamatorias, en donde esta última se torna débil generando como resultado una inflamación exagerada que se verá reflejada en el agravamiento de una infección oportunista subyacente o la reactivación de una infección oportunista previamente enmascarada7,8. En un reciente estudio en el que analizaron cohortes de pacientes con VIH que presentaron IRIS en diferentes países de Europa, África y Latinoamérica, reportaron una incidencia del IRIS que varía entre el 7 % y el 16 %, una edad media de presentación de 36,3 años y una mortalidad del 4,5 %; Sin embargo, no se incluyeron datos referentes a Colombia en este estudio9,10.
Para definir un caso de IRIS se tienen en cuenta ciertos criterios que han sido propuestos y descritos por French et al11 y Robertson et al12. En primer lugar, la existencia de una asociación temporal entre el inicio de la terapia antirretroviral y el desarrollo de los síntomas que usualmente se encuentra dentro de los primeros 3 meses. Así mismo, la evidencia de una restauración inmune demostrada por una disminución de la carga viral (> 1 logi0 copias/ml) y finalmente, la presencia de signos y síntomas clínicos consistentes con un proceso inflamatorio exagerado, que no corresponda al curso normal de una infección oportunista previamente diagnosticada o un nuevo proceso infeccioso11,12.
El IRIS se ha asociado a una amplia variedad de microorganismos patógenos, dentro de los cuales se incluyen, en orden de mayor a menor prevalencia: Mycobacterium tuberculosis, Citomegalovirus, Cryptococcus, Pneumocystis y en menor medida, el Histoplasma6,13,14. La forma diseminada de la histoplasmosis se erige como una micosis oportunista emergente y en pacientes con IRIS su prevalencia no supera el 10 %2,3.
Presentamos el caso de un paciente con diagnóstico reciente de VIH quien posterior a iniciar tratamiento antirretroviral, desarrolló histoplasmosis diseminada con manifestaciones cutáneas en contexto del Síndrome Inflamatorio de Reconstitución Inmune (IRIS). Consideramos la importancia de identificar esta entidad poco frecuente, dado que, a pesar de presentar manifestaciones que pueden resultar atípicas y severas, se puede direccionar hacia un pronóstico favorable si se brinda tratamiento médico oportuno6,7. De esta forma, el objetivo de este artículo es presentar el caso para resaltar estas entidades y sus manifestaciones, dándoles visibilidad en la comunidad médica.
Presentación del caso
Paciente masculino de 25 años de edad, natural de Bucaramanga, Santander; con antecedentes patológicos de sífilis primaria diagnosticada en abril del 2021 para la cual recibió tratamiento con 4 dosis de penicilina benzatínica y VIH diagnosticado simultáneamente y en tratamiento con Dolutegravir 50 mg cada día, Emtricitabina + Tenofovir 200/300 mg cada día y Trimetoprim/Sulfametoxazol 160/800 mg cada día, con conteo inicial de CD4 79 células/μl y carga viral de 93 000 copias. Ingresó al servicio de urgencias del Hospital Universitario de Santander remitido de consulta externa de infectología por cuadro clínico de 28 días de evolución que inicia aproximadamente 30 días posterior al inicio del manejo antirretroviral, consistente en astenia, adinamia, diaforesis, tos con expectoración y aparición de múltiples lesiones cutánea generalizadas.
Al examen físico de ingreso a urgencias se encuentra en regulares condiciones generales, afebril, con signos vitales en rango de normalidad, alerta, orientado, con ánimo triste y lábil, a la auscultación ruidos cardíacos rítmicos sin soplos, murmullo vesicular disminuído en ambos campos pulmonares, sin sobreagregados, abdomen blando, depresible, sin signos de irritación peritoneal, extremidades hipotróficas, presencia de múltiples lesiones en piel tipo máculas eritematovioláceas de aproximadamente 0,5 a 1 cm de diámetro con presencia de una pápula en su centro, no descamativas, que asemejan un aspecto en diana atípica; comprometiendo rostro, tórax, abdomen, dorso, extremidades superiores e inferiores y genitales; respetando palmas, plantas y mucosas (ver Figura 1).
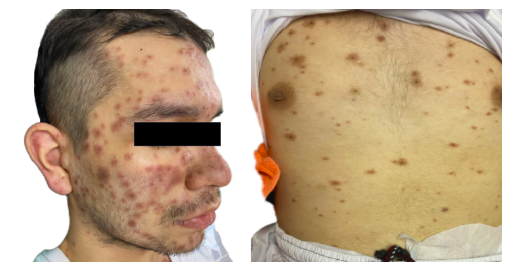
Fuente: autores.
Figura 1 Máculas eritematovioláceas con presencia de una pápula en su centro, no descamativas.
Se consideró paciente inmunocomprometido con compromiso respiratorio y cutáneo, quien no cumple criterios de caso sospechoso de SARS-COV2; se indicó realizar Tomografia de Tórax de Alta Resolucion (TACAR) para evaluar lesiones a nivel intersticial; además, toma de baciloscopias seriadas y Genexpert para descartar tuberculosis. Se solicitaron paraclinicos de extension para valorar respuesta inflamatoria sistémica, función renal, función hepática y estado hidroelectrolítico; los cuales evidenciaron LDH y fosfatasa alcalina elevadas, elevación de transaminasas sin alteraciones en ecografía hepatobiliar a excepción de leve esplenomegalia y perfil hepatotropo negativo, hipoalbuminemia, hiponatremia leve, sin elevación de azoados, bicitopenia dada por anemia moderada microcítica hipocrómica heterogénea con ferropenia asociada y leucopenia leve (ver Tabla 1). En la TACAR se observó el parénquima pulmonar con múltiples lesiones de características nodulares, hallazgos pulmonares sugestivos de origen inflamatorio infeccioso (ver Figura 2). Ante hallazgos imagenológicos fue llevado a fibrobroncoscopia con lavado alveolar en el que se aísla histoplasma. En lo referente al compromiso dermatológico, incialmente con sospecha de Sarcoma de Kaposi, por lo que se realizó biopsia de piel que lo descartó y que reportó estudios con tinciones de PAS y Gomori-Grocott en la que se observaron estructuras micóticas compatibles con histoplasma (ver Figura 3). Adicionalemnte, dado síntomas del estado de ánimo, se solicitó valoración por psiquiatría y psicología quienes consideraron cursando con trastorno adaptativo, descartaron requerimiento de psicofármacos y realizaron seguimiento durante la hospitalización.
Tabla 1 Paraclínicos de ingreso.
| Paraclínicos | Valores al ingreso | Valores de referencia | |
|---|---|---|---|
| Hemograma | Hemoglobina | 9,2 g/dl | 13 - 18 g/dl |
| Hematocrito | 29,6 % | 42 - 52 % | |
| VCM | 82,5 fL | 86 - 98 fL | |
| HCM | 25,6 pg | 27 - 32 pg | |
| CHCM | 31,1 g/dl | 33 - 37 g/dl | |
| Leucocitos | 4,19 x 10^3/ul | 5 - 10 x 10^3/ul | |
| Plaquetas | 289 x 10^3/ul | 150 - 450 x 10^3/ul | |
| Hierro Sérico | 17,9 ug/dl | 33 - 193 ug/dl | |
| Transferrina | 96,2 mg/dl | 200 - 360 mg/dl | |
| Ferritina | 3133,7 ng/ml | 30 - 40 ng/ml | |
| PCR | 76,3 mg/l | 0 - 5 mg/l | |
| Creatinina | 0,87 mg/dl | 0,67 - 1,17 mg/dl | |
| BUN | 11 mg/dl | 6 - 20 mg/dl | |
| ASAT | 300,1 U/L | 6 - 40 U/L | |
| ALAT | 218,7 U/L | 6 - 41 U/L | |
| LDH | 886 U/L | 135 - 250 U/L | |
| Fosfatasa Alcalina | 142 U/L | 40 - 129 U/L | |
| Cloro sérico | 96,2 mmol/L | 98 - 107 mmol/L | |
| Sodio sérico | 130 mmol/L | 135 - 148 mmol/L | |
| Potasio sérico | 3,97 mmol/L | 3,5 - 4,5 mmol/L | |
| Albúmina | 2,5 g/dl | 3,97 - 4,94 g/dl | |
| Fibrinógeno | 423 mg/dl | 200 - 400 mg/dl | |
| Triglicéridos | 112 mg/dl | 0 - 200 mg/dl | |
*VCM: Volumen Corpuscular Medio. *HCM: Hemoglobina Corpuscular Media. *CHCM: Concentración de Hemoglobina Corpuscular Media. *PCR: Proteína C Reactiva. *BUN: Nitrógeno Ureico en sangre. *ASAT: Transaminasa Oxalacetica. *ALAT: Transaminasa Pirúvica. *LDH: Deshidrogenasa Láctica.
Fuente: autores

Fuente: autores.
Figura 2 Tomografía de Tórax de Alta Resolución. Corte Coronal (A), Corte Axial (B). En el parénquima pulmonar se identifican múltiples nódulos de distribución difusa en vidrio despulido asociado a engrasamiento septal con patrón en empedrado, identificándose una consolidación periférica con extensión peribroncovascular en el segmento anterior del lóbulo superior izquierdo asociado a signo del halo.
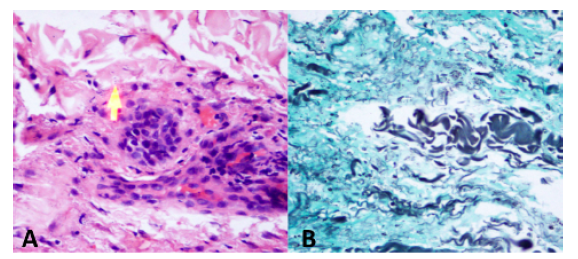
Fuente: autores.
Figura 3 Biopsia de piel. Histopatología. Forma de levadura Histoplasma capsulatum teñida con ácido periódico Schiff (A) y Grocott-Gomori metenamina plata (B).
Paciente con diagnóstico de histoplasmosis diseminada en contexto del Síndrome de Reconstitución Inmune (IRIS), se continuó manejo antirretroviral y se indicó iniciar Anfotericina B a dosis de 1 mg/kg/día por 14 días con lo cual presentó mejoría clínica significativa. Tras culminar dicho esquema, se indicó manejo ambulatorio con itraconazol dosis de carga 200 mg cada 8 horas por 3 días, posterior dosis de mantenimiento de 200 mg cada 12 horas por 1 año. Se obtuvo reporte de conteo de CD4 y de carga viral realizado intrahospitalariamente con CD4 de 27 células/μl y carga viral menor de 40 copias. Posterior al egreso, se continuó seguimiento con infectología de forma ambulatoria, donde se observó franca mejoría de lesiones cutáneas y resolución de síntomas generales asociados.
Discusión
El caso presentado es el de un paciente con histoplasmosis diseminada en contexto del Síndrome Inflamatorio de Reconstitución Inmune, con compromiso de múltiples sistemas, entre ellos se resaltan las manifestaciones cutáneas generalizadas tipo máculas eritematovioláceas con presencia de una pápula en su centro que inicialmente impresionó Sarcoma de Kaposi, pero finalmente con histopatología que evidenció estructuras micóticas compatibles con histoplasma. Teniendo en cuenta que los pacientes con infección por VIH/ SIDA con reciente inicio de la terapia antirretroviral tienen mayor riesgo de presentar agravamiento de infecciones oportunistas subyacentes o la reactivación de infecciones previamente enmascaradas secundario al desarrollo del Síndrome Inflamatorio de Reconstitución Inmune (IRIS),6 se aplicaron los criterios propuestos por French et al11. y Robertson et al12, evidenciando que nuestro paciente cumplió con los mismos, dado que presentó su sintomatología 30 días después del inicio del tratamiento antiretroviral; así mismo, se demostró la disminución de su carga viral en donde pasó de un recuento inicial de 93 000 copias a menos de 40 copias y finalmente, presentó signos y síntomas clínicos consistentes con un proceso inflamatorio exagerado no explicado por un nuevo proceso infeccioso o por toxicidad medicamentosa. En concordancia con lo anterior, se consideró un caso de histoplasmosis diseminada en contexto del IRIS.
Müller y colaboradores analizaron la incidencia del IRIS en pacientes infectados por VIH que iniciaron una terapia antirretroviral combinada. Se revisaron 54 estudios de cohortes con una población total de 1685 pacientes, en donde se calculó una incidencia del IRIS del 16,1 %. De igual forma, se estudió su relación con los diferentes patógenos, hallando, en mayor frecuencia, Citomagalovirus, Cryptococcus y Mycobacterium Tuberculosis con una incidencia del 37,7 %; 19,5 % y 15,7 %, respectivamente; y en menor medida, histoplasma y herpes zoster con incidencias que no superaron el 10 %9. Por otro lado, los análisis de metarregresión mostraron que la incidencia del IRIS está determinada en gran medida por el recuento de células CD4 al inicio de la terapia antirretroviral, con un riesgo alto en pacientes que la inician por debajo de 50 células/μl9. Por lo tanto, se infiere que gran parte de los eventos de IRIS podrían prevenirse con un inicio más temprano de la terapia antirretroviral.
En un estudio multicéntrico retrospectivo realizado por Melzani et al., se describió la incidencia y las características del IRIS asociado a histoplasmosis en una cohorte de personas con VIH. Se incluyeron 22 casos de IRIS asociado a histoplasmosis con una tasa de incidencia general de 0,74 casos por 1.000 personas/año infectadas por el VIH, con una edad media de presentación de 40,5 años y una proporción de 1 hombre por cada 4 mujeres15. Adicionalmente, reportaron las manifestaciones clínicas de los pacientes incluídos; las cuales, en orden de frecuencia fueron: manifestaciones digestivas (61 %), síndrome febril (59 %), hematológicas (52 %), respiratorias (52,27 %), mucocutáneas (27 %), agrandamiento de nódulos linfáticos (52 %), entre otras15. En el presente caso, el paciente cursó con síntomas pulmonares, hematológicos y mucocutáneos; en comparación con el estudio mencionado, sus manifestaciones clínicas están presentes por lo menos en la mitad de los pacientes, con excepción de las mucocutáneas que tuvieron una frecuencia más baja.
Se ha observado que la frecuencia de las manifestaciones mucocutáneas varía ampliamente según la localización demográfica, en países como Estados Unidos se llegan a presentar en un 15 % de los pacientes con histoplasmosis, mientras que en países de latinoamérica se presenta en un 38 a 85 % de los casos; estudios realizados en cepas de Histoplasma capsulatum en países de Suramérica han mostrado que estas cepas poseen mayor dermotropismo en comparación con las de Norte América, siendo esta la causa de esas diferencias tan marcadas16,17.
Las lesiones dermatológicas en pacientes VIH inmunocomprometidos tienen un espectro amplio, lo que hace difícil el diagnóstico clínico. En un estudio observacional realizado en un centro de salud en Ecuador con 13 pacientes VIH positivo con histoplasmosis cutánea, se encontró que la mayoría de pacientes tuvo una presentación generalizada (85 %) y las lesiones papulares fueron las más frecuentes (80 %); los otros tipos de lesiones descritas fueron: placas (40 %), nódulos (15 %), máculas (8 %), lesiones variceliformes (8 %) y lesiones exofíticas (8 %). Adicionalmente, se encontraron costras (62 %) y lesiones ulceradas (38 %)18.
En este caso, el paciente presentó lesiones eritematovioláceas generalizadas no descamativas con presencia de una pápula en su centro que configuran un aspecto en diana atípica tipo eritema multiforme. En la revisión bibliográfica, solo se encontraron 2 casos similares de pacientes con VIH e histoplasmosis diseminada que presentaban lesiones cutáneas tipo eritema multiforme. Estos fueron reportados en una serie de casos realizada por Ramdial et al que incluyó 14 pacientes con estas condiciones. Por lo tanto, las lesiones cutáneas observadas en nuestro paciente representan una manifestación poco común en comparación con lo descrito en la literatura19.
En el proceso de diagnóstico diferencial se interrogó el síndrome hemofagocítico secundario a infección por Histoplasma capsulatum en paciente inmunocomprometido; no obstante, nuestro paciente no cumplía con al menos 5 de los 8 criterios necesarios para su diagnóstico, entre ellos: síndrome febril prolongado, citopenias profundas, hipertrigliceridemia, hipofibrinogenemia y ferritina marcadamente elevada con valores superiores a 10 000 ng/ml. Debe resaltarse que no se contó con la medición de sCD25 (marcador de actividad linfocítica), ni con estudios de médula ósea para detectar la posible hemofagocitosis20.
El tratamiento del IRIS se configura como un reto y debe estar fundamentado en un enfoque completamente individualizado. Se habla de un manejo preventivo y uno para el IRIS constituído en donde en el primero, las estrategias son identificar infecciones oportunistas subclínicas y coinfecciones múltiples en los individuos marcadamente inmunosuprimidos, evaluar endemicidad de dichas infecciones oportunistas y con base en ello, estimar el uso de profilaxis secundaria en algunas de ellas21. Ahora bien, el manejo del IRIS ya constituido se sustenta en mantener la terapia antirretroviral mientras sea posible y en algunos casos será necesario un tratamiento antiinflamatorio coadyuvante con corticoides y AINES. En adición a lo anterior, los estudios demuestran el beneficio de mantener el tratamiento específico de la infección oportunista7,21,22.
En un estudio de cohorte realizado en Colombia en donde se incluyeron 52 pacientes con diagnóstico de histoplasmosis diseminada, se realizó una caracterización y comparación entre pacientes con coinfección de VIH y los no coinfectados. Se documentó en dicha cohorte que los pacientes con VIH que se encontraban con terapia antirretroviral durante el tratamiento tuvieron una resolución completa o una mejoría significativa de los síntomas de histoplasmosis, en comparación con aquellos que no se encontraban en tratamiento antirretroviral lo cuales solo un 47,4 % presentaron mejoría23.
La decisión del tratamiento a seguir se toma teniendo en cuenta las manifestaciones clínicas, la severidad del cuadro y el estado inmunitario2. En el caso de nuestro paciente, se mantuvo la terapia antirretroviral y se administró anfotericina B liposomal por 14 días la cual se prefiere por su mejor respuesta clínica, disminución de la mortalidad y menor riesgo de nefrotoxicidad24. Así mismo, se indicó itraconazol como manejo de mantenimiento por 12 meses para disminuir riesgo de recaídas.
Finalmente, tras analizar la información expuesta en este artículo, se considera que este caso es de gran importancia dado la baja incidencia de histoplasmosis diseminada en contexto de IRIS para así, aumentar su sospecha diagnóstica en una enfermedad con manifestaciones multisistémicas; entre la cuales, destacan las cutáneas que pueden ser a su vez muy variadas. Por otro lado, se reconoce la limitación que supone el diagnóstico tardío dado la no disponibilidad de pruebas no invasivas para la detección del histoplasma y el retraso que supone el estudio histopatológico con el que finalmente se realizó el diagnóstico.
Conclusión
Los pacientes con infección por VIH/SIDA con reciente inicio de terapia antirretroviral tienen riesgo de presentar reactivación de infecciones subyacentes o previamente enmascaradas en relación al IRIS; como en este caso con una histoplasmosis diseminada, entidad poco frecuente, con manifestaciones que pueden llegar a ser tan variadas como severas, incluyendo las lesiones cutáneas tipo eritema multiforme las cuales están poco descritas en la literatura, lo que condiciona una difícil aproximación diagnóstica; sin embargo, con una adecuada respuesta clínica una vez instaurado el tratamiento médico oportuno.















