Introducción
La Pancreatitis Aguda es una lesión inflamatoria causada por la autodigestión del tejido pancreático, que incluye edema, hemorragia y/o necrosis1. Estimaciones en Estados Unidos indican una incidencia de entre 40 a 140 por cada 100 000 habitantes, por lo que es un motivo frecuente de hospitalización en esta población, con una incidencia anual de visitas al servicio de urgencias o de atención ambulatoria de 106 hasta 320 por cada 100 000 habitantes2-5. Mientras tanto, en Latinoamérica y Colombia aún no hay datos suficientes sobre su incidencia real6. Tradicionalmente, la tomografia de abdomen se ha utilizado como prueba diagnóstica de la Pancreatitis Aguda, pero también como marcador pronóstico, utilizando el puntaje de Balthazar y el índice de severidad7.
La etiología de la Pancreatitis Aguda es variada. Las causas más comunes en el mundo son la Colelitiasis (45 %), idiopática (20-34 %) y el consumo de alcohol (3-45 %). Otras relativamente raras incluyen: traumatismos, colangiopancreatografía retrógrada endoscópica (CPRE) (5 %), hipercalcemia (1-4 %), infección (1-2 %), fármacos (0,1-2 %) (antihipertensivos, estatinas, metformina, metimazol, antinflamatorios, inmunosupresores, antimicrobianos, entre otros), hipertrigliceridemia, hiperparatiroidismo, enfermedades autoinmunes, tumores pancreáticos, cirugía, picaduras de escorpión (<1 %), etc.1-6,8. En Colombia, la Pancreatitis Aguda se ha descrito, en la mayoría de los casos, de origen biliar (63 al 93 %), seguido de causas como el consumo de alcohol; dentro de las menos comunes se encuentra la asociación con la ingesta de medicamentos, que representa el 1 %de los casos6,9. Para demostrar esta asociación se ha planteado que es necesario descartar las demás causas de Pancreatitis, con imágenes que descarten obstrucción, perfil lipídico sin hipertrigliceridemia severa, perfil mineral óseo normal, pruebas de autoinmunidad específicas negativas, no evidencia de la ingesta de otros medicamentos, infecciones, traumas o cirugías recientes. Solo para algunos fármacos se ha cumplido con esta condición y además se ha comprobado recurrencia con la reexposición. Para la metformina hay reportes que demuestran causalidad cumpliendo estos criterios, pero aún son escasos8.
Particularmente con la metformina, los casos de asociación con pancreatitis aguda fueron reportados en pacientes con factores de riesgo como función renal deteriorada que predispone a acumulación del fármaco o con efectos adversos gastrointestinales, especialmente episodios de diarrea y/o emesis que pueden llevar a isquemia pancreática en estados de bajo gasto10-13. A pesar de esto, luego de los cambios en el estilo de vida, la metformina es la primera línea farmacológica en el manejo de la prediabetes, tal como lo había mostrado la revisión de Echouffo en 202314. La última guía de la American Diabetes Association plantea que el beneficio del uso de metformina en prediabetes puede esperarse especialmente en pacientes menores de 60 años, obesidad grado II, antecedente de diabetes gestacional, hemoglobina glicada mayor a 6 o glucosa en ayunas mayor a 110 mg/dL. Por tanto, es relevante identificar tempranamente los pacientes que presentan este efecto adverso o tengan factores de riesgo, para en estos casos considerar opciones alternativas como linagliptina y dapagliflozina15.
El objetivo del presente artículo es presentar el caso de una paciente joven, sin enfermedad renal que presentó dos episodios de pancreatitis aguda posterior al tratamiento con metformina a dosis usual; este es uno de los primeros casos reportados con esta asociación en nuestro medio.
Presentación del caso
Paciente de 29 años, procedente de la zona urbana de Cali, Colombia, femenina, acudió al servicio de urgencias por dolor abdominal de 14 horas de evolución y emesis. Como antecedentes personales se destacaba el diagnóstico de síndrome de ovario poliquístico (SOP) (2014), para el cual recibió esquemas de anticonceptivos, sin antecedentes de tabaquismo ni ingesta de licor significativa o antecedentes familiares de relevancia.
Como parte del manejo de SOP, en julio de 2020, se inició metformina, una tableta de 850 mg cada día; luego de 15 días de haberla recibido requirió consultar al servicio de urgencias por dolor abdominal intenso, deposiciones líquidas. Al ingreso estaba hipotensa por lo que se sospechó causas de abdomen agudo quirúrgico, entre ellas la presencia de una colección intraabdominal, y se indicó la realización de una tomografía de abdomen en la que se observó pancreatitis aguda clasificada como Baltazar D. Se documentó un pequeño foco de necrosis en la cola del páncreas, menor al 30 %, índice de severidad de 5, sumado a un reporte elevado de amilasa y lipasa.
A pesar del mal estado inicial, con leucocitosis a expensas de neutrófilos, no presentó compromiso de la función renal ni hepática, tuvo una respuesta rápida y satisfactoria a los líquidos endovenosos y esquema antibiótico con ampicilina sulbactam 3 g endovenosos cada 6 horas en la unidad de cuidados intensivos, no requirió vasopresores; una vez estable, se suspendió el manejo antibiótico al no encontrarse colecciones peripancreáticas y progresivamente toleró la vía oral. En su proceso de atención se descartaron las causas más frecuentes de pancreatitis aguda, la fosfatasa alcalina y la gamma-glutamil transferasa no estaban a favor de un patrón colestásico, no obstante, en el centro donde fue atendida al no evidenciar una etiología optaron por realizar colecistectomía, dada la probabilidad de una causa biliar, sin embargo, no se encontraron cálculos. En ese momento no se pensó que la metformina tuviera una relación y no se generaron recomendaciones médicas al respecto, pero la paciente optó por suspender el medicamento, ante su sospecha de que esta fuera la causa de su cuadro. Por otra parte, continuó manejo con etinilestradiol/acetato de ciproterona 0,035 mg/2 mg para su cuadro de síndrome de ovario poliquístico.
En su centro de atención primaria venía en seguimiento por obesidad, SOP y prediabetes; en febrero de 2021, se formuló nuevamente metformina y se reinició a una dosis menor, media tableta de 850 mg cada día. Luego de dos semanas, en marzo de 2021, tuvo que consultar a urgencias porque presentaba dolor abdominal tipo cólico, irradiado en banda a región dorsal, 10/10 en escala análoga del dolor, asociado a emesis en 4 ocasiones, de contenido alimentario y posteriormente bilioso. Como hallazgos iniciales positivos estaba taquicárdica, con obesidad grado I, IMC 34,4 kg/m2, panículo adiposo, dolor a la palpación de epigastrio e hipocondrio izquierdo, sin signos de irritación peritoneal. En la tabla 1 se encuentran los laboratorios tomados al ingreso; estos mostraron leucocitosis a expensas de neutrofilia, sin alteración en función hepática o renal. La tomografía de abdomen en el primer día de la hospitalización reveló pancreatitis aguda Baltazar C, sin necrosis en el parénquima, y se calculó un puntaje APACHE II de 4. La ecografía de abdomen y la tomografía mencionada, realizadas en el primer día, al igual que la resonancia magnética de abdomen, realizada al tercer día de hospitalización, descartaron compromiso obstructivo en la vía biliopancreática (ver Figura 1).
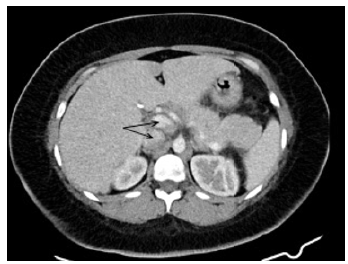
Fuente: autores.
Figura 1 TAC de abdomen. La reconstrucción en plano axial evidencia la glándula pancreática con irregularidad del contorno anterior, en la cabeza y cuerpo (flechas), asociado a moderada estriación de la grasa peri pancreática, sin evidencia de colecciones líquidas.
Tabla 1 Paraclínicos de ingreso.
| Parámetros | Resultados | Referencia |
|---|---|---|
| Leucocitos | 13 750 | 3,910-8,770x103/uL |
| Neutrófilos | 11 300 | 1,8 2 0-7,42 0x103/uL |
| Linfocitos | 1770 | 1,5 0 0-4,0 0 0x103/uL |
| Hemoglobina | 12,3 | 12-15 g/dL |
| Hematocrito | 40,6 | 38-44 % |
| Plaquetas | 448 | 150-450x10/uL |
| Aspartato aminotransferasa | 15,8 | 8-33 U/L |
| Alanina aminotransferasa | 17 | 7-55 U/L |
| Amilasa | 4057 | 40-140 U/L |
| Lipasa | 10 785 | 12-70 U/L |
| Bilirrubina total | 0,16 | <1,2 mg/dL |
| Creatinina | 0,77 | 0,6-1,1 mg/dL |
| Nitrógeno ureico | 12,3 | 6-20 g/dL |
Fuente: autores.
Con los anteriores hallazgos se definió el diagnóstico de pancreatitis aguda Balthazar C, sin evidencia de necrosis parenquimatosa.
Se realizó el tratamiento con hidratación intravenosa, manejo sintomático con dipirona 1 g cada 8 horas y metoclopramida 10 mg cada 8 horas endovenoso. El primer día se suspendió la vía oral como parte del manejo integral de la pancreatitis y la administración de metformina; no requirió correcciones con insulina. El segundo día se logró control del dolor y de las náuseas y se inició dieta blanda, y el tercer día tuvo tolerancia completa a la vía oral. Durante los días siguientes se complementaron los estudios en búsqueda del diagnóstico etiológico, sin recurrencia de los síntomas. Finalmente, al día 8 de estancia se dio egreso.
El evento tuvo una relación temporal plausible con la ingesta de metformina, se descartaron las otras etiologías de pancreatitis, la cual tenía una presentación clínica sugestiva, elevación de enzimas pancreáticas, y fue confirmada por imágenes; en este evento y en el previo hubo mejoría de los síntomas luego de la suspensión del medicamento, y hubo recurrencia de la pancreatitis con el inicio de metformina. Ante esto, la asociación entre metformina y la recurrencia de pancreatitis se clasificó como definitiva en las categorías de causalidad de la Organización Mundial de la Salud-Centro de Monitoreo de Uppsala (OMS-UMC)16 y definida en el algoritmo de Naranjo17.
Pasado un año, la paciente continúa sin dolor abdominal, asintomática, en el programa de obesidad, sin manejo farmacológico, con un plan de cambio en el estilo de vida para lograr pérdida de peso.
Discusión
La pancreatitis inducida por fármacos es uno de los tipos con una incidencia relativamente rara, pero desde el primer informe de pancreatitis aguda causada por clortalidona y cortisona, en la década de 1950, se ha informado que cientos de diferentes clases de medicamentos de uso habitual generan daño pancreático1-6,8. Hasta el momento, el conocimiento sobre la pancreatitis inducida por fármacos es limitado y proviene principalmente de estudios de casos y controles, informes de casos, estudios en animales y otros datos experimentales. Suele considerarse en el contexto de un antecedente de ingesta sospechosa de fármacos, y deben descartarse otras causas frecuentes de pancreatitis, siendo un diagnóstico de exclusión. Sin embargo, no en todos los casos se logra demostrar una relación causal entre el uso del fármaco y la aparición de pancreatitis aguda, debido a que para afirmar el diagnóstico se requiere una nueva prueba de provocación, lo cual implica cuestionamientos éticos1.
Con el objetivo de identificar fármacos con posible asociación con pancreatitis aguda y respaldar esa relación causal, Wolfe y cols.8, en 2020, realizaron una revisión sistemática de la literatura. Identificaron 713 casos de pancreatitis potencialmente inducida por 213 fármacos. De acuerdo con la información recolectada, clasificaron el nivel de la probable causalidad de cada fármaco con el desarrollo de pancreatitis aguda, de acuerdo con el reporte de casos en humanos con re-desafío positivo, el descarte de diagnósticos diferenciales y la relación temporal de la ingesta del medicamento con la pancreatitis aguda o latencia constante. Solo para 19 de estos fármacos la causalidad fue probable o definitiva. Dentro de ellos, la metformina se clasificó como clase Ia, el nivel más alto de evidencia.
En cuanto a los potenciales precipitantes, lo más reportado es que la pancreatitis aguda inducida por metformina ocurra en pacientes con función renal deteriorada y asociada a episodios de diarrea y/o emesis como efectos adversos del medicamento9-13. También existe relación con sobredosis e intoxicación con metformina en pacientes con intento de suicidio11,18,19. Sin embargo, son escasos los reportes de pancreatitis inducida por metformina en pacientes que como en nuestro caso tenían función renal normal y su dosis era usual20-22, no obstante, es relevante que en el primer episodio la presentación clínica inicial fueron síntomas gastrointestinales como diarrea y en el segundo, emesis; las dos causas de bajo gasto y de pancreatitis necrotizante, tal como se ha descrito antes.
La preocupación principal al ingreso en los pacientes con pancreatitis aguda inducida por metformina es el dolor abdominal y emesis10-13,18-22. En el caso que reportamos, esta presentación clínica típica se correlacionó en los dos episodios con altos niveles de lipasa y amilasa y hallazgos compatibles en las tomografías con necrosis en la cabeza del páncreas en la primera vez. El diagnóstico se soportó descartando otras causas conocidas de pancreatitis aguda, como cálculos biliares, abuso de alcohol, hipercalcemia, hipertrigliceridemia, trauma y autoinmunidad.
El manejo con hidratación intravenosa, analgesia y antiemético, más la suspensión de la ingesta de metformina, logró la resolución de sus síntomas en 2020, y presentó recaída tras la reexposición en la pancreatitis aguda reciente, lo que genera una relación causal fuerte con la metformina como la etiología en los dos casos, incluso con una dosis subterapéutica y función renal normal.
Conclusiones
La pancreatitis es un efecto secundario inusual, pero que se debe prever en el manejo con metformina, especialmente en pacientes predispuestos como pacientes con deterioro de la función renal, casos en los que se debe titular la dosis u optar por una terapia diferente. Además, en condiciones de bajo gasto como diarrea y emesis también puede ocurrir la pancreatitis aguda, por esta razón se debe dar los signos de alarma al paciente para procurar una hidratación adecuada y el manejo de los síntomas, dada la posibilidad de desarrollar complicaciones como la necrosis de la cabeza del páncreas.















