Introducción
El glaucoma es una neuropatía óptica progresiva caracterizada por la degeneración de las células ganglionares de la retina, la cual produce un aumento característico de la excavación papilar (1). Se estima que en el mundo existen más de 60 millones de personas con glaucoma, de los cuales aproximadamente siete millones están en Latinoamérica (2). En Colombia se ha reportado una prevalencia del 5,6 % en mayores de 50 años (3). La presión intraocular (PIO) es el factor de riesgo más importante y hasta la fecha el único modificable (4). Todos los pacientes con glaucoma se benefician de una disminución de la PIO (5).
La frecuencia de glaucoma en mujeres embarazadas ha aumentado debido a que las edades para la gestación se han extendido cada vez más; aunque es poco común que esta enfermedad aparezca antes de los 40 años, puede afectar a mujeres en edad reproductiva (6). Fisiológicamente, durante el embarazo ocurre una disminución de la PIO, la cual inicia aproximadamente hacia la semana 18 de gestación y alcanza una disminución de 1 a 4 mmHg por debajo de la PIO basal en el tercer trimestre y el período posparto temprano, por un aumento en el flujo del humor acuoso. Sin embargo, las causas de esto no están bien establecidas (7).
El manejo del glaucoma durante el embarazo y en mujeres que intentan quedar embarazadas representa un reto especial. Además de los efectos adversos de los medicamentos antiglaucomatosos y los riesgos del tratamiento quirúrgico en la mujer embarazada, se deben tener en cuenta también los posibles efectos teratogénicos de los medicamentos en el feto (8). Debido a la falta de guías para el manejo del glaucoma en el embarazo, hay un grado de incertidumbre respecto a la aproximación a esta enfermedad entre quienes se encuentran ante esta situación clínica (9). La presente revisión expone una perspectiva de la importancia del tratamiento en la paciente embarazada para prevenir la progresión del glaucoma y la pérdida visual asociada, así como las precauciones necesarias para evitar efectos adversos en el feto. Además, se presenta un panorama general sobre el manejo del glaucoma durante la lactancia.
Materiales y métodos
Se realizó una búsqueda de la literatura médica en PubMed-Medline, SciELO, OVID y Google Scholar, en la cual se utilizaron los siguientes términos MeSH: glaucoma, pregnancy, breast feeding, lactation, intraocular pressure, beta-blockers, carbonic anhydrase inhibitors, prostaglandins, parasympathomimetics, sympathomimetics, latanoprost, bimatoprost, travoprost, brimonidine, dorzolamide, brinzolamide, acetazolamide, pilocarpine, trabeculoplasty, cyclophotocoagulation, trabeculectomy and glaucoma surgery, así como sus equivalentes en español.
Se tomaron en cuenta estudios de diferente naturaleza, incluyendo reportes de caso y secciones de libros pertinentes al glaucoma durante el embarazo y lactancia, desde el 2001 hasta el 2021, en inglés y español. Todos los estudios encontrados en la búsqueda fueron tamizados por dos autores, quienes definieron cuáles debían ser objeto de análisis.
Presión intraocular durante el embarazo
Durante el embarazo la PIO disminuye por razones fisiológicas (10). Esta situación tiende a darse sobre todo en el segundo (11) y tercer trimestre (12), tras lo cual vuelve a incrementarse hasta alcanzar el valor basal previo a la gestación hacia la sexta semana posparto (13). Los cambios que ocurren en la PIO durante esta etapa no causan ningún daño y no se ha demostrado que aumente por causa de la gestación (14). Rara vez el glaucoma es diagnosticado durante el embarazo, con algunas excepciones en casos de historia familiar de glaucoma juvenil (15).
Causas de la disminución de la presión intraocular durante el embarazo
No hay una razón bien establecida que explique por qué disminuye la PIO en el embarazo, pero hay varias hipótesis. Es claro que dicha disminución se produce por una mayor facilidad para la salida del flujo del humor acuoso y no de una menor producción de este. Los cambios hormonales podrían explicar mejor el flujo de salida del humor acuoso, pero la evidencia que soporta esta hipótesis es mixta (16). Se ha sugerido que la PIO medida durante la gestación tiene un resultado aparentemente más bajo, producto de la hidratación del estroma corneal, lo cual resulta en un incremento del grosor corneal central (17). Este fenómeno fue reportado en estadios tardíos del embarazo, cuando se comparó con un grupo de mujeres no embarazadas (18). Sin embargo, otros estudios no encontraron diferencias significativas en el grosor corneal entre estos dos grupos (19).
Cambios de la presión intraocular en mujeres que ya tienen glaucoma o hipertensión ocular
En un estudio realizado en 13 ojos de 8 mujeres embarazadas no se encontró un aumento significativo de la PIO durante el embarazo, así como tampoco se observaron cambios importantes en el campo visual (20). Otro estudio de 28 ojos de 15 pacientes embarazadas reportó que la PIO estuvo estable y sin cambios en el campo visual en 16 de los 28 ojos, mientras que en 5 hubo pérdida progresiva de este sin alteraciones en la PIO. En otros 5 no cambió el campo visual, pero sí incrementó la presión (21). Esto sugiere que el comportamiento de la PIO en pacientes embarazadas con glaucoma o con hipertensión ocular puede ser variable, y no necesariamente se reducirá como consecuencia de los cambios fisiológicos del embarazo (22).
Medicamentos antiglaucomatosos en el embarazo
La FDA (Food and Drug Administration, por sus siglas en inglés) ha categorizado los riesgos de los medicamentos durante el embarazo en un sistema de cinco letras (8), que se puede ver en la Tabla 1.
Norma final de etiquetado de embarazo y lactancia. A partir del 30 de junio del 2015 se propuso un cambio en la categorización de cinco letras de la FDA por un sistema de etiquetamiento llamado Norma Final de Etiquetado de Embarazo y Lactancia o Pregnancy and Lactation Labeling Final Rule (PLLR), por lo cual todos los medicamentos aprobados por la FDA a partir de esa fecha deberían usar el nuevo formato (22). A pesar de esto, la mayoría de la literatura disponible en medicamentos antiglaucomatosos en el embarazo está con el formato anterior, por lo cual se usó la clasificación de cinco letras en el presente artículo. Modificado de: Gedde SJ, Vinod K, Wright MM, Muir KW, Lind JT, Chen PP, et al. Primary Open-Angle Glaucoma Preferred Practice Pattern® [Internet]. American Academy of Ophthalmology. 2020:101-2. Disponible en: https://www.aao.org/ preferred-practice-pattern/primary-open-angle-glaucoma-ppp
En la Tabla 2 se presenta un resumen de las categorías de medicamentos de glaucoma en el embarazo. Las opciones más frecuentes de tratamiento médico incluyen cuatro clases de hipotensores oculares: los betabloqueadores, los inhibidores de la anhidrasa carbónica (IAC), los agonistas alfa adrenérgicos y los análogos de prostaglandinas. En la Tabla 3 se pueden ver los mecanismos de acción y porcentajes de disminución de PIO para cada grupo de medicamentos (23-30).
Tabla 2: Resumen de las categorías de medicamentos de glaucoma en el embarazo
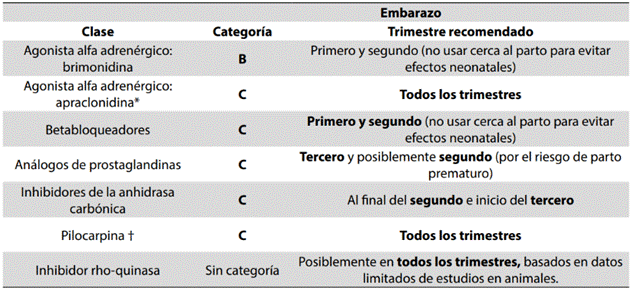
*No disponible en Colombia. †Uso poco frecuente en la práctica clínica. Modificado de: Belkin A, Chen T, DeOliveria AR, Johnson SM, Ramulu PY, Buys YM. A Practical Guide to the Pregnant and Breastfeeding Patient with Glaucoma. Ophthalmol Glaucoma. 2020;3(2):79-89. DOI: 10.1016/j.ogla.2019.12.004
Betabloqueadores (categoría C)
Existen diferentes betabloqueadores tópicos para el manejo del glaucoma. Por un lado, están el timolol, el carteolol y el levobunolol, que actúan sobre los receptores β1 y β2. Por otro lado, está el betaxolol, que solo actúa sobre el receptor β1. El timolol en su presentación al 0,5 % es el medicamento mejor estudiado y el de uso más frecuente para el tratamiento del glaucoma (23). El uso de betabloqueadores durante el segundo y tercer trimestre se ha asociado con una restricción del crecimiento intrauterino y betabloqueo persistente en el recién nacido (8). El timolol se ha asociado con arritmia, bradicardia y alteración del control respiratorio en neonatos. Por esta razón, los recién nacidos expuestos in utero al timolol deben ser monitoreados estrechamente durante las primeras 24 a 48 horas de vida para revisar si presentan bradicardia u otros síntomas cardiorrespiratorios (8). Un estudio poblacional investigó la asociación entre un bajo peso al nacer y el uso de betabloqueadores tópicos en el embarazo, sin hallazgos significativos (31).
Inhibidores de la anhidrasa carbónica (IAC) (categoría C)
Los IAC usados en oftalmología están disponibles en presentación tópica y oral. El uso de la forma tópica es muy frecuente; la presentación oral rara vez es usada y se reserva, entre otros usos, para el manejo del cierre angular primario (32).
Tópicos
Dorzolamida y brinzolamida: no hay reportes de ninguna complicación fetal después del uso tópico de IAC en mujeres embarazadas (8). La absorción sistémica de los IAC tópicos rara vez puede causar efectos adversos sistémicos, en contraste con la administración oral (33).
Orales
Acetazolamida y metazolamida: estudios en animales han informado de anomalías de las extremidades en ratas, ratones y hámsteres secundarias al uso de IAC. El mecanismo por el que estas se producen todavía no ha sido determinado (8). Hay un reporte de acidosis tubular renal en un neonato de 34 semanas por uso de acetazolamida materna de 750 mg/día iniciada tres días antes del nacimiento, probablemente por el paso transplacentario del medicamento (34). Por otro lado, un estudio que incluyó 12 mujeres embarazadas que tomaron acetazolamida oral de 1 g/día para hipertensión intracraneal idiopática no reportó complicaciones maternas o fetales (35).
En general, la recomendación es que la acetazolamida oral sea usada en el embarazo solo si el beneficio supera los riesgos potenciales para el feto. Sin embargo, la acetazolamida no se prescribe de manera frecuente para el control de la PIO; usualmente se usa para el manejo del cierre angular agudo y hay muy baja probabilidad de que se requiera en el embarazo (32).
Análogos de prostaglandinas (categoría C)
Los análogos de prostaglandinas son los medicamentos de primera línea para el tratamiento del glaucoma en la población general, pues tienen una serie de ventajas sobre los otros medicamentos (es de dosis única diaria, de rápida absorción, genera disminución marcada de la PIO, presenta excelente tolerancia y tiene efectos sistémicos insignificantes). Este grupo de antihipertensivos oculares tópicos incluye el latanoprost, el latanoprosteno, el bimatoprost, el travoprost, el tafluprost y la unoprostona. El latanoprost es el medicamento más ampliamente usado y el que está disponible universalmente (25).
Esta misma clase de medicamentos se puede usar para inducir el trabajo de parto, pues estimula la contracción del músculo liso uterino. Las prostaglandinas incrementan el tono uterino y pueden reducir la perfusión del feto. La dosis usada para estimular el aborto sería el equivalente a 400 ml de la formulación ocular de latanoprost (36). Se ha demostrado que el latanoprost, el travoprost y el bimatoprost estimulan la contracción uterina de ratas no embarazadas (37). No hay, sin embargo, reportes de trabajo de parto prematuro asociado a estos medicamentos. Se puede considerar su uso en el embarazo (8) de ser necesario en casos de glaucoma grave.
Latanoprost (categoría C)
Un estudio de 11 embarazadas que recibieron latanoprost en el primer y segundo trimestre, con una duración de uso del medicamento de entre 4 y 70 días, mostró que 9 mujeres dieron a luz niños normales, sin malformaciones. Una paciente tuvo un aborto espontáneo dos semanas después de dejar el tratamiento, en un embarazo de alto riesgo relacionado con edad avanzada, y en otra paciente no hubo seguimiento (38).
Travoprost y bimatoprost (categoría C)
En estudios en ratas hubo una disminución del tiempo de gestación y del índice de masa corporal, y un aumento en la incidencia de fetos muertos y de la mortalidad perinatal. No hay estudios en mujeres embarazadas (8).
Latanoprosteno (categoría D)
Es un medicamento que, una vez se expone a las esterasas del entorno ocular, se divide en latanoprost y en mononitrato de butanodiol, una fracción que dona óxido nítrico. En estudios en ratas embarazadas ha mostrado letalidad embrio-fetal (reabsorción y muerte) y anomalías estructurales. Las malformaciones incluyeron anomalías del esternón, cabeza en forma de domo, hiperextensión de las patas delanteras y malrotación de las patas traseras, anomalías vertebrales y osificación retardada de los huesos distales de las extremidades (39).
Agonistas alfa adrenérgicos: brimonidina (categoría B) y apraclonidina (categoría C)
En niños pequeños la brimonidina causa efectos en el sistema nervioso central (SNC), incluyendo apnea debida a la penetración de la barrera hematoencefálica (40). En estudios en conejos se observó que la apraclonidina presenta efectos embriocidas con dosis 60 veces superiores a las previstas para el ser humano (41).
Inhibidores de rho-quinasa: ripasudil, netasurdil (sin categoría)
Son medicamentos nuevos para el tratamiento del glaucoma e hipertensión ocular. Por el momento no existen datos sobre el uso de netasurdil en mujeres embarazadas; estudios en animales no demostraron efectos adversos en el desarrollo del feto con exposiciones intravenosas relevantes (22). Para el ripasudil no hay estudios en animales ni en mujeres embarazadas (42). Los inhibidores de rho-quinasa no están asignados hasta el momento a ninguna categoría del embarazo de la FDA (22).
Mióticos (categoría C)
En la actualidad la pilocarpina se usa muy poco, dado que existen mejores medicamentos con menos efectos colaterales (25). Se ha usado principalmente para casos de ángulos estrechos antes de realizar iridotomías periféricas con láser (32). Este medicamento no atraviesa bien las membranas: menos del 0,09 % de la dosis materna alcanza la placenta en ratones (43). A pesar de que no hay estudios bien controlados en humanos, los beneficios potenciales pueden superar los riesgos para su uso durante el embarazo (25).
Medicamentos antiglaucomatosos en la lactancia
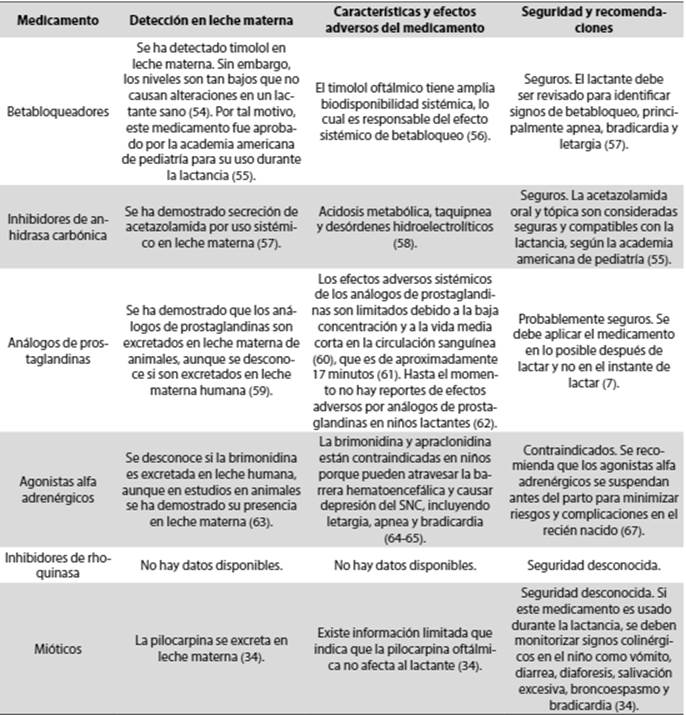
Los medicamentos para el tratamiento del glaucoma administrados a la madre pueden secretarse en la leche materna y causar efectos adversos en el niño lactante, debido a que tiene una capacidad de metabolismo reducida si se compara con la de un adulto (44). Además, la dosificación ocular materna no está ajustada al peso del bebé, lo cual hace que los pacientes pediátricos sean particularmente vulnerables por tener una barrera hematoencefálica inmadura (45).
Aproximadamente el 80 % de las gotas instiladas en el ojo se difunden tras pasar a través de la córnea, la esclera, el humor acuoso y el tracto uveal hacia la circulación sistémica (46). De este porcentaje, la absorción a partir de la mucosa nasal evita el denominado efecto de primer paso por el hígado, razón por la cual los medicamentos tópicos pueden causar efectos adversos sistémicos importantes, en especial cuando se administran de manera crónica (47). Si el citocromo hepático P450 no alcanza a degradar el fármaco a metabolitos inactivos, algo del medicamento activo podrá ser secretado en la leche materna e ingerido por el recién nacido. Esto podría ocasionar efectos indeseables en el lactante, ya que los órganos involucrados en la absorción, distribución y eliminación renal y hepática no han terminado de madurar (48).
Cuando se prescribe un tratamiento a una mujer que se encuentra lactando, es importante administrar la mínima dosis posible que permita controlar la PIO. También se puede optar por la oclusión de los puntos lagrimales de forma transitoria para reducir la absorción sistémica (49). Los niveles de medicamento alcanzan un pico en la secreción de la leche materna entre 30 y 120 minutos después de la instilación (7), por lo que se recomienda administrarlo justo después de lactar, siempre que sea posible (50).
En la Tabla 4 se resume la detección en leche materna, características, efectos adversos, seguridad y recomendaciones acerca de los medicamentos para glaucoma en la lactancia (7,25,51-64).
Manejo del glaucoma con láser en el embarazo
Una modalidad de control de la PIO como manejo del glaucoma es el tratamiento de la malla trabecular con láser. Existen dos modalidades: el tratamiento con láser de argón, el cual tiene un efecto inespecífico en el tejido ocular, y la trabeculoplastia selectiva con láser (SLT), que actúa específicamente en el tejido pigmentario del trabéculo disminuyendo la PIO sin presentar efectos sistémicos (64). Existen múltiples reportes de trabeculoplastia láser en embarazadas y sin complicaciones (65). En un estudio realizado en mujeres gestantes y en lactancia se reportó que 40 ojos de pacientes con glaucoma primario de ángulo abierto (GPAA) y 10 ojos de pacientes con hipertensión ocular que fueron tratadas con SLT presentaron disminución significativa de las PIO y del número de medicamentos usados hasta 6 meses después del procedimiento (66).
Manejo quirúrgico del glaucoma en el embarazo
En algunas pacientes embarazadas no se logra controlar la PIO adecuadamente con el manejo médico o con láser, por lo que, una vez considerada la opción quirúrgica, hay que tener presente que existe un alto riesgo de falla debido a la edad, a que no se pueden usar antimetabolitos y a que los factores de cicatrización están aumentados gracias a los procesos hormonales (7).
Los procedimientos quirúrgicos disponibles son aquellos que involucran ampollas conjuntivales o trabeculectomía (Figura 1) y aquellos con tubos valvulados o no (Figura 2).
La trabeculectomía es la cirugía estándar de glaucoma. Consiste en crear una filtración del humor acuoso al espacio subconjuntival removiendo tejido de la malla trabecular. Esta cirugía filtrante requiere, en la mayoría de los casos, el uso de antimetabolitos como la mitomicina C y el 5-flurouracilo, los cuales no pueden ser usados en pacientes embarazadas por sus propiedades teratogénicas. Aunque la teratogenicidad de la mitomicina C y el 5-flurouracilo tópicos no ha sido estudiada en humanos, los efectos teratogénicos en animales sí se han documentado (8).
En las cirugías con tubos, valvulados o no, se utilizan unos dispositivos que consisten en tubos que van a un reservorio subconjuntival, los cuales pueden ser valvulados como el dispositivo de Ahmed, o de flujo libre como el implante de Baerveldt, ilustrado en la Figura 2. Una de las ventajas de estas cirugías en las pacientes embarazadas es que no necesitan el manejo conjunto de antimetabolitos, los cuales, como se mencionó previamente, están contraindicados en el embarazo (7). Este segundo tipo de cirugía sería el más recomendado en el embarazo (67). También son una opción las cirugías basadas en el ángulo y la cicloablación (64). En esta última se realiza una ablación del cuerpo ciliar para reducir la producción del humor acuoso con una sonda transescleral (68).
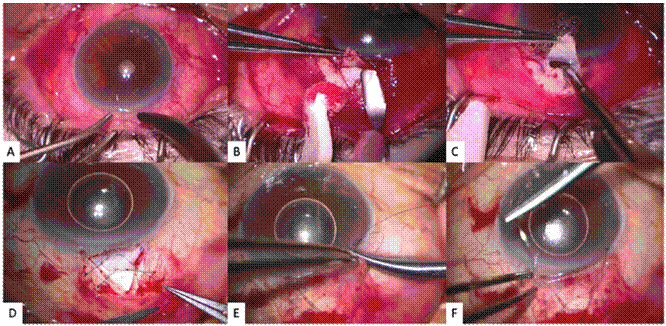
Figura 1: Trabeculectomía. A. Peritomía conjuntival B. Diseño del colgajo escleral C. Penetración a cámara anterior y remoción del bloque esclerocorneal D. Sutura del colgajo escleral asegurando que haya una filtración adecuada E y F. Sutura conjuntival, asegurando cierre hermético de la herida. Fuente: fotografías propias de los autores
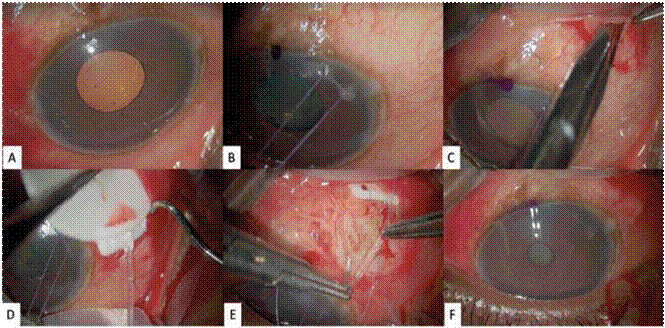
Figura 2 Cirugía de dispositivos de drenaje en glaucoma. A. Exposición del campo operatorio con espéculo palpebral B. Punto de tracción corneal y exposición del área de inserción del cuerpo del dispositivo C. Peritomía conjuntival superior D. Inserción del implante en el cuadrante superotemporal E. Inserción del tubo de la válvula en la cámara anterior y fijación F. Punta del tubo en posición adecuada dentro de la cámara anterior, entre el iris y la córnea superotemporal. Fuente: fotografías propias de los autores
Consideraciones anestésicas
La mayoría de los anestésicos locales han mostrado no ser teratogénicos en humanos (etidocaína, prilocaína y lidocaína, clasificadas como categoría B). Estudios en animales muestran que la bupivacaína y mepivacaína causan bradicardia fetal, por lo cual son categoría C (8). Debido a que no hay estudios adecuados bien controlados en mujeres embarazadas, la bupivacaína solo debe usarse en el embarazo si el beneficio potencial justifica el riesgo para el feto (69).
La anestesia local y subtenoniana para cirugía de glaucoma se tolera mejor y permite menor absorción sistémica del medicamento que la anestesia retrobulbar o general. Un estudio reportó el uso de anestesia peribulbar con bajo volumen más lidocaína subconjuntival sin producir daños al feto en el segundo y tercer trimestres del embarazo (70). No existen contraindicaciones para el uso de gotas tópicas anestésicas en el embarazo o en la lactancia. El anestésico recomendado es la lidocaína (8).
Además de la anestesia, también se debe tener en cuenta el posicionamiento de las pacientes embarazadas durante los procedimientos quirúrgicos largos. Después de la semana 20 de gestación (o antes en caso de polihidramnios o gestación múltiple), la mujer debe adoptar una posición en decúbito lateral izquierdo para evitar que el útero grávido cause compresión aorto-cava durante el procedimiento (71).
Discusión
Aunque la presencia de glaucoma durante el embarazo no es frecuente, cada vez se reportan más casos de esta enfermedad en la mujer gestante. La disminución fisiológica de la PIO en este período no es un factor protector suficiente para la progresión de la enfermedad ocular. Dependiendo del compromiso del nervio óptico y de los valores de la PIO, y a través de una comunicación clara con la paciente, en muchos casos el tratamiento se decide de forma consensuada (72).
Las opciones de manejo comprenden la terapia farmacológica (gotas), el tratamiento con láser y la cirugía. Esta aproximación terapéutica general es similar al abordaje en pacientes no embarazadas. Sin embargo, todos los medicamentos tópicos para el glaucoma, excepto la brimonidina, son categoría C durante el embarazo. Es prudente considerar también las otras alternativas de tratamiento como la trabeculoplastia selectiva con láser, y en casos de PIO muy elevada y riesgo de daño visual se puede requerir la cirugía. Debido a los efectos adversos de los antimetabolitos en el feto, la trabeculectomía puede no ser la mejor opción quirúrgica, por lo que se prefieren los dispositivos de drenaje como la válvula de Ahmed o el implante de Baerveldt (67). Los nuevos procedimientos quirúrgicos para glaucoma, denominados genéricamente MIGS (microinvasive glaucoma surgery, por sus siglas en inglés), pueden llegar a tener un papel importante en los casos de mujeres embarazadas (73).
La determinación de las dosis seguras de los medicamentos de glaucoma en embarazadas tiene las dificultades inherentes a la investigación en pacientes gestantes, y también está relacionada con que en la mayoría de los estudios en animales se usan concentraciones muy altas de estos fármacos, por lo que no es fácil extrapolar los hallazgos a la experiencia clínica en humanos (65). Debido a que el embarazo es un evento limitado en el tiempo, y a que el glaucoma es una enfermedad crónica que generalmente no presenta cambios agudos, permitir un aumento de la PIO en una paciente embarazada puede ser posible en algunos casos, inclusive considerando la suspensión de la terapia. Es importante una correcta interpretación de la literatura publicada sobre el tema y entender sus numerosas limitaciones (7).
Los médicos y pediatras que atienden el parto deben estar al tanto del uso de medicamentos antiglaucomatosos maternos con el fin de prevenir complicaciones neonatales y realizar un
seguimiento apropiado de los signos vitales del recién nacido, en especial si la madre usó betabloqueadores o brimonidina cerca al momento del parto, debido al riesgo de depresión cardiorrespiratoria y del SNC (74). Además, se debe tener precaución con el uso de inhibidores de anhidrasa carbónica cerca al parto, pues pueden ocasionar acidosis tubular renal (75) y problemas metabólicos en el neonato (76).
Un abordaje del manejo médico sugerido para el glaucoma en el embarazo incluye en la primera línea la brimonidina (categoría B), en la segunda línea un betabloqueador como el timolol (categoría C), y en tercera línea los IAC (categoría C), tras lo cual quedan los análogos de prostaglandinas como alternativa. Del mismo modo, en la mujer lactante la primera línea serían los IAC, y las alternativas el timolol, los análogos de prostaglandinas y la combinación de timolol y dorzolamida. El uso de brimonidina en la lactancia está contraindicado (67).
Conclusiones
Aunque la PIO tiende a disminuir durante el embarazo, el tratamiento médico o quirúrgico para glaucoma puede requerirse; la decisión de tratar o no a la paciente embarazada dependerá de muchos factores, entre ellos el nivel de compromiso del nervio óptico, el valor de la PIO y las semanas de gestación. Esta decisión debe ser discutida y consensuada con la paciente. El enfoque de manejo debe contemplar a los diferentes especialistas, no solo al oftalmólogo y el ginecobstetra, sino también a los pediatras, médicos familiares y otros clínicos relacionados con la paciente.