Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
ORINOQUIA
On-line version ISSN 0121-3709
Orinoquia vol.16 no.2 Meta July/Dec. 2012
Valores de referencia para hematocrito, hemoglobina, glucosa y electrolitos de la lora común Amazona ochrocephala (Gmelin, 1788) cautivos en Ibagué
Referential haematocrite, haemoglobin, glucose and electrolyte values for Yellow-crowned Amazon (Amazona ochrocephala (Gmelin, 1788)) kept in captivity in Ibagué
Valores de referência para hematócrito, hemoglobina, glicose e eletrólitos do papagaio comum Amazona ochrocephala (Gmelin, 1788) cativos em Ibagué
Fabián E Castañeda1; Edwin F Buriticá-Gaviria2; Lady J Cruz1
1 Médico Veterinario Zootecnista.
2 Grupo de Investigación en medicina y cirugía en pequeños animales, Facultad de Medicina Veterinaria y Zootecnia, Universidad del Tolima. Email: buriticaes@gmail.com
Recibido: febrero 28 de 2012. Aceptado: agosto 11 de 2012.
Resumen
Amazona ochrocephala conocida comúnmente como Lora común, se encuentra distribuida desde Panamá hasta el norte de Bolivia y occidente de Brasil. En Colombia es la lora de mayor distribución y una de las más traficadas ilegalmente. Los aspectos básicos de la patología clínica, hematología y bioquímica sanguínea, han sido utilizados comúnmente en el diagnóstico de aves enfermas; sin embargo, con el fin de conocer los parámetros normales, es necesario estudiar los parámetros isiológicos, teniendo en cuenta las variables pertinentes a cada región y sus respectivas condiciones. El objetivo de este estudio fue obtener valores de Sodio (Na), Potasio (K), Cloruro (Cl), Glucosa, Calcio iónico (iCa), Hematocrito (Hto), Hemoglobina (Hb), Dióxido de carbono total (TCO2) y Brecha Aniónica de 37 individuos de la especie Amazona ochrocephala ubicadas en cautiverio en el Centro de Atención y Valoración de fauna silvestre CAV de CORTOLIMA. Los datos obtenidos fueron tabulados y analizados mediante estadística descriptiva. Los resultados para los distintos parámetros fueron en su mayoría similares a los reportados para otras aves Psittaciformes, encontrando diferencias superiores e inferiores respecto a otros estudios para el Hto y la Hb y diferencias superiores para el iCa. Dichas diferencias pueden deberse a las distintas condiciones ambientales y de manejo respecto a cada estudio. También se realizaron mediciones de creatinina y nitrógeno uréico sanguíneo, las cuales no se tomaron en cuenta estadísticamente ya que la mayoría de los resultados obtenidos se encontraron por debajo del límite de lectura mínimo ofrecido por el método empleado. Como conclusión se plantea que los valores obtenidos para el Hto, Hb, glucosa, TCO2, Brecha Anionica y Electrolitos provienen de una muestra de individuos clínicamente sanos pudiendo servir estos valores de referencia para instituciones que manejen la especie.
Palabras clave: Amazona ochrocephala, electrolitos, hematología, Psittaciformes.
Abstract
The Yellow-crowned Amazon or Yellow-crowned Parrot (Amazona ochrocephala) is found from Panama to northern Bolivia and western Brazil; it is the most widely distributed parrot in Colombia and one of the most illegally trafficked ones. Basic aspects regarding clinical pathology, haematology and blood biochemistry have usually been used in diagnosing sick birds; however, physiologic parameters should be studied to ascertain normal parameters, bearingeach region'spertinent variables and their respective conditions in mind. This study was aimed at obtaining sodium (Na), potassium (K), chloride (Cl), glucose, ionic calcium (iCa), ha ematocrite (Hto), haemoglobin (Hb),total carbon dioxide (TCO2) and anion gap values for 37 individuals from the species Amazona ochrocephala keptin captivity in CORTOLIMA's wild fauna attention and evaluation centre (Centro de Atención y Valoración de fauna silvestre - CAV). Descriptive statistics were used for tabulating and analysing the data. Most results were similar to those reported for other Psittaciformes, greater and lesser differences being found regarding other Hto and Hb studies and greater differences for iCa. Such difference may have been due to each study's differing environmental and handling conditions. Blood urea nitrogen and creatinine were measured. ; however, they were not statistically significant as most results were below the method's minimum reading limit.
It may thus be concluded that the values obtained from a sample of clinically healthy individuals for Hto, Hb, glucose, TCO2, anion gap and electrolytes could be used as reference values for institutions managing the aforementioned species.
Key words: Amazona ocrocephala, electrolyte, haematology, Psittaciformes (parrots).
Resumo
A Amazona ochrocephala conhecida como papagaio comum, encontra-se desde Panamá até o norte da Bolívia e oeste do Brasil. Na Colômbia é o papagaio de maior distribuição e trafico ilegal. Os aspectos básicos, de patologia clínica, hematologia e bioquímica sanguínea, têm sido utilizados comumente no diagnostico de aves doentes. Porém, com o intuito de conhecer os parâmetros normais, é necessário estudar os valores fisiológicos, considerando as variáveis pertinentes a cada região e as suas respectivas condiçöes. O objetivo deste estudo foi obter os valores de sódio (Na), potássio (K), cloreto (Cl), glicose, cálcio iônico (iCa), hematócrito Hto), hemoglobina (Hb), dióxido de carbono total (TCO2) e intervalo aniônico de 37 indivíduos da espécie Amazon Ochrocephala, mantidas em cativeiro no Centro de Atenção e Valoração de Fauna Silvestre, CAV de Cortolima. Os dados obtidos foram tabulados e analisados com estatística descritiva. Os resultados dos parâmetros avaliados foram similares aos reportados para outras aves Psittaciformes, encontrando diferencias para Hto, Hb e iCA, devido as condiçöes ambientais e de manejo de cada estudo. Foram medidas a creatinina e o nitrogênio úrico sanguíneo. Em conclusão, os valores de Hto, Hb, glicose, TCO2, intervalo iônico e eletrólitos procedentes de uma amostra de indivíduos clinicamente sadios podem ser considerados como valores de referencia para a espécie.
Palavras chave: Amazona ochrocephala, eletrólitos, hematología, Psittaciformes.
Introducción
Colombia es el primer país del mundo en diversidad de aves albergando en su territorio aproximadamente l 19% de las especies mundiales (Rengifo et al, 2002) on 1801 especies reportadas (Humboldt, 2009), en donde el orden Psittaciformes es uno de los más representativos y vistosos, con unos 54 taxones reportados, siendo Colombia el segundo país en número de estas aves en el continente americano superado solamente por Brasil. No obstante, al considerar la concentración de especies por unidad de área, Colombia ocuparía el primer lugar del mundo, dado que su territorio es cerca de 7 veces menor que el brasileño al igual que del australiano, países que ostentan el mayor número de especies del orden (Rodríguez y Hernández, 2002)
Este es uno de los órdenes taxonómicos de aves más apetecidos en el comercio legal e ilegal, razón por la cual ha crecido notoriamente el tráfico de los mismos, así como el incremento del número de personas que tiene en sus casas este tipo de aves. Entre las aves más comercializadas como mascotas no convencionales se encuentran las guacamayas (Ara spp.), cacatúas (Cacatua spp.), pericos australianos, (Melopsittacus undulatus), loros (Amazona spp.), ninfas (Nymphicus hollandicus) y el loro gris africano (Psittacus eritacus) (Figura 1) (Alvarado, et al., 2008). El aumento en el comercio legal e ilegal de estas especies, ha incrementado la frecuencia de estos animales en la clínica veterinaria, así como en centros de rescate y de atención y valoración de fauna silvestre, a menudo por problemas relacionados con el desconocimiento de su ambiente, sus hábitos etológicos y alimenticios, lo cual ha despertado a su vez un gran interés por conocer su biología, etología y parámetros fisiológicos que ayuden a ofrecer una mejor atención a estos animales tanto en vida silvestre como en cautiverio.

La especie A. ochrocephala conocida comúnmente como Lora Común, es un ave que se encuentra dis-tribuida desde Panamá hasta el norte de Bolivia y occidente de Brasil (Rodríguez et al., 2005) (Figura 2). Existen 10 subespecies reconocidas, de las cuales hay tres en Colombia, A. o.ocrocephala, A. o.nattereriy A. o.panamensis (Rodríguez y Hernández 2002). Esta lora habita en selva húmeda, semi-húmeda, manglares, morichales y bosques semi-secos, hasta los 500 m, en donde consume diversos frutos y anida en troncos de palmas y termiteros durante la temporada seca. Mide entre 35 a 41 cm y su peso oscila entre 272 a 440 g. Se distingue por la coronilla, rostro y frente amarilla, siendo su coloración general verde, con un parche rojo en el borde del hombro y mitad del ala. La cola es verde y posee una mancha roja en su base (Figura 3). Está considerada como preocupación menor (LC) por la Unión Internacional para la Conservación de la Naturaleza (UICN 2012). En el ámbito nacional, no se encuentra reportada bajo ningún riesgo de amenaza en el libro rojo de aves de Colombia (Rengifo et al., 2002). En Colombia es la lora de mayor distribución y la más apreciada como ave de jaula, por lo que es uno de los animales más comunes en el tráfico ilegal de fauna silvestre (Rodríguez y Hernández 2002). Se encuentra incluida en el apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES) (Aguilar, 2001; Rodríguez y Hernández 2002; Rodríguez et al., 2005). A nivel mundial es el ave de mayor importancia como ave de compañía, junto con el loro gris africano (P. erytacus), por lo que existe una gran demanda internacional de esta especie, lo que causa que se extraigan miles de pichones anualmente de su hábitat natural para llevarlos al exterior mediante el mercado negro. Distintos zoocriaderos de esta especie han sido instalados en países de Europa así como en Estados Unidos y Brasil (Aguilar, 2001).

Solo recientemente, los aspectos básicos de la patología clínica, hematología y bioquímica sanguínea, han sido utilizados en el diagnóstico de aves enfermas (Paula, et al., 2008). Sin embargo con el fin de establecer los parámetros normales, es necesario conocer los parámetros fisiológicos básicos (Paula, et al., 2008). Como el conocimiento de estos valores en aves es escaso, debido al gran número de especies y la poca investigación científica en esta área, es posible el uso de datos fisiológicos obtenidos de investigaciones realizadas en otros países; pero para que estos datos sean correctamente utilizados, se hace necesario el conocimiento de la constantes fisiológicas para las diferentes especies en las respectivas regiones y condiciones (Cordeiro, 2004; Valle, et al., 2008) de Colombia. El diagnóstico de laboratorio de las enfermedades que sufren las aves en cautiverio, se ve perjudicado principalmente por la dificultad en la toma de las muestras, la técnica de laboratorio para volúmenes pequeños y la falta de valores de referencia regionales para la comparación (Godoy, 2001; Valle, et al., 2008; Paula, et al., 2008). Actualmente, se ha observado en los países de América Latina una elevada casuística clínica de aves silvestres, las cuales necesitan de análisis clínicos (Valle, et al., 2008).
Igualmente, el conocimiento de las alteraciones hematológicas y de bioquímica sanguínea en aves en cautiverio, puede servir como modelo para el estudio de la respuesta que tienen los animales de la misma especie en su hábitat natural frente a un determinado desafío epidemiológico, así como facilitar un diagnostico de enfermedad. La mayoría de las veces, las enfermedades de los animales silvestres en cautiverio son comparables con aquellas observadas en vida silvestre y por lo tanto, determinados programas de conservación ambiental también pueden ser beneficiados con estos datos (Munson y Cook, 1993; Valle, et al., 2008).
El objetivo del presente estudio fue establecer los valores de referencia del Hematocrito (Hto), Hemoglobina (Hb), Sodio (Na), Potasio (K), Cloruro (Cl), Glucosa, Calcio iónico (iCa), Dioxido de carbono total (TCO2) y Brecha aniónica, de una población clínicamente sana de 37 individuos cautivos pertenecientes a la especie A.ochrocephala.
Materiales y métodos
Se muestrearon 37 individuos de A. ochrocephala de una población clínicamente sana, que se encontraba ubicada en el Centro de Atención y Valoración de Fauna Silvestre CAV de la Corporación Autónoma Regional del Tolima (CORTOLIMA), ubicado en el predio el secreto en la vereda Llanitos zona rural del municipio de Ibagué a una altura sobre el nivel del mar de 1760 m con una temperatura promedio de 23 °C.
Las aves objeto de estudio, llevaban aproximadamente de 2 meses en el CAV y habían pasado satisfactoriamente los periodos obligatorios de aislamiento y cuarentena así como los exámenes clínicos que se realizan rutinariamente durante este periodo y procedían de decomisos y entregas voluntarias realizadas en la ciudad de Ibagué, siendo todos animales adultos. No se pudo determinar las subespecies a las que pertenecían los animales puesto que para ello a parte de revisar su morfología se hace necesario conocer también su distribución geográfica lo que se hizo imposible debido a la falta de información suministrada al momento de realizar un decomiso o la entrega voluntaria.
Las aves eran mantenidas en jaulas de vuelo en grupos de tres a cinco animales en algunos casos compartiendo encierro con individuos de la especie A. amazonica. Su dieta era suministraba ad libitum dos veces al día (mañana y tarde) y constaba de semillas de girasol (Helianthus annuus), maíz seco y maíz tierno (Zea mays), maní (Arachis hypogaea), zanahoria (Daucus carota), habichuela (Phaseolus vulgaris), banano (Musa paradisiaca), mango (Mangifera indica), naranja (Citrus sinensis), papaya (Carica papaya), melón (Cucumis melo) y guayaba (Psidium spp.). Las aves fueron manipuladas en dos días diferentes entre las 8:00 y las 11:00 de la mañana, siendo capturadas mediante estricción física, utilizando mallas, guantes de carnaza y toallas para restringirlas. Una vez capturada el ave, se procedió a su identificación por medio de la lectura del chip subdérmico implantado en cada una de ellas, luego se pesaron, se tomaron constantes fisiológicas (FR, FC y temperatura) y se realizo un examen clínico por sistemas en busca de posibles alteraciones con el fin de confirmar que se trataban de aves clínicamente sanas. La muestra sanguínea, se obtuvo de la vena ulnar cutánea con jeringa de 2 ml con embolo de cau-cho y agujas de calibre 23 por 1 pulgada. Las muestras de sangre entera, fueron analizadas de inmediato para Hematocrito (Hto), Hemoglobina (Hb), Calcio iónico (iCa), Sodio (Na), Potasio (K), Cloruro (Cl), Glucosa, Dióxido de carbono Total (TCO2) y Brecha aniónica, con el analizador portátil i STAT Analizer (I-STAT, Abbott, Illinois-USA) con cartuchos i-STAT CHEM8+ (Abbott, Illinois, USA). Estos cartuchos también realizan mediciones de Creatinina y Nitrógeno Ureico Sanguíneo (NUS). No se utilizo ningún tipo de anticoagulante en este estudio.
Los datos fueron tabulados y analizados mediante estadística descriptiva, utilizando el paquete estadístico de análisis de datos del programa Excel 2007 (Microsoft Corp.).
Resultados y discusión
La evaluación del hemograma y bioquímica sanguínea, ha sido una herramienta comúnmente utilizada en el diagnóstico de las enfermedades aviares, siendo los métodos manuales de laboratorio usados rutinariamente en humanos y mamíferos, los más utilizados para los estudios hematológicos en aves (Paula, et al., 2008). Los resultados obtenidos para el análisis del Hto, Hb, iCa, Na, K, Cl, Glucosa, TCO2 y Brecha aniónica en este estudio se encuentran reportados en la tabla 1.

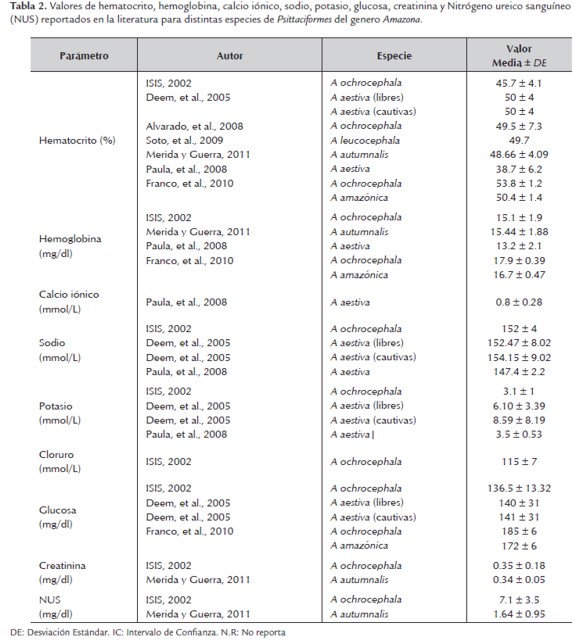
Comparando los resultados obtenidos con los reportados para la media del hematocrito (48.22 ± 5.45 %) y la hemoglobina (16.25 ± 1.87 mg /dl) se evidenció que fueron similares a los encontrados en la literatura consultada para otras aves Psittaciformes (ISIS, 2002; Deem, et al., 2005; Alvarado, et al., 2008; Schmidt, et al., 2009; Soto, et al., 2009; Merida y Guerra 2011). Es de resaltar las diferencias obtenidas para el hematocrito y hemoglobina con el reporte realizado en la ciudad de São Paulo por Paula et al., (2008) para Amazona aestiva, obteniéndose en el presente estudio valores para la media superiores a los reportados por ellos (Hto 38.7 ± 6.2 %; Hb 13.2 ± 2.1 mg/dl), quienes igualmente utilizaron la misma metodología (i STAT Analizer con cartuchos i-STAT EG7+) con la diferencia de que ellos enfocaron su estudio hacia el análisis de gasometría sanguínea, teniendo en común con esta investigación la medición del Hto, Hb, Na, K y iCa. Dicha diferencia puede ser debida por las posibles distintas condiciones de manejo y ambientales tales como el estrés causado en la manipulación, cautiverio o altura sobre el nivel del mar (presente estudio 1760 msnm; Paula et al., 2008 823 msnm). La excitación y el temor del ave en el momento de la extracción sanguínea pueden derivar en un aumento fisiológico en el recuento de glóbulos rojos, hematocrito, la hemoglobina e índices eritrocitarios y recuentos de leucocitos, por la liberación excesiva de corticoides endógenos (Hernandéz, 1991; Franco, et al., 2010). Igualmente, es bien conocido que un aumento significativo en la altitud sobre el nivel del mar, elevará los parámetros eritrocitarios como respuesta fisiológica a la disminución de la presión de oxigeno siendo la relación directamente proporcional, por lo que a mayor altitud mayores serán dichos valores (Bush, 1999). En comparación a lo reportado por Franco et al. (2010), se encontraron valores para la media inferiores a los reportados por ellos para el Hto de Amazona amazónica (50.4 ± 1.4) y A. ochrocephala (53.8 ± 1.2) en cautiverio y valores similares para la Hb con A. amazónica (16.7 ± 0.47) e inferiores para A. ochrocephala (17.9 ± 0.39). Dicha diferencia superior en estos valores en relación a otros reportes es atribuida por Franco et al. (2009) a distintos factores, como el lugar de procedencia, condiciones de confinamiento y factores ambientales.
Los valores para la media del iCa (1.35 ± 0.10 mmol\L) fueron superiores a los reportados por Paula, et al. (2008) (0.8±0.28 mmol\L), siendo este el único reporte encontrado para aves respecto de dicho parámetro, siendo más comunes los reportes sobre el calcio total. El calcio es el elemento químico más abundante en el cuerpo y su fracción ionizada consta del 50% aproximadamente del calcio total circulante siendo esta la parte fisiológicamente activa y un importante componente regulador de la homeostasis. Dicha fracción es esencial para el funcionamiento normal de la contracción cardiaca, funcionamiento del tejido muscular, mitosis, movimientos ciliares, coagulación sanguínea, liberación de neurotransmisores; y la secreción y acción hormonal (Guyton y Hall 1996 citados por Paula, et al., 2008). Bajos niveles de calcio pueden deberse a un hiperparatiroidismo nutricional avanzado, paratiroiditis, falla renal y el síndrome de hipocalcemia idiopática del loro gris africano P. eritacus (Paula, et al., 2008). Los valores más bajos obtenidos por Paula et al., (2008), pueden ser explicados debido a la utilización de jeringas con heparina en el citado estudio, la cual actúa ligando el calcio para evitar la coagulación (Guzman, et al., 2008). Cada unidad de heparina añadida a cada mL de sangre, puede reducir el calcio ionizado en 0.01 mmol\L, por lo que el uso de heparina en una pequeña cantidad de sangre puede reducir ignificativamente los niveles de iCa en las muestras analizadas (Paula, et al., 2008).
Los niveles de Na (147.95 ± 4.2 mmol\L) y K (4.05 ± 0.77 mmol\L) hallados en este estudio, fueron similares a los reportados por Paula, et al., A. aestiva (2008) e inferiores a los reportados por Deem, et al., (2005), para individuos libres y cautivos de A. aestiva en Bolivia (Na = libres 152.47 ± 8.02 mmol\L, cautivos 154.15 ± 9.02 mmol\L; K= libres 6.10 ± 3.39 mmol\L, cautivos 8.59 ± 8.19 mmol\L). Los niveles plasmáticos de Na en aves son mantenidos dentro de los límites normales, a pesar de las amplias variaciones de este en las dietas, en especial, a las ofrecidas a aves Psitaciformes (Hochleithner, 1994). La hiponatremia puede darse en aves debido al incremento de la perdida de Na por enfermedad renal o diarrea severa. También puede ser causada por sobre-hidratación como se observa en la polidipsia psicogénica o después de la administración intravenosa de fluidos libres de Na (Hochleithner, 1994). Una insuficiencia adrenocortical puede también ser causa de hiponatremia en aves (Grifols y Molina, 1995). La hipernatremia puede ocurrir debido al incremento en el Na dietario (alimentación con cacahuates y galletas), una excesiva perdida de agua o a una disminución de su ingesta (Hochleithner, 1994). Por su parte, para el K, cantidades aumentadas pueden verse en daño tisular severo, reducción en la excreción de K por enfermedad renal, en enfermedad adrenal (Hochleithner, 1994; Grifols y Molina, 1995) o por redistribución del K desde el líquido intracelular al fluido extracelular en periodos de acidosis. La deshidratación y la anemia hemolítica también pueden ser causa de hiperkalemia (Hochleithner, 1994). La hipokalemia puede ser causada por una disminución en el K dietario, incremento en su perdida por diarrea severa o terapia con diuréticos y el traslado del K del fluido extracelular al fluido intracelular en alcalosis (Hochleithner, 1994). Las diferencias obtenidas con el reporte realizado por Deem, et al., (2005), pueden deberse a que en dicho estudio se obtuvieran valores de K elevados bien sea por factores dietarios, como por elevaciones causada con algún tipo de daño tisular, pues igualmente encontraron niveles elevados de fosfatasa alcalina (FAS) y aspartato-aminotransferasa (AST), las cuales atribuyeron a algún tipo de trauma ocasionado por la técnica de captura utilizada para las aves que se encontraban en libertad. En relación a lo reportado por el ISIS (2002) se encontraron valores inferiores para la media en el Na (154 ± 4 mmol/L) y superiores para el K (3.1 ± 1 mmol/L).
Los valores para la media obtenidos de glucosa (293.76 ± 52.09 mg/dl) fueron similares a los reportados por Grifols y Molina (1995) para el género Amazona sin mencionar este la especie. En comparación a lo reportado en el ISIS (2002) para la misma especie (136.5 ± 13.32 mg/dl), los valores fueron ampliamente superiores. La misma diferencia fue encontrada al comparar los valores con lo encontrado por Deem, et al., (2005) para A. aestiva (Individuos libres= 140 ± 31 mg/dl; Individuos cautivos= 141 ± 31 mg/dl) y a los reportados por Franco et al., (2010) para A. amazónica (172 ± 6 mg/dl) y A. ochrocephala (185 ± 6 mg/dl). En general los valores de glucosa en aves sanas pueden encontrarse por encima 200 hasta los 500 mg/dl y estos varían en función de la hora de extracción, edad o ayuno. Se ha descrito hipoglucemia en inanición, malnutrición, endocrinopatías, septicemia y enfermedad hepática. La hiperglucemia está asociada al período de cría, estrés, diabetes mellitus e hipertermia (Grifols y Molina, 1995). Los valores relativamente altos en este estudio, pueden deberse al efecto excitatorio de la manipulación física la cual aumenta el estrés en el animal lo que causa una movilización de las reservas de glucógeno hepático desencadenando una hiperglucemia transitoria (Willard y Tvedten, 2004), que en este caso se puede considerar normal. Igualmente es de considerar que los animales no fueron sometidos a ayuno previo al muestreo, lo que puede haber influido en los resultados obtenidos para la glucosa en sangre tal y como lo sugiere Grifols y Molina (1995).
Comparado con lo reportado por el ISIS (2002), los valores hallados para el Cl fueron similares. El cloruro en aves, al igual que en mamíferos, es el metabolito activo del cloro y así como este se encuentra estrechamente asociado al Na dietario, siendo los dos excretados bajo las mismas condiciones (Brue, 1994). El Cl, es un elemento importante en el equilibrio acidobásico en el organismo (Brue, 1994; Guyton y Hall, 1996), aunque su papel en el mantenimiento de dicho equilibrio en aves no ha sido lo suficientemente evaluado (Hochleithner, 1994). Es el anión extracelular de mayor concentración y junto con el Na representan los mayores constituyentes de la actividad osmótica del plasma. Elevaciones en las concentraciones de Cl son raramente detectadas. La hipercloremia puede ocurrir en estados de deshidratación (Hochleithner, 1994) mientras que la hipocloremia puede presentarse debido a vómitos crónicos de contenido gástrico y el tratamiento intensivo con furosemida (Willard y Tvedten, 2004).
En mamíferos, el TCO2 ayuda a determinar la necesidad de indicar análisis de gases en sangre. Dichas determinaciones, se aconsejan en pacientes con intoxicación con etilenglicol o salicilatos, cetoacidosis diabética, uremia graves y en general cualquier proceso patológico sistémico grave (Willard y Tvedten, 2004). Sus valores referenciales en aves son difíciles de hallar, pues son escasas las publicaciones al respecto encontradas para aves silvestres, pudiendo considerarse en este estudio que los valores hallados (19.68 ± 2.52 mmol/L) son normales o podrían encontrase levemente disminuidos debido a la hiperventilación aguda con hipocapnia, causando una pequeña reducción en el TCO2 y HCO3 séricos debido a captación celular (Paula, et al., 2008). Por su parte, la brecha aniónica, es la diferencia entre los aniones no medidos y los cationes no medidos, y puede afectarse por cambios en la concentración de cualquiera de los componentes (Di Bartola, 2006). Los valores encontrados en este estudio para la brecha aniónica (17.32 ± 1.83 mmol/L) pueden ser considerados como normales para las especie, pues la magnitud del cambio en la concentración de cualquiera de los cationes no medidos (por ejemplo calcio o magnesio) necesaria para causar un cambio apreciable en la brecha aniónica probablemente sería incompatible con la vida (Gabow, 1985 citado por Di Bartola). Como resultado, la mayor parte de los análisis sobre la brecha aniónica se centran en cambios en los aniones no medidos, siendo más comunes los incrementos en sus valores que su disminución y su concepto suele emplearse como un auxiliar para diferenciar las causas de acidosis metabólicas (DiBartola, 2006).
También fueron realizadas mediciones de creatinina y NUS, pero dichas mediciones no fueron tenidas en cuenta estadísticamente debido a que la mayoría de los resultados obtenidos para estos parámetros se encontraron por debajo del límite de lectura mínimo ofrecido por el método empleado (creatinina <0.2 mg/ dl; NUS <3 mg/dl). Esto se debe a que las aves generan principalmente como desecho del metabolismo proteico el acido úrico (Armand 1986; Hochleithner, 1994; Grifols y Molina, 1995; ISIS, 2002). Para la creatinina, solo cuatro animales marcaron valores superiores al rango mínimo, encontrándose entre 0.2 mg/dl (n= 1), 0.3 mg/dl (n= 2) y 0.4 mg/dl (n= 1), mientras para el NUS solo un individuo marco un valor de 3 mg/dl, encontrándose todos estos valores dentro de los valores normales reportados para las especies del género Amazona por otros autores (Grifols y Molina, 1995; ISIS, 2002; Merida y Guerra, 2011). La creatinina sérica, proviene del catabolismo de la creatina, la cual se encuentra en el tejido muscular. La creatina es usada para generar energía en el musculo y su metabolismo es constante (Hochleithner, 1994; Guyton y Hall, 1996). La excreción de la creatinina se hace por vía renal en los mamíferos y dicha vía es evaluada a menudo, por la medición de la creatinina y su correlación con el NUS (Armand 1986; Wilard y Tvedten, 2004). En aves, la mayor cantidad de la creatina es excretada en la orina antes de que sea convertida a creatinina, por lo que esta prueba de función renal es muy poco sensible (Armand 1986; Hochleithner, 1994; Grifols y Molina, 1995). El NUS, hace parte de la úrea en sangre representando casi la mitad del peso de esta. La úrea en la sangre de las aves, es producida por los mismos mecanismos que se conocen ya en mamíferos, aunque no en las mismas cantidades (Armand 1986; Hochleithner, 1994), siendo el acido úrico el mayor producto del catabolismo del nitrógeno. Este metabolito es un buen indicador de enfermedad renal así como de otras patologías (Armand 1986; Hochleithner, 1994; Grifols y Molina, 1995).
Conclusión
En general, los resultados obtenidos fueron similares a los reportados en la literatura para otras aves del mismo orden, en estudios realizados con métodos de hematología y bioquímica sanguínea convencionales, mientras que las diferencias obtenidas pueden deberse a las distintas condiciones ambientales y de manejo entre los diferentes estudios pues los animales muestreados se consideraron clínicamente sanos. Por otra parte el uso del equipo empleado facilitó en gran medida el análisis de las muestras, debido a que es un equipo portátil y fácil de manejar por lo que puede llevarse al sitio de trabajo con lo que es posible obtener resultados rápidos, además de analizar una gran cantidad de parámetros sanguíneos con solo una pequeña cantidad de muestra, lo que es una ventaja en los estudios realizados con animales silvestres en especial con aves como las del género Amazona, tal y como lo describe Paula et al., (2008), pues el obtener grandes volúmenes de sangre de estas aves es una labor difícil, debido a la fácil formación de hematomas y colapso de los vasos sanguíneos, además del aumento del estrés causado por el manejo de las aves, por lo que el uso de herramientas que ayuden a reducir la cantidad de muestra y tiempo de manipulación de estas especies para la realización de exámenes paraclínicos, son de gran utilidad. Es de resaltar que técnicas diagnosticas que acerquen rápidamente a un diagnóstico acertado, son importantes, principalmente cuando obtener muestras sanguíneas es relativamente complicado, como puede llegar a ser en animales silvestres, por lo que las diferentes instituciones que manejan estas especies pueden valerse de las mismas, ya que un análisis efectivo y rápido puede marcar la diferencia con un acertado tratamiento. Igualmente este trabajo es uno de los primeros en Colombia en ofrecer datos sobre electrolitos de una población clínicamente sana de A. ochrocephala, por lo que los datos obtenidos en este estudio pueden ser utilizados por las instituciones que manejan la especie principalmente centros de rescate y de atención y valoración de fauna silvestre, debido a que las diferencias son mínimas con los datos ofrecidos por otras investigaciones, lo cual es de gran importancia, ya que esta especie es una de las más traficadas en Colombia.
Referencias
Aguilar F. Algunas notas sobre el loro real Amazona ochrocephala (GMELIN) (Psittacidae: Psittacinae: Arini) en Venezuela. Rev. Eco. Lat. Am. 2001; 8(1): 17-39. [ Links ]
Alvarado MC, Arraga AC, Rincón M, Fernández G, Aguilar J, Villamil Y, Gómez O, Henríquez A. Valores hematológicos de psitácidos de los géneros Ara y Amazona cautivos en zoológicos de Venezuela. Revista Científica, FCV-LUZ. 2008; 18(6): 649-661 [ Links ]
Armand WB. Avian clinical hematology and blood chemistry. 1986. In: Fowler ME. (Editor) Zoo and wild animal medicine. Philadelphia, Pennsylvania. USA. Morris Animal Foundation. pp 263- 276. [ Links ]
Brue RN. 1994. Nutrition. In: Ritchie BW, Harrison GJ, Harrison LR. (Editors) Avian medicine: Principles and application. Florida. USA. Wingers Publishing. INC. pp 63 - 95. [ Links ]
Bush BM. Interpretación de los análisis de laboratorio para clínicos de pequeños animales. Harcourt. Madrid - España. 1999. 616p. [ Links ]
Cordeiro PC. 2004. A Fragmentação da Mata Atlântica no Sul da Bahia e suas implicaçöes na conservação dos psitacídeos. In: rado PI. Landau EC. Moura RT. Pinto LPS. Fonseca GAB. Alger KN. (orgs.) Corredor de Biodiversidade da Mata Atlântica do Sul da Bahia. Publicação em CD-ROM, Ilhéus, IESB / CI / CABS / UFMG / UNICAMP. [ Links ]
Deem SL, Noss AJ, Cuellar RL, Karesh WB. Health evaluation of freeranging and captive blue-fronted amazon parrots (Amazonaaestiva) in the Gran Chaco, Bolivia. Journal of Zoo and Wildlife Medicine. 2005; 36(4): 598-605 [ Links ]
DiBartola SP. 2006.Introduction to acid-base disorders. In: DiBartola SP. (Editor). Fluid, electrolyte, and acid-base disorders in small nimal practice. Third edition. St Louis, Missouri. USA. Elsevier INC. p 229 - 251. [ Links ]
Franco M, Hoyos L, Ramírez GF, Correa AM. Hallazgos hematológicos y química sanguínea en Amazona amazónica y Amazona ochrocephala cautivas de la reserva forestal torre cuatro. bol. cient. mus. hist. nat. 2010;13 (2): 63 - 77 [ Links ]
Godoy SN. 2001. Patologia comparada de psitacídeos mantidos em cativeiro no Estado de São Paulo. Dissertação (Mestrado em Patologia Experimental Comparada) - Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo. 214p [ Links ]
Grifols J, Molina R. 1995. Manual Clínico de Aves Exóticas. Barcelona. España Editorial Grass-Iatros. 217 [ Links ]
Guyton AC, Hall JE. 1996. Tratado de fisiologia medica. 9 ed. Philadelphia. USA. W.B. Saunders. 1063p [ Links ]
Guzman DSM, Mitchell MA, Gaunt SD, Beaufrère H, Tully TN. Comparison of Hematologic Values in Blood Samples with Lithium Heparin or Dipotassium Ethylenediaminetetraacetic Acid Anticoagulants in Hispaniolan Amazon Parrots (Amazona ventralis). Journal of Avian Medicine and Surgery, 2008; 22(2):108-113. [ Links ]
Hochleithner M. 1994. Biochemistries. In: Ritchie BW, Harrison GJ, Harrison LR. (Editors) Avian medicine: Principles and application. Florida. USA. Wingers Publishing. INC. pp 223-245 [ Links ]
INTERNATIONAL SPECIES INFORMATION SYSTEM (ISIS). 2002. Reference ranges for physiological values in captive wildlife. mazona ochrocephala. [CD ROM]. USA: Ed. Teare, J. A. [ Links ]
Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Colombia. Colombia en el mundo. [En línea] 2009 [Citado el 3 de Agosto de 2012]. Disponible en internet: http://www.humboldt.org.co/iavh/component/k2/item/129- colombia-en-el-mundo [ Links ]
Merida SA, Guerra DS. [En línea] 2011. Valores preliminares de referencia para hematología y química sérica del loro frente roja (Amazona autumnalis) en cautiverio. [Citado el 3 de Agosto de 2012]. Disponible en internet en: http://www.veterinaria.org/ revistas/redvet/n030311/031106.pdf [ Links ]
Munson L, Cook RA. Monitoring investigation and surveillance of diseases in captive wildlife. Journal of Zoo and Wildlife Medicine. 1993; 24: 281-289. [ Links ]
Paula VV, Fantoni DT, Otsuki DA, Auler JO. Blood-gas and electrolyte values for non-anesthetized Amazon parrots (Amazonaaestiva). Pesquisa Veterinária Brasileira. 2008; 28(2):108-112 [ Links ]
Rengifo LM, Franco-Maya AM, Amaya-Espinel JD, Kattan GH, López- -Lanús B. (eds). 2002. Libro rojo de aves de Colombia. Serie libros rojos de especies amenazada de Colombia. Instituto de investigación de recursos biológicos Alexander von Humboldt y Ministerio del Medio Ambiente. Bogota, Colombia. [ Links ]
Rodríguez JV, Rojas F, Arzuza DE, Gonzales A. 2005. Loros, pericos y guacamayas neotropicales. Conservación Internacional. Bogotá Colombia. 185pp [ Links ]
Rodríguez JV, Hernández JI. 2002. Loros de Colombia. Conservación Internacional. Bogotá-Colombia. 478pp [ Links ]
Schmidt EM, Lange RR, Ribas JM, Daciuk BM, Ferreira FM, Paulillo AC. Hematology of the red-capped parrot (Pionopsittapileata) and vinaceous amazon parrot (Amazonavinacea) in captivity. Journal of Zoo and Wildlife Medicine. 2009; 40(1): 15-17 [ Links ]
Soto CJ, Acosta I, Cruz E. [En línea] 2009. Parámetros hematológicos de Cotorras (Amazona leucocephala) y Cateyes (Aratinga euops). REDVET. Revista electrónica de Veterinaria. [Citado el 15 de Octubre de 2009]. Disponible en internet en: http://www.veterinaria.org/revistas/redvet/n070709B/070907.pdf [ Links ]
Union International Conservation of Nature. [En línea] 2012. Amazona ochrocephala. [Citado el 2 de Agosto de 2012]. Disponible en internet en: http://www.iucnredlist.org/apps/redlist/details/106001681/0 [ Links ]
Valle SD, AllgayerI MD, Pereira RA, Barcellos LJ, Hlavac NR, et al. Parâmetros de bioquímica sérica de machos, fêmeas e filhotes de Araras canindé (Ara ararauna) saudáveis mantidas em cativeiro comercial. Ciência Rural. 2008; 38(3): 711-716 [ Links ]
Willard MD, Tvedten H. 2004. Diagnostico clínico-patológico practico en los pequeños animales. 4 ed. Buenos Aires - Argentina. Interamericana. 456p. [ Links ]












