INTRODUCCIÓN
Los ovinos se distribuyen ampliamente por todo el mundo y ha logrado sobrevivir en una gran diversidad de entornos. En México, la oveja Pelibuey es la de mayor distribución entre las razas de pelo debido a su rusticidad, resistencia a parásitos, buena habilidad materna y estacionalidad reproductiva reducida 1. Esta raza tiene índices variables de ovulación que van desde 1.3±0.16 hasta 3.0±0.18 y a nivel de prolificidad de 1.4±0.2 a 1.8±0.2 2.
La reproducción de ovinos puede ser controlada por varios métodos desarrollados que implican la administración de hormonas exógenas y modifican la cadena fisiológica de eventos involucrados en el ciclo estral 3. Dentro de las biotecnologías reproductivas usadas en la ovinocultura, se tiene la técnica de producción de embriones in vivo, la cual se asocia siempre a una súper estimulación ovárica lo que da como resultado la ovulación múltiple, con el objetivo de obtener una mayor tasa ovulatoria, además, siempre buscando obtener un buen porcentaje de fecundación, para luego recuperar los embriones 4. Actualmente, se han estudiado una diversidad de métodos de ovulación múltiple, donde la mayoría de los estudios han sido enfocados en el uso de gonadotropinas tales como la gonadotropina coriónica equina [eCG] y hormona estimulante del folículo [FSH porcina u ovina]. Estas hormonas estimulan el crecimiento folicular asociado a un tratamiento previo con progestágenos (5,6). La eficiencia de la aplicación de la FSH es muy variable, ya que se han realizado estudios suministrando dosis con un rango de 100-300-mg FSH; sin embargo, esta variabilidad también depende del efecto de la raza y de la duración del tratamiento superovulatorio 6. Por su parte, la aplicación de la prostaglandina tiene un efecto de sensibilizar a la hipófisis para la liberación de la hormona liberadora de gonadotropinas (GnRH), lo cual conlleva a la liberación de la hormona luteinizante (LH) y con ello una ovulación 7.
La LH es la hormona encargada de la ruptura del folículo para provocar la ovulación, para posteriormente convertirse en cuerpo lúteo (CL), cuya función es secretar la progesterona (P4) que sirve para mantener una gestación 7. Sin embargo, se lograría mejor respuesta si la preparación de FSH tuviera menos del 10% de LH, ya que la relación FSH:LH se vería afectada críticamente en el desarrollo preovulatorio y la ovulación 8. Por lo tanto, las concentraciones elevadas de LH durante un lapso extenso antes de ocurrir el pico de LH, alteraría los tiempos de la ovulación 9.
La información del uso de la hormona luteinizante humana recombinante (r-hLH) es nula en la aplicación sobre los protocolos de superovulación en ovejas. Sin embargo, si existe evidencia del uso de LH porcina (pLH), donde se ha demostrado que induce una ovulación en folículos dominantes, por lo que se sugiere que podría ser utilizado para suprimir el dominio folicular 10. Su uso podría estimular e incrementar la cantidad de ovocitos liberados para ser fertilizados y la cantidad de embriones obtenidos. Por lo tanto, el objetivo de este estudio fue evaluar la influencia de lutropina alfa (LH recombinante humana, r-hLH) administrada a 12 y 24 h postretiro del dispositivo de progesterona (CIDR) en la respuesta de horas al inicio del estro, tasa ovulatoria, ovocitos no fertilizados, embriones transferibles y niveles plasmáticos de LH, en un protocolo de superovulación a base de FSHp en ovejas Pelibuey.
MATERIALES Y MÉTODOS
Localización. El estudio se realizó durante los meses de junio y julio de 2020, que corresponde al inicio de la época reproductiva. Fue realizado, en las instalaciones del Campus Córdoba del Colegio de Postgraduados, ubicado en la carretera federal Córdoba-Veracruz km 348, en congregación Manuel León, municipio de Amatlán de los Reyes, Veracruz, México. La ubicación geográfica es 18°51'20" N y 96°51'37" O, con una altitud de 720 m. El clima es templado-regular, con una temperatura promedio de 18°C y una precipitación media anual de 1.807 mm.
Ovejas y manejo. Se usaron 18 hembras Pelibuey aptas fisiológica y reproductivamente, con un promedio de 2 partos, un peso de 37.6±0.6 kg, edad 2.2±0.37 años y con una condición corporal de 2.9±0.4 en una escala de 0 a 5 (0= delgado; 5= obeso) de acuerdo con Russel et al 10. Las ovejas fueron pastoreadas en praderas con pasto estrella (Cynodon dactylon L.) durante 7 a 8 h día-1; este pastoreo es de manera habitual durante todo el año. Así mismo, se ofreció un suplemento en el corral de 400 g-1 oveja-1, con un aporte de 16% de proteína cruda (PC) y 2.9 Mcal de Energía Metabolizable EM/kg MS-1 durante el tiempo que duro el tratamiento. También se les ofreció agua limpia y fresca ad libitum.
Protocolos de superovulación. Las ovejas seleccionadas se distribuyeron al azar en tres tratamientos de superovulación (T1, T2 y T3; Figura 1). El protocolo incluyó la sincronización del estro de las ovejas mediante la inserción de un dispositivo intravaginal (día cero; CIDR®, Pfizer, Hamilton, Nueva Zelanda), impregnado con 0.3 g de progesterona (P4), durante un período de 9 días. El día siete posterior a la introducción del CIDR, se aplicó 250 mcg de cloprostenol vía IM (Prostaglandina, Celosil®, Schering-Plough de Intervet Sanidad Animal) con la finalidad de provocar la luteolisis de algún cuerpo lúteo presente y por la tarde del día nueve, se retiró el CIDR a todas las ovejas.
T1(n=6): En el día seis posterior a la colocación del CIDR, se comenzó con la aplicación de 200 mg de NIH = National Institutes of Health-FSH-P1 (Folltropin®-V, Laboratorio Bioniche, Animal Health Canada Inc.), vía IM, administrada cada 12 h (mañana/tarde) en ocho dosis decrecientes (40/40; 30/30; 20/20 y 10/10 mg). La dosis inicial se suministró 72 h antes del retiro del CIDR y la última, 12 h posteriores de su retiro (Figura 1).
T2 (n=6): El mismo procedimiento de administración de FSH fue similar al del T1, más una dosis de 75 UI de lutropina alfa (r-hLH, Luver-1. S., MERCK SERONO), aplicada 12 h posteriores al retiro del dispositivo intravaginal (Figura 1).
T3 (n=6): El procedimiento de administración de FSH fue similar al del T1, más una dosis de 75 UI de lutropina alfa (r-hLH, Luver-1. S., MERCK SERONO), aplicada 24 h posteriores al retiro del dispositivo intravaginal (Figura 1).

Figura 1 Esquema de tratamientos de superovulación con FSHp más la aplicación de r-hLH a las 12 y 24 h posteriores al retiro del CIDR.
Detección de estros y monta natural. Una vez que se retiró el CIDR, se inició con la detección de estros a las 4 h, con el uso de tres carneros raza Pelibuey en una condición corporal de 3.0 en promedio, los cuales fueron probados con anterioridad al evaluar su líbido; para dicha actividad se introdujo un carnero a la vez, provisto de un mandil. El tiempo que se presentó el macho a las ovejas fue de 30 min, con un intervalo de cuatro horas. Las ovejas al presentar estro, fueron separadas y llevadas con otro semental, evaluado previamente en términos de su calidad seminal, para que se realizara la monta natural (MN). La monta inicial fue en la etapa en que la oveja manifestó estar receptiva al macho y una segunda monta se realizó 12 h posteriores a la primera.
Recolecta de estructuras embrionarias. Los embriones se recolectaron 6 días después de la detección del celo, mediante la técnica quirúrgica de laparotomía ventral medial. Veinticuatro horas antes de la cirugía, se les restringió la comida y el agua a todas las ovejas tratadas. Las ovejas fueron anestesiadas en plano general, administrándoles una combinación de Xilazina (Procin®, Laboratorios PiSA; 0.25 mg/kg P.V.), más ketamina (Anesket®, Laboratorios PiSA; 1.25 mg/kg P.V.), por vía intravenosa (I.V.). Posteriormente, las ovejas fueron entubadas utilizando una sonda endotraqueal conectada a un tubo con suministro de óxido nitroso. Una vez aplicada la anestesia, se colocó a cada una de las hembras en decúbito supino dorsal. Se afeitó y desinfectó el campo quirúrgico; se colocaron los campos quirúrgicos para continuar con la cirugía, a fin de exponer el útero y los ovarios.
Tras la exposición de los ovarios, se midió la tasa ovulatoria mediante el recuento de los cuerpos lúteos (CL). El proceso de recuperación embrionaria se realizó de forma gravitacional, utilizando una sonda Foley (10 fr.), a través de una punción en la base del cuerno. A continuación, se colocó un catéter intravenoso (1.20 x 25 mm de longitud, Punzocat®) en la unión uterotubárica, para inyectar medio de lavado (VIGRO® Complete Flush Solution, Bioniche, Animal Health Canada Inc.) precalentado a 37°C. El medio recuperado se depositó en un tubo colector estéril precalentado a 37°C, el cual se colocó en un baño de agua. A continuación, se lavó el aparato genital con solución salina y se introdujo en la cavidad abdominal para realizar las suturas en los planos quirúrgicos. Por último, se administró a las ovejas 1 mL 20/kg P.V. de antibiótico (Shotapen® L.A. Virbac, México), 1 mL 10/kg P.V. de analgésico (Biodipirona® Bio Zoo, México) y 1 mL de un análogo de la PGF2a (Celosil®; 250 mcg de cloprostenol). Posteriormente la búsqueda y clasificación embrionaria se realizó de acuerdo al procedimiento descrito por García-Salas et al 11.
Muestreo sanguíneo y análisis de LH. A todas las ovejas en los tres tratamientos se les colectó una muestra de sangre (5 mL) de la vena yugular al momento del retiro del CIDR y posteriormente a intervalos de 2 h, hasta alcanzar las 48 h post retiro. Las muestras sanguíneas se centrifugaron a 600 x g por 15 min (Solbat® C-600 centrífuga). Posteriormente, el suero se separó por decantación y se almacenó en tubos de polipropileno para su congelamiento a -20°C hasta el momento de su análisis. La concentración de LH inmunoreactiva se midió con un radioinmunoensayo en fase líquida, para LH bovina 12. El trazador se formó con la incorporación del NaI125 al USDA-bLH-B5-AFP11743B, con el método del IODO-GEN (13) in basic (A, pH, 10.75-9.75; B, pH 9.58-8.41. La misma proteína se empleó como referencia a las dosis de 0.1, 0.5, 1.0, 2.5, 5.0 y 10 ng tubo-1 en cuatro replicas. El anticuerpo primario (anti-oLH-26) se utilizó a una dilución de trabajo 1:60,000 en presencia de suero normal de conejo, 1:1600 y la separación del complejo antígeno-anticuerpo se obtuvo en presencia del anticuerpo secundario (anti-IgG de conejo generado en burro, 1:80) posterior a la incubación de 120 h a 4°C. La cantidad mínima detectable en el sistema fue 0.05 ng mL-1 y los coeficientes de variación (CV) intra ensayo fue de 12.9%, los valores obtenidos se reportan en ng mL-1.
Análisis estadístico. Los datos fueron analizados con el Modelo Lineal Generalizado (GENMOD) del paquete estadístico (SAS 2013), en particular, con el uso de una regresión binomial negativa para las variables respuesta de conteos, las cuales fueron: TO, ONF, EC1, ET y total de estructuras recolectadas (TER).
Para la variable IE (h), se evalúo por medio de la curva de supervivencia de Log Rank y las gráficas de Kaplan-Meier. En el análisis para LH, se utilizó la prueba de Tukey para el efecto del intervalo de muestreo y análisis de medias entre tratamientos. Los resultados se muestran como media ± error estándar, y las diferencias se consideran significativas cuando p<0.05.
RESULTADOS
Para las condiciones en que se llevó a cabo la presente investigación, se encontró que el 100% de las ovejas tratadas en todos los tratamientos presentaron señales externas de estro, lo cual es una respuesta favorable del protocolo hormonal utilizado en el estudio. Así mismo, no hubo diferencias (p>0.05) en la variable horas del inicio a la manifestación del estro después de retirado el CIDR (Figura 2).
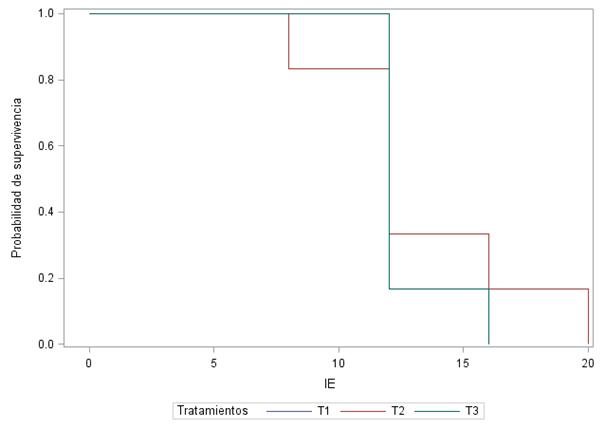
Figura 2 Curvas de supervivencia del IE en horas post-retiro del CIDR en ovejas Pelibuey sometidas a diferentes tratamientos de ovulación múltiple (T1 = FSH; T2 = FSH+LH 12 h y T3 = FSH + LH 24 h).
En la respuesta de la variable TO fue similar entre tratamientos (p>0.05).
El T2 presentó el mayor número de ONF (p<0.05), superando con 3.7 al T3 y en 4.1 al T1, respectivamente. Por otro lado, los ET están en función de la calidad y desarrollo embrionario, por tanto, el T3 fue superior y diferente estadísticamente (p<0.05) al T1 y T2, quienes mostraron el menor número de EC1 y ET, respectivamente, lo cual indica efecto positivo de la aplicación de la hormona r-hLH 24 h después de retirar el CIDR. Con relación al TER, el número fue mayor (p<0.05) en el T3 y T2 comparado con T1 respectivamente (Tabla 1).
Tabla 1 Respuesta ovulatoria y producción de embriones en ovejas de la raza Pelibuey sometidas a diferentes tratamientos de ovulación múltiple (medias ± error estándar).
| Variables | Tratamiento (n=6) | ||
|---|---|---|---|
| T1 | T2 (LH 12 h) | T3 (LH 24 h) | |
| Ovejas en estro (%) | 100.0 | 100.0 | 100.0 |
| Horas a la presencia del estro (h) | 12.6 ±0.7 a | 13.3 ±1.7 a | 12.6 ±0.7 a |
| 1Tasa Ovulatoria (CL) | 13.3 ±3.0 a | 14.5 ±2.9 a | 12.3 ±1.9 a |
| Ovocitos No Fertilizados | 0.83 ±0.6 a | 5.0 ±2.3 b | 1.3 ±0.7 a |
| Embriones Calidad 1 | 1.1 ±0.3 a | 0.6 ±0.5 a | 3.1 ±1.1 b |
| Embriones Transferibles | 4.0 ±0.6 a | 2.0 ±1.0 a | 6.6 ±0.9 b |
| Total de Estructuras Recolectadas | 5.3 ±0.9 a | 7.0 ±2.0 b | 8.7 ±1.9 b |
a,b Medias con literales diferentes entre hileras indican diferencias entre tratamientos (p<0.05). 1Número de cuerpos lúteos.
Las mayores concentraciones plasmáticas de LH se presentaron en las ovejas que recibieron una dosis de 75 UI de lutropina alfa (r-hLH) a las 24 h siguientes a la extracción del CIDR (Figura 3).
DISCUSIÓN
Los protocolos de múltiple ovulación muestran una gran variabilidad en la respuesta ovárica con respecto al desarrollo folicular y el rendimiento embrionario. Esta respuesta depende del tratamiento de hiperestimulación; dosis de FSH, relación FSH:LH, época del año y del intervalo de tiempo entre colectas en una misma oveja (4,11,14). En el presente estudio se encontró información relevante de las diferencias en la función ovárica y el pico preovulatorio entre el momento de la aplicación de r-hLH sobre la ovulación inducida en ovejas; estas diferencias se han centrado principalmente en la funcionalidad de los folículos preovulatorios, la concentración de LH basal, el momento y las características del pico de LH preovulatorio 7.
Para las condiciones del presente estudio, se obtuvo como resultados que el 100% de las hembras tratadas presentaron señales externas de estro en promedio a las 12 h post-retiro del CIDR. García-Salas et al 11 reportan las mismas horas al inicio del estro cuando se utiliza solo FSH-p, en comparación con una combinación de FSH-LH y siendo aún menor las horas a la presencia del estro cuando se adiciona eCG. El inicio del estro ocurre más temprano en animales con altas concentraciones circulantes de estradiol en el momento de retirado el dispositivo y 12 h posteriores (11). Para la variable TO se presentó semejanza entre grupos experimentales (p>0.05J, con una respuesta ovulatoria positiva y similar a otros estudios (15,16). En los resultados de TO de este estudio, la aplicación de r-hLH no tuvo influencia significativa, ya que los números reportados en otros estudios son similares a los obtenidos.
Por su parte, en los ONF, se encontró diferencias entre tratamientos (p<0.05), con lo cual se obtuvo una mayor cantidad en el tratamiento con aplicación de r-hLH a 12 h de retirado el CIDR (T2) en comparación a la aplicación a 24 h post-retiro del mismo (T3) y el tratamiento sin aplicación de r-hLH (T1). En el T2, la aplicación de r-hLH quizá pudo haber provocado una ovulación temprana, y como consecuencia, la unión de los gametos no se dio en el tiempo y lugar idóneo para llevar a cabo la fecundación (17,18). Para las variables EC1 y ET, se encontró una mayor cantidad en el T3 con aplicación de r-hLH a 24 h de retirado el CIDR, a consecuencia de la amplitud y frecuencia de LH en el organismo de la oveja; esto probablemente como respuesta a una mayor sincronía en la ovulación que permite una mejor tasa de fecundación y producción embrionaria (10,19). Martínez-Ros et al 7 demostraron que el pico de LH surge en un rango de 8±3.7 a 12±5.7 h de haber iniciado el estro. Con base en lo anterior, se puede explicar del porque el pico de LH se potencializa más en las ovejas del T3 en el cual se obtuvieron los mejores resultados de ET. Sin embargo, se ha reportado que la relación FSH/LH de manera temprana, influye de manera negativa en la respuesta superovulatoria y en el momento de la fecundación (11,20).
El resultado de este estudio mostró un ligero incremento en la cantidad de ET (6.6±0.9) en comparación con otros estudios reportados (5,14), lo cual indica que la adición de la r-hLH a 24 h posteriores al retiro del progestágeno, tuvo influencia favorable para potencializar el pico de LH, lo cual provocó la ovulación de los folículos y con ello favoreció el momento de la unión de los gametos para dar paso a la fertilización. Para los niveles basales de LH, hace notar un pico preovulatorio muy marcado en las aplicaciones de r-hLH a las 24 h, en relación con el pico preovulatorio presente de manera natural, lo cual fue indicativo en la respuesta de la cantidad y calidad de embriones obtenidos en los diferentes tratamientos 5,19,21,22.
En conclusión, la aplicación de r-hLH a las 24 h posteriores al retiro del progestágeno, potencializa una mayor amplitud del pico de LH, lo cual aporta un resultado positivo en cuanto a un menor número de ovocitos no fertilizados y una mayor calidad y cantidad de embriones transferibles en los tratamientos de superovulación en ovejas Pelibuey















