INTRODUCCIÓN
La ganadería es una fuente de ingresos importantes en los países en desarrollo, con la ganadería como un sector influyente en la economía de la industria láctea. México se ubica en el lugar 16 en la producción mundial de leche, con una obtención anualizada de 450 millones de litros, lo que representa el 2% del total con relación al mercado internacional de lácteos. El valor de ventas al exterior fue de 617 millones de dólares; La producción de leche en México se considera una actividad rentable, dentro de la industria existen 130 empresas formales que procesan el 86% de la producción nacional 1. Entre los problemas de la industria láctea en este sector se observan los reproductivos, productivos y, nutricionales. Algunos problemas reproductivos ocurren durante la gestación como los prolapsos vaginales, las distocias y los abortos infecciosos y no infecciosos, genéticos, de manejo, que afectan la productividad del ganado 2.
Los principales obstáculos que afectan el rendimiento reproductivo del ganado lechero es el aborto, lo cual puede generar una pérdida económica significativa para la industria láctea, debido a una involución uterina más lenta, una tasa reproductiva reducida, intervalo interconcepcional y entre partos prolongado, un efecto negativo en la fertilidad, con el consecuente aumento en el costo de los medicamentos, disminución en la producción de leche, menor número terneros, supervivencia reducida de vacas recién paridas y la depreciación temprana de estas potencialmente usadas 3.
Las consecuencias económicas de la pérdida de preñez en los hatos lecheros son evidentes, y más aún si se tienen en cuenta las bajas tasas de preñez alcanzadas en los programas regulares de inseminación. A pesar de la magnitud de este problema y de la relevancia económica para los rebaños lecheros, existe poca información sobre su incidencia o su impacto económico en México.
El costo de la pérdida de una gestación durante el primer trimestre se estimó en US$308.27 (trecientos ocho dólares y veintisiete centavos de dólares), entre los días 91 y 180 en US$567.72; y por más de 181 días a US$1290.14. La mayor incidencia en pérdida de gestación tuvo lugar durante los primeros 90 días o primer trimestre, la pérdida de esta puede ser la causa principal reproductiva que afecta la rentabilidad de los sistemas de producción lechera intensiva 4.
El aborto bovino se tipifica como la muerte fetal, o pérdida del producto de la gestación a una edad entre los 42 y 260 días. Antes de los 42 días se considera como una reabsorción embrionaria y después de los 260 días se cataloga como parto prematuro. El aborto no sólo se reduce a la pérdida del producto, sino que también se le considera un desequilibrio gestacional multivariado, un factor limitante que reduce el tamaño del hato y las consecuencias para el ganadero 5.
Las causas del aborto son multifactoriales; pueden ser infecciosas y no infecciosas, estas últimas incluyen agentes físicos, genéticos, cromosómicos, nutricionales, químicos (fármacos, hormonas entre otros). Las pérdidas de la gestación debidas a la mortalidad embrionaria y el aborto son las principales limitantes para completar la gestación en todos los animales 6.
El aborto en bovinos se define tradicionalmente como la muerte fetal acompañada de la expulsión uterina del ternero. Así, el diagnóstico de aborto implica la certeza de la expulsión física del feto, sin embargo, es posible que la muerte fetal no siempre sea verificable y el único signo que indica la pérdida de preñez es el regreso de la vaca al estro o un diagnóstico negativo en la confirmación de la preñez 4.
En los últimos años, se ha incrementado el número de abortos en vacas lecheras, no obstante, las causas de estos abortos persisten en la incertidumbre. Para proteger y sostener la industria de los rumiantes debemos de estudiar todas las razones del aborto, aislar y analizar las características genéticas, de los patógenos relacionados con el aborto 7.
Los abortos espontáneos se han asociado con factores como anomalías cromosómicas 8. En general, las anomalías cromosómicas se pueden clasificar en aberraciones cromosómicas numéricas (euploidía, como monoploidía, poliploidía y aneuploidía-monosomía, trisomía), así como reordenamientos estructurales. Las aberraciones numéricas de los autosomas (poliploidias y aneuploidías), suelen ser letales en la etapa embrionaria y/o fetal y rara vez se encuentran en individuos nacidos vivos. Esto probablemente se deba a las eliminaciones en el desarrollo embrionario temprano o por parte de los criadores cuando se producen defectos anatómicos graves.
El análisis cromosómico sigue siendo un proceso fundamental para la identificación de aberraciones cromosómicas en los laboratorios de citogenética animal 9. El análisis citogenético de cromosomas en vacas lecheras permite suponer una disminución de las funciones reproductivas con aberraciones cromosómicas 10. Los errores de segregación cromosómica se presentan con frecuencia durante la meiosis en las hembras, no obstante, también en las primeras mitosis del desarrollo preimplantacional de los mamíferos. Dichos errores pueden provocar aneuploidías, abortos espontáneos y defectos de nacimiento 3.
La aneuploidía es la causa más frecuente de aborto temprano. Cualquier defecto en la segregación cromosómica no satisface la fase de la mitosis, el punto crítico se produce en el huso mitótico, por cuya falla no se completa la metafase, causando aneuploidía 11 además, de ser la presencia de un número incorrecto de cromosomas en una célula. Los errores de segregación cromosómica durante la mitosis o la meiosis conducen a células aneuploides que poseen un número de cromosomas que se diferencia del número haploide exacto 12.
La aneuploidía es la presencia de un número incorrecto de cromosomas en una célula. Los errores de segregación cromosómica durante la mitosis o la meiosis conducen a células aneuploides que contienen un número de cromosomas que difiere del número haploide exacto. La aneuploidía en las células germinales es una causa importante de complicaciones reproductivas 12.
Por lo anterior se planteó la hipótesis que vacas con historial de aborto que presenten aneuploidías/poliploidías, de edad entre 3 y 10 años serán más propensas a abortos en el municipio de Enrique Estrada, Zacatecas, México. El objetivo de esta investigación fue determinar las aberraciones cromosómicas (poliploidías/ aneuploidías) en vacas Holstein con ese historial y esa edad en el municipio señalado.
MATERIALES Y MÉTODOS
Localización del estudio. Este se efectuó en el municipio de Enrique Estrada, Zacatecas, México, Ubicado a una longitud de 102°42', latitud 23°18'; altura de 2230 msnm y con una temperatura promedio anual de 17°C. Se realizó en un hato lechero de vacas Holstein con historial de aborto, con edad de entre 3 y 10 años con una n = 107. Se obtuvieron 7 mL de muestra sanguínea en tubos vacutainer® heparinizados de la vena yugular de cada animal, se trasladaron en una hielera para continuar con el proceso de recepción, procesamiento y el análisis, se realizó en el Laboratorio de Citogenética de la UAMVZ-UAZ 13. Las vacas Holstein provienen de un solo hato del municipio en cuestión, se encontraban en producción de leche, respecto al manejo se ordeñaban a las 04:00 h de la mañana y por la tarde a las 17:00 h, salían a pastar de 8:00 h a 14:00 h, retornaban al establo, se alimentaban con silo de maíz y alimento concentrado, las vacas se observaban en la pradera para ver el comportamiento reproductivo como identificación de celos, posibles problemas clínicos, fueron importadas de Canadá, las hembras que estaban en celo eran inseminadas por el médico veterinario zootecnista, no había machos en el hato, criterios de inclusión se consideró que estuvieran en producción, para ser candidatas en el estudio y los criterios de exclusión reproductiva fueron que repitieran más de 4 celos consecutivos de manera irregular, vacas con 6 partos, que tengan afectados dos de los cuartos de la glándula mamaría. El diseño del trabajo fue de carácter observacional descriptivo analítico 14.
Procesamiento en el laboratorio de citogenética. De cada muestra sanguínea previamente obtenida en los tubos vacutainer® heparinizados de cada animal se procedió a tomar 0.5 mL de sangre y se deposita en tubos de cultivo con 3.0 mL de medio McCoy 5 A modificado (Laboratorio Microlab S.A. de C.V.) se les añadió 0.2 mL de fitohemaglutinina, para estimular la mitosis e incubarse a 38°C por 71 h. Pasado el periodo de incubación, se agregó 1.0 mL de colchicina (4 μg/mL en PBS) a cada tubo con muestra y se dejó reposar por 1 h, para posteriormente centrifugar a 3000Xg durante 10 min, se decantó y se agregaron 6 mL de KCl a 0.075 M (solución hipotónica). Pasados 30 min, se volvió a centrifugar y decantar, para luego fijar en una solución de Carnoy metanol-ácido acético en relación 3:1. Se realizaron tres lavados con la misma solución, centrifugando y decantando 15. Se procedió a preparar tres laminillas de cada muestra por la técnica de goteo. Posteriormente se tiñeron con Giemsa durante 30 min. Las muestras se montaron con resina, se cuantificaron y analizaron los cromosomas metafásicos observados al microscopio óptico a 10X y 100X. Se obtuvieron las fotografías para realizar los cariogramas correspondientes y llevar a cabo el análisis e identificación de las aberraciones cromosómicas como fueron las aneuploidías - poliploidías 16,17.
Análisis estadístico. De los datos obtenidos se generó la base de datos de los 107 registros en número progresivo y un identificador de cada sujeto experimental, municipio, edad, aborto, metafases, cariotipo, las aberraciones cromosómicas poliploidías/aneuploidías, se ordenaron de manera decreciente con respecto a el porcentaje de ap/pp. Para el análisis estadístico se utilizó el lenguaje y ambiente de programación estadística R versión 3.0.3 18. Se calcularon resúmenes en torno a la mediana y promedio de la edad y las poliploidías, proporción y porcentajes de los abortos, correlaciones y la regresión logística, para calcular las razones de momios, estimar el riesgo relativo mediante la regresión log-binomial, razón de momios. Se utilizaron los modelos logarítmicos lineales, por ser variables cualitativas, con la función loglm del paquete MASS 19. También se realizaron comparaciones múltiples de proporciones para cuadros de contingencia, con la función "prop. multcomp", del paquete RVA 20. Análisis: Correlación, Razón de momios, Regresión logística, Regresión logbinomial, Comparación de los modelos y predicción 21.
RESULTADOS
Del análisis citogenético a 107 vacas con edad de entre 3 y 10 años con antecedentes de aborto, las aberraciones cromosómicas como las aneuploidías/poliploidías (ap/pp). Se observaron vacas que no presentaron ap/pp es decir 0%, con una mediana de 2%, y un máximo de 16%. Con relación a la edad presentaron una edad mínima de 3.5 años, una mediana de 5.8 y una máxima de 7.4 (Tabla 1).
Tabla 1 Variables de las vacas edad y poliploidías.
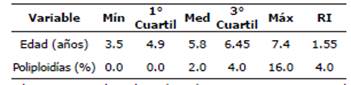
Mín: Minimo; Med: Media; Máx: Máximo; RI: Rango intercuartil Ambas distribuciones son asimétricas.
El promedio aritmético de la edad de las 107 vacas fue de 5.75 años, con una desviación estándar de ±0.88 y un coeficiente de variación de 15.4%. Las poliploidías expresadas mostraron un promedio de 3.05%, una desviación estándar de ±3.36 y un coeficiente de variación de 110.2. Comparando la información de la mediana y el promedio, se observa que la edad es más simétrica que el porcentaje de poliploidía que, en la primera variable, el valor de la mediana y el del promedio casi coinciden, mientras que, en la segunda, la mediana es mucho menor al promedio, lo que revela una asimetría hacia la derecha. Por otra parte, el porcentaje es mucho más disperso que la edad, tal como se puede apreciar en el coeficiente de variabilidad por ciento. Con respecto a las correlaciones de la edad de las vacas y el porcentaje de las ap/pp es de -0.179, la asociación entre la edad y el porcentaje de poliploidía es más bien baja e inversamente proporcional.
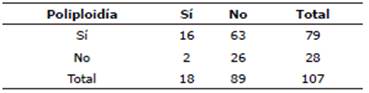
Respecto a las aberraciones cromosómicas ap/pp observadas en las metafases de los linfocitos de las vacas lecheras de las n=107 en porcentaje 100, las que mostraron ap/pp n=79 en porcentaje 73.8 mientras que las vacas cuyos linfocitos que no presentan ap/pp n=28 en porcentaje 26.2, aparentemente alto, ya que se observan en más del 70% de las vacas en estudio con diferentes porcentajes de esta aberración que van desde el uno y hasta el 16%.
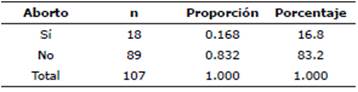
La distribución de abortos, del hato de vacas Holstein del municipio de Enrique Estrada, solo 18 vacas presentaron aborto y 89 no lo presentaron, 16 de las 18 vacas que mostraron aborto presentaron ap/pp en diferentes porcentajes, el resto llevaron a término la gestación. La tasa de aborto en estas vacas es alta pues supera al 15%. Las proporciones y porcentajes de aborto se muestra en las Tablas 2 y 3.
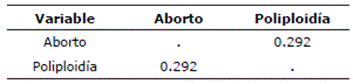
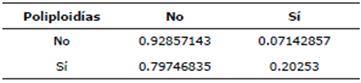
En esta tabla, se registraron dos grupos de individuos: aquellos con poliploidía (grupo "Sí") y aquellos sin poliploidía (grupo "No"). El análisis de la correlación de Spearman entre el porcentaje de ap/pp reporta valores entre 0 y 16 y la ocurrencia de aborto con valores 0 y 1 se observa en la Tabla 4. El análisis estadístico indica una asociación directamente proporcional moderada entre ambas variables. No se puede rechazar la hipótesis de independencia de acuerdo con la prueba exacta de Fisher, que arroja una p=0.1463 o sea p>0.05, esto a pesar de que en la Tabla 5 la de contingencia de proporciones es similar, es decir p>0.05.
La probabilidad de que aborte una de las vacas poliploides estudiadas es p1= 0.203, mientras que la probabilidad de que no lo haga es 1-p=0.797. De aquí que los momios (en inglés odds) de que una vaca poliploide aborte serán de o1=0.254. Por otra parte, la probabilidad de que aborte una de las vacas estudiadas sin poliploidía es p2=0.071, mientras que la probabilidad de no abortar será 1- =p2 0.929. De aquí que los momios de que una vaca no poliploide aborte serán de o 2=0.0769. En consecuencia, la razón de momios será, para que las vacas poliploides aborten, OR=3.3, lo que significa que es 3.3 veces más posible que una vaca poliploide aborte a que lo haga una vaca no poliploide. Sin embargo, a pesar de lo aparatoso de este resultado quizás éste no sea estadísticamente significativo. Habrá que realizar una prueba que lo establezca, siendo para estos casos, la más usada la prueba exacta de Fisher, ya realizada anteriormente y que arrojó un resultado de p=0.146, que claramente es superior a α=0.05, que sería el área crítica de rechazo.
En este trabajo, las poliploidías fueron medidas en porcentaje, una variable cuantitativa continua, con valores que oscilan entre 0 y 16 inclusive. La regresión logística o razón de momios, se transformó a la variable poliploidías en poliploidía, una variable dicotómica con valores "Sí" y "No", cuando se convierte una variable cuantitativa a cualitativa, se pierde información. Todos los valores de 1 a 16 se transformaron en "Sí". Además, se registró la edad (3.5 ≤ edad ≤7.5) y sería interesante saber si esta variable tiene efecto sobre la ocurrencia de abortos en estas vacas. Por estas razones, fue conveniente analizar los datos mediante las regresiones logística o logbinomial. La primera es muy adecuada para describir y probar hipótesis sobre las relaciones entre una variable de respuesta dicotómica con una o más variables explicativas categóricas o cuantitativas.
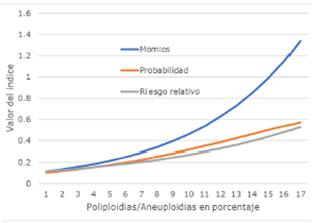
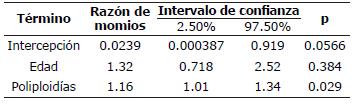
El modelo de regresión logística es un caso especial del modelo lineal general o MLG. Se corre, entonces, una regresión logística. Se hace una tabla con los valores de las razones y sus intervalos de confianza a 95%. Se supone que si la proporción del evento es mayor a un 10% se sobrestima el riesgo relativo, sin embargo, aquí se calcula la razón de momios para ver a cuánto llegará dicha sobrestimación, así como se muestra en la Tabla 6, lo que indica esta tabla es que la posibilidad de que una vaca aborte se incrementa en un 31.7% con cada año. Sin embargo, la p de este coeficiente es 0.384- no significativo. Por otra parte, la posibilidad de que una vaca aborte se incrementa en un 16.5% con cada incremento porcentual unitario del grado de poliploidía, y la p para este coeficiente es 0.029 que sí es significativo. Debido a que la proporción de abortos en este estudio es alta, es decir, 16.8>10.0. Por lo tanto, es conveniente estimar el riesgo relativo mediante la regresión logbinomial.
Tabla 6 Efecto de la poliploidía y la edad sobre el aborto en vacas lecheras, modelo de regresión logística.
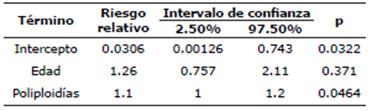
El riesgo relativo es una razón de la probabilidad de que un evento ocurra en un grupo de individuos expuestos a una condición peligrosa para la salud, en comparación con la probabilidad de que dicho evento ocurra en un grupo no expuesto a dicha condición. Por ello, al modelo logbinomial suele denominarse modelo de regresión de riesgo relativo, así como se muestra en la Tabla 7. Lo que indica esta tabla es que el riesgo de que una vaca aborte se incrementa en un 26.3% con cada año. Sin embargo, la de este coeficiente es 0.371, no significativo. El riesgo de que una vaca aborte se incrementa en un 9.84% con cada incremento porcentual unitario del grado de poliploidía, y el coeficiente es 0.0464 que sí es significativo.
Tabla 7 Efecto de la poliploidía y la edad sobre el aborto en vacas lecheras, modelo de regresión logbinomial.
Para realizar la comparación entre los modelos se utilizó el logaritmo natural de la verosimilitud, el criterio de información de Akaike y el criterio de información bayesiano (Tabla 8). Como se puede apreciar, los valores obtenidos por los dos modelos son sumamente similares, lo que impide la opción de elegir uno sobre el otro.
Ocurre un aumento sostenido en los tres índices reportados. En la Tabla 8 se muestran los datos a edad promedio, pero como ambas covariables muestran tendencias positivas, es de esperarse que estos índices sean mayores conforme se incremente la edad de las vacas (Figura 2). En esta figura se puede observar el efecto positivo que la poliploidía tuvo en la tasa de abortos en las vacas lecheras Holstein. Además, estos efectos son significativos (p<0.05), por lo que se puede afirmar, a la luz de estos hallazgos, que la presencia de células poliploides está asociada con la ocurrencia de esta condición reproductiva. También es la única forma eficiente de analizar poblaciones de células quiméricas o en mosaico.
DISCUSIÓN
Raudsepp y Chowdhary 22 manifiestan que de los inconvenientes de la industria láctea; son los abortos en general, que el aborto fue del 7.53%, la cual es una amenaza para la industria ya que causa pérdidas fetales, patologías uterinas prolongadas, seguida de infertilidad y esterilidad 22. Así mismo Rocha-Valdez et al 23 reportan un hato lechero se acepta como normal una incidencia de aproximadamente un 10% de abortos, pero si sobrepasa este límite se puede estar en presencia de un brote de abortos 23. Coincidiendo parcialmente con su publicación, pero diferimos con sus hallazgos, los cuales son menores a los que se observaron en nuestro estudio (16%), y representan lo doble de lo reportado por ellos.
Raudsepp y Chowdhary 22 manifiestan que la asociación entre anomalías cromosómicas y la fertilidad reducida en animales domésticos está bien documentada. Las aberraciones cromosómicas afectan directamente la meiosis, la gametogénesis y la viabilidad de los cigotos y embriones, provocando que, en ocasiones, los productos no sean viables y se produzcan abortos, con lo que se coincide en que las aberraciones cromosómicas (ap/pp) afectan la viabilidad de los productos y muy probablemente se produzcan los abortos.
Las aberraciones cromosómicas numéricas (aneuploidía y poliploidía) de los autosomas tienden a ser letales en la etapa embrionaria y rara vez se encuentran en individuos nacidos vivos. El inconveniente es que algunas de las trisomías autosómicas pueden estar asociadas con una edad materna avanzada 24, lo cual puede influir de manera directa ya que al parecer a mayor edad de las vacas aumenta la probabilidad de que se observen las aberraciones cromosómicas y con ello los abortos.
Como se puede constatar mediante esta investigación, la asociación entre la edad y el porcentaje de poliploidía es más bien baja e inversamente proporcional, coincidiendo con Waldner 24 en que las vacas a mayor edad mayor probabilidades de abortar y mayor porcentaje de ap/pp fueron vacas que tenían más de 10 años.
De acuerdo con el trabajo de Gowda et al 21 encontraron una mayor incidencia de aborto (13.13%) en vacas pluríparas en comparación con primíparas (2.38) de raza de Holstein Frisian. Algo similar se observó con respecto a los abortos encontrando un 16% y con edad de 7.4 años y en vacas jóvenes de 3.5 años y prácticamente sin presentar ap/pp.
Las causas del aborto son multifactoriales; puede ser infeccioso y no infeccioso. Las causas no infecciosas incluyen agentes físicos, genéticos, cromosómicos, nutricionales, químicos (fármacos, hormonales y otros) 26. Se coincide con el autor y sus colaboradores, ya que no todos los abortos tienen su causa posible en las aberraciones cromosómicas, al menos 2 de estos 18 abortos es el 7.14% de las vacas sin poliploidías. No se observó en ningún porcentaje aberración cromosómica aneuploide o poliploide, como para asumir que fue debido a ello. En cambio, en los 16 restantes se observaron aberraciones cromosómicas como la ap/pp, la cual puede ser causa de que se presenten aborto.
Estudios realizados con la técnica de citogenética clásica en productos abortados de manera espontánea, muestran anomalías cromosómicas que oscilan entre el 50 y 70%, reportándose que en los casos de edad materna avanzada es recurrente la pérdida de la gestación y fallas aún con técnicas de reproducción asistida, lo que podría indicar que la infertilidad puede ser causada por la producción aneuploide de gametos 27.
Gädicke y Monti 27 reportan que una variable intrínseca importante asociada con el riesgo de aborto es el tipo de raza, y describen que el hato de tipo Holstein tiene un mayor riesgo de aborto que los otros tipos. Esta investigación se realizó en vacas Holstein y con la característica y/o condición de que tuviera antecedente de aborto, aunque no se evaluó otra raza(s) como para contrastarla, a diferencia de Gädicke y Monti 27 se realizó el análisis cromosómico y se determinaron aberraciones cromosómicas como las ap/pp. En caso de ellos, solo determinaron las tasas de aborto al analizar los registros reproductivos 27.
Zhao et al. 11 manifiestan que la aneuploidía es la etiología más frecuente del aborto espontáneo y que los mecanismos moleculares esclarecen que las aneuploidías son importantes en el que experimentan el aborto espontáneo. Los resultados obtenidos coinciden con lo publicados por Hossein-Zadeh y Kohram 28 para la tasa de aborto en vacas multíparas (15.9%) para partos únicos con respecto los hallazgos encontrados en vacas Holstein con historial de aborto en el presente estudio con un 16%.
Albuja et al. 4 indican que la tasa de pérdida de preñez fluctúa entre 15% y 23% en hatos lecheros y su impacto económico estimado de perder una sola gestación en otros países es varíable, dependiendo de la edad gestacional en la que se produzca la muerte fetal, de 550 a 1280 dólares estadounidenses, dependiendo de la edad gestacional en la que se produzca la muerte fetal. Los resultados de esta investigación coinciden con los resultados de Albuja et al. 4 de su trabajo Impacto económico de la pérdida de gestación en un sistema de producción lechera intensiva 4.
La probabilidad de pérdida de la preñez se puede predecir ya sea estimando las concentraciones séricas de glicoproteínas asociadas a la preñez o progesterona, o diseñando un modelo estadístico para definir vacas con alta probabilidad de perder la gestación. Si se determinan las condiciones asociadas con un alto riesgo de pérdida de preñez, será posible reducir la incidencia corrigiendo estas condiciones y/o aplicando un enfoque terapéutico a las vacas de alto riesgo 19.
Quizás el cariotipo de embriones es un área que necesita un impulso de los avances tecnológicos y probablemente será el primero en beneficiarse de las tecnologías moleculares de próxima generación 24. La gametogénesis anormal en una madre fenotípicamente normal portadora de la rcp 12,27, da lugar a cuatro tipos de cigotos desequilibrados tras la fecundación con un espermatozoide de toro normal 24. Estos cigotos con translocaciones desequilibradas terminan como embriones abortados o con la muerte prematura de los recién nacidos 9.
En conclusión, el análisis cromosómico tradicional sigue siendo el método directo y rentable para detectar aberraciones cromosómicas como son las aneuploidías/poliploidías para identificar el efecto sobre el aborto en las vacas. A medida que avanza la edad, incrementa la probabilidad de que se presenten aberraciones cromosómicas y la correlación de estas posiblemente sea consecuencia de aborto. Se acepta la hipótesis de que las vacas con aberraciones cromosómicas como son las aneuploidías/poliploidías con historial de aborto son más susceptibles al aborto, prediciendo que existe la posibilidad de que una vaca aborte se incrementa en un 31.7% con cada año. Sin embargo, la p de este coeficiente es 0.384-no significativo. Por otra parte, la posibilidad de que una vaca aborte se incrementa en un 16.5% con cada incremento porcentual unitario del grado de poliploidía, y la p para este coeficiente es 0.029 que sí es significativo.