Introducción
Las Enfermedades Cardiovasculares (ECV) afectan calidad de vida, son la principal causa de muerte a nivel mundial1 ya que implican pérdida de 1,9 millones de vidas anuales en las Américas2, tres cuartas partes ocurren en países de bajos y medianos recursos3.
La reducción de las ECV es una de las metas en la región. La agenda de salud sostenible para las Américas 2018-2030, propone mediante prevención y tratamiento disminuir en un tercio la mortalidad prematura por enfermedades no transmisibles (ENT) incluyendo ECV4. Colombia, en el plan decenal de salud 2022-2031, presenta como meta para 2031 reducir la mortalidad prematura por ENT en un 25% en población de 30 a 70 años 5.
El tipo más común de ECV es la Enfermedad Arterial Coronaria (EAC), proceso patológico crónico dinámico secundario a la acumulación de ateromas en arterias coronarias epicárdicas6. Para la prevención primaria de EAC se requiere identificación de factores de riesgo para evitar la aparición de la enfermedad, se han reconocido factores como: hipertensión, diabetes mellitus tipo 2 (DM2), tabaquismo, dislipidemias, enfermedad renal crónica, obesidad y síndromes metabólicos 7)(8.
La aleatorización mendeliana (AM) es un tipo de estudio que usa variantes genéticas para evaluar relación causal entre un factor de riesgo y un resultado de interés 9, implica buscar variantes asociadas con la exposición y luego probar vinculación con los resultados, evitando factores confusores 10 gracias a esta metodología, se avanza en el estudio de relaciones entre diversas exposiciones modificables y la ECV11.
A partir de lo anterior, el presente artículo tiene como objetivo recopilar información de factores de riesgo de la EAC coronaria en población adulta evidenciados en estudios de aleatorización mendeliana.
Metodología
Se realizó búsqueda en las bases de datos de PubMed, EMBASE y BIREME. Los términos DeCS/Mesh en inglés utilizados en las estrategias de búsqueda aparecen en la tabla 1:
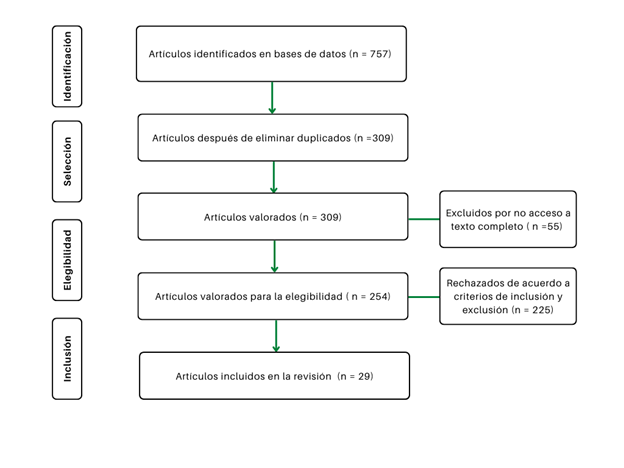
El resultado de la búsqueda arrojó 757 artículos, se incluyeron 29 artículos como aparece en la figura 1. No se encontraron estudios con información genética latinoamericana. Para elección de los artículos los criterios de inclusión fueron: (1) estudios mendelianos (2) con acceso completo gratis; y los criterios de exclusión: (1) no realizados en humanos (2) que estudiaran causalidad de un factor en una enfermedad diferente o adicional a la enfermedad arterial coronaria (3) AM bidireccional (4) escritos en lengua oriental.
Resultados
1. Metabolismo de los lípidos:
1.1 La apolipoproteína B (ApoB): se comprueba que es importante en la EAC, el estudio de Richardson et al. 12 resalta su presencia en cada partícula de lipoproteína aterogénica circulante, incluyendo aquellas que contienen colesterol de lipoproteína de baja densidad (LDL por sus siglas en inglés) y triglicéridos (TAG), reconociéndola como el rasgo lipídico predominante en el riesgo de EAC, en comparación con colesterol LDL y TAG, OR=1,92(IC 95%:1,31-2,81;P<0,001) en AM multivariable y OR=1,73(IC 95%:1,56-1,91;P<0,001) en AM univariable12 . En la misma línea, el estudio de Zuber et al. 13 incluso refiere a la ApoB como principal determinante lipídico de EAC por representar el número total de lipoproteínas derivadas del hígado.
1.2. El colesterol LDL y los TAG: tienen una relación causal clara con el riesgo de EAC, el estudio de Richardson et al. 12 muestra en AM univariable por aumento en 1 desviación estándar (DE) de colesterol LDL, OR=1,66(IC 95%:1,49 -1,86; P<0,001) y de TAG, OR=1,34(IC 95%:1,25-1,44; P<0,001). Así mismo, el estudio de Gordillo et al. 14, entre colesterol LDL, TAG y colesterol de lipoproteínas de alta densidad (HDL por sus siglas en inglés), presenta en AM multivariable al colesterol LDL, OR=1,53(IC 95 %:1,44 -1,62) y a los TAG, OR=1,09(IC 95 %:1,01-1,17) como factores de riesgo de EAC pero no manifiesta si es estadísticamente significativo. Sin embargo, el estudio de Wang et al. 15 ratifica relación causal, el aumento de 33,63 mg/dL de colesterol LDL, OR=1,80(IC 95%:1,63 - 1,99;P=7,74 x 10 −31 ), aumento de 90,68 mg/dL de TAG, OR=1,32(IC 95%:1,12-1,57;P=1,25x 10 −3 ) y aumento de 44,21 mg/dL de colesterol total, OR=1,35(IC 95%:1,21-1,50;P=1,89x 10 −8 ), presentando asociación de colesterol LDL, TAG y colesterol total con EAC.
El reconocimiento de TAG como factor causal de EAC es reciente, el estudio realizado por Ference et al. 16 encuentra relación entre menor riesgo de EAC con variantes reductoras de TAG en el gen de lipoproteína lipasa (LPL), OR=0,771(IC 95 %:0,741-0,802;P=3,9x 10 −38 ) y con variantes reductoras del colesterol LDL en el gen del receptor de LDL (LDLR por sus siglas en inglés), OR=0,773(IC 95%:0,747-0,801;P=1,1x 10 −46 ), sugiere mediante reducción de TAG y colesterol LDL, menor riesgo de EAC, con un impacto clínico similar a la disminución de 10 mg/dl de lipoproteínas que contienen ApoB.
Según el estudio de Jansen et al. 17, el incremento en 1 DE en colesterol LDL en <50 años tiene más impacto como factor de riesgo de EAC, OR=1,16(IC 95%:1,06-1,22) que en >70 años OR=1,02(IC 95%:0,97-1,08; P=4,0x 10 −5 )17 de manera que el control del colesterol LDL, en mediana edad tiene un papel relevante para prevenir EAC17. El mismo fenómeno se observa en TAG, mayor riesgo de EAC en <50 años que en >70 años, sin embargo, los resultados no fueron estadísticamente significativos (P=0,23).
1.3 Apolipoproteina C3 : el papel de variantes comunes y raras de Apolipoproteina C3 (APOC3) no es claro, en el estudio de Sjaarda et al. 18 presenta a la APOC3 como factor de riesgo de EAC, OR=1,17(IC 95:1,08-1,26;P=0,0000345). Sin embargo, el estudio de Goyal et al. 19 muestra no concluyente a la relación de variantes: comunes de APOC3 con aumento de TAG, por inhibir LPL, enzima encargada de hidrólisis de lipoproteínas de densidad intermedia, restos de quilomicrones y lipoproteínas de muy baja densidad ricas en TAG; ni raras de APOC3 con disminución de TAG como cardioprotector de EAC.
1.4.La proteína de transferencia de ésteres de colesterol (PTEC): ha sido estudiada, en la investigación de Blauw et al. 20, la PTEC favorece transferencia de ésteres de colesterol desde HDL hacia LDL, junto con transferencia de TAG desde LDL a HDL, contribuyendo al incremento de colesterol LDL, un aumento de 1 mcg/ml en concentración de PTEC se asocia con riesgo de EAC, OR=1,08(IC 95%:0,94-1,23). Sin embargo, el estudio no muestra si es estadísticamente significativo.
Por otro lado, la transferencia de TAG al HDL también puede ser factor de riesgo para EAC. El estudio de Prats-Uribe et al. 21 cuestiona el factor protector de HDL frente a EAC, porque fármacos como fibratos, niacina e inhibidores de PTEC que aumentan niveles de HDL, no logran disminuir riesgo de EAC. Sin embargo, el estudio de Wang et al.15 identifica incremento de 14,80 mg/dL de HDL, OR=0,89(IC 95%:0,82-0,97; P=5,29x 10 −3 ), como factor protector.
El estudio de Prats-Uribe et al. 21 manifiesta que el papel protector no depende solo del nivel del colesterol HDL sino también de la calidad y función de la molécula de colesterol HDL, las moléculas de HDL con mayor contenido de TAG sea transferido por PTEC o por envejecimiento de HDL que aumenta su composición de TAG, tienen una Apolipoproteína A1 (ApoA-1) en una conformación inestable, esta puede alterar la función de la molécula, el incremento de TAG, si el resto de variables se mantienen constantes, incrementa el OR en 1,150 de EAC (β=0,14;IC 95%:0,040-0,25;P=0,00684). El estudio muestra que el efecto protector de HDL también depende del tamaño de la molécula, cuando el colesterol no se transporta en moléculas grandes de HDL sino en moléculas más pequeñas e incluso de mediano tamaño, el riesgo de EAC se reduce, el HDL muy grande, si el resto de variables se mantienen constantes, aumenta el OR en 1,336 de EAC (β=0,29;IC 95%:0,17-0,40;P= 0.000000890), y tiene mayor OR de EAC en 1,08 que el colesterol en HDL de tamaño mediano (β=−0,076;IC 95%:-0,10−0,052;P=0,0000000000455).
Esto depende de las condiciones iniciales de salud, en estados patológicos prooxidativos y proinflamatorios, las moléculas pequeñas de HDL, pobres en lípidos y ricas en proteínas, podrían ser disfuncionales por modificaciones postraduccionales de las proteínas y su enriquecimiento en mediadores proinflamatorios, de esta manera se da importancia al nivel, calidad y funcionalidad de HDL para cumplir un efecto protector frente a la EAC21.
1.5. Omega 6: algunos estudios han atribuido al omega 6 como factor protector de EAC, sin embargo, el estudio de Liao et al. 22 muestra al metabolito circulante, como factor de riesgo, en específico, presenta cómo la alteración metabólica del ácido araquidónico (uno de los cuatro tipos principales de omega 6(, componente esencial de las membranas celulares, produce un incremento en la formación de eicosanoides proinflamatorios y disminuye la producción de factores antiinflamatorios, teniendo un papel en la regulación de la inflamación que puede asociarse con el riesgo de EAC.
Otro mecanismo propuesto involucra al ácido linoleico, otro tipo de omega 6, que promueve el estrés oxidativo, y la oxidación de colesterol LDL aumentando la aterogénesis. El estudio encontró una asociación causal de omega 6 sobre los factores causales de EAC: colesterol total, colesterol LDL y TAG, OR=1,239(IC 95%:1,125 -1,364; P = 0,000) y evidenció una asociación causal de omega 6 sobre la EAC, OR=1,418(IC 95%:1,087-1,851; P=0.050)(22).
Sobre este mismo factor el estudio de Park et al. 23 muestra el análisis de cada subtipo de omega 6 y su asociación causal con EAC, donde evidencia al ácido araquidónico como un factor de riesgo, OR=1,012(IC 95%:1,000-1,024; P=0,042), pero no todos los tipos de omega 6 fueron considerados factor de riesgo.
1.6. Lipoproteína (a): el estudio de Lamina y Kronenberg 24, evidencia una asociación causal entre reducción de 10 mg/dl de lipoproteína (a) con disminución en el riesgo de EAC, OR=0,941, mostrando como factor protector la reducción de la lipoproteína (a), el estudio expone a la disminución de 65,7 mg/dL (IC 95%:46,3-88,3) comparable con el beneficio clínico de reducir 38,67 mg/dL de colesterol LDL(24) pero no muestra si sus resultados son estadísticamente significativos. Sin embargo, Sjaarda et al. (18) en su investigación sí evidencia a la lipoproteína (a) como factor de riesgo de EAC, OR=1,22(IC 95%:1,20-1,25; P<1,00 x 10 −50 ). Por tanto, se requieren nuevos estudios para dilucidar la relación de TAG en mediana y avanzada edad, APOC3, PTEC, subtipos de omega 6 con la EAC para futuras recomendaciones.
2. Obesidad:
El estudio de Zhang et al. 25 presenta a la obesidad como factor de riesgo, debido a la enfermedad metabólica secundaria por adiposidad general que puede producir resistencia a la insulina, mayor actividad en el eje renina - angiotensina - aldosterona, inflamación subclínica y niveles bajos de péptido natriurético que pueden aumentar el riesgo de EAC.
El aumento en 1 DE del índice de masa corporal (IMC), OR=1,37(IC 95%:1,15-1,63; P= 0,000474), circunferencia de la cintura, OR=1,39(IC 95%:1,06-1,84; P=0,018) y relación cintura-cadera, OR=1,46(IC 95%:1,17-1,91; P=0,006), medidas relacionadas con la obesidad son factores causales de EAC25.
El estudio de Lv et al. 26 reafirma estas interacciones, plantea la asociación entre rasgos de adiposidad independientemente de la presión arterial, dislipidemia y rasgos glucémicos como factores de riesgo para desarrollar EAC, por mecanismos como inflamación de bajo grado, disfunción endotelial y respuestas vasodilatadoras endoteliales alteradas, el estudio muestra aumento en 1 DE en IMC, OR=1,50(IC 95%:1,30-1,75;P=1,3x 10 −8 ), índice cintura-cadera, OR=1,44(IC 95%:1,11-1,87;P=0,005) e índice cintura-cadera ajustado a IMC, OR=1,32 (IC 95%:1,08-1,62;P=0,009), respaldando a la obesidad general medida con el IMC y obesidad central medida con el índice cintura-cadera y el índice ajustado al IMC como factores de riesgo de EAC.
La relación del IMC puede no ser igual en toda la población, según el estudio de Jansen et al. 17, el aumento en 1 DE del IMC en < 50 años tiene un mayor impacto como factor de riesgo de EAC, OR=1,22 (IC 95%:1,17-1,28) que en > de 70 años, OR=1,02(IC 95%:0,97-1,08; P=3,4 x 10 −6 ). De manera que el control del IMC, tiene un papel relevante en la mediana edad.
Así mismo, se puede presentar una diferenciación por grupo poblacional, según la investigación de Wang et al. 15 por aumento del IMC de 4,8 kg/m2, en población asiática oriental el riesgo es mayor, OR=1,67(IC 95%:1,48-1,89;P=4,04x 10 −16 ), con respecto a la población europea, OR=1,38(IC 95%:1,29-1,47;P=2,20x 10 −20 ), este último estudio en cuanto a medidas antropométricas presenta al aumento de 9,3 cm en la estatura como factor protector de la EAC, OR=0,85(IC 95%:0,82-088;P=1,65x 10 −23 ).Nuevas investigaciones permitirán esclarecer el protagonismo de la estatura en la EAC.
3. Glucosa:
Para evaluar la relación de glucosa con el riesgo de la EAC el estudio de Burgess et al.27 utiliza a la hemoglobina A1C (HbA1c) porque representa el nivel promedio de la glucosa durante aproximadamente 120 días, que equivale a la vida media del eritrocito, evitando variabilidad dependiente del momento del registro de glucosa, cada aumento de 1 mmol/mol de HbA1c se asocia con un 11% más de riesgo de EAC, HR=1,11(IC 95%:1,05-1,18;P=2x 10 −4 )27.
Así mismo, en el estudio de Leong et al.28, el aumento de niveles de HbA1c por % de unidad se asocia con mayor riesgo de EAC, OR=1,61(IC 95 %:1,40-1,84; P=6,9x 10 −12 ). Por su parte, en el estudio de Wang et al. 15, un aumento en 0.60% de HbA1C, OR=1,26(IC 95%:1,19-1,34;P=8,26x 10 −14 ), la presencia de DM2, OR=1,10(IC 95%:1,07-1,13;P=1,48x 10 −11 ) y el incremento de 21.82mg/dL en la glucosa en ayunas, OR=1,23(IC 95%:1,13-1,35;P=4,48x 10 −6 ) se evidencian como factores de riesgo de EAC. La reducción de los niveles de glucosa en sangre y con ello prevención de DM2 hacen parte de las estrategias para evitar la EAC.
4. Tabaquismo:
El estudio de Chen et al. 29 expone a la nicotina como causante de daños del sistema cardiovascular al incrementar radicales libres y sustancias tóxicas que pueden afectar la pared arterial, mediante oxidación de lípidos, proliferación de células del músculo liso vascular, expresión de factores inflamatorios y trombogénesis, la investigación revela que en pacientes con diabetes el inicio del hábito de fumar es un riesgo de EAC, OR=1,322(IC 95 %:1,114-1,568; P=0,001). De manera que en pacientes con diabetes la prevención de EAC incluye evitar el inicio del tabaquismo.
5. Presión arterial (PA):
En el estudio de Wang et al.15 se encuentra aumento de 18,67 mmHg en la presión arterial sistólica, OR=1,87(IC 95%:1,66-2,10; P=1,74x 10 −25 ) e incremento de 10,14 mmHg en presión arterial diastólica, OR=1,83(IC 95%:1,59-2,10; P=9,47x 10 −18 ), se presentan como factores de riesgo.
El aumento de PA puede tener un efecto diferente según la edad, el estudio de Jansen et al. 17 evidencia mayor riesgo de EAC, con incremento de PA en < 50 años que en > 70 años, pero los resultados no fueron estadísticamente significativos (P = 0,22)(17).El estudio de Gill et al.30 presenta riesgo de EAC a mayor edad con un aumento de PA en mediana edad, medida por un incremento de 10 mmHg en la presión arterial media en ≤55 años, OR=1,43(IC 95%:1,16-1,77;P=0,001); teniendo la presión arterial elevada un efecto acumulativo de por vida sobre el riesgo de EAC nuevos estudios esclarecerán esta relación, no obstante el control de PA durante toda la vida y no centrada solo en edades avanzadas puede hacer parte de la prevención de EAC.
6. Hormona paratiroidea sérica:
El estudio de Melhus et al. 31 no presenta al aumento en las concentraciones de hormona paratiroidea sérica, reguladora de la concentración de calcio y fósforo extracelular, como factor de riesgo de EAC, OR=1,01(IC 95%:0,93-1,09; P=0,88) la asociación evidenciada no es estadísticamente significativa.
7. Niveles de fosfato sérico:
No solo la hiperfosfatemia causa EAC, el estudio de Campos et al.32 muestra niveles de fosfato sérico aumentados pero dentro de rangos normales como factor de riesgo, principalmente en hombres, asociado al papel del fosfato en calcificación arterial, por inducción activa de diferenciación osteoblástica de células vasculares o deposición pasiva de fosfato cálcico, el estudio presenta incremento de niveles de fosfato sérico en 1 DE, es decir 0,16 mmol/L=0,49 mg/dL, en ausencia de: Hiperfosfatemia (>1.45 mmol/L=4.5 mg/dL), enfermedad renal crónica definida como tasa de filtración glomerular <60 ml/min por 1,73 𝑚 2 y ECV, como factor de riesgo al aumentar el OR de EAC en 3,421 veces más (β =1,23;IC 95%:0,17-2,28;P=0,023).
8. La enfermedad del hígado graso no alcohólico (EHGNA):
La asociación casual entre la EHGNA y EAC fue estudiada por Ren et al 33. La investigación enuncia a la EHGNA como principal causa de enfermedad hepática crónica a nivel mundial, secundaria a mecanismos como aumento del flujo de ácidos grasos libres y mayores tasas de lipogénesis de novo, sin embargo, en la mayoría de los casos con ausencia en la alteración en la vía de secreción de VLDL.
El estudio muestra a la EHGNA predicha genéticamente después de la exclusión de variantes genéticas implicadas en la secreción alterada de VLDL como factor de riesgo para EAC, incluso cuando la EHGNA es confirmada por biopsia, OR=1,113(IC 95%:1,041-1,189), pero no presenta si es estadísticamente significativo.33 . Investigaciones adicionales pueden reafirmar esta relación causal.
9. Síndrome de ovario poliquístico (SOP):
El estudio de Simons et al. 34 frente al SOP, principal síndrome en mujeres pre menopaúsicas, no muestra relación causal con EAC, OR=0,99(IC 95%:0,89-1,11; P=18,5), asocia una posible relación entre un mayor IMC con el SOP y con la EAC, los resultados expuestos no son estadísticamente significativos por lo que no son concluyentes.
10. Globulina fijadora de hormonas sexuales (SHBG por sus siglas en inglés) y testosterona:
El estudio de Li et al. 35 investiga la asociación de SHBG, una glicoproteína transportadora de testosterona que reduce su fracción libre al unirse a ella y a la testosterona una hormona que se reduce en los hombres con la edad por disminución en la función suprarrenal y testicular, con la EAC. En AM univariable evidencia que el aumento de 1 DE de SHBG, disminuye el riesgo de EAC en aproximadamente 14%, OR=0,86(IC 95%:0,76-0,97;P=0,02), y el aumento de testosterona total (incluye testosterona libre y testosterona unida a proteínas) disminuye el riesgo de EAC aproximadamente 8 %, OR=0,92(IC 95%:0,85-0,99;P=0,03), en AM multivariable no es estadísticamente significativo (P=0,053).
11. Filoquinona circulante y Proteína Gla de la Matriz (MGP por sus siglas en inglés) inactiva:
El estudio de Zwakenberg et al.36 expone a la filoquinona y menaquinona como formas biológicamente activas de vitamina K, la cual activa a la MGP, niveles bajos de MGP inactiva, es decir MGP desfosforilada y no carboxilada (dp-ucMGP por sus siglas en inglés), indica niveles más altos de ingesta de vitamina K a largo plazo, refleja biodisponibilidad de ingesta de filoquinona y menaquinona durante semanas.
Se ha descrito que la vitamina K tiene un papel beneficioso en la prevención del riesgo de ECV, el estudio presenta por cada disminución de 10μg/L en dp-ucMGP reducción en el riesgo de EAC, RR=0,96(IC 95%:0,93-0,99;P=0,02), no encontró diferencia entre las concentraciones circulantes de filoquinona y el riesgo de EAC, RR=1.00(IC 95%:0,98-1,04) sin embargo no presenta si estadísticamente significativo, se requieren más estudios para el esclarecimiento del papel de filoquinona y la intervención de la menaquinona en la EAC36.
12. Antioxidantes circulantes derivados de la dieta:
Según la investigación de Luo et al. 37 pese a que los antioxidantes eliminan radicales libres contrarrestando al estrés oxidativo y con ello daño macromolecular y disfunción endotelial, la mayoría de los niveles absolutos de antioxidantes derivados de la dieta no tienen relación protectora frente a la EAC, por aumento de unidad de b-caroteno, OR=1,03(IC 95%:0,97-1,10), de retinol, OR=0,94(IC 95%:0,63-1,10), de 1 mg/dl de licopeno, OR=1,02(IC 95%:0,99-1,06) y 1 mmol/l de ascorbato, OR=1,00(IC del 95 %: 0,99 a 1,00), esta investigación no muestra si los resultados fueron estadísticamente significativos.
13. Aminoácidos:
El papel protector de la glicina en EAC no es claro, en el estudio de Jia et al. No evidencia relación protectora de los alelos que incrementan la glicina y un menor riesgo de EAC, pese a que se ha atribuido a la glicina una reducción en los niveles de plaquetas, en la agregación plaquetaria y un efecto antihipertensivo(38). Se requieren nuevos estudios.
La investigación de Xu et al., muestra que la homocisteína podría afectar la pared arterial mediante daño y disfunción endotelial y podría aumentar la trombogenicidad, sin embargo, en personas con diabetes el estudio no evidencia asociación causal entre homocisteína y EAC, OR=1,14(IC 95%:0,82-1,58; P=0,43) no es estadísticamente significativo, esto no respalda relación causal39. Pero nuevas investigaciones permitirán esclarecer la asociación de la homocisteína derivados de la dieta en la EAC.
14. Ácido úrico:
El estudio de Wang et al 15 identifica un aumento de 1.35 mg/dL de ácido úrico como factor de riesgo de EAC en los asiáticos orientales, OR=1,27(IC 95%:1,13-1,42;P=3,27x 10 −5 ), lo que puede darse por mayor prevalencia de hiperuricemia y gota en asiáticos orientales con respecto a europeos, el ácido úrico podría implicar disfunción endotelial, proliferación de células del músculo liso vascular e inflamación que se relacionan con mecanismos causales de EAC.
15. Marcadores inflamatorios:
El estudio de Zhao et al. 40 investiga la asociación de glóbulos blancos (GB) con EAC, los presenta como marcadores inflamatorios agudos o crónicos y reconoce a la aterosclerosis como trastorno inflamatorio crónico complejo mediado por inmunidad tanto adaptativa como innata, en el que leucocitos pueden interactuar con el endotelio arterial estructuralmente intacto pero disfuncional, y desarrollar un ambiente proinflamatorio y protrombótico y posterior a disfunción endotelial generar un mayor reclutamiento de leucocitos, lípidos, células de músculo liso, fibroblastos y plaquetas en la pared arterial, que provoca proliferación de la íntima y formación de ateroma.
El estudio expone que las lesiones ateroscleróticas y trombos arteriales tanto en humanos como en ratones contienen estructuras de las trampas extracelulares de neutrófilos (NET) las cuales tienen proteínas de origen nuclear, granular y de membrana celular, así como cromatina, de manera que cuando los neutrófilos entran contacto con colesterol, generan NET, y estos NET desencadenan liberación de citoquinas de los macrófagos, activando células T colaboradoras estimulando así reclutamiento de células inmunes para conformación del ateroma40.
El recuento de GB se asocia con mayor riesgo de EAC, OR=1,07(IC 95%:1,01-1,14) y el recuento de neutrófilos también, OR=1,09(IC 95%:1,02-1,16) los dos casos estadísticamente significativos (P<0,05). No hubo una asociación significativa entre monocitos, basófilos, linfocitos, eosinófilos y EAC (P>0,05).40 El estudio de Wang et al.15 no demuestra asociación significativa entre GB, neutrófilos u otro leucocito en incluso Proteína C Reactiva con EAC en población europea o asiática oriental.
De otra parte el estudio de Sjaarda et al. 18 muestra otros marcadores inflamatorios y factores de riesgo de EAC presenta al Factor- 1 estimulante de colonias de macrófagos (CSF-1 por sus siglas en inglés), OR=1,18(IC 95%:1,08-1,30;P=0.000207) y al factor- 1 derivado de células estromales (SDF‑1 por sus siglas en inglés o CXCL12), OR=1,69(IC 95%:1,40-2,05;P=6,16x 10 −8 ), la investigación manifiesta que CSF - 1 participa en reclutamiento y supervivencia de monocitos en el ateroma, así mismo CXCL12 se ha expresado en células del músculo liso y células endoteliales de la placa aterosclerótica. Nuevas investigaciones permitirán esclarecer la relevancia de los procesos inflamatorios en EAC.
16. Glóbulos rojos (GR):
El estudio de Wang et al. 15 identifica incremento de 1.23 g/dL en hemoglobina, OR=1,28 (IC 95%:1,11-1,47; P=4,29x 10 −5 ) y aumento del 3.53% en el hematocrito, OR=1,31(IC 95%:1,16-1,48; P=4,59x 10 −8 ) como riesgos para EAC, secundario a posible vasoconstricción por eliminación de óxido nítrico por la hemoglobina; y estimulación o activación de adhesión plaquetaria por aumento del hematocrito.
También presenta un incremento de 40,94× 10 4 /μL de GR como factor de riesgo de EAC en población asiática oriental, OR=1,21(IC 95%:1,10-1,33; P=9,46x 10 −5 ), por la posible participación de GR normales en generación de trombina y el efecto de su elevación en trombosis arterial y venosa por aumento en viscosidad sanguínea. El estudio aclara que la anemia puede exacerbar las complicaciones cardiovasculares y sugiere una interpretación cautelosa de los extremos de los índices de GR15. Estos resultados dan una nueva perspectiva a futuras medidas de prevención de EAC.
Conclusiones
Esta revisión encuentra mayor aprobación en los estudios de AM a la DM2 y al inicio del hábito de fumar en pacientes con diabetes y al aumento en: ApoB, lipoproteína (a), colesterol LDL, TAG, colesterol total, HDL rica en TAG, moléculas grandes de HDL, obesidad, glicemia, presión arterial, niveles de fosfato sérico, hemoglobina, hematocrito, CSF-1 y CXCL12 como factores de riesgo de la EAC. Por lo anterior, se invita a la realización de revisiones sistemáticas que permitan esclarecer estos resultados; y se sugiere nuevos estudios con información genética colombiana para respaldar los factores de riesgo aquí presentados, teniendo en cuenta que ninguno de los estudios utilizó información genética latinoamericana, limitando su extrapolación.