Introducción
El bagazo de manzana resultante de la extracción del jugo, utilizado en el proceso industrial de producción de sidra, es considerado como residuo agroindustrial. Su producción fluctúa entre el 15% y 30% del total de fruta procesada (Vicente et al., 2005), que para el 2018 en el municipio de Huejotzingo, en el estado de Puebla, México, fue de 18,5 toneladas de manzana empleada en la producción de sidra (Servicio de Información Aagroalimentaria y Pesquera [SIAP], 2019). Estos desechos han servido como fuente potencial de azúcares, lípidos, carbohidratos, ácidos minerales, fibras dietarías, compuestos inorgánicos, fitoquímicos, incluidos fenoles, carotenoides y tocoferoles (Lin et al., 2013).
Los fitoquímicos representan una oportunidad prometedora como compuestos altamente demandados por los sectores alimentario, farmacéutico y cosmético (Đilas et al., 2009; Ruales- Salcedo et al., 2017). Los compuestos fenólicos son compuestos aromáticos hidroxilados que poseen uno o más anillos aromáticos con uno o más grupos hidroxilo, que incluyen una gran cantidad de subclases, como flavonoides, ácidos fenólicos, estilbenos, lignanos, taninos y polifenoles oxidados, entre otros (Peñarrieta et al., 2014), que son utilizados para el tratamiento y prevención de diversas enfermedades como cáncer, diabetes, trastornos cardiovasculares y daño hepático; asimismo, presentan actividad antimicrobiana y antioxidante (Baydar & Baydar, 2013). Los antioxidantes en la dieta humana son de gran interés como posibles agentes protectores para reducir el daño oxidativo causado por radicales, el cual puede estar relacionado con el envejecimiento y enfermedades como la aterosclerosis, el cáncer y la artritis reumatoide (Mau et al., 2002).
Uno de los procesos para la obtención de compuestos antioxidantes suele involucrar procesos de fermentación en estado sólido (FES) (Barrios-González & Mejía, 1996), sobre un soporte sólido, con un bajo contenido de humedad que ocurre en estado natural (Nigam & Singh, 1994; Robinson et al., 2002). Recientemente la FES ha sido empleada para generar polifenoles que contribuyan al enriquecimiento de alimentos fermentados o bien en la hidrolisis de diversos materiales lignocelulósicos para la producción de compuestos fenólicos con actividad antioxidante de importancia industrial (de Boer et al., 2016).
La posibilidad de utilizar diversos residuos agroindustriales como materia prima en la producción de FES denota la posibilidad de aprovechar desechos, que al ser recursos bióticos no explotados pueden fungir como soporte o sustrato en la producción de metabolitos secundarios con valor agregado a bajos costos de producción (Rodríguez Couto, 2008).
La demanda de compuestos bioactivos con actividad antioxidante, obtenidos de fuentes naturales o por la aplicación de bioprocesos, como la FES, ha propiciado el interés de la industria alimenticia, para desarrollar alimentos funcionales, y la farmacéutica, para la obtención de nuevos fármacos (Andrade-Damián et al., 2019; Salinas-Flores et al., 2019).
Martínez-Ávila et al. (2013) describen las ventajas biotecnológicas de la fermentación de residuos agroindustriales para la producción de fitoquímicos con alta actividad antioxidante y con valor comercial agregado, tales como ácidos orgánicos, proteínas, alcohol, enzimas y compuestos fenólicos (Mamma et al., 2008). Además es una técnica eficiente y económica, debido a la alta especificidad de las reacciones que se llevan a cabo en el sistema y al uso de residuos vegetales de baja o nula utilidad como soporte y fuente de nutrientes para los microorganismos que se emplean (Martins et al., 2011; Soccol et al., 2017), por lo que se puede obtener también valor agregado de esos residuos (Pandey, 2003).
El uso de residuos para la producción de hongos propicia el desarrollo sustentable por el aprovechamiento máximo de recursos y disminuye la disposición de residuos orgánicos (Piña- Guzmán et al., 2016). Ya que la mayoría de los residuos agroindustriales se degradan lentamente debido a su naturaleza lignocelulósica, rica en celulosa, hemicelulosa y lignina, puede provocar contaminación ambiental y daños adversos a la salud si no se someten a un adecuado proceso de explotación (Vargas & Pérez, 2018). El cultivo de setas es un sistema biotecnológico eficiente, pues logra altos rendimientos y buena productividad con pocos controles ambientales. Además, su tiempo de crecimiento es corto, con un amplio intervalo de temperaturas y la posibilidad de usar diversos materiales lignocelulósicos como sustratos, que son fuente de carbono para su crecimiento y para la obtención de compuestos de interés biológico como enzimas y fitoquímicos (Piña-Guzmán et al., 2016; Ramírez-Carmona & Muñoz-Blandón, 2016).
La composición química de cada residuo agroindustrial varía según la especie, por lo que es indispensable estudiar las propiedades fisicoquímicas del bagazo de manzana para conocer la viabilidad del desecho para el crecimiento y desarrollo del hongo seta. Por lo anterior, este trabajo tuvo como objetivo determinar la adaptación de desarrollo de Pleurotus ostreatus en el bagazo de manzana, así como la cantidad de compuestos fenólicos totales y la actividad antioxidante de extractos de metanol obtenidos durante la fermentación sólida por 28 días del residuo de manzana inoculado con la cepa P. ostreatus.
Materiales y métodos
La metodología utilizada en este trabajo describe, a partir de la obtención del residuo agroindustrial, el análisis proximal y los análisis químicos realizados para determinar los compuestos fenólicos y la actividad antioxidante generados durante su fermentación en estado sólido por el hongo Pleurotus ostreatus (figura 2).
Obtención y tratamiento del residuo agroindustrial
Se colectaron 50 kg de bagazo de manzana (Malus domestica Borkh., var. panochera) obtenida por el método de cuarteo, de acuerdo con la Norma Mexicana NMX-AA-15-1985 (Diario Oficial de la Federación [DOF], 1985), procedentes de la industria sidrera de la localidad de Huejotzingo, Puebla, México. Este bagazo se escaldó a una temperatura de 70 °C por 10 minutos; posteriormente, se deshidrató en un horno de aire forzado (Lumistell mod HTP 72) a 70 °C durante seis horas, y se pulverizó en un procesador de alimentos (Hallde mod CC 32) hasta obtener un tamaño de partícula de 0,250 mm; por último, se conservó en una bolsa cerrada herméticamente para su posterior análisis.
Composición química de bagazo de manzana
Al residuo se le realizó el análisis químico proximal: contenido de humedad, cenizas, proteínas por el método Kjeldahl, extracto etéreo, carbohidratos totales, fibra cruda y fibra dietaría total, que es la sumatoria de la fibra insoluble y la fibra soluble (Helrich, 1990). El contenido de lignina fue obtenido por el método de Klason, calculado a través de la metodología de Schwanninger y Hinterstoisser (2002), mientras que los porcentajes de hemicelulosa y celulosa fueron determinados a través de las cantidades de fibra detergente neutra (FDN) (Horwitz, 2006) y fibra detergente ácida (FDA) (Horwitz, 2006). El análisis se determinó por triplicado.
Microorganismos utilizados en la fermentación
Se utilizó la cepa de Pleurotus ostreatus (Jacq. ex Fr.) P. Kumm. (Fungi: Agaricomycetes, Agaricales: Pleurotaceae), obtenida en el Departamento de Investigación en Ciencias Agrícolas del Instituto de Ciencias de la Benemérita Universidad Autónoma de Puebla. La cepa fue activada en agar papa dextrosa (Bioxon) en cajas Petri e incubada a 25 °C por 72 h.
Fermentación en estado sólido
Se utilizaron 10 g de bagazo de manzana con 80% de humedad y pH de 6,5 por cada biorreactor. Los biorreactores de vidrio con dimensiones de 9,7-2,6 cm se esterilizaron en una autoclave (AESA mod CV300) a 121 °C y 15 psi durante 45 minutos. Posteriormente, se determinó la cantidad de P. ostreatus, equivalente a 3 mg de biomasa en peso seco, y se introdujo en los biorreactores por triplicado para su fermentación en una estufa (Ríos Rocha mod 070) a 25 °C, para ser evaluados los días 0, 7, 14, 21 y 28 de la fermentación.
Obtención de extractos
Después del tiempo de fermentación, se les adicionó 12 mL de metanol al 100%. Posteriormente, se sometieron a agitación en un Shaker (Orbital Shaker Leex KJ-201BD) a 80 rpm durante 1 h; luego, se filtraron y se centrifugaron (Centrifuga Hermle Z 200A) a 750 rpm por 12 min, y el sobrenadante se almacenó en tubos Eppendorf a -20 °C para su posterior análisis.
Cuantificación de compuestos fenólicos totales (CFT)
Se utilizó el método propuesto por Singleton y Rossi (1965) con algunas modificaciones. A 50 μL de extracto se le agregaron 250 μL de reactivo de Folin-Ciocalteu 50%; se agitó y se dejó reposar en oscuridad durante 8 min. Posteriormente, se adicionó 1,25 mL de CaCO3 al 5% (m/v); finalmente, se dejó reposar por 30 min en oscuridad a temperatura ambiente. La absorbancia se leyó a 725 nm en un espectrofotómetro UV-Vis (Jenmay 7305). Se utilizó una curva de calibración de ácido gálico (Sigma Aldrich, CAS 149-91-7) (y = 1,9196x + 0,1124, R2 = 0,977) en un intervalo de 0-0,3 mg/mL. Los resultados se expresaron en miligramos equivalentes de ácido gálico/gramos sustrato en base seca (mg de EAG/g sustrato BS).
Determinación de actividad antioxidante por método de 1,1-difenil-2-picrilhidracilo (DPPH•)
Se empleó el método desarrollado por Brand-Williams et al. (1995) con modificaciones. Se tomaron 10 μL de extracto obtenido de la FES; se agregaron 990 μL de DPPH (Sigma Aldrich, CAS 1898-66-4) 0,188 mM. La mezcla se homogenizó y se mantuvo en oscuridad durante 30 min a temperatura ambiente. Posteriormente, se midió la absorbancia a 517 nm en un espectrofotómetro UV-Vis (Jenmay 7305), siendo A0 la absorbancia del control (metanol) y A1 la absorbancia del extracto (muestra). Los resultados se expresaron como la concentración inhibitoria al 50% (CI50), para lo cual se calculó el porcentaje de inhibición de cuatro diferentes concentraciones, con el fin de obtener una curva de regresión lineal. El cálculo del porcentaje de inhibición se realizó de acuerdo con la siguiente ecuación:
Determinación de actividad antioxidante por método de 2,2’-azino-bis (3- etilbenzotiazolina)-6 sulfonato de amonio (ABTS+)
Se utilizó el método propuesto por Re et al. (1999). Para ello, se tomaron 0,0033 g de persulfato de potasio y 0,0194 g de reactivo ABTS (2,2'‐azinobis‐(3‐etilbenzotiazolin‐6‐ácido sulfónico) (Sigma Aldrich, CAS 30931-67-0) en 5 mL de agua destilada. La mezcla se agitó y se colocó en oscuridad durante 16 h a temperatura ambiente. Después de transcurrido este tiempo, se realizó una mezcla con etanol absoluto con el radical ABTS+ hasta obtener una absorbancia de 0,70 ± 0,02 a 754 nm. Tras esto, se agregaron 3.920 μL de la solución de radical ABTS y se registró la absorbancia inicial (Ai); luego, se adicionaron 80 μL de extracto, se mezclaron y al término de 7 min se registró la absorbancia final (Af) con el uso de un espectrofotómetro UV- Vis (Jenmay 7305). Los resultados fueron expresados como la concentración media inhibitoria (CI50), para lo cual se calculó el porcentaje de inhibición aplicando la siguiente ecuación:
Análisis estadístico
En el análisis químico proximal del bagazo de manzana se hicieron tres repeticiones de cada análisis realizado. El diseño experimental consistió en definir un bagazo experimental (1 nivel), un solvente para la extracción (1 nivel) y cinco periodos de toma de muestra durante la FES, correspondientes a los días 0, 7, 14, 21 y 28 (cinco niveles). Las determinaciones se hicieron por triplicado (tres repeticiones) de cada una de las muestras obtenidas. Los resultados se examinaron utilizando el paquete estadístico Statistical Analysis System (SAS) versión 9.0 (SAS Institute Inc, 1999), donde se realizaron las pruebas de análisis de varianza (ANOVA) y prueba de medias (Tukey α = 0,05). Los valores se expresaron en media y desviación estándar.
Resultados y discusión
Composición química de bagazo de manzana
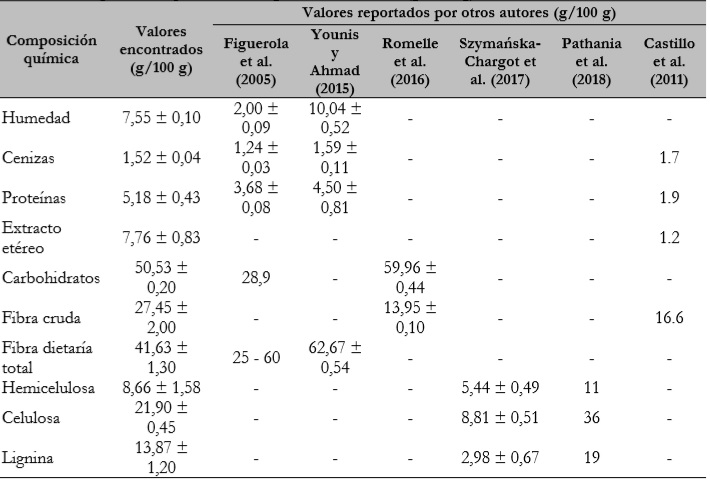
Los resultados del análisis químico proximal del bagazo de manzana se expresaron en g/100 g (tabla 1). El porcentaje de humedad en el bagazo fue adecuado, ya que concentraciones menores a 10% previenen el crecimiento y reproducción de microorganismos responsables de la descomposición y reducen las reacciones de deterioro (Afolabi, 2014; Sandulachi, 2012). El contenido de cenizas, proteína, extracto etéreo, carbohidratos totales, fibra cruda y fibra dietaria total presentaron valores similares a los reportados por Figuerola et al. (2005) en pulpa de manzana, Younis y Ahmad (2015) en residuo de manzana y Romelle et al. (2016) en cáscara de manzana. De estos parametros, cabe destacar que los carbohidratos poseen las propiedades biológicas de favorecer reacciones metabólicas; la concentración de carbohidratos presente en el bagazo de manzana puede ser considerada apropiada, ya que materiales lignocelulosicos con alto contenido de carbohidratos generan una adecuado crecimiento y desarrollo del hongo Pleurotus (Zhou et al., 2016).
El residuo de manzana es un alimento con una buena fuente de fibra dietaria, debido a que su contenido oscila entre 25-60 g/100 g de materia seca (Figuerola et al., 2005; Garau et al., 2007). La fibra dietaria se compone de complejos carbohidratos de las paredes celulares como celulosa, hemicelulosa, pectinas y lignina, así como de polisacáridos intracelulares que no son hidrolizados por las enzimas digestivas de los humanos (Raghavendra et al., 2006). Las concentraciones de hemicelulosa, celulosa y lignina fueron similares a las reportadas por Szymańska-Chargot et al. (2017) y Pathania et al. (2018). Mejía Giraldo et al. (2007) y Rojas-González et al. (2019) mencionan que los residuos con contenidos importantes de celulosa y hemicelulosa superiores de 19,09% en base seca pueden ser utilizados como sustrato potencial para la extracción de metabolitos secundarios. La lignina, a pesar de encontrarse en niveles bajos en frutas y verduras, es un polímero fenólico formado por tres precursores monoméricos principales: alcohol p- cumarílico, alcohol sinapílico y alcohol coniferílico; por lo tanto, se le puede relacionar con la actividad antioxidante de los compuestos fenólicos (Vicente et al., 2009; Zheng et al., 2009).
La presencia de celulosa, hemicelulosa y lignina en el bagazo de manzana propicia la adaptación de Pleurotus, que se caracteriza por ser un hongo saprófito que descompone los subproductos de las plantas agrícolas, degradando los residuos de lignocelulosas como fuente de nutrición y convirtiéndolos en biomasa rica en proteínas (Savoie et al., 2019). Esto proporciona una forma económica y respetuosa con el medio ambiente de convertir los desechos agroindustriales en materiales potencialmente valiosos que se pueden utilizar en la fabricación de papel, producción de combustible de biomasa, compostaje, alimentación humana y animal, entre otros (Besufekad et al., 2020; Sánchez, 2009). Incluso recientemente se han identificado ventajas de los desechos agrícolas lignocelulósicos utilizados como sustratos en FES para la obtención de enzimas y metabolitos secundarios (Ibarra-Cantún et al., 2020; Wang et al., 2019).
Compuestos fenólicos totales (CFT)
La concentración mayor de compuestos fenólicos totales (CFT) se presentó en el día cero: 0,87 ± 0,12 mg de EAG/g sustrato BS; sin embargo, este contenido corresponde a los metabolitos secundarios del residuo de manzana, que en ese momento no ha iniciado el proceso de fermentación. Este resultado fue bajo en comparación con otros experimentos que señalan concentraciones de hasta 52,2 ± 4,80 mg de EAG/g sustrato BS en extracto de metanol del residuo de manzana (Peschel et al., 2006). Conforme avanza el tiempo de fermentación, el contenido de CFT dismuye, y fue a partir del día 21, con una concentración de 0,39 ± 0,07 mg de EAG/g sustrato BS hasta el día 28 con una concentración de 0,48 ± 0,02 mg de EAG/g sustrato BS, cuando se muestra una estabilización del contenido de CFT y un aumento en el día 28 de fermentación (figura 3). Esto mostró que la biosíntesis de compuestos fenólicos inició a partir del día 21, ya que la producción de compuestos bioactivos se realiza después de la trofofase, es decir, al inicio de la fermentación; el hongo toma los nutrientes necesarios para su crecimiento y adaptación a su medio y es hasta el proceso de idiofase, donde no existe proliferación celular, cuando presenta la biosíntesis de metabolitos secundarios, los cuales ayudan a la cepa de Pleurotus a permanecer y sobrevivir en el residuo (Liao et al., 1995).

Fuente: Elaboración propia
Figura 3 Compuestos fenólicos totales de la fermentación en estado sólido de Pleurotus ostreatus en residuos de manzana (mg EAG/g sustrato BS). Letras diferentes en cada columna indican diferencia significativa Tukey (p ≤ 0,05).
La biosíntesis de CFT en residuos de piña y arroz, a partir de la fermentación sólida, reportó valores similares a los encontrados en esta investigación: concentraciones de 0,179- 0,650 mg de EAG/g sustrato BS (Rashad et al., 2016). Sin embargo, en residuos de manzana bajo fermentación por Phanerochaete chrysosporium (Burdsall) (Fungi: Basidiomycota, Polyporales, Phanerochaetaceae), se reportaron concentraciones más altas: 4,6- 16,12 mg de EAG/g sustrato BS en extractos con solventes de distinta polaridad (Ajila et al., 2011).
Actividad antioxidante
La actividad antioxidante tuvo el mismo comportamiento en el tiempo cero que el contenido de CFT, donde la actividad antioxidante fue mayor: 19,47 ± 0,57 mg/mL, debido a que el residuo de manzana manifestó la mayor concentración de compuestos fenólicos. Posterior al inicio de la fermentación, la capacidad de los compuestos fenólicos para inhibir la formación de radicales DPPH se observó a partir del día 21 con una concentración de 342,10 ± 1,08 mg/mL, llegando a los 232,32 ± 5,33 mg/mL en el día 28; esta disminución se debe a una mayor actividad antioxidante del extracto de metanol, es decir, un valor de CI50 más bajo indica una mayor actividad antioxidante, ya que se require una menor concentración de antioxidantes necesarios para reducir la cantidad inicial del radical DPPH en un 50% (Shrikanta et al., 2015) (figura 4).

Fuente: Elaboración propia
Figura 4 Capacidad inhibitoria al 50% de DPPH de la fermentación en estado sólido de Pleurotus ostreatus en residuos de manzana (mg/mL). Letras diferentes en cada columna indican diferencia significativa Tukey (p ≤ 0,05).
En la prueba ABTS se presentó un intervalo de 77,29-325,44 mg/mL de residuo (figura 5). Además, se observó la misma tendencia del CI50-DPPH, una mayor actividad antioxidante en el día 0, y hasta el día 21 y 28 se volvió a manifestar dicha actividad con concentraciones de 323,02 y 210,08 mg/mL, respectivamente.

Fuente: Elaboración propia
Figura 5 Capacidad inhibitoria al 50% de ABTS de la fermentación en estado sólido de Pleurotus ostreatus en residuos de manzana (mg/mL). Letras diferentes en cada columna indican diferencia significativa Tukey (p ≤ 0,05).
El incremento de la actividad antioxindate al final de la fermentación se debió a la producción de compuestos fenolicos totales que se generan después de la trofofase. Además, Dey et al. (2016) mencionan que los hongos degradan primero la lignina a través del efecto de las enzimas lignolíticas (lignina peroxidasa, manganeso peroxidasa y lacasa), y luego pueden acceder a polisacáridos ricos en energía para su metabolismo y continuar con su crecimiento. La hidrólisis enzimática de los conjugados fenólicos no solo libera fenólicos libres, sino que también produce un peso molecular más bajo que contribuye a aumentar la actividad antioxidante (Ferreira-Leitão et al., 2017; Verduzco-Oliva & Gutierrez-Uribe, 2020). Aunado a lo encontrado por Cai et al. (2012), quienes manifestaron que los compuestos fenólicos determinaron la capacidad antioxidante en residuos tratados a partir de la fermentación sólida, los contenidos tanto en compuestos fenólicos como en la capacidad antioxidante pueden variar por diferentes factores ecológicos: clima, cantidad lumínica, etapa de desarrollo, procesamiento y almacenamiento del material vegetal o residuo, así como las condiciones de extracción, el tiempo, el método, la temperatura de extracción, el tipo de solvente y la susceptibilidad a la degradación (Ignat et al., 2011; Palomino García et al., 2015; Zambrano et al., 2018). Por esta razón, es necesario seguir investigando acerca de la obtención de metabolitos secundarios, mediante la fermentación en estado sólido a partir de residuos lignocelulósicos.
Conclusiones
El bagazo de manzana es una alternativa de aprovechamiento para las industrias alimentaria y farmacéutica, debido a la creciente demanda de compuestos fenólicos, dando así un uso a este residuo que contribuye a la sostenibilidad y a la conservación del medio ambiente. El análisis químico proximal arrojó que el contenido de carbohidratos, hemicelulosa, celulosa y lignina tuvieron las características óptimas para que el bagazo de manzana fuera empleado como sustrato en la generación de compuestos fenólicos totales a partir de la fermentación en estado sólido generada por el hongo Pleurotus ostreatus. Si bien el contenido de CFT disminuye al inicio de la FES, también mostró una estabilización en su contenido en el día 21 y se aprecia un aumento en el día 28, por lo que la propuesta de un ensayo con más días de fermentación puede darnos concentraciones mayores de CFT y de actividad antioxidante.