Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Boletín de Investigaciones Marinas y Costeras - INVEMAR
Print version ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.41 no.2 Santa Marta July/Dec. 2012
CONCENTRACIÓN DE MERCURIO TOTAL Y METILMERCURIO EN SEDIMENTO Y SESTON DE LA BAHÍA DE CARTAGENA, CARIBE COLOMBIANO*
TOTAL MERCURY AND METHYLMERCURY CONCENTRATION IN SEDIMENT AND SESTON OF CARTAGENA BAY, COLOMBIAN CARIBBEAN
Pilar Cogua1, Néstor Hernando Campos-Campos2 y Guillermo Duque3
1 Universidad Nacional de Colombia, Departamento de Biología y Centro de Ciencias del Mar -Cecimar-. Invemar, Cerro Punta Betín, Santa Marta, Colombia. rdcoguaro@unal.edu.co.
2 Universidad Nacional de Colombia sede Caribe, Centro de Ciencias del Mar -Cecimar-. Invemar, Cerro Punta Betín, Santa Marta, Colombia. nhcamposc@bt.unal.edu.co.
3 Universidad Nacional de Colombia sede Palmira, Departamento de Ingeniería, Ingeniería Ambiental, Carrera 32 vía a Candelaria, Palmira, Valle del Cauca, Colombia. gduquen@unal.edu.co.
RESUMEN
En Colombia, la bahía de Cartagena es uno de los ecosistemas costeros más influenciados por la contaminación con mercurio (Hg). Con el propósito de identificar el estado ambiental de la bahía de Cartagena, en este estudio se determinó metilmercurio (MeHg) y mercurio total (HgT) en sedimentos superficiales y seston, durante cinco muestreos (febrero, abril, junio, julio y octubre), en cinco estaciones (Zona Industrial, Frente al Dique, Centro, Boca Chica y Tierra Bomba), dentro de la bahía, durante 2006. Los resultados señalan que el promedio de HgT en los sedimentos fue 0.18 ± 0.01 µg/gp.s y en seston fue 0.16 ± 0.002 µg/gp.s. En ambos casos el 10% corresponde a MeHg. Se encontró una correlación entre HgT y MeHg en sedimentos (r = 0.87, p < 0.0001) y en seston (r = 0.66, p = 0.0003). El análisis de regresión múltiple sugiere que para la bahía de Cartagena el pH y el potencial redox determinan el proceso de metilación de mercurio tanto en sedimentos como en el seston.
PALABRAS CLAVE: Mercurio, metilación, sedimentos, seston, bahía de Cartagena.
ABSTRACT
In Colombia, the bay of Cartagena is one of the coastal ecosystems more influenced by mercury (Hg) contamination. In order to estimate its environmental impact, in this study it was determined methylmercury (MeHg) and total mercury (HgT) in sediment and seston, taking five field samples along 2006 (February, April, June, July, and October) in five areas (Industrial zone, Dique, Center of the bay, Boca Chica, and Tierra Bomba). The mean of HgT in the sediments was 0.18 ± 0.01 µg/g dd.w., and in seston was 0.16 ± 0.002 µg/gd.w., from which about 10% was MeHg in both cases. It is reported a strong correlation between total mercury and methylmercury in both sediments (r = 0.87, p < 0.0001) and seston (r = 0.66, p = 0.0003). In Cartagena Bay, pH and redox determine the methylation process of mercury in sediments and seston as was suggested by a multiple regression analysis.
KEY WORDS: Mercury, methylation, sediments, seston, Cartagena Bay.
INTRODUCCIÓN
La bahía de Cartagena, de acuerdo con sus características y comportamiento con el tiempo, se convirtió en un estuario costero típico, con una elevada capacidad de producción y transferencia energética hacia los sistemas oceánicos (Day et al., 1989; Vélez et al., 2003). Actualmente, soporta una alta influencia humana por la actividad residencial, industrial, comercial, turística, marítima y portuaria de la ciudad, así como por los aportes de sedimentos del Canal del Dique, ocasionado cambios considerables en cuanto a sus variables fisicoquímicas (Garay y Castro, 1997; Invemar, 1997).
Los sedimentos constituyen un excelente indicador del grado de contaminación para un área determinada, teniendo en cuenta que los contaminantes orgánicos persistentes se adsorben sobre el material en suspensión, que tiende a sedimentarse y finalmente se acumulan en los sedimentos superficiales; constituyen así un testigo confiable de la afectación de un ecosistema (Pascoe et al., 2002; Casanova et al., 2006; Kadiri et al., 2011; Pazi, 2011). Los análisis de sedimentos acuáticos tienen un papel especial en la valoración de la contaminación por mercurio, porque sus resultados pueden revelar el estatus actual de la deposición ambiental (Ram et al., 2003; Abreu et al., 2008). Como el mercurio tiene la capacidad de transformarse a sus formas orgánicas, se comporta como un contaminante orgánico a pesar de ser un metal. El porcentaje de materia orgánica en los sedimentos permite inferir la distribución de los metales en los ecosistemas estuarinos (Lindberg y Harriss, 1974; Langston, 1982; Wren et al., 1983; Stephenson y Mackie, 1988; Rada et al., 1989; Coquery y Welbourn, 1995; Pazi, 2011). La materia orgánica resulta de la excreción, defecación y muerte de los organismos vivos o de la descomposición enzimática producida por los microorganismos (Day et al., 1989).
El sistema acuoso regula las tasas de adsorción-absorción en el sistema agua-sedimento, la adsorción remueve el metal de la columna de agua y luego este puede ser incorporado nuevamente; la salinidad, el pH y el potencial redox (Eh) regulan estos procesos. Un incremento en la salinidad implica una competencia por mantenerse ligado a la materia orgánica, por tanto se liberan los metales pesados a la columna de agua. Un decrecimiento del pH puede aumentar la solubilidad de los metales disueltos (Fiorentino et al., 2011).
En la bahía de Cartagena funcionó desde 1973 hasta mayo de 1977, la planta de soda cáustica ALCO Ltda. (Mandelli, 1977; FAO y CCO, 1978). El cambio en el proceso electrolítico es en gran parte, eliminado usando mercurio en la plantas de plantas de soda cáustica, las emisiones son depositadas en el ambiente acuático, dejando una huella continua en el agua, sedimentos y biota de las regiones influenciadas por estos flujos (Ram et al., 2003; Abreu et al., 2008). En este estudio se determinó la concentración de mercurio total y metilmercurio en sedimento y seston de la bahía de Cartagena, con el objetivo de evaluar la calidad ambiental de este ecosistema estratégico por los beneficios ecológicos y socioeconómicos que ofrece al país.
ÁREA DE ESTUDIO
La bahía de Cartagena se encuentra localizada sobre la costa del Caribe colombiano, en el departamento de Bolívar, entre los 10°16'N y 75°36'W (Figura 1). Es un sistema semicerrado con un espejo de agua de aproximadamente 82 km2 de área (15 km de largo y 8 km de ancho) y una profundidad promedio de 22 m aproximadamente (Garay y Bermúdez, 1997). Su origen se atribuye a las barreras naturales de coral que se extendieron paralelamente a la costa y se consolidaron hacia finales del periodo Cuaternario Superior (CIOH, 1997).
La bahía se encuentra rodeada por islas que forman conjuntamente canales naturales, permitiendo así una comunicación directa entre la bahía y el mar Caribe, y la renovación periódica de sus aguas. Estos canales son: Bocagrande, ubicado en el extremo noroccidental de la bahía (con una extensión de 1.9 km y profundidades entre 0.6 y 3 m), y Bocachica, que se encuentra en el costado occidental de la Isla de Tierrabomba (con una extensión de 0.45 km hasta Isla Draga y una profundidad máxima de 30 m) constituyendo el principal canal de navegación y la boca de mayor intercambio entre la bahía y el mar (Moncaleano y Niño, 1979).
La bahía recibe aproximadamente 7344000 m3/día de agua dulce y 1836 t/d de sólidos suspendidos provenientes del Canal del Dique (Cepal, 1992), lo que altera permanentemente las variables físicas, químicas y biológicas. Los sedimentos se componen de lodos y limos arcillosos de origen orgánico, presentando las características típicas de un ambiente estuarino (Restrepo, 1977).
MATERIALES Y MÉTODOS
Se realizaron cinco recolectas de sedimentos y seston (detritus) en los meses de febrero, abril, junio, julio y octubre de 2006 en las estaciones: Zona Industrial, Centro de la Bahía, Canal del Dique, Tierra Bomba y Boca Chica (Figura 1). Se midieron además variables físicoquímicas (temperatura del agua, conductividad, salinidad, porcentaje de saturación y potencial redox del agua) con un multímetro portátil modelo Thermo Scientific, previamente calibrado.
Para las muestras de sedimentos se tomaron muestras compuestas por tres submuestras de la fracción superficial del sedimento alrededor del punto de referencia; esta fracción es considerada la mejor para medir el contenido de mercurio total (González, 1991; Daskalakis y O'Connor, 1995). La recolecta de sedimento se realizó con una draga tipo Eckman, de la cual se tomó solo la parte central de la muestra con el fin de evitar una posible contaminación con las paredes de la draga. Las muestras se empacaron individualmente en bolsas de polietileno de baja densidad previamente rotuladas y se trasladaron al laboratorio en neveras con hielo a 4 °C, para la posterior determinación de porcentaje de materia orgánica (MO), mercurio total (HgT) y metilmercurio (MeHg). La MO en sedimentos, se cuantificó mediante calcimetría, tomando una submuestra de 5 g de sedimento seco (W1) y se colocó en un crisol previamente pesado. Las muestras se llevaron a la mufla a 550 °C, durante tres horas aproximadamente. Se dejaron secar en un desecador y se pesaron nuevamente (W2). La diferencia entre estos pesos fue el contenido de MO (W3) (González y Brügmann, 1991; Coquery y Welbourn, 1995; Cividanes et al., 2002; Fidêncio et al., 2002).
Para las muestras de seston [materia particulada suspendida (viva o muerta) y compuestos orgánicos e inorgánicos (ug/g)] se recolectaron tres muestras de agua y se homogenizó cada una por agitación. Cada muestra homogenizada se dividió en tres partes iguales y cada una se pasó por filtros de fibra de vidrio (Whatman GF/C de 47 mm de diámetro), con una bomba de vacío manual, para posterior determinación de seston orgánico, HgT y MeHg.
Para la determinación de HgT en sedimento y seston se utilizó un análisis por pirólisis a 800 ºC, seguido de absorción atómica a través de un analizador de mercurio Lumex-RA-915 con pirolizador PYRO-915 (Sholupov et al., 2004). El mercurio vaporizado fue cuantificado empleando una curva de calibración (R2 = 0.9995), utilizando estándares certificados (IAEA 433 0.169 ± 0.002; TOR-2 0.27 ± 0.01; DORM2 4.55 ± 0.04; CRM008/050). La totalidad de las muestras, los estándares para la curva de calibración y los controles de calidad, fueron medidos mínimo dos veces. La variabilidad entre los valores obtenidos para una misma muestra siempre fue menor al 7%, el límite de detección de 6.78 ng/g, y un porcentaje de recuperación de 98.2 ± 4.2%.
Para la determinación de MeHg en sedimentos y seston se utilizó un cromatógrafo de gases con detector de captura de electrones (PNUMA et al., 1987) modelo PE Autosystem XL. La temperatura de la columna fue mantenida a 100 ºC por 1 min, con programación de temperatura hasta alcanzar 140 °C (5 ºC/min), y permaneció a la misma durante 4 min. La columna capilar utilizada fue una Megabore de 30 m x 0.53 mm de diámetro (RTX-1701, 14% cianopropilfenil, 86% dimetilsiloxano); gas de arrastre fue He a 8 mL/min y el gas make up empleado fue N2 a 45 mL/min; la temperatura del puerto de inyección y el detector fueron 140 y 240 ºC, respectivamente. La variabilidad entre los valores obtenidos para una misma muestra siempre fue menor al 7%, el límite de detección osciló alrededor de 6.78 ng/g y se registró un porcentaje de recuperación de 97.5 ± 4.6%.
Para el tratamiento de resultados de las variables físicoquímicas y de las concentraciones de HgT y MeHg en sedimento y seston, se realizaron análisis de varianza univariados (Anova) por estaciones climáticas y por estación de muestreo como variables independientes por medio del programa estadístico SAS 9.1 (SAS, 2003). Los test de normalidad se obtuvieron mediante la transformación de logaritmo + 1. Se aplicó la prueba de medias de cuadrados mínimos de Tukey-Kramer para determinar diferencias entre estaciones y épocas climáticas. Se efectuó un análisis de correlación múltiple entre las variables físicoquímicas y las concentraciones de HgT y MeHg y se realizaron análisis de correlación simple entre las concentraciones de mercurio y metilmercurio en sedimentos y seston.
RESULTADOS
Durante 2006 la salinidad en la bahía de Cartagena respecto a la variación anual (Tabla 1) presentó los valores más altos en abril, que corresponde a la época seca (21.0 ± 2.7); en general, los valores más bajos se presentaron en julio, que corresponde a la época de transición (15.1 ± 2.0). Sin embargo, el Anova mostró que no hay diferencias significativas entre épocas de muestreo (p = 0.9386).
De acuerdo con los resultados por estaciones de muestreo se forman tres zonas principales de agua por su salinidad: la primera conformada por la estación Frente al Canal del Dique (1.1 ± 0.3), en la cual se presentan los valores más bajos; la segunda por las estaciones Frente a la Zona Industrial (15.7 ± 0.5) y Centro (16.5 ± 0.9); y la tercera formada por las estaciones Tierra Bomba (27.8 ± 1.1) y Boca Chica (29.2 ± 0.3), las cuales presentan los valores más altos de salinidad (Tabla 1). El Anova mostró que existen diferencias significativas entre estaciones de muestreo (p < 0.0001); la prueba posterior (Tukey) mostró diferencias entre las tres zonas en las que se agrupan las diferentes estaciones, la segunda zona y la primera zona (p < 0.0001), la segunda zona y la tercera zona (p = 0.0002), la tercera zona y la primera zona (p < 0.0001).
Durante 2006 la temperatura del agua en la bahía de Cartagena se comportó de manera similar entre todas las estaciones (Tabla 1). En general, las temperaturas más altas se presentaron en julio que corresponde a la época de transición (32.4 ± 0.1 °C) y las bajas en junio que corresponde a la de lluvias (29.6 ± 0.1 °C). El Anova mostró que existen diferencias significativas entre épocas climáticas (p = 0.0001). La prueba posterior (Tukey) mostró que existen diferencias significativas entre la época de transición (julio) y las demás épocas de muestreo, seca [febrero (p = 0.0028) y abril (p = 0.0038)] y de lluvias [junio (p = 0.0018) y octubre (p = 0.0378)]. Aunque las temperaturas altas se presentaron en las estaciones Frente al Dique y Centro (30.9 ± 0.3 °C) y las bajas en Boca Chica (30.4 ± 0.2 °C), el Anova mostró que no hay diferencias significativas entre las estaciones de muestreo (p = 0.8447).
Durante 2006, el pH del agua en la bahía de Cartagena presentó una tendencia a ser básico (8.0 ± 0.04) (Tabla 1); los valores mayores (8.3 ±0.1) se presentaron en abril que corresponde a la época seca y los menores (7.8 ± 0.1) se presentaron en julio que corresponde a la época de transición. El Anova mostró que no hay diferencias significativas entre las épocas de muestreo (p = 0.3703).
El comportamiento del pH entre las estaciones de muestreo, en general, presentó la misma tendencia a valores básicos, a excepción de la estación Frente al Canal del Dique, que presentó una tendencia a la neutralidad (7.3 ± 0.1). El Anova mostró que existen diferencias significativas entre las estaciones de muestreo (p = 0.0004). La prueba posterior (Tukey) mostró que existen diferencias significativas entre la estación Frente al Dique y todas las otras estaciones [Zona Industrial (p = 0.0003), Centro (p = 0.039), Boca Chica (p = 0.0021) y Tierra Bomba (p = 0.021)].
El porcentaje de materia orgánica (% MO) en el sedimento durante 2006 en la bahía de Cartagena presenta los valores más altos en época de lluvias en junio (26.4 ± 1.7) y los valores más bajos en época seca en abril (1.7%) y octubre (1.8%) (Tabla 1). El Anova mostró que existen diferencias significativas entre épocas de muestreo (p < 0.0001). La prueba posterior (Tukey) mostró que existen diferencias significativas entre la época de transición y las demás épocas de muestreo, seca [febrero (p < 0.0001) y abril (p = 0.0001)] y de lluvias (p = 0.0001), así como entre la época seca y la de lluvias (p = 0.0002).
Aunque los mayores porcentajes de MO corresponden a la estación Frente a la Zona Industrial (11.8%) y los valores más bajos se registraron en la estación Tierra Bomba (3.9 ± 1.0), el Anova mostró que no hay diferencias significativas entre estaciones (p = 0.8570). El contenido de seston orgánico (SO) en la bahía de Cartagena presentó los valores más altos en abril (0.032 ± 0.005 ug/g) que corresponde al final de la época seca; los valores más bajos se registraron en febrero (0.008 ± 0.001 ug/g) que corresponde al inicio de la época seca (Tabla 1). El Anova mostró que no existen diferencias significativas entre los muestreos (p = 0.2908).
Al comparar los contenidos de SO entre las estaciones de muestreo se observa que los mayores contenidos corresponden a las estaciones Frente al Dique (0.023 ug/g) y Frente a la Zona Industrial (0.021 ± 0.002 ug/g); los valores más bajos se registraron en Centro (0.013 ± 0.001 ug/g). El Anova mostró que no hay diferencias significativas entre estaciones (p = 0.5237). Durante el período de muestreo, los contenidos de HgT (µg/g) en el sedimento de la bahía de Cartagena presentaron valores similares respecto a la variación estacional anual (Figura 2a), a excepción de febrero que corresponde al inicio de la estación seca (0.11 µg/g). De igual manera, el MeHg en el sedimento (µg/g, peso seco) es similar durante todo el año (0.02 µg/g). El Anova mostró que no existen diferencias significativas por épocas de muestreo para HgT (p = 0.9150) ni para MeHg en los sedimentos (p = 0.3096).
Para las estaciones de muestreo se observó un patrón de dilución tanto para HgT como para MeHg (Figura 2b). La concentración de HgT (µg/g) es mayor desde la estación Frente a la Zona Industrial (0.55 ± 0.03) y disminuye hacia mar abierto que corresponde a las estaciones Boca Chica (0.02 ± 0.00) y Tierra Bomba (0.03 ± 0.00). Se observó el mismo patrón para las concentraciones de MeHg (µg/g) por estaciones de muestreo, presentando los valores más altos en la estación Frenta a la Zona Industrial (0.06 ± 0.01) y los más bajos en Boca Chica (0.004 ± 0.00) y Tierra Bomba (0.000 ± 0.00).
El Anova mostró que existen diferencias significativas entre estaciones para HgT (p = 0.0001). La prueba posterior (Tukey) mostró que las diferencias están entre la estación Frente a la Zona Industrial y las estaciones Boca Chica (p = 0.0003), Centro (p = 0.0013) y Frente al Dique (p = 0.0012). También existen diferencias entre la Tierra Bomba y la estación Frente al Dique (p = 0.0339).
De igual manera, para MeHg el Anova mostró diferencias significativas entre estaciones (p = 0.0018). La prueba posterior (Tukey) mostró diferencias significativas entre la estación Frente a la Zona Industrial y las estaciones Boca Chica (p = 0.0191) y Centro (p = 0.021).
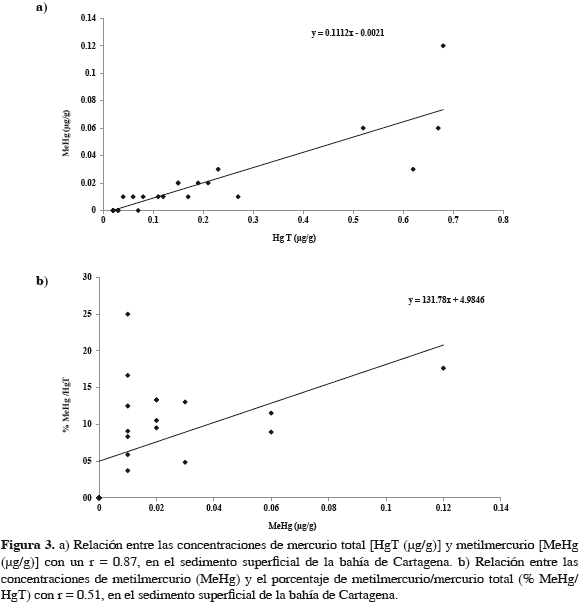
Respecto al promedio de HgT en los sedimentos (0.18 ± 0.04) el 10% corresponde a MeHg. Los análisis de correlación muestran que los modelos son válidos entre la concentración de HgT y de MeHg (Figura 3a) con una correlación positiva (r = 0.87, p < 0.0001), así como entre la concentración de MeHg y el porcentaje de MeHg/HgT (Figura 3b) con una correlación positiva (r = 0.51, p = 0.0096).
El HgT en el seston de la bahía de Cartagena presentó valores similares durante todo el año (0.16 µg/g) a excepción de junio, que corresponde al inicio de la época de lluvias (0.19 µg/g), que mostró los valores más altos. El MeHg en el seston (µg/g) presenta valores similares durante todo el año (0.02 ± 0.00) (Figura 4a). El Anova mostró que no hay diferencias significativas entre épocas de muestreo para HgT (p = 0.6052) ni para MeHg (p = 0.3567) en seston.
El HgT en el seston muestra un patrón de dilución respecto a las estaciones de muestreo (Figura 4b); la concentración de HgT (µg/g) es mayor desde la fuente original que corresponde a la estación Frente a la Zona Industrial (0.19 µg/g) y disminuye alejándose de esta estación, hacia la parte central y occidental de la bahía y hacia las estaciones Tierra Bomba (0.15 ± 0.00) y Boca Chica (0.14 ± 0.00).
Respecto a las concentraciones de MeHg en seston por estaciones de muestreo no se establece un patrón claro, encontrándose los valores más altos en la estación Frente al Dique (0.018 ± 0.00) y los más bajos en Tierra Bomba (0.014 ± 0.01), las demás estaciones presentan el mismo valor (0.016 ± 0.01). El Anova mostró que no hay diferencias significativas entre estaciones para HgT (p = 0.4819) ni para MeHg (p = 0.4546) en seston.
Respecto al promedio de HgT en el seston (0.16 ± 0.002), el 10% corresponde a MeHg. Los análisis de correlación muestran que el modelo es válido entre la concentración de MeHg y el porcentaje de MeHg respecto al HgT (Figura 5) con una correlación positiva entre estas variables (r = 0.66 p = 0.0003).
El análisis de regresión múltiple entre las variables físicoquímicas y las concentraciones de HgT y MeHg mostró que el modelo se ajusta para el sedimento y el seston (Tabla 2). La concentración de HgT en el sedimento se relaciona positivamente con el pH y oxígeno disuelto y negativamente con el potencial redox y conductividad con una regresión total de r2 = 0.59 (p > 0.001); teniendo el pH mayor peso (r2 = 0.29). La concentración de MeHg en el sedimento se relaciona positivamente con el pH y negativamente con el potencial redox y la conductividad (con una regresión total de r2 = 0.44, p > 0.007) teniendo el potencial redox mayor peso (r2 = -0.17).
La concentración de HgT en el seston se relaciona negativamente solo con el potencial redox (r2 = -0.18; p > 0.04). La concentración de MeHg en el seston se relaciona negativamente solo con la temperatura (r2 = -0.16; p > 0.05). Aunque el modelo es estadísticamente significativo, la regresión entre las variables es débil para el seston tanto en HgT como en MeHg.
DISCUSIÓN
La información obtenida de las variables fisicoquímicas en cada estación analizada permitió conocer las condiciones de la dinámica del mercurio en la bahía de Cartagena. De acuerdo con las características físicoquímicas determinadas por la salinidad, la temperatura y el pH, la bahía de Cartagena cumple con las condiciones de un ambiente estuarino tropical, según Day et al. (1989) y Valiela (1995).
La salinidad promedio de las estaciones permite diferenciar tres zonas con diferentes tipos de agua en la bahía de Cartagena: una de agua marina, conformada por las estaciones de Boca Chica y Tierra Bomba; una de agua de mezcla, conformada por las estaciones Frente a la Zona Industrial y Centro; y una de agua dulce, conformada por la estación Frente al Dique. Aunque la bahía de Cartagena presenta una temperatura promedio para este estudio (30.7 ± 0.1 °C) y un pH básico (8.0 ± 0.04), el análisis de varianza permite comprobar que la época de transición marca una diferencia para el microclima del ecosistema, lo cual puede reflejarse en las condiciones óptimas para el desarrollo de los organismos, como es el caso de la fauna íctica (Blanco et al., 2007).
Durante la estación de lluvias la entrada de aguas continentales arrastra sedimentos hacia la bahía de Cartagena, aumentando el porcentaje de materia orgánica en la capa superior, lo cual corresponde con el mayor porcentaje de materia orgánica (26.4 ± 1.7 %) determinado para esta época durante este estudio. La relación en el aporte de materia orgánica hacia el ecosistema desde ecosistemas adyacentes y su relación con la época climática es confirmada mediante el análisis de varianza al establecer diferencias significativas entre la época de lluvias y la seca. Esta premisa ha sido observada en otros estudios (Olivero y Solano, 1998; Alonso et al., 2000).
Las concentraciones de mercurio para la bahía de Cartagena, muestran que es muy probable que aún exista una influencia desde la zona industrial (donde operaba la planta de soda cáustica), sobre la distribución de este contaminante en los sedimentos superficiales del ecosistema. En el estudio, se observó un claro efecto de dilución desde el principal punto de contaminación (estación Frente a la Zona Industrial) hacia las estaciones donde el agua presenta mayor salinidad (Boca Chica y Tierra Bomba), en donde la dilución es mayor. Lo anterior, es confirmado por el Anova que muestra diferencias significativas entre estaciones de muestreo para HgT y MeHg.
Por otro lado, es posible que exista una fuente que está causando que las concentraciones en la estación Frente a la Zona Industrial permanezcan relativamente constantes desde hace más de 10 años. Una posibilidad es que se presente una entrada actual de mercurio al ecosistema a través del Canal del Dique. Esta posible entrada no se refleja en los sedimentos de la estación Frente al Dique, probablemente por la picnoclina que se forma en los primeros metros de las capas superficiales de la columna de agua (CIOH, 2004, 2006).
Con relación a la materia orgánica particulada suspendida en la columna de agua (seston), los análisis de varianza muestran que las variaciones de seston orgánico son mayores en la estación Frente a la Zona Industrial (0.021 ± 0.002 µg/g); lo que puede sugerir una mayor entrada de seston a las redes tróficas en esta estación, probablemente por la dinámica de las corrientes de la bahía de Cartagena (CIOH, 2006). Con estos resultados también se comprueba la persistencia del mercurio en los sedimentos y su presencia en el ecosistema después de muchos años de no existir la fuente directa de contaminación. Esta fuente era generada por la planta de soda cáustica ALCO Ltda. hasta mayo de 1977 cuando no pudo operar más (Mandelli, 1977; FAO y CCO, 1978). La Organización Mundial de la Salud (OMS) estipula que el nivel máximo de mercurio permisible en sedimentos es de 0.1 µg/g (peso seco). En 1978, la concentración de mercurio total en los sedimentos de la bahía de Cartagena, de acuerdo con el estudio realizado por la Comisión Colombiana Oceanográfica (FAO y CCO, 1978), era de 7 µg/g. En el estudio de Alonso et al. (2000), en 1996, la concentración de mercurio en el sedimento de la bahía de Cartagena fue de 1.9 µg/g. En el presente estudio la concentración promedio del ecosistema fue de 0.18 ± 0.01 µg/g.
Aunque la concentración de mercurio en los sedimentos ha disminuido de forma drástica después de 28 años de haber sido cerrada la planta ALCO, es importante resaltar que los niveles de HgT en el sedimento, siguen siendo importantes y aún en 2006 se mantienen por encima de los límites de la OMS. Lo anterior, indica un alto impacto de la planta ALCO, haciendo que el mercurio permanezca en este ecosistema y pueda estar disponible para ingresar a las redes tróficas (Alonso et al., 2000).
La prueba posterior (Tukey) confirma el impacto que sigue causando sobre el ecosistema el mercurio que fue vertido desde la planta ALCO, al mostrar diferencias significativas entre la estación Frente a la Zona Industrial y las demás. De igual manera, sucede con la concentración de MeHg en los sedimentos donde la prueba posterior (Tukey) mostró diferencias entre la estación Frente a la Zona Industrial y las estaciones Boca Chica y Centro. Diferentes estudios documentan que los sedimentos adyacentes a las plantas de soda cáustica contienen altos niveles de mercurio (Escobar y Camacho, 1977; Escobar et al., 1977; Mandelli, 1977; Loring y Bewers, 1978; Bothner et al., 1980; Baldi y Bargagli, 1984; Shaw et al., 1988).
El análisis de correlación entre las concentraciones de HgT y MeHg (r = 0.87, p < 0.0001) demuestra la alta dependencia de las variables indicando que para este ecosistema la presencia de mercurio en los sedimentos sugiere una biodisponibilidad del elemento para ingresar a las redes tróficas. Esto es corroborado por el análisis de correlación entre el MeHg y el porcentaje de MeHg en los sedimentos (r = 0.51, p = 0.0096). Estos resultados son similares a los encontrados por Kannan et al. (1998).
Los sedimentos actúan como un reservorio de las entradas de mercurio, en el pasado y el presente, debido a la afinidad de las especies de mercurio inorgánico por partículas y materia orgánica (Gagnon et al., 1996; Mason y Lawrence, 1999). Varios estudios indican la afinidad del mercurio por la fracción orgánica de los sedimentos (Lindberg y Harriss, 1974; Langston, 1982; Wren et al., 1983; Stephenson y Mackie, 1988; Rada et al., 1989; Coquery y Welbourn, 1995).
Para este estudio no se determinó una correlación significativa entre el porcentaje de materia orgánica respecto al HgT ni al MeHg en los sedimentos. Lo anterior, sugiriere que existen otras características hidrológicas en la bahía de Cartagena que son más dominantes que el porcentaje de materia orgánica en el ciclo biogeoquímico del mercurio, estos resultados son similares a los de otros estudios (Mason et al., 2006; He et al., 2007; Manion et al., 2010).
En general los resultados obtenidos para seston son similares a los obtenidos para sedimentos, lo cual puede indicar un fuerte proceso de resuspensión de sedimentos en la columna de agua. Esta resuspensión de materia orgánica particulada permite que haya una vía de entrada importante del mercurio al fitoplancton en este ecosistema en particular. De hecho al comparar los coeficientes de correlación en sedimentos y seston se observa el mismo comportamiento, el cual indica que un porcentaje importante de mercurio está siendo metilado en los compartimentos abióticos incrementando la biodisponibilidad del contaminante para ingresar a las redes tróficas del ecosistema.
El análisis de correlación múltiple permite comprobar que las variables fisicoquímicas determinan la presencia de mercurio en compartimentos abióticos del ecosistema y que también pueden determinar la biodisponibilidad del mercurio para poder ingresar a los organismos, al hacer más factibles los procesos de metilación. Las dos variables que permiten explicar mejor la concentración de HgT y MeHg en los sedimentos son el pH y el potencial redox (Tabla 2), las cuales se relacionan entre sí. Para el seston las variables que explican estas concentraciones son el potencial redox y la temperatura. De igual manera, otros autores han comprobado que las variables físicoquímicas determinan los procesos de metilación en los sedimentos y en la columna de agua en ecosistemas marinos y estuarinos (Hintelmann et al., 2000; Howland et al., 2000; Ogrinc et al., 2007).
CONCLUSIONES
La bahía de Cartagena presenta un aporte constante de mercurio al ecosistema, que se transfiere a los compartimentos abióticos (seston y sedimentos). La dinámica de las corrientes de la bahía de Cartagena permite la constante resuspensión de sedimentos a la columna de agua; las condiciones físicoquímicas principalmente pH y potencial redox hacen que el proceso de metilación de mercurio se dé activamente, lo que hace que el ecosistema sea un lugar propicio para el proceso de acumulación de mercurio en los organismos. Es importante resaltar que, aunque las concentraciones de mercurio total y metilmercurio tanto en seston como en sedimentos son bajas, comparadas con ecosistemas altamente contaminados con este metal, existe una fracción aproximada del 10% que está disponible en el ecosistema para ingresar a las redes tróficas.
AGRADECIMIENTOS
Los autores agradecen a la División de Investigaciones de la Universidad Nacional de Colombia (sede Bogotá) por el apoyo económico para la realización de este estudio. De igual manera, al Instituto de Investigaciones Marinas y Costeras (Invemar), por todo el apoyo logístico y el apoyo en la salidas de campo. De forma muy especial agradecemos a todos los miembros del programa de Calidad Ambiental Marina del Invemar por su apoyo en la realización de esta investigación y a los profesores del Doctorado en Biología (línea Biología Marina).
BIBLIOGRAFÍA
1 Abreu, S. N., A. M. Soares, A. J. Nogueira y F. Morgado. 2008. Tree rings, Populus nigra L., as mercury data logger in aquatic environments: case study of a historically contaminated environment. Bull Environ Contam Toxicol., 80: 294-299. [ Links ]
2 Alonso, D., P. Pineda, J. Olivero, H. González y N. Campos. 2000. Mercury levels in muscle of two fish species and sediments from the Cartagena Bay and the Ciénaga Grande de Santa Marta, Colombia. Environm. Pollut., 109: 157-163. [ Links ]
3 Baldi, F. y R. Bargagli. 1984. Mercury pollution in marine sediments near a chlor-alkali plant: distribution and availability of the metal. Sci Total Environ., 39: 15-26. [ Links ]
4 Blanco, J. A., J. C. Narváez y E. A. Viloria. 2007. ENSO and the rise and fall of a tilapia fishery in northern Colombia. Fish. Res., 88: 100-108. [ Links ]
5 Bothner, M. H., R. A. Jahnke, M. L. Peterson y R. Carpenter. 1980. Rate of mercury loss from contaminated estuarine sediments. Geochim. Cosmochim. Acta, 44: 273-285. [ Links ]
6 Casanova, R., M. M. Zambrano y C. Castrillon (Eds.). 2006. Evaluación de hidrocarburos aromáticos policíclicos en sedimentos superficiales de los esteros el Pajal y Candamo de la bahía de Tumaco. Bol. Cient. CCCP, 13: 85-96. [ Links ]
7 Cepal. 1992. Plan básico para la gestión ambiental del Distrito de Cartagena de Indias. Comisión Económica para América Latina, Cartagena. 116 p. [ Links ]
8 Cividanes, S., M. Incera y J. López. 2002. Temporal variability in the biochemical composition of sedimentary organic matter in an intertidal flat of the Galician coast (NW Spain). Oceanol. Acta, 25: 1-12. [ Links ]
9 CIOH. 1997. Proyecto regional de planificación y manejo de bahías y áreas costeras fuertemente contaminadas del gran Caribe. Estudio de caso: bahía de Cartagena, Colombia. Informe final, Centro de Investigaciones Oceanográficas e Hidrográficas (CIOH), Fondo para el medio ambiente mundial, y Programa de las Naciones Unidas para el Desarrollo (PNUD). Cartagena. 145 p. [ Links ]
10 CIOH. 2004. Régimen de vientos y corrientes, bahía de Cartagena. Centro de Investigaciones Oceanográficas e Hidrográficas, Cartagena. 24 p. [ Links ]
11 CIOH. 2006. Seguimiento de las condiciones oceanográficas y meteorológicas en el Caribe colombiano. Centro de Investigaciones Oceanográficas e Hidrográficas, Cartagena. 74 p. [ Links ]
12 Coquery, M. y P. Welbourn. 1995. The relationship between metal concentration and organic matter sediments and metal concentration in the aquatic macrophyte Eriocaulon septangulare. Water Resources Res., 29: 2094-2102. [ Links ]
13 Daskalakis, K. y T. O'Connor. 1995. Normalization and elemental sediment contamination in the coastal United States. Environ. Sci. Technol., 29: 470-477. [ Links ]
14 Day, J. W., C. A. S. Hall, W. M. Kemp y A. Yañez-Arancibia. 1989. Estuarine ecology. Wiley, Nueva York. 558 p. [ Links ]
15 Escobar, J. J. y G. Camacho. 1977. Concentraciones de mercurio en aguas y sedimentos de la bahía de Cartagena, Colombia. Inderena, Cartagena. 21 p. [ Links ]
16 Escobar, J., J. Granados, E. Podlesky y V. Valle. 1977. Estudio de la contaminación con mercurio de la bahía de Cartagena (Colombia). Inderena, Cartagena. 32 p. [ Links ]
17 FAO y CCO. 1978. Study concerning the mercury pollution of the Cartagena bay. Pollution assessment project. Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y Comisión Colombiana Oceanográfica (CCO). Swedish Water and Air Pollution Research Institute. Estocolmo. 63 p. [ Links ]
18 Fidêncio, P. H., R. J. Poppi y J. C. de Andrade. 2002. Determination of organic matter in soils using radial basis function networks and near infrared spectroscopy. Anal. Chim. Acta, 453: 125-134. [ Links ]
19 Fiorentino, J. C., J. Enzweiler y R. S. Angélica. 2011. Geochemistry of mercury along a soil profile compared to other elements and to the parental rock: evidence of external input. Water, Air and Soil Pollution. doi 10.1007/s11270-011-0769-x. [ Links ]
20 Gagnon, C., E. Pelletier y A. Mucci. 1996. Behavior of anthropogenic mercury in coastal marine sediments. Mar. Chem., 59: 159-176. [ Links ]
21 Garay, J. y H. Bermúdez. 1997. Estimación de los residuos vertidos por los buques en los puertos Colombianos. Informe final de proyecto de consultoría "La iniciativa del Gran Caribe para los residuos de los buques OMI", Centro de Investigaciones Oceánicas e Hidrográficas (CIOH), Cartagena. 70 p. [ Links ]
22 Garay, J. y L. A. Castro. 1997. Estudio de la contaminación por plaguicidas, hidrocarburos y eutroficación en lagunas costeras del Caribe colombiano (cuerpos de agua de Cartagena, Colombia). Fase I. Informe técnico, DIMAR/CIOH, Cartagena. 47 p. [ Links ]
23 González, H. 1991. Mercury pollution caused by a chlor-alkali plant. Wat. Air Soil Pollut., 56: 83-93. [ Links ]
24 González, H. y L. Brüggmann. 1991. Heavy metals in littoral deposits off Havana, Cuba. Chem. Ecol., 5: 171-179. [ Links ]
25 He, T., J. Lu, F. Yang y X. Feng. 2007. Horizontal and vertical variability of mercury species in pore water and sediments in small lakes in Ontario. Sci. Total. Environ., 386: 53-64. [ Links ]
26 Hintelmann, H., K. Keppel-Jones y R. D. Evans. 2000. Constants of mercury methylation and demethylation rates in sediments and comparison of tracer and ambient mercury availability. Environ. Toxicol. Chem., 19: 2204-2211. [ Links ]
27 Howland, R. J. M., A. D. Tappin, R. J. Uncles, D. H. Plummer y N. J. Bloomer. 2000. Distributions and seasonal variability of pH and alkalinity in the Tweed Estuary, UK. Sci. Total. Environ., 251/252: 125-138. [ Links ]
28 Invemar. 1997. Diagnóstico del estado actual de las comunidades bióticas de la bahía de Cartagena y su respuesta a la contaminación. Informe del proyecto GEF/RLA/93/G41, Instituto de Investigaciones Marinas y Costeras, Santa Marta. 110 p. [ Links ]
29 Kadiri, M., K. L. Spencer, C. M. Heppell y P. Fletcher. 2011. Sediment characteristics of a restored saltmarsh and mudflat in a managed realignment scheme in Southeast England. Hydrobiologia. doi 10.1007/s10750-011-0755-8. [ Links ]
30 Kannan, K., R. G. Smith Jr., R. F. Lee, H. L. Windom, P. T. Heitmuller, J. M. Macauley y J. K. Summers. 1998. Distribution of total mercury and methyl mercury in water, sediment, and fish from South Florida estuaries. Arch. Environ. Contam. Toxicol. 34: 109-118. [ Links ]
31 Langston, W. J. 1982. The distribution of mercury in British estuarine sediments and its availability to deposit-feeding bivalves. J. Mar. Biol. Ass. U.K., 62: 667-684. [ Links ]
32 Lindberg, S. E. y R. C. Harriss. 1974. Mercury-organic matter associations in estuarine sediments and interstitial. Water. Envir. Sci. Technol., 8: 459-462. [ Links ]
33 Loring, D. H. y J. M. Bewers. 1978. Geochemical mass balances for mercury in a Canadian Fjord. Chem. Geol., 22: 309-330. [ Links ]
34 Mandelli, E. F. 1977. Informe técnico sobre la consulta realizada en Colombia con referencia a la contaminación por mercurio de la bahía de Cartagena. Unesco/PNUD, Ciudad de México. 27 p. [ Links ]
35 Manion, N. C., L. Campbell y A. Rutter. 2010. Historic brownfields and industrial activity in Kingston, Ontario: Assessing potential contributions to mercury contamination in sediment of the Cataraqui River. Sci. Total. Environ., 408: 2060-2067. [ Links ]
36 Mason, R. P. y A. L. Lawrence. 1999. The concentration, distribution and bioavailability of mercury in sediments of Baltimore Harbor and Chesapeake Bay. Environ. Toxicol. Chem., 18: 2138-2447. [ Links ]
37 Mason, R. P., E. H. Kim, J. Comwell y D. Heyes. 2006. An examination of the factors influencing the flux of mercury, methylmercury and other constituents from estuarine sediment (introduction). Mar. Chem., 102: 96-110. [ Links ]
38 Moncaleano, A. y L. Niño. 1979. Celenterados planctónicos de la bahía de Cartagena. Descripción, distribución y notas ecológicas. Bol. Museo Mar., 9: 37-96. [ Links ]
39 Ogrinc, N., M. Monperrus, J. Kotnik, V. Fajon, K. Vidimova, D. Amouroux, D. Kocman, E. Tessier, S. Zizek y M. Horvat. 2007. Distribution of mercury and methylmercury in deep-sea surficial sediments of the Mediterranean Sea. Marin. Chem., 107: 31-48. [ Links ]
40 Olivero, J. y B. Solano. 1998. Mercury in environmental samples from a waterbody contaminated by gold mining in Colombia, South America. Sci. Total Environ., 217: 83-89. [ Links ]
41 Pascoe, G. A., P. McLaren y M. Soldate. 2002. Impact of offsite sediment transport and toxicity on remediation of a contaminated estuarine bay. Marin. Pollut. Bull., 44: 1184-1193. [ Links ]
42 Pazi, I. 2011. Assessment of heavy metal contamination in Candarli Gulf sediment, Eastern Aegean Sea. Env. Mon. Ass., 174: 199-208. [ Links ]
43 PNUMA, FAO y OIEA. 1987. Determinación de metilmercurio en organismos marinos seleccionados, por cromatografía de gases. Métodos de referencia para estudios de contaminación marina No. 13, Programa de las Naciones Unidas para el Medio Ambiente (PNUMA), Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y Organismo Internacional de Energía Atómica (OIEA), Montecarlo, Mónaco. 12 p. [ Links ]
44 Rada, G. R., J. G. Wiener, M. R. Winfrey y D. E. Powell. 1989. Recent increases in atmospheric deposition of mercury to north-central Wisconsin lakes inferred from sediment analyses. Arch. Envir. Contam. Toxic., 18: 175-181. [ Links ]
45 Ram, A., M. A. Rokade, D. V. Borole y M. D. Zingde. 2003. Mercury in sediments of Ulhas estuary. Marin. Pollut. Bull., 46: 846-857. [ Links ]
46 Restrepo, J. 1977. Tanatocenosis de los foraminíferos bentónicos recientes presentes en los sedimentos de la bahía de Cartagena. Tesis Biol. Mar., Univ. Bogotá Jorge Tadeo Lozano, Cartagena. 86 p. [ Links ]
47 SAS Institute. 2003. SAS/STAT guide for personal computers. Sexta edición, SAS Institute, Cary, EE. UU. [ Links ]
48 Shaw, B. P., A. Sahu, S. B. Chaudhuri y A. K. Panigrahy. 1988. Mercury in the Rushikulya river estuary. Mar. Pollut. Bull., 19: 233-234. [ Links ]
49 Sholupov, S., S. Pogarev, V. Ryzhov, N. Mashyanov y A. Straganov. 2004. Zeeman atomic absorption spectrometer RA-915 + for direct determination of mercury in air and complex matrix samples. Fuel Process. Technol., 85: 475-485. [ Links ]
50 Stephenson, M. y G. L. Mackie. 1988. Total cadmium concentrations in the water and littoral sediments of central Ontario lakes. War. Air Soil Pollut., 38: 121-136. [ Links ]
51 Valiela, I. 1995. Marine ecological processes. Segunda Edición, Springer, Nueva York. 686 p. [ Links ]
52 Vélez, M. T., B. J. Restrepo y J. Olivero. 2003. Manejo de las aguas servidas y problemática ambiental en la ciudad de Cartagena, Colombia. 57-58. En: Fernández, A. y C. Di Risio (Eds.). El agua en Iberoamerica. Aspectos de la problemática urbana. CYTED, Madrid. 102 p. [ Links ]
53 Wren, C. D., H. R. MacCrimmon y D. R. Loescher. 1983. Examination of bioaccumulation and biomagnification of metal in a Precambrian shield lake. War. Air Soil Pollut., 19: 277-291. [ Links ]
FECHA DE RECEPCIÓN: 13/09/2011 FECHA DE ACEPTACIÓN: 10/08/20112
*Contribución No. 1107 del Instituto de Investigaciones Marinas y Costeras -Invemar- y No. 372 del Centro de Estudios en Ciencias del Mar -Cecimar-, Universidad Nacional de Colombia sede Caribe.