1. Introducción
El cáncer de cuello uterino (CCU) es el cuarto cáncer más común en mujeres a nivel mundial. En Colombia, es la primera causa de muerte por cáncer entre mujeres de 30 a 59 años. Su principal agente causal es el virus del papiloma humano (VPH). Según el Ministerio de Salud colombiano, la alta mortalidad por cáncer de cuello uterino está asociada a condiciones socioeconómicas bajas, así como a la ubicación geográfica; encontrándose en mayor riesgo las poblaciones que se encuentran en zonas rurales, con acceso limitado a los servicios de salud y con menor nivel educativo 1.
Pruebas de tamizaje preventivas como la citología permitirían disminuir la cantidad de muertes por cáncer de cuello uterino, debido a que la mayoría de los casos se presentan en estados avanzados y solo el 18% de los casos notificados con inicio de tratamiento oportuno registran una oportunidad alta de cura 2. Esto indica que un diagnóstico temprano y un inicio de tratamiento a tiempo brindaría mayores posibilidades de recuperación de la paciente.
El contexto anterior expone la importancia de implementar nuevas técnicas de tamización que apoyen el diagnóstico médico de esta patología en etapas tempranas (precánceres) para reducir la tasa de mortalidad de las mujeres.
La espectroscopia óptica de fluorescencia (EOF) es un método no invasivo que genera una respuesta espectral de fluorescencia de una muestra mediante el uso de un haz de luz, que caracteriza los tejidos biológicos del cuello uterino gracias a los fluoróforos presentes en él.
Para el funcionamiento óptimo de la técnica EOF, todos sus componentes deben funcionar de manera adecuada, iniciando con la fuente de luz que es la encargada de generar una excitación en el tejido estudiado. La emisión de la luz se puede producir en diferentes longitudes de onda, dependiendo del objetivo de cada estudio. En tejidos como el cuello uterino se usa la radiación en un rango de longitudes de onda entre 280 nm y 520 nm. En este tejido se encuentran presentes moléculas como el triptófano, FAD, colágeno, elastina, NADH, entre otras, que generan fluorescencia y contribuyen a la emisión del espectro cuando son excitadas. Por lo general la iluminación se realiza por medio de una fibra óptica que conduce la luz proveniente de la fuente hasta el tejido. A su vez, esta fibra va conectada al espectrómetro encargado de recolectar la información espectral proveniente del tejido para su posterior procesamiento 3.
Diferentes estudios abordan la EOF como una técnica para detección de patologías y explican el fenómeno físico y las propiedades de los tejidos biológicos, los cuales, a partir de sus cambios morfológicos y bioquímicos presentes en las etapas iniciales de la displasia, cambian el espectro de fluorescencia y así permiten ser una herramienta de diagnóstico clínico, dando relevancia a los precánceres y cánceres, in vivo4. En la EOF se evidencia el uso de diferentes tipos de fuentes de luz monocromáticas en diferentes rangos del espectro electromagnético para generar excitación en los tejidos, como es el caso del láser de gas nitrógeno con una longitud de onda de 337.1 nm utilizado en investigaciones para la excitación de tejidos del cuello uterino y mama 5,6. También se ha utilizado el láser de Neodimio para estudiar células de sangre de rata 7 y en los textos académicos para la implementación de la EOF se presentan como fuentes de luz los láseres de argón, neón de helio y iones de criptón; como también, lámparas policromáticas de arco de mercurio y xenón 8,9.
Se realizó la caracterización de una fuente de luz LED con aplicación en la terapia fotodinámica del cáncer de cérvix, la fuente de luz LED utilizada emite en una longitud de onda de 633 y 405 nm, empleada por medio de un adaptador óptico diseñado y construido con el fin de concentrar la luz emitida por el LED. Los resultados obtenidos con esta fuente logran un aumento en la posibilidad de localizar el tratamiento de acuerdo a los requerimientos de neoplasias específicas, teniendo un impacto clínico en el hecho de iluminar zonas puntuales mediante la fibra óptica, aprovechando las cavidades naturales del cuerpo humano como lo es el cuello uterino, otro factor es el socio-económico debido a que la tecnología utilizada es más económica y podría llegar a las pacientes de servicios asistenciales públicos beneficiando a una gran parte de la población 10.
En la implementación de la técnica EOF con dispositivos de emisión de luz LED se observaron márgenes de mejoras con respecto a los precios actuales ofrecidos en el mercado por otras fuentes emisoras de luz, se evidenció el potencial de la luz LED para continuar siendo utilizada en instrumentación para laboratorios ópticos 11.
Se prueba que la EOF ha sido ampliamente explorada para aplicaciones como el crecimiento neoplásico temprano en tejidos, si esta técnica no invasiva se puede aplicar con éxito, puede aumentar el potencial de tamizaje para que las personas puedan acceder a un diagnóstico y tratamiento oportuno y así reducir tasas de mortalidad 12.
Se observa la importancia de analizar la técnica EOF utilizando radiación electromagnética de tipo LED con una longitud de onda determinada generando la excitación necesaria para que los fluoróforos puedan interaccionar y dar origen a los espectros de emisión característicos para su posterior análisis.
2. Metodología
Equipos e implementos necesarios para ejecutar la técnica espectroscopia óptica de fluorescencia:
Fuente de luz LED en el rango de 335 a 345 nm perteneciente al espectro ultravioleta con lente colimador.
Fibra óptica bifurcada.
Espectrómetro Ocean Optics HR4000 High Resolution.
Computador con el software Ocean View encargado de la adquisición de las señales espectrales.
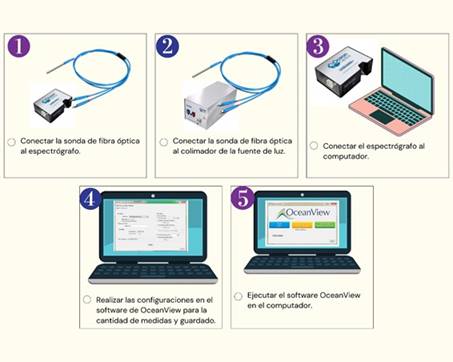
Conexiones de los elementos de medida para la técnica Espectroscopia óptica de Fluorescencia: La fibra óptica se compone de dos extremos, y uno de ellos se divide en dos partes. El primero se conectará con el espectrómetro y el segundo se conectará a la fuente de luz LED mediante un lente colimador. El otro extremo de la fibra óptica es un conducto flexible que iluminará las biopsias de tejido de cuello uterino. Posteriormente, se realiza la conexión del espectrómetro con el computador a través de un cable USB. En el computador se realiza la respectiva configuración en el software OceanView para la toma de los espectros del tejido. (Figura 1)
Recursos biológicos: Fueron proporcionadas biopsias de útero y cuello uterino por el Instituto Caldense de Patología (ICP) de la ciudad de Manizales-Colombia, de las cuales se pudo recuperar de manera completa 22 cuellos uterinos con o sin patologías visibles.

Figura 2 Fotografías de los cuellos uterinos para posteriores medidas de EOF. A) cuello uterino totalmente liso y sin anomalías, B) cuello uterino con anomalías de tamaño pequeño y C) cuello uterino con anomalía grande en el extremo inferior.
Posición para medición de biopsias de cuellos uterinos: Se realizan mediciones en cada uno de los cuellos uterinos en 5 puntos de análisis, como se muestra en la Figura 3. Cuatro puntos se toman después de la unión escamosa cilíndrica posterior al orificio cervical externo, donde hay mayor presencia de células escamosas y se presentan la mayoría de cánceres. Se siguen las manecillas del reloj y se procura mantener el mismo radio de medida. Cabe aclarar que no se toman medidas en las zonas con cortes y el quinto punto es aleatorio o donde el tejido presente anomalías visibles.

Figura 3 Diagrama para identificar lugar del tejido del cuello uterino donde se realizaron las medidas
Adquisición de señales espectrales de fluorescencia: Se activa la fuente de luz LED y se realiza una leve presión con uno de los extremos de la sonda de fibra óptica sobre la zona del tejido a medir. Desde el computador, se activa el proceso de guardado de la información espectral de fluorescencia. La configuración del software para almacenar la información consta de realizar 30 registros espectrales por cada punto de análisis sobre el tejido cervical, los cuales se promedian para obtener un solo espectro por punto medido y luego realizar el procesamiento. (Figura 4)
Procesamiento de las señales espectrales obtenidas: para el procesamiento se desarrollaron e implementaron algoritmos en lenguaje de programación Python. A todas las señales obtenidas se les realizó un filtrado digital aplicando un filtro Savitzky-Golay y un ajuste gaussiano. Este ajuste se integra a partir de las ecuaciones presentadas en la sección 7, titulada: simulación del espectro de fluorescencia y de células biológicas 6, donde la intensidad total del espectro está en función de diferentes parámetros como se refleja en la siguiente ecuación:
Donde 𝐶𝐹𝑘𝑥 son los factores de contribución como una función de longitud de onda en función de la longitud de onda de excitación presentados en la EC. 2.
k depende de cada uno de los fluoróforos (k=1: colágeno k=2: elastina, k=3: NADH y k =4: flavinas), 𝜆𝑘𝑥 es la longitud de onda de excitación, 𝐼𝑘𝑥 es la intensidad y 𝑊𝑘𝑥 Es el ancho de la gaussiana a la mitad de la altura mayor de la curva. 𝐴𝜆 y 𝐴𝑥 son la transmitancia de emisión y excitación respectivamente. Finalmente 𝑐𝑘 es la contribución de cada fluoróforo y 𝜆𝑘 es la longitud de onda media de los picos de emisión de cada uno de los fluoróforos presentes en la información espectral de fluorescencia obtenida de los tejidos de cuello uterino ex-vivo. 𝐼𝑡𝑟 es una banda de dispersión Raman del agua y otra variable de ajuste dentro del sistema que se calcularán bajo un medio descrita por: EC. 3
𝐼𝑟𝑟, 𝜆 𝑟𝑟, 𝑊𝑟𝑟 y𝑐𝑟𝑟 son la intensidad, la longitud de onda central, el ancho de la gaussiana a la mitad de la altura mayor de la curva y la contribución de la banda de dispersión respectivamente. Para obtención de las anteriores variables se aplicó al espectro de emisión de fluorescencia el método de mínimos cuadrados no lineales para ajustarlo a la Ec.1.
3. Resultados y discusión
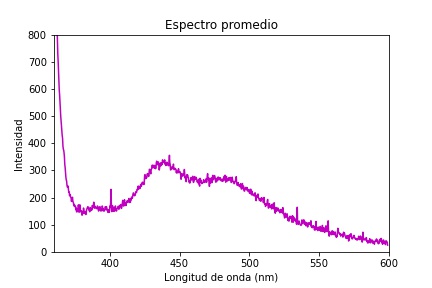
Se utilizó la técnica de espectroscopia óptica de fluorescencia con una longitud de onda en el rango de 335 a 345 nm como fuente de luz electromagnética para excitar la muestra. Se aplicó a 22 tejidos de cuello uterino proporcionados por el ICP, se tomaron medidas en 5 puntos de cada una de las biopsias de cuellos uterinos, lo que resultó en un total de 110 puntos analizados. La Figura 5 muestra el espectro de emisión seleccionado al azar de una de las biopsias en estudio y en la Figura 6 muestra el espectro promedio de los 110 puntos de análisis. Preliminarmente, se observa una respuesta activa en el rango de 380 a 560 nm.
Se hizo una revisión bibliográfica para buscar espectros de emisión del tejido del cuello uterino con características similares de excitación, en el rango de 335 a 345 nm, con el fin de encontrar similitudes o diferencias con los obtenidos. Se analizan los espectros en el rango de 350 a 600 nm, donde se evidencia la formación de tres picos: la primera banda con su pico de emisión en los aproximadamente 350 nm, la segunda banda en los aproximadamente 440 nm y es la de mayor ancho a la mitad de la altura. Finalmente, la última banda se encuentra alrededor de los 500 nm, coincidiendo con los espectros de la literatura 13,14,6.
Sin embargo, en la Figura 7 se evidencia un cuarto pico que pertenece a los 500 a 550 nm en los espectros con algún tipo de carcinoma. En dichas longitudes de onda el espectro obtenido con radicación LED sigue activo y es posible que dependa del estado en el que se encuentra la biopsia o esté circunscrita en la tercera banda. Se hace énfasis en que, el espectro obtenido guarda un alto grado de similitud con los de la literatura y reaccionan según lo esperado, además, dependiendo del punto de análisis cambia la intensidad de la respuesta debido a las propiedades inherentes del tejido cervical que varían según la etapa de la displasia en la que se encuentre presente o no en el tejido. Lo anterior permite aseverar que la fuente de Luz LED funcionó de manera adecuada para excitar los tejidos.

Figura 7 Espectro de emisión de fluorescencia de tejido del cérvix, con 3 tipos de espectros Normal, carcinoma de células escamosas moderadamente diferenciado (MDSCC) y carcinoma de células escamosas poco diferenciado (PDSCC), Tomada y adaptada de 14.
Posteriormente, siguiendo la metodología se hace un procesamiento de la señal a fin de seguir estudiando el comportamiento del espectro, se realizó el ajuste que permite calcular la contribución de cada fluoróforo y descomponer el espectro en gaussianas simulando los valores obtenidos del ajuste con la Ec. 2.
Se permite identificar más fácil el comportamiento de los fluoróforos presentes en el tejido del cuello uterino y comprobar que su ubicación pertenezca a los rangos de emisión encontrados en 4,6,15 y reportados en la Tabla 1 donde se presenta la longitud de onda de absorción y de emisión de algunas moléculas presentes en el tejido del cuello uterino.
Tabla 1 Longitudes de onda de absorción y emisión de algunos fluoróforos presentes en el tejido de cuello uterino
| Molécula | Longitud de onda de absorción | Longitud de onda de emisión |
|---|---|---|
| Triptófano | 280nm | 350-356 nm |
| Colágeno | 325 nm | 390-400 nm |
| Elastina | 320 nm | 400-410 nm |
| NADH | 365 nm | 440-470 nm |
| Flavinas | 440 nm | 520-535 nm |
A continuación, se presentan las gaussianas obtenidas relacionadas con la función de onda de la contribución de las moléculas que se encuentran en el tejido de cuello uterino y que debido a la longitud de onda utilizada en la técnica EOF realizan emisión, como son: el colágeno, la elastina, el NADH y flavinas. Se presenta a la izquierda los 110 puntos de análisis y a la derecha el promedio de estos.
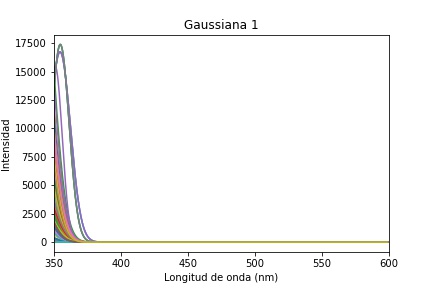
La primera gaussiana es el ajuste que corresponde a información de dispersión y no se la debería considerar dentro de las respuestas de las moléculas del tejido, Figura 8. Las posteriores tres gaussianas mostradas en la Figura 9, 10y 11están dentro de su respectivo rango de emisión de los fluoróforos correspondiendo respectivamente al Colágeno, Elastina y NADH. Se esperaría encontrar una quinta gaussiana correspondiente a las flavinas, pese a ello en el rango de 520-535 nm no se obtiene una respuesta clara, si bien la gaussiana 5 mostrada en la Figura 12 está asociada a las flavinas, el promedio de todos los puntos de análisis está corrido en el rango, pero se observan algunos puntos dentro de este. El comportamiento se asocia a la presencia o no de patologías, al tener una intensidad de emisión baja el ajuste no es capaz de reconocerla en el rango adecuado y la asocia a la gaussiana correspondiente al NADH o la contribución de las flavinas se deba a una banda de menor absorción, pero presente, entre los 350 a 400 nm, como se observa en la Figura 2.3 de 6. Para hacer más detalle en lo anterior se examina un espectro que tenga una contribución de la flavina más clara y en su rango de longitud de onda de emisión, Figura 13.
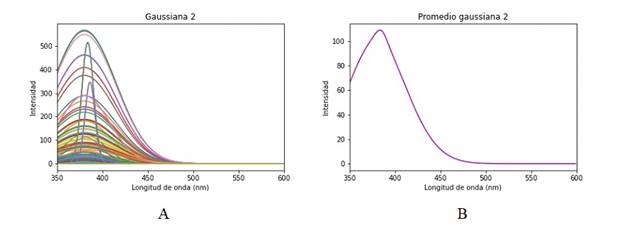
Figura 9 Gaussiana 2 del espectro de emisión de fluorescencia, contribución del colágeno. B Promedio gaussiana 2.

Figura 10 A. Gaussiana 3 del espectro de fluorescencia contribución de la elastina B. Promedio gaussiana

Figura 11 A. Gaussiana 4 del espectro de fluorescencia, contribución del NADH. B. Promedio gaussiana 4.
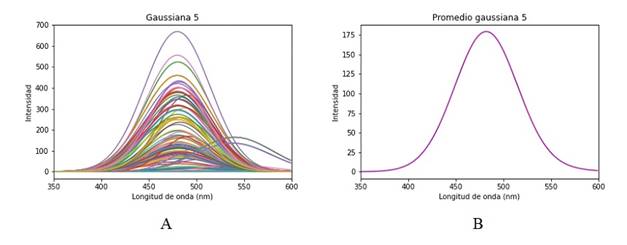
Figura 12 A. Gaussiana 5 del espectro de fluorescencia, contribución de la flavina. B. Promedio Gaussiana 5

Figura 13 Punto de análisis con todas las gaussianas G2. G3, G4, G5 en el rango de longitud de onda de emisión correspondiente a los fluoróforos Colágeno, Elastina, NADH, Flavinas respectivamente.
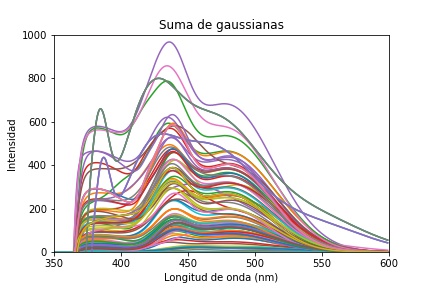
Finalmente, en la Figura 14 se muestra la suma de las gaussianas 𝑆𝐺 que dan el espectro ajustado y filtrado y está relacionada con la Ec. 4
Esta gráfica junto con las anteriores se utilizará para posteriores procesamientos, para clasificar un punto de análisis en patológico o no patológico.
4. Conclusiones
Los espectros generados por la EOF aplicada en tejido de cuello uterino con luz tipo LED son similares a los obtenidos con la espectroscopia óptica de fluorescencia tradicional aplicada con fuentes de luz láser, generando viabilidad para continuar con el procesamiento de los espectros del tejido del cuello uterino con una fuente de excitación de este tipo y generar posteriormente una clasificación según su patología, además, de reducir costos en la aplicación de la técnica, debido a la diferencia de precio que manejan las fuentes láseres con las LED.
Después de realizar el análisis de los espectros, tanto filtrado como ajuste, se ha determinado la contribución de cada fluoróforo y se ha observado que su respuesta se encuentra dentro del rango de longitud de onda de emisión que se espera para el caso del Colágeno, Elastina y NADH. Sin embargo, en el caso de las flavinas, no se ha logrado obtener una contribución en su rango esperado (espectro corrido). Esto se podría deber a que las flavinas tienen su mayor pico de absorción se encuentra entre los 440 a 500nm, pero conservan una menor absorción entre 335 y 345 nm. Por lo anterior, la contribución puede ser menor, no nula y correr la banda del espectro. Para mejorar la excitación del tejido y obtener mejores respuestas espectrales se podría considerar añadir un segundo LED en el rango de mayor excitación de las flavinas.
La EOF aplicada con tecnología LED a tejido de cuello uterino cuenta con potencial aplicación como soporte al diagnóstico médico del cáncer de cuello uterino, debido a que el análisis de los espectros indicó la excitación de los fluoróforos presentes en el tejido cervical y estos cambian su contribución a medida que se cambia la posición de medida en el tejido que puede estar ligado a la presencia o no de la displasia y al estado de esta.