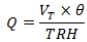INTRODUCCIÓN
Ligado al proceso de extracción y beneficio de la minería se encuentra la generación de grandes volúmenes de drenajes que pueden ser ácidos, neutros o fuertemente básicos, incluso pueden ser radiactivos, corrosivos y/o tóxicos (Nordstrom, 2011). Los drenajes ácidos de mina (DAM) se caracterizan por tener bajo pH (< 4,5), alto contenido de iones metálicos y metaloides disueltos (Zn2+, Fe2+, Al3+, Mn2+, Pb2+, Cd2+, Cu2+, Hg2+, As (III/V), Se (VI), Sb (III/V)) así como sulfatos (Adams et al., 2014). Cuando los DAM son vertidos en la superficie destruyen la capa vegetal, erosionan el suelo y contaminan los cauces de los ríos eliminando los organismos bentónicos e interrumpiendo la cadena trófica (Nordstrom, 2015). Además, los DAM pueden impactar la naturaleza por cientos de años, incluso a perpetuidad, mientras que la contaminación por metales puede extenderse cientos de kilómetros rio abajo de la zona minera (Macías et al., 2017).
Estudios sobre toxicidad del DAM presentan letalidad sobre Daphnia magna y Danio rerio (Chamorro et al., 2018). Además, se ha encontrado que afectan los perfiles genéticos de las comunidades microbianas del suelo, alterando los genes de resistencia a metales (Zhang et al., 2019), y reduciendo la actividad de las enzimas β-glucosidasa, ureasa y fosfatasa ácida y alcalina afectando la degradación de nutrientes (Quiceno-Vallejo et al., 2020). La toxicidad del DAM está relacionada con la concentración de metales como Fe, Zn y Cu los cuales pueden interferir con la división celular, generando estrés oxidativo e inhibiendo el transporte de nutrientes esenciales (Carabassa et al., 2019)
La red internacional para la prevención de drenajes ácidos estimó que cerca de 100.000 sitios mineros en varios países (USA, Australia, Reino Unido, Alemania, Perú y Chile) generan drenajes ácidos que afectan a más de 80.000 km de riberas de ríos y lagos con metales como Cd2+, Cu2+, Ag1+, Zn2+ y As (III/V) (INAP, 2020). Además, a nivel mundial se producen más de 7.300 millones de toneladas de carbón mineral con presencia de DAM en todos los escenarios (WCA, 2020). En Colombia, se han detectado drenajes ácidos en la mayoría de los distritos mineros y en los últimos años se han intentado caracterizar en regiones de explotación de oro y carbón. Distritos mineros como Zipa-Samacá (Cundinamarca y Boyacá), El Tambo-Dovio (Yumbo-Valle del cauca) y Paz del Rio (Boyacá) presentan drenajes con bajo pH (< 3,0), altos contenidos de sulfatos (> 1.500 mg L-1) y presencia de metales disueltos como Fe2+, Zn2+, Mn2+, Cu2+ y Ni2+ (Figura 1). En los estudios realizados por MINMINAS, UPME y la Universidad de Córdoba, (2015) sobre la calidad de los drenajes en regiones mineras del país, se encontró que la mayoría de las minas generan DAM y las concentraciones de metales son superiores a las establecidas por la legislación colombiana (Resolución 631 de 2015).

Figura 1 Drenajes ácidos de mina en varias regiones de Colombia: a y b. Distrito Minero Zipa-Samacá (a. Samacá (Boyacá) 5°27'59" N; 73°33'23" O; b Guachetá (Cundinamarca) 5°23'40" N; 73°39'50" O), c. Distrito Minero Paz del Rio (Páramo de Pisba en Tasco; 5°56'22" N; 72°35'50" O), d. Distrito minero El Tambo-Dovio (corregimiento Pedregal-Yumbo; 3°31 '16" N; 76° 32' 56" O) (Fotografías Vásquez Y).
Diferentes tecnologías para el tratamiento de DAM están disponibles y son conocidas como sistemas activos y pasivos. Los sistemas activos son altamente eficientes y son instalados en minas en operación, pero requieren la continua adición de sustancias químicas neutralizantes (p.e., cal, carbonato de calcio, carbonato de sodio, hidróxido de sodio) generando lodos con metales que requieren un manejo adecuado implicando altos costos para la empresa (Rakotonimaro et al., 2017). Por otra parte, los sistemas pasivos, se recomiendan en la etapa de cierre de mina o en minas abandonadas y reciben su nombre porque utilizan procesos químicos, físicos y biológicos simulando procedimientos naturales y no requieren supervisión ni mantenimiento continuo (Ali et al., 2019).
Los sistemas pasivos pueden ser clasificados como bioquímicos o biológicos con presencia de organismos vivos (plantas, bacterias, hongos, algas) y fisicoquímicos o geoquímicos con materiales inorgánicos neutralizantes (dolomita, carbonatos, silicatos y boratos). Los sistemas biológicos incluyen humedales artificiales (aerobios o anaerobios), reactores bioquímicos pasivos o reactores sulfato reductores, biofiltros de turba o compost y barreras reactivas permeables. Los sistemas fisicoquímicos incluyen drenajes anóxicos calizos (DAC), canales abiertos de piedra caliza (CAC), substratos dispersores de alcalinidad (SDA) y sistemas sucesivos productores de alcalinidad (SSPA; Skousen et al., 2016).
En algunos casos dada la compleja composición de los DAM se requiere de la combinación de sistemas activos y pasivos o de varios sistemas pasivos conformando los sistemas de tratamiento multietapas. Algunos de estos pueden estar compuestos por substratos dispersores de alcalinidad con cascadas de aireación (Rótting et al., 2008) o con puntos de decantación (Macías et al., 2012). Otros combinan reactores bioquímicos con canales de piedra caliza (Genty et al., 2016) o con biofiltros de turba (Clyde et al., 2016) o un sistema dispersor de alcalinidad entre dos reactores bioquímicos (Genty et al., 201 8; Rakotonimaro et al., 2018).
Los sistemas pasivos tienen su origen en el grupo pionero de Huntsman et al. (1978), perteneciente a la Universidad Estatal de Wright (Ohio, Estados Unidos). Ellos identificaron que cuando el DAM ingresaba en un pantano natural, se reducía la concentración de metales y sulfato, mientras incrementaba el pH y la alcalinidad. Estas observaciones de campo permitieron desarrollar la idea de construir humedales artificiales para el tratamiento del DAM y el consecuente desarrollo de los sistemas de tratamiento pasivo. Posteriormente, con base en las investigaciones desarrolladas por Tuttle et al., (1969) sobre el metabolismo de las bacterias sulfato reductoras (BSR) y su potencial uso en el tratamiento DAM, investigadores como Hedin (1994), Dvorak (1992) y Cheong (1998), desarrollaron los protocolos de implementación de los tratamientos pasivos. La propuesta realizada por estos investigadores es aún vigente y está basada en la química del DAM donde se tiene en cuenta la concentración de metales, metaloides, sulfatos, pH, acidez, sólidos solubles y condiciones redox, el caudal de generación de DAM y la topografía del lugar donde se pretende instalar. Skousen et al. (2017), presenta un diagrama de selección del tratamiento pasivo donde resumen los principales aspectos encontrados por estos investigadores.
Uno de los sistemas pasivos biológicos más investigados en los últimos años para la remediación del DAM son los reactores bioquímicos pasivos (RBP), también conocidos como reactores sulfato-reductores, los cuales son fáciles de instalar y operar en áreas montañosas y generalmente remotas. Los RBP son una tecnología limpia que involucra bioprocesos, reacciones químicas y precipitación de metales, minimizando el impacto de los vertimientos ácidos sobre suelos y aguas en las áreas mineras (Skousen et al., 2017; Haakensen et al., 2015).
En este contexto, el objetivo de esta revisión es brindar información reciente acerca de RBP, así como dar a conocer las necesidades de investigación en el tema. Este documento presenta una revisión de literatura sobre la generación química y biológica de los DAM, así como su biorremediación utilizando RBP. También se describen los estudios recientes sobre las comunidades microbianas presentes en los RBP y como estas influyen en su eficiencia. El conocimiento de los conceptos básicos de estos procesos es extremadamente útil para evaluar las posibles aplicaciones, beneficios y limitaciones de estos sistemas de tratamiento utilizados por la biotecnología durante la biorremediación de efluentes mineros.
Generación del DAM
La generación de DAM es un proceso que combina la química y la biología, la primera fase del proceso es química, y ocurre cuando los minerales sulfurados (pe., Calcopirita, Esfalerita, Galena, Arsenopirita, Molibdenita, Pirita, entre otros) presentes en el suelo son expuestos al agua y al oxígeno. Tomando como ejemplo la pirita, a pH neutro se oxida produciendo iones ferrosos (Fe+2), sulfatos (SO4-2) y protones (H+) ocasionando una disminución del pH (Ecuación 1) y provocando un incremento en los sólidos totales disueltos (Nordstrom, 2011).
FeS2 + 3.5O2+H2O - Fe+2 + 2SO4-2 + 2H+ (Ecuación 1)
Cuando el pH desciende (< 4,0), se inicia el mecanismo biológico y la anterior reacción puede ser catalizada por microorganismos que incrementan la cinética de reacción en seis o siete órdenes de magnitud, descendiendo aún más el pH (Sánchez-Andrea, et al., 2014). Durante esta etapa la bacteria ataca al sulfuro mediante su adherencia al mineral y la posterior acción enzimática que involucra transferencia de electrones desde la parte reducida del mineral al oxígeno disuelto (Kefeni et al., 2017). Si el ambiente es muy ácido, con un pH cercano a 3,0 el ion ferroso (Fe+2) se oxidan a ion férrico (Fe+3; Ecuación 2).
4Fe+2 + O2 + 4H+1 - 4Fe+3 + 2H2O (Ecuación 2)
El ion férrico es un fuerte agente oxidante de los minerales sulfurados, incluso más activo que el oxígeno. Cuando el pH decrece este permanece en solución y es reducido por la pirita generando más iones ferrosos (Fe+2) y mayor acidez (Nancucheo y Barrie Johnson, 2014; Ecuación 3).
FeS2 + 14Fe+3 + 8H2O -15Fe+2 + 2SO4-2 +16 H+ (Ecuación 3)
Si el ambiente próximo es muy oxidante y el pH es cercano a 3,0 muchos iones ferrosos se oxidan a iones férricos que reaccionan con el agua, precipitando como hidróxido y generando más acidez (Ecuación 4).
Fe+3 + 3H2O - Fe (OH)3 + 3H+1 (Ecuación 4)
Inicialmente la oxidación de la pirita es un proceso lento, pero a medida que la capacidad de neutralizar del medio se pierde y el pH desciende, la capacidad del Fe+3 para oxidar la pirita incrementa siendo la causa de la rápida formación del DAM. Además, la tasa de formación del DAM se ve afectado por factores como: oxígeno, agua, microorganismos, textura (tamaño de grano y superficie), solubilidad del mineral y concentración de elementos traza (Nordstrom et al., 2015).
La segunda fase del proceso de generación del DAM es biológica, donde las propiedades fisicoquímicas del DAM (pH, fuerza iónica, temperatura) restringen el habitad para unos pocos microorganismos debido al limitado número de reacciones capaces de suministrar energía (Xu et al., 2018). Los microorganismos detectados en el DAM con múltiples mecanismos de resistencia a ambientes extremos pertenecen a los phyla Proteobacteria, Nitrospirae, Firmicutes Acidobacteria Proteobacteria, Aquificae, el phylum candidato TM7 en el dominio Bacteria, y Euryarchaeota y Crenarchaeota en Archaea (Chen et al., 2016; Teng et al., 2017). Leptospirillum, Ferroplas-ma, Ferrovum, Gallionella, Acidiphilium, Acidithrix, Side-roxydans, Acidithiobacillus y Nitrospira son los géneros más comunes con abundancia relativa alta (> 63, 31, 6 y 2%, respectivamente), presentes en biofilms, aguas, suelos/sedimentos y biorreactores con DAM (Villegas-Plazas et al., 2019).
El uso de las técnicas moleculares en el estudio en la microbiología del DAM ha incrementado el conocimiento de la diversidad de microorganismos acidófilos (Chen et al., 2015; García-Moyano et al., 2015; Méndez-García et al., 2015). Estos incluyen bacterias moderadamente termófilas (20°C - 35°C) como Leptospirillum ferrooxidans, moderadamente acidófilas como Thiomonas o Halothiobacillus spp y oxidadoras de hierro como la especie propuesta Ferrovum myxofaciens. Las arqueas involucradas en la generación del DAM, han sido poco estudiadas y sólo se conocen algunas. La más relevante es Ferroplasma acidiphilum aislada de la mina Richmond (California, EE. UU), capaz de realizar la oxido-reducción del hierro (Hallberg, 2010). Otras arqueas pertenecientes los grupos Euryarchaeota y Thermoplasmatales también han sido identificadas en ambientes impactados por DAM (García-Moyano et al., 2015).
Además de los análisis de diversidad a través de tecnologías de secuenciación, en la última década estudios metagenómicos y metatranscriptómicos han permitido no solo el ensamblaje de genomas completos, sino también la identificación del potencial metabólico y funcional de los microorganismos que viven el DAM (Lukhele et al., 2019). Adicional a las rutas metabólicas centrales como la fosforilación oxidativa, biosíntesis de aminoácidos, metabolismo del nitrógeno y el carbono, entre los transcriptos presentes en el DAM se encuentran los relacionados a mecanismos de resistencia al estrés inherentes a un ambiente de condiciones extremas. Por ejemplo, estrategias para sobrevivir a pHs bajos como la expresión de enzimas implicadas en la impermeabilización y generación de potencial de membrana positivo, expulsión y secuestro intracelular de protones. También la expresión de genes relacionados a resistencia a metales (Zn, Fe, Pb, Cd, Co, Cu), y en la reparación de daños al ADN y proteínas (Hua et al., 2015).
Aunque el DAM es considerado un residuo minero, en los últimos años se han realizado estudios en recuperación de elementos y metales de tierras raras (Itrio), ambos con intereses comerciales. El DAM puede albergar Itrio hasta dos órdenes de magnitud más altas que las aguas y océanos continentales. Estos minerales son materias primas esenciales para aplicaciones tecnológicas modernas. En el 2016 la demanda global de este material y sus óxidos llegó a 160.000 toneladas, por lo cual se iniciaron estudios para identificarlos y recuperarlos de los drenajes de mina por métodos biotecnológicos (Ayora et al., 2016).
Reactores bioquímicos pasivos
Los RBPs son columnas o cavidades poco profundas (≥ 1 m) con revestimiento plástico como aislante y empacadas con una mezcla reactiva conformada por substratos orgánicos, inorgánicos y un inóculo microbiano (Adams et al., 2014). Durante el funcionamiento, el DAM pasa a través de la mezcla reactiva en un tiempo de retención hidráulico (TRH) con el fin de incrementar el pH, mientras se reducen los sulfatos y metales (Gusek, 2015). Los RBPs pueden ser utilizados como sistema de tratamiento primario o secundario, pero eso depende de la química del DAM (Figura 2).

Figura 2 Selección de un RBP como tratamiento primario o secundario durante la biorremediación del DAM. (Drenajes anóxicos calizos (DAC), canales abiertos de piedra caliza (CAC), substratos dispersores de alcalinidad (SDA), sistemas sucesivos productores de alcalinidad (SSPA)).
La eficiencia de los RBP durante la remediación del DAM ha sido estudiada y descrita en varios estudios por cerca de 20 años (Tabla 1). Los RBP se pueden diseñar de flujo ascendente, descendente u horizontal, siendo los descendente los más utilizados debido a que se aprovecha la gravedad reduciendo costos, no obstante, se debe tener cuidado en que no se formen caminos de DAM en la mezcla reactiva. Para su instalación en el fondo de cada tanque o columna se coloca un sistema de tubería en forma de cruz, construido con tubos en rejilla o flauta, que permiten colectar el DAM tratado de manera homogénea y conducirlo al puerto de descarga donde se controla el caudal de salida (Figura 3a). Los reactores son ensamblados colocando una capa de gravilla (0=1,0 mm) de aproximadamente 15 cm de alto sobre la tubería en forma de cruz y sobre esta una geo-membrana (malla 25) para evitar la pérdida de materia orgánica y el taponamiento del sistema de salida del DAM tratado (Figura 3b). Luego sobre la geomembrana se coloca la mezcla reactiva o substrato en capas de 15 cm que se compactan suavemente hasta alcanzar una altura máxima de 80 cm (Figura 3c), siguiendo las recomendaciones de Yim et al., (2015). Después, se coloca otra geomembrana, otra capa de gravilla y un disco poroso o plato plástico con pequeñas perforaciones para asegurar la distribución homogénea del DAM en el reactor y finalmente la tapa con el puerto de ingreso del DAM y una pequeña válvula para la salida de los gases (figura 3d) que se pueden llegar a generar durante la actividad microbiana. Aunque se han realizado estudios utilizando reactores sin tapa (Lefticariu et al., 2014) no se ha logrado la eficiencia esperada (> 70%) para la remoción de metales debido a que no se logran las condiciones anaerobias necesarias para la actividad de las BSR.
Tabla 1 Estudios sobre la eficiencia de los RBP durante la remediación del DAM.
| Escala de reactor | Volumen total del reactor (m 3 ) | DAM | substrato orgánico de la mezcla reactiva | TRH (días) | pH | Remoción de sulfato (%) | Remoción de metales (%) | Referencias | |
|---|---|---|---|---|---|---|---|---|---|
| Entrada | Salida | ||||||||
| Banco | 0.011 | Sintético | 48% aserrín, 1 0% de compost de hojas, 30% de cenizas, 1 0% de arena y 2% de lodo municipal. | 0.5 -1 | 2.8 | 6.4 | 12 | Ni 99; Fe 75; Cu 80 | Ali etal., 2020 |
| Banco | 1.6 | sintético | 1 0% compost de champiñón, 20% ocre (arcilla y arena), 30% escoria de acero y 40% caliza | 3 | 3.5 | 6.5 | Fe 94,6; Mn 61,2; Zn 96,7; Al 96 | Madzin etal., 2020 | |
| Banco | 0.2 | Natural | Melaza | 10 | 6.5 | 7.1 | 100 | Zn 73,5; Ni 45 | Nielsen etal., 2018 |
| Banco | 0.06 | Natural | 1 2 % Salvado de arroz, 45% de carbonato, 0.5% de suelo y una capa en la parte superior de cascarilla de arroz | 2 | 3.5 | 7.0 | 77.8 | Zn 83,6; Cu 99; Cd 99 | Sato etal., 2018 |
| Banco | 0.07 | sintético | 1 5% de estiércol de vaca, 10% de compost de hongos, 25% de aserrín de sajo, 1 5% de grava, 20% de piedra caliza y 1 5% de sedimento de humedal como inoculo | 2,4 | 3.5 | 7.2 | 60 | Fe 85; Zn 100 | Vásquez et al. ,2016 |
| piloto | 2.65 | Sintético | 5% astillas de madera, 10% aserrín, 5% gallinaza, 1 0% compost, 8% sedimento de rio, 1 0% arena, 2% urea, 50% carbonato de calcio | 14.6 | 2.8 | 6.7 | 72 | Fe 89,7 | Genty et al,. 2018) |
| Piloto | 50 | Natural | 1 2 % Salvado de arroz, 45% de carbonato, 0.5% de suelo y una capa en la parte superior de cascarilla de arroz | 1.1 | 3.5 | 7.0 | Zn 70,6; Cu 99; Cd 80 | Aoyagi etal., 2017 | |
| Piloto | 0.21 | Natural | 36% compost de hojas, 1 8 % residuos cerveceros de cebada, 36% de pasto, 5% astillas de madera, 2 %suero de leche en polvo, 3% carbonato | 3 | 4.0 | 6.7 | 32 | Fe83;Mn6; Ni 81;Zn 95; Cu 85; Cd 92 | Lefticariu etal., 2015 |
| Planta | 158 | Natural | 50% astillas de madera, 1 0% arena, 20% gallinaza, 1 0 % compost, 20% calcita | 5 | 3.0 | 6.2 | 72.2 | Fe 99,2 | Rakotonimaro etal., 2018 |
| Planta | 840 | Natural | 45% de astillas de madera, 45% de compost de residuos municipales y 1 0% de lodos de aguas residuales | 3 | 6.0 | 7.5 | 100 | Zn 98; Cd 94; Pb 94 | Bailey etal., 2016 https://www2.groundstabili ty.com/force-crag-mine-water-treatm ent-scheme/ |

Figura 3 Montaje y puesta en marcha de un RBP piloto con flujo descendente: a. Tubería de descarga del DAM tratado, b. capa de gravilla y geomembrana, c. mezcla reactiva, d. capa de gravilla de la parte superior, e. reactor completo. (Fotografías Vásquez Y).
Posterior al montaje de los reactores, estos se llenan lentamente con un medio líquido que facilite la adaptación de las BSR para que resistan el cambio brusco una vez ingrese el DAM e inicie la fase de operación. La fase de incubación es de 2 a 4 semanas y se considera terminada cuando se han establecido las condiciones sulfato reductoras (pH > 7,0 y potencial de óxido reducción (ORP) < -300 mV; Postgate, 1984). Algunos autores recomiendan que la saturación del reactor se realice con medio Postgate (Genty et al., 2020; Rakotonimaro et al., 2018) y otros directamente con DAM (Vásquez et al., 2016b; Yim et al., 2015).
En la primera etapa de funcionamiento de un biorreactor, los procesos más importantes de remoción son la adsorción y la precipitación en forma de hidróxidos y de carbonatos. Sin embargo, una vez las condiciones de sulfato reducción están establecidas, la precipitación de sulfuros metálicos (Pb2+, Co2+, Cd2+ Cu2+ Ni2+ Fe2+ Zn2+), hidróxidos (Fe3+, Cr3+, y Al3+) y carbonatos (Fe2+, Mn2+) se convierte en el mecanismo predominante, debido a la facilidad de reacción de los metales y los sulfuros disueltos en el medio (Haakensen et al., 2015). La principal ventaja que da la formación de los sulfuros metálicos es que son muy insolubles, y por lo tanto menos biodisponibles en comparación con otros minerales metálicos (Sánchez-Andrea et al., 2014).
Los reactores pasivos son una promisoria tecnología para la biorremediación de DAM, sin embargo, su éxito en campo requiere de un escalonado proceso de ensayo usando reactores por lotes (Figura 4a), en continuo a escala banco (Figura 4b y 4c) y piloto en campo (Figura 3e) que permiten hacer validaciones de diseño antes de la instalación a escala planta (Adams et al., 2014). Un apropiado diseño piloto en campo es el mejor lugar para ajustar el rango de flujo que debe ser tratado en el reactor de acuerdo con la concentración de metales y sulfatos presentes en el DAM durante la temporada seca y de lluvia. También, se recomienda que la evaluación del sistema piloto se realice durante varios meses, incluso años dependiendo de las fluctuaciones climáticas (ITRC, 2013).

Figura 4 Reactores bioquímicos pasivo en laboratorio: a. reactores por lotes, b. reactores en continuo de flujo ascendente. (Fotografías Escobar M.C).
Previos estudios han determinado que el agotamiento de los substratos orgánicos, la reducción del área reactiva de la mezcla y la pérdida de la permeabilidad son los factores que afectan la eficiencia y longevidad de los reactores en campo (Genty et al., 2020). Estimar correctamente estos parámetros en un sistema piloto puede prevenir errores en el tratamiento a escala en planta. Si en un estudio piloto se presenta este tipo de problemas es posible reevaluar los parámetros hidráulicos, ajustar la composición de la mezcla reactiva o considerar la adición de un pre o postratamiento (Lefticariu et al., 2015). En reactores pasivos los ensayos piloto también permiten determinar las características de la mezcla reactiva posttratamiento, así como su toxicidad para prever la disposición final de los residuos (Jouini et al., 2019). Por último, el sistema piloto permite estimar los costos de la implementación del sistema final en campo, así como los costos de operación durante el tratamiento del DAM.
Mezcla reactiva
La mezcla reactiva está conformada por substratos orgánicos como fuente de energía para los microorganismos, materiales inorgánicos para incrementar el pH y la permeabilidad y un inóculo microbiano con bacterias celulolíticas, fermentadoras y sulfato reductoras (Ali et al., 2019). Los substratos orgánicos pueden ser compuestos de bajo peso molecular o residuos orgánicos lignocelulósicos. Entre los de bajo peso molecular encontramos alcoholes (metanol y etanol), ácidos orgánicos (acetato, lactato, piruvato) y azúcares (glucosa), los cuales tienen la ventaja de ser directamente utilizados por las BSR, pero implican altos costos que los hacen inviables y algunos, como los alcoholes, involucran problemas de seguridad pública cuando son almacenados en grandes cantidades en minas abandonadas.
La cuidadosa selección de una mezcla reactiva capaz de suministrar carbono y nitrógeno orgánico a los microorganismos a corto y largo plazo asegura una mayor eficiencia al biorreactor (Tabla 2). Entre los substratos orgánicos encontramos materiales como el compost (champiñón, pasto, acelgas, gallinaza, estiércol de vaca, caballo u ovejo), residuos lignocelulósicos (desechos de papel, aserrín, paja, astillas de madera), desechos de alimentos (papa, vino, melaza, suero de queso, mosto de cerveza) y aguas residuales domesticas con alta carga orgánica (Sánchez-Andrea et al., 2014). Aunque estos substratos son abundantes y económicos, son de lenta degradación y deben ser reducidos a compuestos de bajo peso molecular por los microorganismos heterotróficos antes de ser utilizados por las BSR (Hao et al., 2014). Si se utilizan substratos lignocelulósicos, éstos deben permitir el arranque, el establecimiento y la operatividad del biorreactor por largos períodos de tiempo, para esto deben contener sustancias fácilmente disponibles (azúcares solubles, aminoácidos, algunas proteínas, almidón, celulosa, hemicelulosa y lignina) (Vásquez et al., 2016a). La celulosa es degradada lentamente hasta moléculas simples, por degradadores de celulosa, y su tasa de descomposición determina a largo plazo la tasa de remoción de sulfato. Finalmente, la lignina que se considera no degradable por los microorganismos anaerobios se recomienda ser adicionada a la mezcla reactiva en baja concentración (Adams et al., 2014).
Tabla 2 Función de los componentes de la mezcla reactiva.
| Función | Material |
|---|---|
| Fuente de carbón y nitrógeno a largo plazo | Astillas de madera, aserrín, conchas de caracol, compost, gallinaza, cascarilla de arroz, heno, ensilajc, marlode maíz |
| Fuente de carbón y nitrógeno a corto plazo | Estiércol, quitina, desechos de cervecería/lácteos, pulpa de remolacha, etanol, acerato, suero de leche, biosólidos |
| Inoculo microbiano | Estiércol de rumiante, residuos de RBPs, lodos de planta de tratamiento, sedimentos de ríos cercanos a zonas mineras |
| Neutralización | Calcita, dolomita, carbonato de calcio, ceniza de madera, quitina |
| Permeabilidad | Arena, gravilla, astillas de madera, roca picada, piedra pómez |
La mezcla reactiva debe contener un inóculo de microorganismos que favorezcan la degradación de celulosa y el establecimiento de las condiciones sulfato reductoras. En estudios por lotes se ha determinado que cuando se utiliza un buen inóculo, la remoción de sulfato y la producción de sulfuros se realiza en períodos más cortos (Pereyra et al., 2012). Como inóculo se puede utilizar sedimentos de lagos y de ríos contaminados con DAM en donde se encuentren microorganismos aerobios que favorezcan el rápido consumo de oxígeno y nitrato, así como organismos anaerobios que se establezcan en el reactor (Biermann et al., 2014). Diferentes estudios indican que, en gran medida el rendimiento y longevidad de los biorreactores depende de la actividad de las BSR (Rezadehbashi y Baldwin, 2018). Sin embargo, las BSR no pueden oxidar directamente fuentes complejas de carbono y dependen del metabolismo de otras bacterias como las fermentadoras y celulolíticas. Esto implica que el número de bacterias degradadoras de fuentes complejas de carbono presentes en el inóculo es otro factor crítico. La inoculación con bacterias de cultivos o con estiércol suple el sistema con BSR, pero estos microorganismos son obligados a readaptarse a los metales, lo que puede demorar el arranque del biorreactor, por tanto, se recomienda el uso de inóculos con BSR provenientes de suelos, sedimentos, desechos industriales y mineros (Hwang et al., 2018).
En cuanto al material de soporte o componente inorgánico que se adiciona a la mezcla reactiva, se reporta que las mayores tasas de reducción de sulfatos en los RBP se logran cuando los microorganismos tienen acceso a una superficie porosa, especialmente si el poro es grande con un buen volumen vacío porque permite que los microorganismos se puedan establecer y llevar a cabo los procesos metabólicos. El diámetro recomendado es > 0,6 mm, de lo contrario el substrato tiende a compactarse y disminuye la conductividad hidráulica debida a la precipitación de sulfuros metálicos y del incremento de la biomasa microbiana (Haakensen et al., 2015).
Al final del ciclo de vida de los RBP la mezcla reactiva debe ser remplazada en su totalidad y se recomienda que la mezcla postratamiento sea manejada apropiadamente evitando contacto con el agua y el oxígeno para prevenir la disolución de los minerales y la consecuente liberación de los metales al ambiente. Estudios previos han mostrado que estos residuos tienen poca estabilidad y su comportamiento ambiental es difícil de predecir (Jouini et al., 2019). También, que dependiendo de la composición química del DAM los residuos se pueden clasificar como no peligrosos e inertes (Simonton et al., 2000), inestables (Genty et al., 2012), peligrosos o inapropiados para el relleno sanitario sin pretratamiento (Kousi et al., 2018).
Propiedades hidráulicas de los RBP
La eficiencia y el funcionamiento a largo plazo de un RBP también dependen de sus propiedades hidráulicas, especialmente de la conductividad, la porosidad de la mezcla reactiva, el tiempo de retención hidráulica y el caudal (ITRC, 2013). La conductividad hidráulica (Ksat) representa la mayor o menor facilidad con la que la mezcla reactiva deja pasar el DAM a través de ella y está gobernada por la ley de Darcy que puede expresarse de la siguiente manera:
Donde Q es el caudal (cm3 s-1), A es el área transversal (cm2), Ah/AL es el gradiente hidráulico (cm/cm). Estimar correctamente Ksat previene problemas futuros de reducción de porosidad y permeabilidad causados por los sólidos suspendidos (oxi-hidróxidos, carbonatos, sulfuros metálicos y biomasa) en el reactor, que pueden afectar la eficiencia y finalmente causar fallas (Genty et al., 2018). El Ksat de la mezcla reactiva debe ser cercano a 10-2 cm s-1, y ajustar la composición en busca de este valor favorece el dimensionamiento de sistema piloto. En los biorreactores pasivos que utilizan compost como único substrato el Ksat tiene un valor cercano a 10-4 cm s-1, y se han observado problemas de compactación y sedimentación en los primeros meses de operación. Por tanto, se recomienda una mezcla reactiva con diferentes substratos orgánicos (cascaras de nuez, astillas de madera) y en especial con aserrín, debido a su alta conductividad hidráulica (desde 10-3 hasta 10-2 cm s-1) que previene el taponamiento (Haakensen et al., 2015).
La porosidad de la mezcla reactiva es otro parámetro hidráulico importante y debe ser estimada antes de establecer el TRH (Adams et al., 2014). Este parámetro aumenta con el porcentaje de aserrín o de astillas de madera presentes en la mezcla reactiva. Estos substratos pueden ocupar los huecos entre la gravilla y separar los componentes incrementando los caminos de flujo (Genty et al., 2018). La porosidad es un parámetro que debe tenerse en cuenta durante la selección de la mezcla reactiva y en el dimensionamiento de los biorreactores en campo.
Una vez seleccionada la mezcla reactiva el siguiente paso es la evaluación de la eficiencia del reactor en flujo continuo y para esto se debe establecer el TRH. Este parámetro hidráulico se define como el tiempo promedio que una gota de DAM se demora desde que ingresa hasta que sale del biorreactor. En estudios de campo se ha encontrado que el TRH de los biorreactores pasivos debe ser mínimo 1,5 días y máximo 4 días, su elección depende de la carga de los metales y el pH del DAM (Tabla 1). En reactores pasivos se ha encontrado que después de la elección de la apropiada mezcla reactiva, el TRH es el parámetro hidráulico más difícil de ajustar. Esto se debe a que un bajo TRH no permite que la actividad bacteriana neutralice la acidez y precipiten los metales, además puede llevar a un lavado de los nutrientes y microorganismos presentes en la mezcla reactiva, mientras que un alto TRH puede ocasionar el crecimiento excesivo de los microorganismos que consumen los substratos orgánicos agotando la mezcla reactiva (Vásquez, et al., 2016b).
El TRH tiene influencia directa sobre la eficiencia de los reactores pasivos y es dependiente del flujo o caudal que ingresa al reactor (Adams et al., 2014) y puede calcularse de la siguiente forma:
Donde Q es el caudal (cm3 s-1), VT es el volumen total de la mezcla reactiva (cm3) y θ la porosidad de la mezcla reactiva. El volumen de DAM que ingresa al reactor y el tiempo de residencia tiene impacto directo sobre la eficiencia, si es muy alto puede colmatar el biorreactor, sobresaturando la mezcla reactiva e inhibiendo la actividad de los microorganismos. Por el contrario, si es muy bajo, el substrato puede oxidarse y liberar los metales que ya habían sido precipitados y disminuir la actividad de la comunidad microbiana (Skousen et al., 2017). Por otra parte, si el caudal incrementa significativamente por encima del caudal de diseño, la comunidad microbiana puede sufrir un efecto de lavado, reduciendo la eficiencia del reactor y requiriendo mantenimiento adicional (Vásquez et al., 2016b).
Degradación de materia orgánica en los RBP
En ambientes anaerobios con presencia de sulfato, la degradación de la materia orgánica requiere de la interacción de diferentes grupos microbianos, en la cual el producto metabólico final de un grupo es el substrato de otro, hasta que la oxidación completa se lleve a cabo. Los microorganismos celulolíticos y fermentativos, son los primeros en hidrolizar polímeros de gran peso molecular (polisacáridos, lípidos, proteínas) en azúcares, ácidos grasos y aminoácidos, entre otros, y los microorganismos fermentadores generan a partir de ellos: H2, CO2, acetato, alcoholes y ácidos orgánicos (lactato, buti-rato y propionato). Las bacterias acetogénicas transforan estos ácidos orgánicos y alcoholes en acetato, H2 y CO2 (Schuchmann y Müller, 2016).
Por su parte los microorganismos sulfato reductores pueden llevar a cabo la degradación de los compuestos orgánicos hidrolizados o fermentados de forma incompleta hasta acetato o de forma completa hasta CO2 (Hao et al., 2014). Las BSR utilizan gran variedad de donadores de electrones: compuestos orgánicos (lactato, piruvato, malato, succinato, formiato, etanol), carbohidratos pequeños (glucosa, sacarosa, fructosa), ácidos grasos de cadena corta (acetato), ácidos grasos de cadena larga y compuestos aromáticos (benzoato, fenol, tolueno) (Han et al., 2016).
El lactato es el mejor substrato para las BSR porque es buen donador de electrones, debido a que produce tres moles de bicarbonato por cada dos moles de substrato consumido, ayudando a neutralizar el pH de los efluentes en los RBP (Xu et al., 2018). Sin embargo, no todas las especies de BSR pueden oxidar el lactato ni el etanol a CO2. Solo algunas pueden oxidar parcialmente moléculas orgánicas simples en acetato, y muy pocas pueden usar solo el acetato (Brahmacharimayum et al., 2019).
En ambientes anaerobios con bajo ORP (< - 300 mV) existe competencia por los substratos disponibles. Los microorganismos metanogénicos utilizan los productos finales de todos los procesos anteriores (H2, CO2 y acetato) para generar metano (CH4), y compiten con las BSR debido a que ocupan ecosistemas análogos en los que ambos utilizan acetato e hidrógeno molecular como donador de electrones (Laothanachareon et al., 2014). Cuando la concentración de sulfato está en exceso, generalmente los microorganismos metanogénicos son pobres competidores, tanto en ambientes naturales como en sistemas artificiales. Se cree que el paradigma de la predominancia de BSR en ambientes con altas concentraciones de sulfato y de metanogénicos en ambientes con baja concentraciones de sulfato, se debe a que las BSR tienen ventajas cinéticas y termodinámicas, como por ejemplo bajos valores de la constante de afinidad (Km) tanto para el H2 como para el acetato (Stams et al., 2019). No obstante, aun con excesos de sulfato, se ha reportado la coexistencia de estos dos microorganismos (Pereyra et al., 2008); esto ha sido atribuido principalmente a diferencias en la colonización y en las propiedades de adhesión de las comunidades microbianas, o a la variabilidad en la toxicidad del sulfuro.
Las BSR son anaerobias estrictas, sin embargo, algunas especies pueden tolerar e incluso reducir el oxígeno por períodos de tiempo muy limitados. Algunos también pueden utilizar el sulfito (SO32-), tiosulfato (S2O3 2-) o azufre como aceptores de electrones alternativos, y reducirlos de igual manera, a sulfuro (Bell et al., 2020). Existen otros compuestos que sirven de aceptores finales de electrones para las BSR, sin embargo, estos procesos de reducción no se encuentran acoplados al crecimiento de estos microorganismos. Entre estos se encuentran: el hierro, uranio, seleniato, cromato y arsenato. Por último, también se ha observado que las BSR pueden usar compuestos orgánicos, como el fumarato o el dimetilsulfóxido, como aceptores finales de electrones, para su crecimiento (Hao et al., 2014).
Comunidades microbianas encontradas en RBP
Se ha observado que en los RBP alimentados con moléculas de bajo peso molecular (etanol, metanol, lactato) la población microbiana está conformada en su mayoría (95%) por BSR. Sin embargo, en biorreactores empacados con mezclas reactivas se ha evidenciado mayor diversidad de bacterias celulolíticas y fermentativas, capaces de degradar la materia orgánica con capacidad para donar electrones y afectar la cinética de formación de sulfuros metálicos, mientras que las BSR se encuentran en baja proporción (5 - 10 %) (Hiibel et al., 2008; Rezadehbashi y Baldwin, 2018). Se ha establecido que la comunidad microbiana en los reactores pasivos está relacionada con factores como el inóculo (Pereyra et al., 2010), los substratos orgánicos (Song et al., 2012a; Song et al., 2012b; Lefticariu et al., 2015), el tiempo de operación (Aoyagi et al., 201 8), pH (Aoyagi et al., 201 7; Fan et al., 2019) y el tiempo de retención hidráulica (Aoyagi et al., 2017; Vásquez et al., 2018; Xu et al., 2018).
Los phyla dominantes en los reactores pasivos empacados con material ligno-celulósico corresponden a Chlo-roflexi, Chlorobi, Proteobacteria, Firmicutes, Actinobacteria, Planctomycetes, Spirochaetes, Acidobacteria, Bacteroidetes, Verrucomicrobia, Gemmatimonadetes, Synergistetes, Caldiserica, Cyanobacteria, Spirochaete y OP11 (Drennan et al., 2016; Mirjafari y Baldwin 2016; Baldwin et al., 2016; Aoyagi et al., 2018; Sato et al., 2019). Tambien, se han reportado más de 100 géneros siendo los microorganismos heterótrofos que degradan celulosa y otros polisacáridos los más abundantes, 25 al 30% del total de la comunidad. Los géneros celulolíticos de mayor abundancia reportados en estudios de biorreactores pasivos corresponden a Bacteroides, Clostridium, Acetivibrio, Spirochaeta, Ruminococcus y Cellullomonas. De igual manera, los fermentativos más reportados son Palu-dibacter, Clostridium, Devosia y Treponema (Baldwin et al., 2016).
El análisis comparativo de secuencias del 16SrRNA agrupa a los microorganismos reductores de sulfato en siete linajes filogenéticos: cinco de bacteria y dos de archaea. La mayoría de BSR pertenecen a la clase mesofílicas Gram-negativas Deltaproteobacteria (~23 géneros). Las familias miembros de esta clase que cuentan con un mayor número de especies son Desulfobacteraceae, Desulfobulbaceae y Desulfovibrionaceae, cuyo género más numeroso es Desulfovibrio spp. El siguiente grupo más numeroso es la clase Clostridia conformada con 3 géneros de bacterias Grampositivas: Desulfotomaculum, Desulfosporosinus y Desulfosporomusa (Liu et al., 2018). Las tres últimas clases dentro del dominio Bacteria, están conformadas por BSR termófilas: Nitrospirae, Thermodesulfobacteria y Thermodesulfobiaceae (Brahmacharimayum et al., 2019).
Con el desarrollo de las técnicas moleculares se han reconocido 40 géneros que han sido agrupados por su fisiología y rol ecológico en completas (22 géneros) e incompletas (16 géneros) oxidadoras de compuestos orgánicos y un remanente formado por Desulfotomaculum y Desulfomonile, que presentan las dos características (Hao et al., 2014). Diversos géneros han sido encontrados en los biorreactores pasivos, pero los de mayor abundancia son Desulfovibrio, Desulfobulbus, Desulfomicrobium que pertenecen al grupo de las incompletas oxidadoras y Desulfobacter que es el género dominante de las completas oxidadoras (Sánchez-Andrea et al., 2014).
Los métodos tradicionales de cultivo no se consideran eficaces para cuantificar grupos microbianos reductores de sulfato, celulolíticos y fermentadores, involucrados en los procesos biogeoquímicos de los reactores, debido a que requieren mucho tiempo y subestiman el número de bacterias. Además, el conteo por la técnica del número más probable limita el conocimiento de las comunidades microbianas, mientras que técnicas moleculares modernas permiten cuantificar y entender la dinámica de las comunidades en diferentes ambientes. Los métodos moleculares, pueden proveer información precisa sobre el número y posible función, mediante la amplificación de genes funcionales (Lukhele et al., 2019). La cuantificación de las BSR se ha llevado a cabo mediante el uso de gen dsrA que codifica para la subunidad a de la enzima desasimilativa sulfato reductasa encargada de catalizar la reducción del (bi) sulfito a sulfuro (Liu et al., 2018). Este gen ha sido ampliamente utilizado como marcador molecular durante la detección y enumeración de BSR en diferentes ambientes con gran eficiencia debido a que está evolutivamente conservado y es un gen constitutivo (Zhang et al., 2016). Para el caso de las bacterias celulolíticas, la hidrólisis de celulosa es catalizada por enzimas pertenecientes al grupo de las glucosidasas, las cuales están dividas según su estructura y función en familias de enzimas. La mayoría de las glucosidasas de microorganismos anaerobios pertenecen solo a tres familias: 5, 9 y 48 (Pereyra et al., 2012). La familia 48 incluye en su mayoría exonucleasas, codificadas por el gen cel48, de única copia en los genomas de los microorganismos celulolíticos (Hua et al., 2018). En casi todas las bacterias fermentativas (microorganismos anaerobios estrictos o facultativos), los electrones reducidos se canalizan a H2 través de la enzima hidrogenasa (Ding et al., 2016). Por último, se conoce que el gen hydA codifica para una proteína de 350 aminoácidos que corresponde a la subunidad alfa del hierro hidrogenasa (Poudel et al., 2016).
La degradación de celulosa, la fermentación y la sulfato reducción, son procesos enzimáticos que coexisten en los reactores para la remediación de DAM. La cuantificación de genes que codifican estas enzimas es ventajoso porque da información funcional directa, en comparación a las técnicas de secuenciación del gen 16S rRNA (como el ilumina). La cuantificación de los genes funcionales dsrA, cel48 y hydA por qPCR ha permitido el estudio de su dinámica bajo la influencia de diferentes factores que determinan la eficiencia de los RBP. En previos estudios con estos genes se ha demostrado cómo la composición de los substratos orgánicos (Hiibel et al., 2011), el efecto de la bioaumentación y bioestimulación (Pereyra et al., 2012), las condiciones medio ambientales y de operación (Vásquez et al., 2018) de los biorreactores pueden incrementar las comunidades microbianas, y por lo tanto el éxito para la remoción de sulfatos y metales.
Aunque se han realizado importantes estudios sobre la diversidad microbiana asociada a la biorremediación del DAM, investigaciones recientes (Aoyagi et al., 2018; Hessler et al., 2018; Rezadehbash y Baldwin, 2018; Fan et al., 2019) utilizando técnicas de secuenciación masiva han detectado nuevos grupos sin asignación taxonómica, y han logrado el ensamblaje de genomas completos de nuevos representantes de BSR a partir de metagenomas de biorreactores (Almstrand et al., 2016). Sugiriendo que el potencial metabólico involucrado en la degradación de la materia orgánica y de la biotransformación de metales es más diverso de lo conocido hasta ahora. Recientemente, se ha establecido que el metabolismo bacteriano influye sobre la especiación de los metales y sulfuros, conduciendo a una rápida atenuación de la contaminación por DAM (Aguinaga et al., 2019).
Factores que afectan la eficiencia de los RBP
La eficiencia de un reactor pasivo para remediar el DAM se determina por el incremento del pH y la alcalinidad, así como por la remoción de sulfatos y metales. El pH del DAM debe incrementarse antes y durante el tratamiento hasta un valor cercano a la neutralidad. Un pH > 7,0 asegura una óptima remoción de sulfatos y metales mientras que a valores < 5,0 se inhibe la sulfato reducción y se incrementa la solubilidad de los sulfuros metálicos (Xu y Chen, 2020). Además, a bajo pH, la presencia de ácidos orgánicos producidos durante la fermentación puede inhibir el sulfato reducción. Los ácidos orgánicos a bajo pH pueden difundir a través de la membrana celular y una vez dentro, el pH intracelular (neutro) favorece la disociación del ácido, liberando protones que terminan afectando el pH celular (Hao et al., 2014). La adición de carbonato de calcio a la mezcla reactiva durante el montaje del reactor favorece el incremento del pH durante los primeros meses, pero durante el tratamiento, la alcalinidad es generada por la actividad de las BSR.
Otro factor que reduce la eficiencia de los biorreactores pasivos es la concentración de sulfuros disueltos en el caudal, el cual inhibe los microorganismos cuando una de sus formas (H2S, HS- o S-2), dependiendo del pH, ingresa a la célula y se combina con el hierro de la ferrodoxina, los citocromos u otras enzimas con centros catalíticos metálicos, causando inhibición en la cadena transportadora de electrones (Sánchez-Andrea et al., 2014). Sin embargo, los sulfuros metálicos también pueden generar toxicidad e inhibir los microorganismos por recubrimiento de las células causando dificultad para acceder a la materia orgánica (Shahsavari et al., 2019). El efecto de los sulfuros sobre los microorganismos presentes en los reactores pasivos depende del pH, la temperatura, tipo de fuente de carbono y concentración de hierro y sulfato (Hao, 2014). En un biorreactor pasivo se espera que el ORP sea negativo (<-100 mV) para proveer un ambiente sustentable para los microorganismos anaerobios. Sin embargo, cuando ingresa oxígeno disuelto al reactor a través del DAM, el ORP aumenta afectando los microorganismos y reduciendo la eficiencia. La concentración de oxígeno disuelto en el DAM para que la sulfato reducción no sea inhibida debe estar entre 0,1y 1,0 mg L-1, pero cuando hay materia orgánica presente se pueden formar micro-nichos donde los microorganismos están protegidos (Hao et al., 2014). Por otro lado, la eficiencia y el funcionamiento del biorreactor a largo plazo también dependen de la composición química del DAM, las variaciones del flujo, la conductividad hidráulica, la porosidad de la mezcla reactiva y el TRH.
Conclusiones y necesidades de investigación
Aunque los reactores pasivos son una opción efectiva para la remediación de los DAM, y los efectos de los parámetros de diseño sobre la eficiencia de los reactores han sido descritos, todavía no se entiende bien la relación entre los parámetros de operación y la comunidad microbiana durante su funcionamiento (Tsai et al., 2019). Este tipo de estudios son esenciales para asegurar el funcionamiento de los biorreactores y ayudar a mejorar su diseño y rendimiento a largo plazo. Hasta ahora la mayoría de las investigaciones se han enfocado en correlacionar la eficiencia de los biorreactores con el conteo de BSR dejando de lado las bacterias celulolíticas y fermentadoras, que son las encargadas de degradar fuentes de carbono complejas, haciéndolas disponibles a las BSR.
A pesar de los avances en el tratamiento de DAM a nivel mundial, todavía se necesitan mayores estudios sobre la optimización de estos sistemas en campo, empleando TRH más cortos y determinando correctamente la mezcla reactiva empleando residuos orgánicos de cada región. De igual manera, los microorganismos involucrados en la reducción de los sulfatos durante la remediación en campo y los factores que afectan su desempeño han sido poco estudiados. El conocimiento de la comunidad microbiana presente en estos sistemas ha sido lento y no se sabe cómo sus interacciones pueden ayudar a mejorar la eficiencia durante el tiempo de operación o en el futuro cuando el reactor esté terminando su vida útil.
En Colombia también es necesario evaluar a escala piloto en campo y con DAM natural las condiciones seleccionadas en reactores a escala de laboratorio. El conocimiento que se obtenga desde esta aproximación ingenieril y microbiológica permitirá comprender con más detalle las condiciones óptimas para el diseño de reactores pasivos para el tratamiento de DAM en campo. Además, se brindará una opción al gremio minero para incorporar procesos químicos y biológicos que contribuyan con el uso de tecnologías limpias durante la extracción del carbón y oro para la obtención de productos que minimicen los impactos ambientales, económicos y sociales.