INTRODUCCIÓN
El capitán de la sabana (Eremophilus mutisii) es una especie íctica endémica del altiplano Cundiboyacense, emblemática dentro de la cultura andina. Pertenece a la familia Trichomycteridae; su distribución geográfica, se localiza en la cuenca del río Magdalena, según Maldonado-Ocampo et al. (2008) y en la subcuenca del Altiplano Cundí-boyacense, entre los 2.500 y los 3.100m s.n.m., donde la temperatura ambiental no sobrepasa los 18-20°C (Mojica et al. 2012).
Los principales estudios realizados en el E. mutisii son ecológicos (Flórez & Sarmiento, 1989), biométricos (Cala, 1985) y reproductivos (Rodríguez & Rosado, 1993), por lo cual, existe un vacío en el conocimiento respecto a las primeras etapas de vida de la especie, indispensables para un posible aprovechamiento piscícola. Según Feiden et al. (2006) es importante el estudio del desarrollo de embriones y larvas, con dos propósitos principales: conservación y producción en cautiverio, justificando el estudio de las características morfofisiológicas del desarrollo embrionario, que proporciona información sobre su ciclo vital, permitiendo un mejor manejo de la especie.
El desarrollo embrionario es utilizado para estudios ontogénicos, modelos experimentales y evaluaciones, acerca de las cualidades y los efectos de sustancias tóxicas en el ambiente acuático (Ninhaus et al. 2006). Estudios en bagre yaque (Leiarius marmoratus) (Zapata-Berruecos et al. 2008) y en bagre rayado (Psedoplatystoma sp.) (Marques et al. 2016) muestran que entre especies de la misma familia existen marcadas diferencias, en cuanto a la cronología del desarrollo embrionario, lo cual, hace necesario realizar trabajos, para conocer la embriología de cada especie, en particular.
El pez E. mutisii ha sido catalogado como el bagre de agua dulce con mayores probabilidades de piscicultura en zonas frías alto andinas (Rosado & González, 2007). La disminución poblacional de E. mutisii o, incluso, su desaparición en algunos cuerpos de agua naturales, ocasionó que, en el 2012, fuera catalogada como especie vulnerable en el Libro Rojo de los Peces (Mojica et al. 2012).
Al respecto, González-M. et al. (2014), encontraron altos niveles de Plomo en el músculo, en el 93% de los ejemplares de capitán de la sabana muestreados, sin observar efectos fisiológicos o patológicos derivados de este hallazgo y recomiendan mantener una vigilancia sobre las implicaciones que pueda tener este hallazgo al futuro, en el estado sanitario de la especie.
Mojica et al. (2012) sugieren medidas de conservación, propuestas para la protección de hábitat, educación ambiental y el desarrollo de programas de reproducción; no obstante, se requieren estudios de la etapa de incubación y de larvicultura de esta especie, que permitan, a futuro, la obtención de alevinos de esta especie.
Por tanto, el objetivo del presente trabajo fue describir morfológica e histológicamente, el desarrollo embrionario de E. mutisii, desde la fecundación hasta la eclosión de las larvas.
MATERIALES Y MÉTODOS
Los embriones, se obtuvieron de individuos adultos y maduros sexualmente de E. mutisii, capturados en la represa del Sisga, ubicada en el municipio de Chocontá, Cundinamarca (5°05’17”N 73°43’18”W). Estos peces fueron transportados al laboratorio, ubicado en las instalaciones de la Unidad Académica El Remanso, de la Universidad de Ciencias Aplicadas y Ambientales U.D.C.A, sede Bogotá, situada a 2.600m.s.n.m. y temperaturas que oscilan entre 9 y 20°C (IDEAM, 2016).
Una vez adaptados los animales al cautiverio, se procedió a realizar el protocolo de inducción hormonal, con extracto de hipófisis de carpa (EPC). El número de animales utilizados en el protocolo de reproducción fue 2 hembras y 3 machos.
El protocolo utilizado fue el propuesto por González et al. (2017), donde la dosis total para las hembras fue de 5,5mg de EPC/kg, de peso de la hembra, con un intervalo de 12 horas; las modificaciones planteadas frente a este protocolo fueron dadas en una mayor dosis para las hembras y cambio en los intervalos de dosis, puesto que la primera dosis fue de 0,25mg/kg de peso de la hembra; la segunda dosis, 0,5mg/ kg de peso de la hembra, 28 horas después de la primera dosis y, la tercera, fue 5mg/kg de peso de la hembra, 12 horas después de la segunda dosis. A los machos, se les hizo una sola aplicación de 4mg/kg de peso de cada macho, a la misma hora de la tercera dosis de la hembra.
Los ovocitos y el semen fueron obtenidos por presión abdominal, 24 horas después de la última dosis, a 15°±0,5°C. El proceso de fertilización, se realizó mezclando el esperma y los ovocitos; luego, se adicionó a la mezcla agua, para activar los espermatozoides y permitir la hidratación de los huevos. Una vez fecundados, se trasladaron a incubadoras tipo bandeja, en tanques de plástico de 250L, con sistema de recirculación, filtro biológico y temperatura controlada, en un promedio de 15±0,6°C.
Para determinar la duración del desarrollo embrionario, se consideró, como momento cero, la hora de activación de los gametos y como hora final, el momento en que el 90% de los embriones de una muestra aleatoria, alcanzó la eclosión (Jhonston et al. 1995).
La toma de muestras, se realizó cada 60 minutos, durante las primeras doce horas post-fertilización (HPF); a partir de aquí y hasta la eclosión, las muestras fueron fijadas cada 6 horas. En cada muestra, se tomó, al menos, 10 unidades, fijadas en formalina bufferada al 4%, para su posterior análisis descriptivo.
En total, se observaron 23 muestras, en las 3 bandejas de incubación. Con estas, se procedió a la descripción del desarrollo embrionario, utilizando un microscopio óptico Nikon Eclipse Ci con cámara Nikon DS-Fi 1 y pantalla digital Nikon Sight.
Consecutivamente, las muestras fueron fijadas en formol bufferado 10%, para rutina histológica, sometidas a un proceso de deshidratación e inclusión en parafina (MERCK, punto de fusión 52-54°C) (Agarwal, 1996; Jaramillo et al. 2009); se realizaron cortes transversales de 5µm de espesor, en un microtómo rotatorio, los cuales, se tiñeron con la técnica de Mayer y Harris, hematoxilina-Eosina (Agarwal, 1996). Seguidamente, estas se analizaron y se fotografiaron, para su descripción histológica, en un microscopio Nikon eclipse E-600 y cámara digital Nikon DXM 1200.
RESULTADOS Y DISCUSIÓN
El desove, se realizó a las 24 horas, posteriores a la aplicación de la dosis definitiva a los reproductores, bajo las condiciones de cautiverio, en las que la temperatura de mantenimiento fue de 15,2±0,5°C, que corresponde a 364 horas grado. En condiciones semejantes, González et al. (2017) encontraron que el periodo de respuesta fue a las 290 a 345 horas grado. El procedimiento completo, desde la primera dosis hormonal y el desove, tuvo una duración de 64 horas.
Los ovocitos de E. mutisii, al momento del desove, son esféricos, con diámetro promedio de 1.270 micras; presentan abundante vitelo, de color verde claro (Figura 1a). Al momento de la hidratación, se visualizó la presencia de una doble membrana. En esta etapa, el ovocito aumenta de tamaño, alcanzando 1.484 micras de diámetro, la primera membrana y 2.037 micras de diámetro, la membrana más externa (Figura 1b, 1c y 1d). De la hora cero a la hora uno HPF ocurrió la diferenciación del polo animal, por la presencia de los pronúcleos y el polo vegetal, por la concentración de vitelo (Figura 1h).
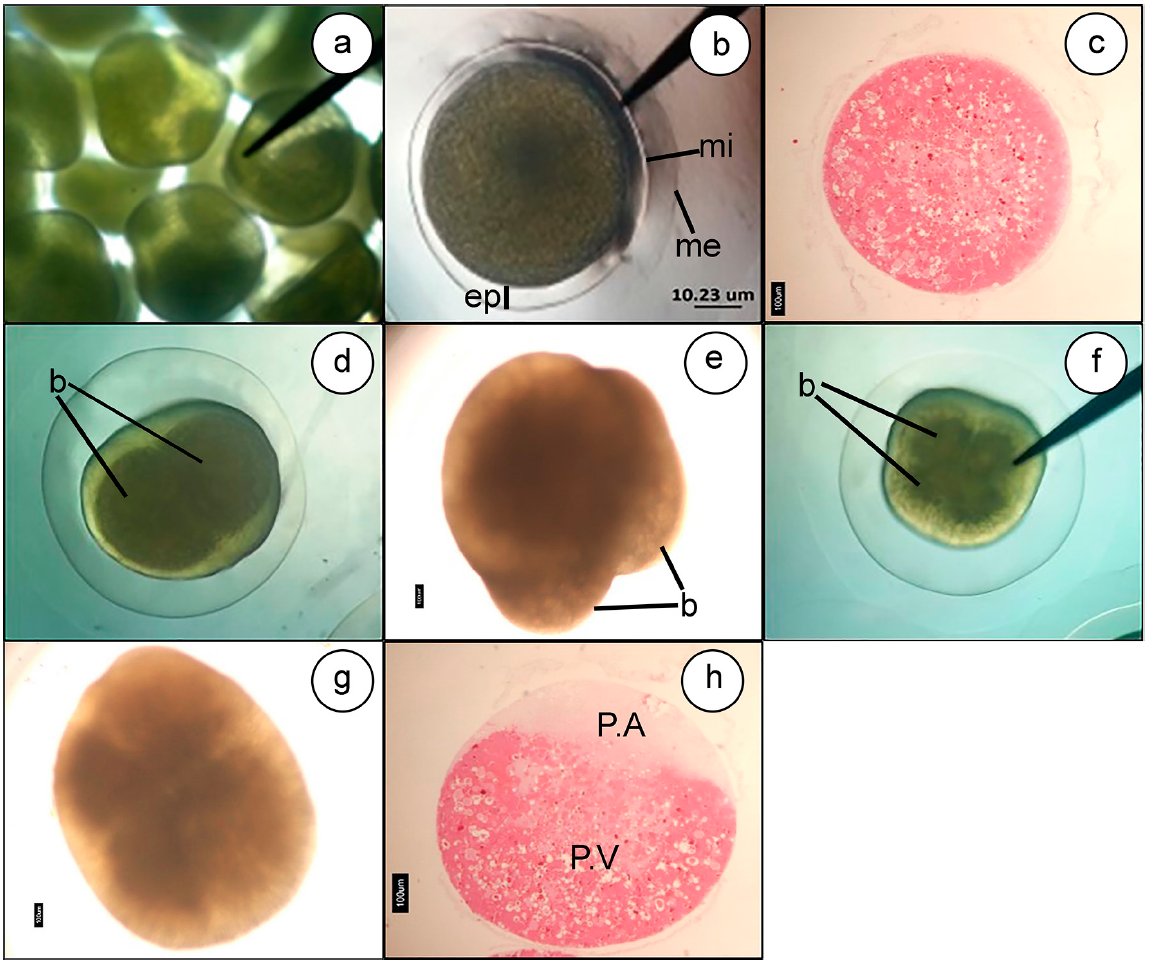
Figura 1 Ovocitos y clivaje de Eremophilus mutisii. a. Huevos maduros (4x); b. Huevo recién fertilizado (4x), 0 horas post-fertilización (HPF); c. Huevo en tinción H&E (4x), 0 horas postfertilización (HPF); d y e. Primeras divisiones celulares (4x), 2 horas postfertilización (HPF); f y g. 4 divisiones celulares (4x), 3 horas postfertilización (HPF); h. Diferenciación del polo vegetal y animal (4x), 2 horas postfertilización (HPF), tinción de H&E. mi) membrana interna; me) membrana externa; ep) espacio perivitelino; c) Corion; P.A) Polo animal; P.V) Polo vegetal; b) Blastómero.
Los huevos de los peces, se pueden clasificar como telolecitos, debido a que acumulan el vitelo en el polo vegetal y presentan una división parcial o meroblástica durante los primeros estadios del desarrollo (Ninhaus et al. 2006). Los huevos de E. mutisii, se ajustan a esta clasificación y, por lo tanto, presentan divisiones meroblásticas o parciales, limitadas al polo animal, como se describe también para el pez P. grosskopfii (Valbuena-Villareal et al. 2012).
Las observaciones del desarrollo embrionario en E. mutisii muestran que el tiempo hasta la eclosión es más largo que en otras especies de siluridos de aguas cálidas (Marques et al. 2008; Faustino et al. 2007; Honji et al. 2012).
La presencia de doble membrana, se debe a una adaptación morfológica que brinda protección al embrión en aguas con alta turbidez (Cardoso et al. 1995; Pereira et al. 2006). Esta característica, se presenta en ovocitos de peces siluriformes, como el Pseudoplatystoma sp. (Díaz-Olarte et al. 2010; Marques et al. 2008), coincidiendo con nuestros hallazgos. Adicionalmente, tiene función de protección del embrión y adhesión a diversos materiales, para evitar daños en los mismos.
Respecto al análisis histológico, se aprecia externamente una estructura delgada, ligeramente basofílica, soportada sobre una lámina eosinofílica, la cual, corresponde a la membrana vitelina, separada de las otras estructuras del huevo, por un espacio claro, que corresponde a la cápsula.
Periodo de segmentación. La blastomeración es de tipo meroblastico; el primer clivaje ocurrió a las 2HPF (Figura 1d, 1e), dividiendo el blastodisco verticalmente, para formar dos células de igual tamaño. La segunda división ocurrió perpendicular a la primera, a las tres HPF, originando cuatro blastómeros (Figura 1f,1g).
A nivel histológico, se empieza a observar la agrupación del material particulado eosinofílico, que conforma el vitelo hacia uno de los polos, denominado polo vegetal; este material es el más abundante y ocupa el 80% del huevo. Hacia el otro extremo, se empieza a depositar el material eosinofilo tenue homogéneo, haciendo evidente el polo animal; este material ocupa el 20% del embrión (Figura 1h).
A las 4HPF, la división fue doble y paralela al primer eje del clivaje (Figura 2a, 2b, 2c, 2d). El cuarto clivaje ocurrió a las 5HPF, originando 16 blastómeros (Figura 2e, 2f).

Figura 2. Clivaje de Eremophilus mutisii. a, b y c. 8 divisiones celulares (4x), 4 horas postfertilización (HPF); d, e y f. 16 di-visiones celulares (4x), 5 horas postfertilización (HPF); G, H y I) 32 células (4x), 6-7 horas postfertilización (HPF); j, k y l. 64 células (4x), 7-8 horas postfertilización (HPF); c, f, i y l. Tinción en H&E. t) Tabiques o Septos.
Los primeros clivajes observados en la especie estudiada, siguen el mismo patrón de segmentación que los reportados por otros silúridos, tales como Rhamdia quelen (Pereira et al. 2006), P. grosskopfii (Valbuena-Villareal et al. 2012), P. corruscans (Marques et al. 2008), Zungaru jau (Marques et al. 2017) y en el hibrido de P. corruscans x P. fasciatum (Faustino et al. 2007).
Adicionalmente, se empieza a hacer evidente la segmentación, división embrionaria o clivaje del manto embriónico, limitada en esta especie a la zona del blastodisco (segmentación meroblástica discoidal). Esta segmentación, se hizo evidente por la presencia de 8 estructuras de gran tamaño, con aspecto de cúpula o domo, formando un montículo en la superficie del polo animal, las cuales, corresponden a las células (blastómeros), que se forman en la fase de clivaje en esta hora. Estas células contienen un material eosinofílico tenue homogéneo y, a pesar de presentar una ligera separación entre ellas por un tabique o septo, todas se encuentran interconectadas (Figura 2c).
Del quinto al sexto clivaje, se originan 32 blastómeros (Figura 2g, 2h, 2i) y 64 blastómeros (Figura 2j, 2k, 2l), lo cual, dificulta su visualización y, por lo tanto, su conteo, en virtud de tamaño y disposición de las células.
El tiempo transcurrido desde la fertilización hasta llegar al quinto clivaje, 32 células y sexto clivajes, 64 células, fluctuó entre 6 y 8HPF, en E. mutisii. Para otros siluridos, como el Pseudoplatystoma sp., el tiempo para este estado embrionario fluctúa entre 1 y 2HPF (Díaz-Olarte et al. 2010). Cabe resaltar que la diferencia de temperatura del agua en que viven estas especies contribuye a tiempos de desarrollo más cortos.
También, se comenzaron a observar algunas vacuolas en el citoplasma de estas células y los pronúcleos basofílicos se hacen un poco más visibles y toman forma de línea o barra. Los tabiques o septos delgados que separan las células son mucho más prolongados, pudiéndose observar casi una completa separación entre las células, aunque todavía se mantienen interconectadas por pequeñas áreas (Figura 2c, 2f, 2i, 2l).
Periodo de blastulación. La blástula, se observó como una capa celular que empieza a envolver el vitelo, que recibe la denominación de blastodisco, dándole el embrión una forma ovalada. Este periodo, se caracterizó por 3 etapas: inicial, de elevación y de achatamiento, esta última marca el final de la blastulación y el comienzo de la gastrulación (Figura 3).
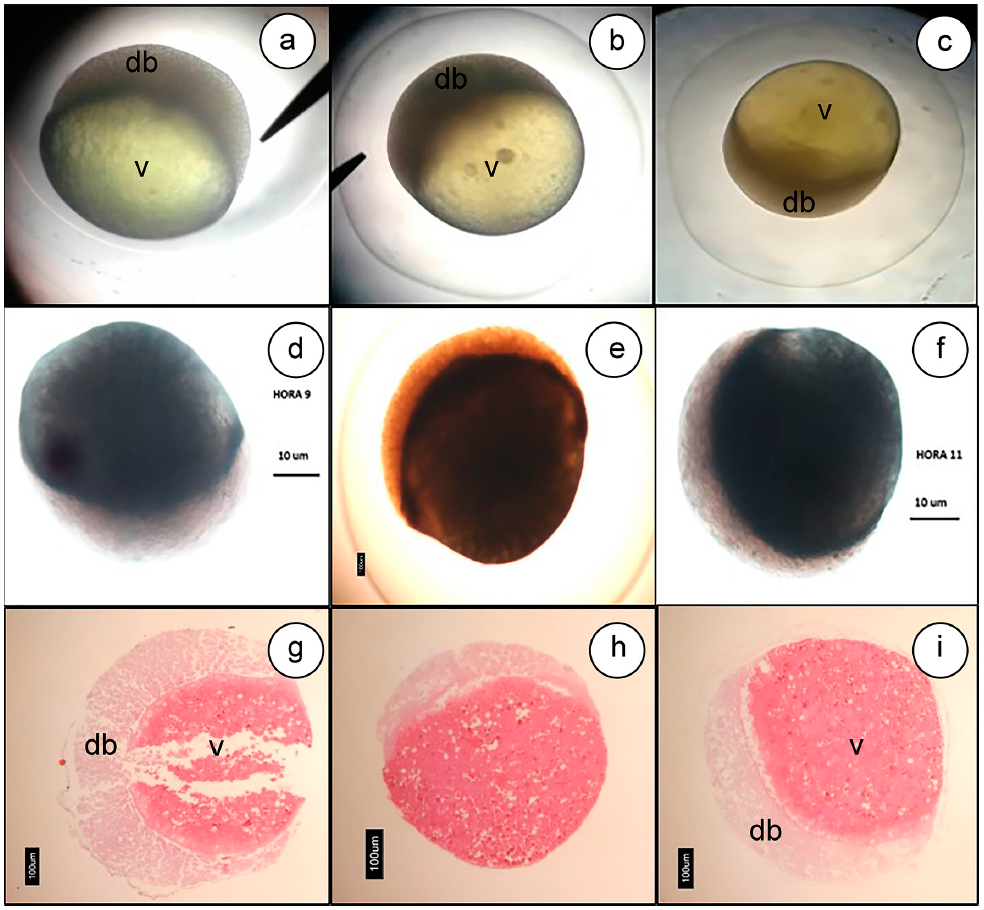
Figura 3 Blastulación Eremophilus mutisii: Elevación del blastodisco 9HPF (4x) (a, d y g.); elevación del blastodisco 10HPF (4X) (b, e y h); inicio del descenso del blastodisco sobre el polo vegetal 11,12HPF (4x) (c, f e i.); Hematoxilina -Eosina (g, h, e i.). db) Blastodisco; v) Vitelo.
Los hallazgos microscópicos consistieron en la presencia de la membrana vitelina, delgada, ligeramente basofílica, soportada sobre una lámina eosinofílica y rodeando concéntricamente el huevo. El polo animal contiene células con un material eosinofílico tenue homogéneo, con núcleos basófilos bien visibles, ubicados en el centro de la célula, la mitad en forma de barra y la otra redondeada. Adicionalmente, se observó que, en esta hora, las células son más redondas y se observa una separación de las mismas, que deja espacios translucidos entre ellas, a veces, dando la apariencia que las células se están encogiendo. También, se observaron algunas de las vacuolas citoplasmáticas reportadas anteriormente (Figura 3g, 3h y 3i).
El paso de blástula a gástrula, conocido como el proceso de epibolia, en E. mutisii alcanzó el 50%, luego, llegó al 80-95%, hasta llegar al cierre del blastoporo, donde finalmente el epiblasto forma el ectodermo y el hipoblasto crea la notocorda y el mesodermo (Arratia et al. 2003).
Adicionalmente, los cambios más significativos, en esta fase, correspondieron a poder observar vacuolas citoplasmáticas y los pronúcleos basofílicos de manera más visible, algunos redondeados y otros en forma de barras, dando la apariencia de estar en proceso de mitosis. Cerca al vitelo, se observa una capa de células alargadas con núcleos ovalados, ligeramente basofílicos, que sirven de soporte al polo animal, con-teniendo hasta 2 y 3 núcleos de diferentes tamaños; estas células, se denominan sincitiales vitelinas, debido a que se caracterizan por tener varios núcleos, resultante de la fusión de varias células (García, 1973) y están presentes en el vitelo.
Las vacuolas contenidas en las células del blastóforo son pleomórficas y dorsal al blastóforo; se comienzan a apreciar una capa de células columnares, las cuales, corresponden a células mesenquimales, que tienen un potencial proliferativo, capaz de auto renovarse, formando células idénticas a las células de origen y la capacidad de generar uno o más tipos celulares, que desempeñan funciones especializadas en el organismo (Mayani, 2003; Flores et al. 2006).
Periodo de gastrulación. Las células blastodérmicas y periblásticas comienzan a envolver el vitelo, mediante movimientos epibólicos (Figura 4a, 4g, 4j). La epibolia llegó al 50%, a la hora 18 post fertilización (Figura 4d, 4e, 4f); en la hora 24 post fertilización, el porcentaje de epibolia llega al 70-80% (Figura 4g, 4h, 4i); en la última etapa, se observa el cierre del blastoporo, haciéndose más evidente la diferenciación del eje cráneo-caudal, hora 30 post fertilización (Figura 4j, 4k, 4l).

Figura 4 Gastrulación Eremophilus mutisii: Inicio de la epibolia, 12HPF (a, b y c.); epibolia al 50%, 18HPF (d, e y f.); epibolia al 70-80%, 24HPF (g, h e i.); cierre del blastoporo, 30HPF (j, k y l). bp) Borde del periblasto; v) Vitelo; tv) Tapón del vitelo; cb) Cabeza; cl) Cola.
Periodo de organogénesis. En esta etapa, se observa la diferenciación céfalo-caudal de simetría bilateral y el comienzo de la neurolación, a las 42HPF (Figura 5a, 5b, 5c). A las 48HPF, se observa la vesícula óptica, vesícula ótica y la formación de las primeras somitas (Figura 5d, 5e, 5f). Este proceso en el Pseudoplatystoma sp., se observa entre la 8-16HPF (Díaz-Olarte et al 2010); en el P. grosskopfii, a las 7HPF (Valbuena-Villareal et al. 2012) y en Zungaru jau, a las 6HPF (Marques et al. 2017).
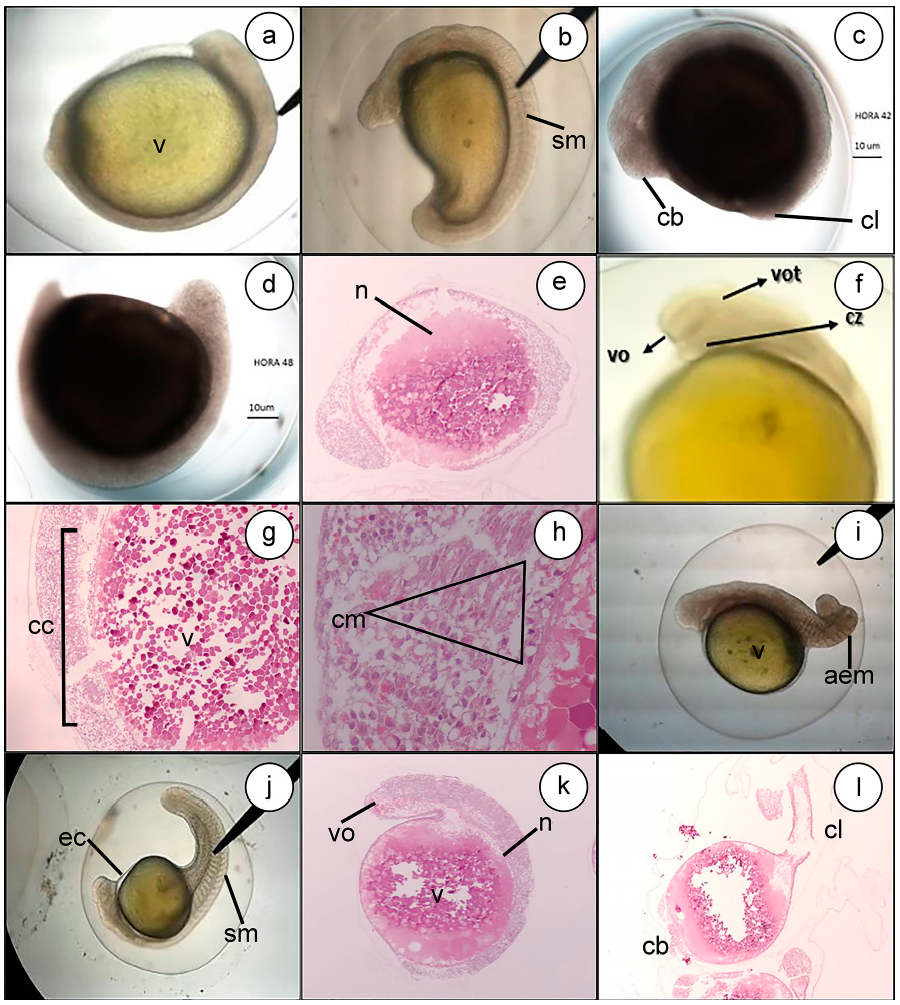
Figura 5 Organogénesis Eremophilus mutisii. 42HPF (a, b y c) 4X. Diferenciación céfalo caudal de simetría bilateral, formación de las primeras somitas y el comienzo de la neurolación. Se observa 48HPF (d, e y f.) 4X. Vesícula óptica, ótica y corazón. (G) Capa de células columnares, las cuales, corresponden a células mesenquimales del tubo neural. H&E (H) Estructuras triangulares, compuestas de células mesenquimales. H&E 60HPF (i y j), se evidenció desprendimiento de la cola del saco vitelino. 66HPF (k y l) H&E. V) vitelo; sm) Somitas; cb) Cabeza; cl) Cola; n) Notocordio; vo) Vesícula óptica; vot) Vesícula ótica; cz) Corazón; cc) Capa de Células Columnares; Cm) Células Mesenquimales; aem) Aleta embrionaria; ec) Ectodermo; sm) Somitas; vo) Vesícula Óptica; n) Notocordio; v) Vitelo; cb) Cabeza; cl) Cola.
Respecto al contenido del embrión, el polo animal ocupó un 30% y se caracterizó por presentar diferenciación céfalo-caudal; la parte más grande del polo animal corresponde a la región cefálica y la más pequeña, a la caudal. Todo el blastoporo estuvo poblado por células pequeñas y medianas, con núcleos redondeados basofílicos y citoplasmas vacuolados, casi en un 90%. El borde del vitelo presentó una capa de células sincitiales vitelinas, más delgadas con células aplanadas y núcleos alargados, semejante a un epitelio escamoso simple.
Se apreció una capa de células columnares, las cuales, corresponden a células mesenquimales del tubo neural (Figura 5g). Al lado de esta estructura, se evidenciaron 10 estructuras triangulares o piramidales, compuestas de células mesenquimales, que corresponden a somitas (Figura 5h).
Hacia la 60HPF, se evidenció el desprendimiento de la cola del saco vitelino (Figura 5i, 5j); a las 66HPF (Figura 5k, 5l), se observaron los primeros movimientos autónomos, diferenciando el corazón y el inicio de la circulación periférica, con movimientos cada vez más fuertes, acompañados de numerosas contracciones caudales y marcado deterioro de la membrana.
El vitelo ocupó el 60% del embrión, conteniendo material particulado eosinofílico pleomórfico, el cual, hacia la zona de la cabeza y cola, comenzó a perder la eosinofilia y se volvió más vacuolado, dando la apariencia de vacuolas semejantes al tejido adiposo. El blastodermo cubrió en forma de semiluna el vitelo, que estuvo poblado por células pequeñas y medianas, con núcleos redondeados basofílicos y citoplasmas vacuolados, casi en un 80%. El borde del vitelo presentó una capa de células aplanadas, con núcleos alargados basófilos. En esta hora, se pudo observar el notocordio, similar al tejido del cordón espinal en animales adultos, con las somitas triangulares, debajo de este. Hacia la región craneal, se observó una estructura circular rodeada por una membrana, aparentemente la vesícula óptica, que presentaba múltiples células en apoptosis.
La duración de la organogénesis, se mostró entre las 42HPF y 66HPF. Respecto a otros silúridos es mucho mayor, como es el caso del Pseudoplatystoma corruscans, que se observó entre las 7-14HPF (Cardoso et al. 1995). En especies, como P. grosskopfii, se observa entre las 7-11HPF (Valbuena-Villareal et al. 2012).
Eclosión. La eclosión, se inició a las 72HPF (Figura 6), correspondiente a 1.096 horas grado, con una temperatura promedio de 15,2 ± 0,6°C. Las larvas mostraban ausencia de pigmentación y un tracto digestivo rudimentario, debido una estructura tubular con un lumen; esta estructura no tenía abertura bucal y anal. Se observó la presencia de abundante saco vitelino con movimientos verticales continuos de la larva. A las seis horas post eclosión, el volumen del saco vitelino es de 1,1µm3 y la longitud total es de 3,7mm, mayor a las larvas de Pimelodus maculatus, que eclosionan a las 14 h 30 min post-fertilización, a 25,5 ± 0,3°C, midiendo 2,56 ± 0,13mm (Luz et al. 2001).
El vitelo, se observó homogéneo y continuo, perdiendo más la eosinofilia y presentando múltiples vacuolas, semejantes a las del tejido adiposo.
E. mutisii tiene un desarrollo embrionario más lento que otras especies, como Pseudoplatystoma corruscans (Marques et al. 2008), Steindachneridion parahybae (Honji et al. 2012) o el hibrido entre Pseudoplatystoma corruscans y Pseudoplatystoma fasciatum (Faustino et al. 2007) y ello, se debe, principalmente, a que la temperatura de incubación fue más baja que las especies descritas anteriormente y la razón radica en que los teleósteos son vertebrados ectotérmicos.
Los datos actuales, por lo tanto, mostraron que el estudio del desarrollo embrionario es esencial para un mejor conocimiento de algunas características biológicas de una especie.
Estos resultados contribuyen a la recuperación de esta especie amenazada, al proporcionar herramientas biológicas, que permiten predecir y resolver problemas futuros, aportando, así, a la conservación y uso de la especie, para estudios posteriores de crecimiento en cautiverio, como alternativa de producción en aguas frías.















