INTRODUCCIÓN
Alrededor del 30% de las enfermedades infecciosas emergentes en los últimos 60 años son provocadas por microorganismos que se transmiten, a través de productos comestibles (McLinden et al. 2014). Un factor importante en la incidencia de las Toxiinfecciones Alimentarias (TIA) es la resistencia a los agentes antimicrobianos o antibióticos, por su uso indiscriminado en las producciones pecuarias (Jurado-Gámez & Zambrano-Mora, 2020). En este sentido, el Centro de Prevención y Control de Enfermedades de la Unión Europea (ECDC) y la Autoridad Europea de Seguridad Alimentaria (EFSA), alertan sobre el aumento de la resistencia a los antibióticos de cepas de E. coli, que es una de las bacterias más común en los alimentos contaminados (EFSA & ECDC, 2018).
Los microorganismos benéficos incrementan el valor nutricional y la supervivencia y disminuyen la incidencia de enfermedades causadas por bacterias patógenas (García et al. 2016). De acuerdo con la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización Mundial de la Salud (OMS) definen a los probióticos como microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped (FAO/WHO, 2002). En el área de sanidad y producción animal, Cossio et al. (2018) señalan que la aplicación de estos microorganismos se relaciona con la estabilización y la protección del ecosistema gastrointestinal, mejoras en los procesos metabólicos y digestivos, así como también en la modulación del sistema inmune. Dentro de la categoría de los probióticos, se encuentran las Bacterias Ácido Lácticas (BAL), consideradas seguras y utilizadas en muchos países en la producción de alimentos fermentados, controlando el crecimiento de patógenos. Por lo general, las cepas empleadas para el desarrollo de alimentos probióticos son aisladas de humanos, ya que poseen mayor posibilidad de adherirse y colonizar el epitelio intestinal; sin embargo, se ha demostrado que cepas de origen animal también poseen efectos favorables en el humano (Ruiz et al. 2017).
El género Lactobacillus comprende un gran grupo heterogéneo de bacterias anaerobias facultativas, no esporulantes, Gram positivas. Incluye especies, como L. plantarum, L. acidophilus, L. rhamnosus, L. bulgaricus, L. casei y L. reuteri (Duar et al. 2017). Por su parte, L. plantarum es una especie bacteriana asociada a especies vegetales y al tracto gastrointestinal (TGI) de humanos, ratones y cerdos. Esta bacteria puede fermentar un amplio espectro de carbohidratos vegetales; es tolerante a las sales biliares y a un pH bajo y posee una producción de sustancias antimicrobianas y bacteriocinas contra los patógenos intestinales (Betancur et al. 2020). A pesar que se ha demostrado la capacidad de las BAL de sobrevivir en el tracto gastrointestinal (Montalban-Arques et al. 2015) es fundamental favorecer su supervivencia, lo cual, se puede obtener mediante la técnica de microencapsulación.
Por lo expuesto anteriormente, el objetivo del presente trabajo de investigación fue evaluar la viabilidad de L. plantarum microencapsulado bajo condiciones gastrointestinales simuladas y su actividad inhibitoria sobre E. coli O157:H7, cuyos hallazgos van en dirección a generar una potencial alternativa de control de agentes bacterianos importantes, en las infecciones de origen alimentario.
MATERIALES Y MÉTODOS
La investigación, se realizó en el Laboratorio de Microbiología del Grupo de Investigación PROBIOTEC-FORAPIS y en los laboratorios especializados de la Universidad de Nariño. Se utilizaron L. plantarum ATCC® 8014 y E. coli O157:H7 ATCC® 43888. La obtención y ajuste del inóculo, se realizó de acuerdo con lo descrito por Jurado et al. (2014).
Los parámetros cinéticos de L. plantarum, se evaluaron en medio MRS comercial; para esto, se tomaron muestras y mediciones cada 2:50h, de las siguientes variables: conteo de microorganismos viables en placa (UFC/mL) (Lanara, 1981), pH, consumo de azúcar (mg/L) (Dubois et al. 1956), producción de proteína (mg/L) (Lowry et al. 1951) y producción de ácido láctico (%). La biomasa, se determinó a través del método propuesto por Crueger & Crueger (1993), así como otras variables cinéticas de crecimiento (velocidad específica de crecimiento, tiempo de duplicación celular, cosecha máxima y tiempo de generación). Finalmente, se tomó una muestra de sobrenadante de L. plantarum y, por HPLC-DAD, se determinó el contenido de péptidos y de aminoácidos; para lo anterior, se ajustó, por espectrofotometría, a una densidad óptica 0,125, en escala McFarland patrón 0,5 (1,5 x 108 bacterias/mL). Luego, se trasfirieron muestras en tubos Eppendorf y se centrifugaron a 18.000rpm, durante 30min, a 4°C. Por último, el sobrenadante se filtró, utilizando membranas PVDF de 0,2micras y se llevó a lectura.
Una vez obtenidos los datos cinéticos para el proceso de encapsulación, se realizó el ajuste del inóculo, en donde a L. plantarum, se llevó a incubación, a 37°C, por 24h, a una proporción, según Crueger & Crueger (1993), del 10% v/v, es decir, en 90mL de caldo MRS estéril, se añadió 10mL del inóculo bacteriano. Para el conteo, se tomó 1mL y se llevó a lectura directa en espectrofotómetro, a 625nm. El patrón en la escala de McFarland, a la cual, se ajustó la población bacteriana, fue de 4, equivalente a 1,2x109UFC/mL. Posteriormente, de acuerdo con Rodríguez et al. (2012), se preparó para el microorganismo una suspensión, que consistió en la adición del 15% p/v, en relación 1:1p/p de los agentes microencapsulantes inulina y maltodextrina y, posteriormente, se inoculó con 109 UFC/g del microorganismo. Para esto, se utilizó el equipo de secado por aspersión Secador Spray Bilon 6000s®, con una temperatura de entrada de 170°C y una temperatura de salida de 66°C, con ciclo completo de 2h y 30min, para un flujo de alimentación de 400mL, del total de inóculo.
Se evaluó el rendimiento del microencapsulado después del secado por aspersión razón de BAL microencapsulado, respecto al adicionado en la solución, de acuerdo con Pulido & Beristain (2010). De igual manera, se determinaron las siguientes propiedades físicas del microencapsulado: actividad de agua, humedad relativa, solubilidad, humectabilidad, higroscopicidad y eficiencia de microencapsulación (%EE= (A-B/A) X 100; siendo A, la concentración bacteriana antes de la microencapsulación y B es la concentración de la bacteria después de microencapsular, encontrada en el sobrenadante), siguiendo las metodologías propuestas por Rodríguez-Barona et al. (2016) y González et al. (2015). Además, se determinó el tamaño y la morfología de las microcápsulas, utilizando un microscopio electrónico de barrido FEG (Field Emission Gun) - QUANTA 650 FEG. Dicho análisis fue realizado en el laboratorio del Centro de Microscopía y Microanálisis (Bogotá, Colombia). El material microencapsulado, se almacenó a temperatura ambiente del laboratorio de investigación, de 20±2°C, durante 45 días.
Después de realizada la microencapsulación, se determinó el crecimiento de L. plantarum microencapsulado en condiciones gastrointestinales simuladas, con concentraciones de sales biliares bovinas, de 0,3 y 1% y bilis bovina, de 0,3 y 0,5% y a niveles, de pH de 3,0 y 7,0. La incubación, se realizó en condiciones de aerobiosis en medio MRS comercial, a 37°C, durante 48h y el ajuste del pH, se realizó con ácido tartárico (Freudig et al. 1999). Adicionalmente, se evaluó la resistencia a lisozima, sometiendo la cepa láctica a diferentes preparaciones de lisozima: (i) 0,6µL de cultivo y 0,60µg de lisozima, (ii) 0,6µL de cultivo y 120µg de lisozima, (iii) 0,6µL de cultivo y 180µg de lisozima. Se llevó a incubación, durante 24h, a 37°C.
Para evaluar el efecto inhibitorio de L. plantarum, de acuerdo con la metodología de Tagg & McGiven (1971), los volúmenes trabajados en los métodos discos de agar, doble capa y difusión en pozos fueron de 90,125 y 150µL y para el método discos modificado (PADS) fueron de 80, 90 y 100µL, respectivamente. Además, se verificó la producción de exopolisacáridos (EPS), de acuerdo con lo descrito por Elinalva Maciel et al. (2012), donde se utilizaron discos de papel de filtro estéril (5mm), impregnados con 5µL de cultivo láctico, en placas de Petri, con agar MRS, para observar la producción de EPS (Guimarães et al. 1999). El ensayo, se realizó bajo las siguientes condiciones: diferentes niveles de pH (6,0±0,2 y 7,5±0,2), temperatura (28±2ºC, 35±2ºC y 42±2ºC) y tiempos de incubación (24h, 48h y 7 días). Finalmente, se evaluó la susceptibilidad de L. plantarum y E. coli O157:H7 frente a los antibióticos penicilina (10UI), cefalotina (KF 30µg), ciprofloxacina (CIP 5µg), gentamicina (CN 10µg), dicloxacilina (DCX 1µg), ampicilina (AMP 10µg), cefatoxima (CTX 30µg) y florfenicol (FFC 30µg) (Bauer et al. 1966).
En este orden de ideas, los parámetros de la cinética de crecimiento se realizaron cada 2,5 horas, con 8 muestreos para cada variable; con la información recolectada, se obtuvo el promedio para cada punto y se realizaron las curvas de evolución en el tiempo para los parámetros. La evaluación de la microencapsulación, se realizó por triplicado para cada uno de los parámetros (rendimiento y propiedades físicas), obteniendo la media como resultado. Para la susceptibilidad de las cepas a los diferentes antibióticos, se usaron 8 repeticiones. El mismo número de réplicas se hicieron en las pruebas de inhibición. Los resultados fueron organizados en hoja de cálculo Excel( y los análisis se realizaron en el software estadístico R (4.0.0, 2018). Para todas las variables, se determinaron los parámetros descriptivos, como la media y la desviación estándar.
RESULTADOS Y DISCUSIÓN
Según la información obtenida en la cinética de fermentación, se encontró que L. plantarum alcanzó su fase exponencial a las 11:50 horas y los valores de consumo de azúcares, producción de proteínas, ácido láctico y pH, se muestran en la figura 1. Al respecto, Agudelo et al. (2010) mencionan que, hasta las 24 horas de fermentación, la bacteria se reproduce sin limitación de sustancias nutritivas a velocidad máxima. De acuerdo con lo anterior, se puede observar que la variable Ln UFC/150µL de L. plantarum presentó diferencias estadísticas significativas (P≤0,05), entre el tiempo 11:50, donde tuvo lugar el máximo crecimiento y los tiempos 0:0, 2:50, 14:50, 20:50 y 23:50, confirmando la tendencia del microorganismo observado en la cinética. En cuanto al consumo de azúcares y producción de proteínas, en la fase exponencial, fue de 6,98mg/L y de 4,88mg/L, respectivamente. En este sentido, la BAL en estudio puede ser utilizada en la industria alimentaria por su rendimiento, que se traduce en la obtención de productos en menor tiempo, generando menores costos de producción. Asimismo, L. plantarum obtuvo un número de generaciones por hora de 4,62, una cosecha máxima de 10,3Ln UFC/150µl, así como también, una velocidad específica de crecimiento de 2,872 y un tiempo de duplicación celular de 14,47min, valores relativamente altos, en contraste con lo reportado por Agudelo et al. (2010), que fueron de 0,53 y 1,28, respectivamente; sin embargo, otros autores, como Jurado et al. (2015), reportaron valores de 0,98 y 42,42, respectivamente. Es de considerar que la velocidad y el tiempo de duplicación dependen de la concentración de nutrientes; así, a altas concentraciones, la velocidad específica alcanza valores máximos (Agudelo et al. 2010). En cuanto al pH y ácido láctico, los mismos autores señalan que, en los productos derivados de la fermentación, se encuentran altas concentraciones de ácido láctico y otros ácidos orgánicos, como productos finales del proceso catabólico de Lactobacillus y, en esta investigación, el descenso del pH para L. plantarum, en el medio MRS, pasó de 5,6 a 4,27 y que tiene un efecto inhibidor sobre el crecimiento de patógenos a estos pH alcanzados, por las BAL (Jurado Gámez et al. 2019). En cuanto a la identificación del perfil de péptidos para la cepa láctica, se detectaron 4 espectros UV, obtenidos a 214 y 280nm, correspondiente al péptido de composición VAL-TIR-VAL (PM = 379,5), con una concentración de 0,52mg/mL, similar a lo reportado por Jurado et al. (2015), en lo que respecta a valina y tirosina. En el perfil de aminoácidos en el sobrenadante de la BAL, se encontró lo siguiente: cantidad relativa porcentual %: A. aspártico: 5,1; Serina: 9,7; Arginina: 7,6; Tirosina: 4,5; Valina: 10,4. Y, 5 aminoácidos para la cepa patógena (A. aspártico: 4,0; Serina: 7,5; Arginina: 6,0; Tirosina: 43,5; Valina: 15,5). Este parámetro es importante por la actividad inhibidora de las BAL en la producción de bacteriocinas de ser bactericidas o bacteriostáticos frente a microorganismos sensibles de la misma especie o estrechamente relacionados (Svetoslav et al. 2018). Egan et al. (2016) sostienen que las bacteriocinas son una defensa para las bacterias productoras, inhibiendo o destruyendo aquellas bacterias sensibles, que compiten por el mismo nicho ecológico. Por su parte, Castellano et al. (2017) mencionan que son inocuas para los consumidores y tampoco afectan la microbiota intestinal, ya que se inactivan en el sistema digestivo.

Figura 1 Crecimiento de Lactobacillus plantarum (Ln UFC/150µL) vs Variables evaluadas durante la cinética de fermentación. a) consumo de azúcares mg/L; b) producción de proteínas mg/L; c) pH; d) % ácido láctico.
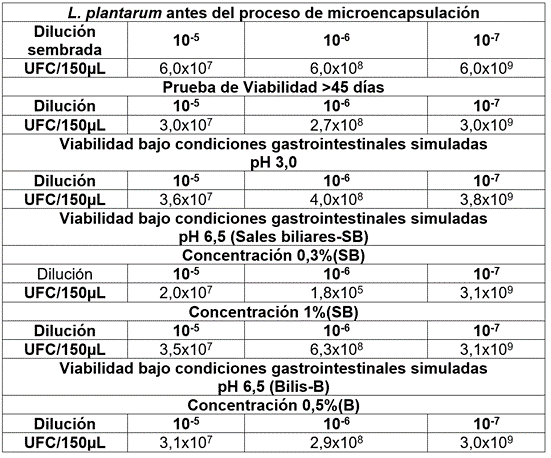
Se determinó la viabilidad de L. plantarum (UFC/g y %), antes (6,0x108 UFC/g) y después (3,2x108 UFC/g - 50% viabilidad) de la microencapsulación, después de 45 días de almacenamiento, a 20±2°C. En la viabilidad, bajo condiciones gastrointestinales simuladas, se observó un mejor crecimiento, con valores de 3,8x109 UFC/150µL, óptimo para el establecimiento, a nivel intestinal (Tabla 1). En complemento, la viabilidad de L. plantarum, en presencia de las diferentes preparaciones de lisozima, estuvo entre 2,0x109 y 3,0x1012 UFC/150µL. Al respecto, Gutiérrez-Sarmiento et al. (2020) mencionan que la supervivencia de los microorganismos, a través del tracto gastrointestinal, es un criterio probiótico importante, ejerciendo un efecto benéfico en la salud del consumidor.
Tabla 1 Valores de crecimiento de L. plantarum microencapsulado a 45 días y viabilidad, bajo condiciones gastrointestinales simuladas.
En la evaluación del material microencapsulado físicamente, se encontraron los siguientes valores: humedad (7,054%), Aw (0,400), higroscopicidad (7,01g humedad/100g de sólido seco), humectabilidad (1,56min), solubilidad (92%) y eficiencia (42%), estas determinaciones se realizaron cada 10 días. Adicionalmente, el rendimiento del proceso de secado fue del 40% y su viabilidad fue superior al nivel mínimo de 6,0log UFC/g, recomendado por FAO/OMS (2002), como la cantidad requerida para producir beneficios terapéuticos y, ligeramente mayor, a la reportada por Rodríguez et al. (2012), la cual, fue de 46,53%, con una matriz de Inulina, a una temperatura de entrada de 150°C y de salida de 90°C, después de 21 días de almacenado. Estos resultados fueron más altos que los observados por Kingwatee et al. (2015), en el secado por atomización del jugo de lichi suplementado con L. casei 01, utilizando materiales de pared, como maltodextrina y goma arábiga, mezclados o no con inulina. Los polvos producidos a la temperatura de salida más alta mostraron una menor viabilidad y recuentos de células (2,46 y 4,73log UFC/g), en comparación con los producidos a 60°C (5,75 y 6,80log UFC/g). La alta viabilidad encontrada para la BAL, en este estudio, puede ser atribuida al efecto termoprotector de la inulina. Fritzen-Freire et al. (2012) estudiaron la microencapsulación de Bifidobacterium BB-12, mediante secado por aspersión, utilizando leche descremada reconstituida, como material de pared, en presencia de inulina y oligofructosa. Los valores porcentuales para la eficiencia de microencapsulación son similares a los reportados por González et al. (2015); para esta última, fue 50% inferior en el presente estudio, debido, quizá, a que se evaluó una matriz de alginato (AS) y goma gelana de alto acilo (GAA).
La caracterización morfológica por microscopía electrónica de barrido reflejó que el microorganismo presentó una cápsula de forma simple y uniforme, sin grietas ni abultamientos (Figura 2), evidenciando la eficiencia de la matriz microencapsulante y una garantía para el correcto desempeño del microorganismo, en el lugar de adhesión. De esta manera, se obtuvieron tamaños con un rango entre 1,566 y 8,55µm, similares a los reportados por Rodríguez et al. (2012) y Paim et al. (2016), donde el tamaño osciló entre 6,23 y 9,13µm. El tamaño de las partículas es importante, ya que afecta el flujo del polvo, la capacidad de rehidratación, la solubilidad y la dispersabilidad, así como la compactación y la segregación de una mezcla de componentes. Según Schubert (1993), los polvos muy finos pueden tener una humectabilidad baja, debido a la alta tensión superficial, que conduce a la formación de una "capa viscosa" en la superficie del líquido, que dificulta el flujo de la capilaridad, a través de los poros intergranulares. El objetivo de la microencapsulación fue otorgar protección a L. plantarum frente a entornos que puedan afectar significativamente su desempeño y la expresión de su potencial probiótico, mantener su viabilidad durante el almacenamiento y asegurar su supervivencia frente a las enzimas digestivas y bilis del tracto gastrointestinal, permitiendo, en el intestino, conferir sus efectos beneficiosos al huésped. La resistencia a las condiciones gastrointestinales depende de las especies y de las cepas (Monteagudo-Mera et al. 2012) y la elección de la matriz del portador es decisiva para mejorar la supervivencia y la viabilidad en el colon. La incorporación de la matriz maltodextrina-inulina confirió una protección eficaz contra el jugo gástrico de bajo pH y la presencia de inulina mejoró aún más la recuperación de células viables, al final de la digestión simulada. Así, pues, las microcápsulas son vehículos valiosos para la liberación controlada de fármacos y de probióticos.
En la prueba de susceptibilidad frente a agentes antimicrobianos, L. plantarum y E. coli O157:H7 mostraron la mayor sensibilidad frente a CTX y CIP (Tabla 2). Sánchez de Ramos et al. (2011) reportaron una resistencia a los antibióticos gentamicina y ciprofloxacina en cepas de Lactobacillus. En cuanto a la sensibilidad/resistencia de E. coli O157:H7 fueron similares a los reportados por Toledo et al. (2015) en AMP y KF y sensibilidad a CIP y CN. Cueto-Vigil et al. (2010) afirman que las bacterias intestinales comensales, incluyendo a las BAL, actúan como reservorios de genes de resistencia a antibióticos similares a los encontrados en patógenos humanos, transfiriéndolos a bacterias patógenas, a través de plásmidos o transposones. Wendlandt et al. (2015) plantean que la diseminación de cepas resistentes son producto de infecciones alimentarias adquiridas por el contacto con productos contaminados, donde el hospedero es infectado o colonizado con el microorganismo resistente. Al respecto, Cueto & Aragón (2012) establecen que la estructura de la pared celular de las especies Gram positivas es gruesa (como en el caso de las BAL) y en las Gram negativas es muy delgada, lo cual, puede ser un factor que induzca a su sensibilidad a los antibióticos.
Tabla 2 Prueba de susceptibilidad frente a agentes antimicrobianos en L. plantarum frente a E. coli O157:H7.
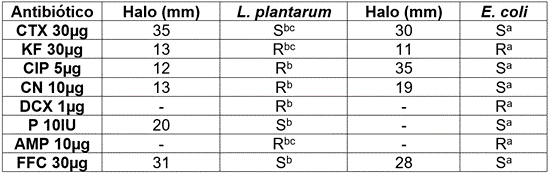
CTX: Cefatoxima, KF: Cefalotina, CIP: Ciprofloxacina, CN: Gentamicina, DCX: Dicloxacilina, P: Penicilina, AMP: Ampicilina, FFC: Florfenicol. a: Manual para antibiograma LABORCLIN, b: Sánchez de Ramos et al. (2011), c: Charteris et al. (1998).
Los ensayos de inhibición in vitro de L. plantarum y su sobrenadante por el método de discos modificado (PADS) frente a E. coli O157:H7 mostraron la mayor susceptibilidad a una concentración de 90μL (Tabla 3). Esta acción inhibitoria, se atribuye a sustancias como ácidos orgánicos, peróxido de hidrógeno, bacteriocinas, entre otras, favoreciendo un ambiente favorable para la microbiota benéfica y el huésped (Heredia-Castro et al. 2017). La respuesta antagónica e inocua en los halos de L. plantarum es similar a lo reportado por Vera-Mejía et al. (2018). Por su parte, Abramov et al. (2014) y Sánchez et al. (2015) mencionan que la producción del peróxido de hidrógeno y ácido láctico por Lactobacillus no permite la colonización por microorganismos patogénicos, alterando su permeabilidad celular, así como descenso del pH intracelular. En la determinación de presencia de EPS, se encontró un material translúcido asociado a una colonia mucoide y precipitación de la muestra en alcohol absoluto, indicando la potencial producción de EPS (28 y 35°C). Nácher Vásquez et al. (2016) consideran que intervienen en: capacidad de adhesión bacteriana, formación de biopelículas, protección de la integridad celular en diferentes ambientes y en su adaptación para colonizar el tracto digestivo o la mucosa vaginal, asociado a su capacidad para ser organismos simbióticos.
Se concluye que L. plantarum expresó su potencial probiótico al inhibir a E. coli O157:H7; la microencapsulación permitió el almacenamiento de L. plantarum. A pesar que la temperatura del secado por aspersión afectó un porcentaje de viabilidad, este efecto se contrarrestó por la excelente estabilidad durante el almacenamiento a temperatura ambiente, que se mantuvo después de 6 semanas. La matriz maltodextrina-inulina mejoró las tasas de supervivencia en condiciones gastrointestinales simuladas; sin embargo, un nuevo reto es encontrar un material con mayor afinidad con el microorganismo, para superar más eficazmente los pasos desde la producción hasta el almacenamiento y la digestión.

















