INTRODUCCIÓN
Los ríos andinos se encuentran alterados por distintas actividades antrópicas, que tienen consecuencias negativas sobre la diversidad biológica y la calidad ecológica de los ecosistemas acuáticos (Chará et al. 2007; Giraldo et al. 2020). Factores como la deforestación (Bojsen & Jacobsen, 2003; Galeano-Rendón & Mancera-Rodríguez, 2018) y el cambio de uso del suelo hacia actividades agrícolas o ganaderas son las causas más comunes del empobrecimiento de las comunidades dulceacuícolas y la vegetación ribereña asociada (Chará et al. 2007; Villada-Bedoya et al. 2017; Giraldo et al. 2020).
La calidad hídrica de los ríos y las quebradas depende directamente del hábitat ribereño, por lo que, en ecosistemas degradados por actividades antrópicas, la disponibilidad y la calidad del agua es menor y la composición y la estructura del ensamblaje de macroinvertebrados acuáticos presenta algún grado de alteración (Bonada et al. 2006). En consecuencia, y ante la creciente transformación de los ecosistemas acuáticos y la pérdida de diversidad por actividades antrópicas, es fundamental integrar diferentes índices, que permitan evaluar la calidad ecológica y generar información, para diseñar estrategias de conservación, de restauración y de protección de quebradas andinas (Galeano-Rendón et al. 2017), que vayan acompañadas del trabajo con las comunidades humanas, allí asentadas, para minimizar los efectos negativos de los impactos antrópicos.
Los objetivos de este trabajo fueron determinar la calidad ecológica y conocer los patrones de la estructura taxonómica del ensamblaje de macroinvertebrados acuáticos de una quebrada andina, con diferentes niveles de alteración antrópica, en el municipio de Zapatoca, Santander (Colombia). Se plantea que la quebrada tendrá mejor calidad ecológica y mayor diversidad taxonómica en la estación con mejor estado de conservación de sus márgenes y con menor alteración por actividades antrópicas. Este estudio es el primer acercamiento de evaluación sobre el efecto de las actividades antrópicas en la calidad ecológica y la diversidad de las comunidades bentónicas en la quebrada El Poleo, ubicada en el municipio de Zapatoca, Colombia.
MATERIALES Y MÉTODOS
El estudio, se realizó en la quebrada El Poleo, ubicada en el municipio de Zapatoca (Santander, Colombia), que drena al río Sogamoso, cuenca del río Magdalena. La zona posee una temperatura media anual de 18,8 °C y precipitación media anual de 1314 mm, la altitud varía entre 1.600-2.300 m s.n.m. y según Holdridge, la zona de vida corresponde a Bosque Húmedo Premontano (bh-PM) (Martín Pérez et al. 2017).
Se realizaron dos muestreos en período seco, en junio de 2018 y abril de 2019, en un tramo de 100 m, en tres zonas de la quebrada, sometidas a diferentes niveles de alteración antrópica: Estación 1: Baja alteración antrópica (BA; 6°50’3,22”N 73°18’13,09”W, 1974 m s.n.m.), que corresponde al área de nacimiento de la quebrada, con bosque nativo conservado en ambos márgenes, en un estado de sucesión avanzada mayor a 50 años, una población relictual de palma de cera Ceroxylon quindiuense y presenta extracción de agua para uso doméstico. Estación 2: Media alteración antrópica (MA; 6°50’8,22”N 73°18’7,16”W, 1914 m s.n.m.), con bosque nativo, en estado de regeneración natural superior a 20 años con roble Quercus humboldtii y regeneración asistida desde 2017, en donde se plantaron plántulas de aliso (Alnus acuminata Kunth), guamo (Inga sp.), cedro de montaña (Cedrela montana), gaque (Clusia sp.), tamarindo (Tamarindus indica L.) y estacas de higuerón (Ficus cf. crocata Miq.), caucho (F. americana Aubl.), cauchona (Ficus sp1 y sp2), búcaro (Erythrina fusca Lour.), anaco (E. poeppigiana Walp.), chachafruto (E. edulis Triana ex Micheli), aro (Trichanthera gigantea Bonpl.) y ciruelo (Spondias purpurea L.). Esta estación está alterada por caminos que atraviesan el cauce y en la parte alta del sitio de muestreo, por una poza artificial de mayor profundidad y anchura que el cauce actual. La Estación 3: Alta alteración antrópica (AA; 6°50’3,48”N 73°17’15,04”W, 1645 m s.n.m.), corresponde a un área alterada por cambios de uso de suelo hacia cultivos con irrigación y pastos, presencia de viviendas cercanas, vertimiento de residuos a la quebrada, extracción de agua para uso doméstico y aguas con presencia de aceites.
Para cada estación de muestreo, se tomaron registros in situ de temperatura superficial del agua (°C), pH, conductividad (µS/cm) y oxígeno disuelto (mg/L), con un dispositivo multiparamétrico Hanna (HI9828/4-01). El caudal, se calculó a partir del ancho de la quebrada medido, con un flexómetro; la profundidad, se midió cada 20 cm, con una vara graduada en cm y la velocidad del flujo, se determinó con un correntómetro Global Water FP111, a 10 cm de profundidad. Para las tres estaciones, se determinó el Índice de Calidad de la Vegetación de Ribera Andina (QBR-And) (Acosta et al. 2009), el Índice de Hábitat Fluvial (IHF) (Pardo et al. 2002), el índice Biological Monitoring Working Party, adaptado para Colombia (BMWP-Col) (Roldán Pérez, 2003), el puntaje promedio por taxón (Average Score per Taxon, ASPT) (Armitage et al. 1983) y el Índice de Porcentaje de Individuos de Ephemeroptera, Plecoptera y Trichoptera (EPT%) (Carrera Reyes & Fierro Peralbo, 2001).
La recolección de macroinvertebrados acuáticos, se realizó con una red Surber de 30,5 x 30,5 cm y ojo de malla de 250 µm, en 10 puntos al azar, a lo largo del tramo de 100 m en cada estación, según la metodología descrita por Roldán Pérez & Ramírez Restrepo (2008). Las 10 submuestras fueron tratadas como una sola e identificadas taxonómicamente, hasta nivel de familia, usando las claves de Roldán (1988), Domínguez & Fernández (2009) y Hamada et al. (2018). Para establecer diferencias significativas en los valores de las variables físicas, químicas e hidrológicas y en los valores de diversidad taxonómica entre las tres estaciones de muestreo, se aplicaron análisis de varianza unidireccionales (ANOVA) a cada variable, con un nivel de confianza del 95 %, previa validación de los supuestos de normalidad (prueba de Shapiro-Wilk) y homocedasticidad (prueba de Bartlett). Se realizaron comparaciones (post hoc), que fueron evaluadas mediante la prueba de Tukey o, cuando no se cumplieron los supuestos, con las pruebas no paramétricas de Kruskall-Wallis y Mann-Whitney. Se determinaron el número de individuos y los números de Hill (q0, q1 y q2) (Hill, 1973) y se definieron los patrones de variación en la composición taxonómica del ensamblaje de macroinvertebrados entre estaciones y muestreos con respecto a las variables ambientales y a los valores de los Índices QBR-And y BMWP-Col, mediante un análisis de correspondencia canónica ACC, que se realizó sobre los taxones con una abundancia mayor al 1 % en cada estación, con el programa RWizard (Guisande, 2015).
RESULTADOS Y DISCUSIÓN
La temperatura superficial del agua presentó diferencias significativas entre las tres estaciones (Kruskall-Wallis, x2=18,68; P <0,001), con mayores valores para la estación de alta alteración (AA) (Tabla 1). La mayor temperatura en esta estación puede estar asociada a que se ubicó en una altitud menor, presentó menos sombra en el cauce y, por lo tanto, una mayor radiación solar incidente, mientras que, en BA, la vegetación riparia ayuda a que disminuya la temperatura del agua, debido al mayor porcentaje de cobertura vegetal en los márgenes.
Tabla 1 Valores de los índices y características fisicoquímicas e hidrológicas en tres estaciones, con diferentes niveles de alteración antrópica (BA: baja alteración; MA: media alteración; AA: alta alteración), de la quebrada El Poleo, cuenca del río Magdalena, Colombia.
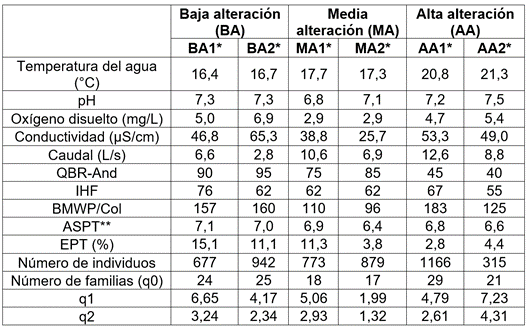
*Los números representan cada muestreo: (1= junio de 2018 y 2= abril 2019).
**ASPT (Average score per taxon): Puntaje promedio por taxón.
El valor promedio del oxígeno disuelto y la conductividad fueron significativamente menores en la estación con media alteración (MA), con relación a las otras dos (ANOVA, F=19,49; P <0,001, Mann-Whitney, P=0,029, respectivamente), lo que puede ser debido a la poza artificial, ubicada aguas arriba del tramo muestreado que, al presentar menor velocidad de la corriente, permitiría que se acumule mayor cantidad de sedimentos y restos de vegetación, lo que causaría colmatación del lecho y disminución de la disponibilidad de oxígeno e incidiría en que se presente un menor número de familias de macroinvertebrados. El oxígeno disuelto puede variar por aumento en la temperatura, o la velocidad de la corriente, o por presencia de vertimientos, materia orgánica y mayor aporte de nutrientes (Oscoz et al. 2006).
La estación BA presentó los mayores valores del índice IHF, seguida de MA, con valores mayores a 62 en los dos muestreos (Tabla 1). Por otra parte, las estaciones BA y MA mostraron valores altos del índice QBR-And (entre 95 y 75), mientras que AA tuvo entre 40 y 45 (Tabla 1). Los altos valores de QBR-And para las estaciones BA y MA indican una calidad de bosque de ribera buena, mientras que el bajo valor para AA, una alteración importante, a causa de actividades agrícolas y ganaderas e intervenciones antrópicas. El índice BMWP/Col presentó valores altos para las tres estaciones (Tabla 1) y el índice ASPT fue > 6,5 en todas las estaciones, lo que muestra una calidad aceptable, con agua ligeramente contaminada, a excepción de MA, en el segundo muestreo, que presentó un valor de 6,4, con aguas moderadamente contaminadas (ASPT entre 4,5 - 6,5) (Tabla 1). Resultados similares de disminución de calidad ecológica y diversidad de macroinvertebrados acuáticos en gradientes de bosques conservados hacia zonas perturbadas o alteradas por actividades agrícolas o ganaderas han sido registrados por Bojsen & Jacobsen (2003), Galeano-Rendón et al. (2017), Galeano-Rendón & Mancera-Rodríguez (2018) y Urdanigo et al. (2019).
Los mayores valores del índice EPT se presentaron en BA, con un gradiente de disminución hacia las zonas, son más alteradas (Tabla 1). Al respecto, De Paiva et al. (2021) encontraron que el aumento del impacto antrópico redujo la diversidad de EPT, órdenes que, generalmente, han sido asociados con una mayor heterogeneidad de hábitat. En ecosistemas alterados, la proporción de EPT se reduce por factores, como el incremento de la concentración de nutrientes (Townsend et al. 2008), el aumento de la temperatura, la conductividad y los sedimentos finos (Wahl et al. 2013), la pérdida de cobertura riparia (Bispo et al. 2006), el vertimiento de aguas residuales y la alteración del flujo (Oliveira et al. 2011).
En total, se recolectaron 4.752 individuos, correspondientes a cuatro filos, seis clases, 12 órdenes y 40 familias de macroinvertebrados acuáticos. Las estaciones BA y AA presentaron mayor riqueza de familias, en comparación con MA (Tabla 1). El orden Diptera fue el más abundante en las tres estaciones, con 3.304 individuos, que corresponden al 69,5 %, con predominancia de la familia Chironomidae. Resultados similares de predominio del orden Diptera fueron encontrados por Zúñiga et al. (2013), Giraldo et al. (2014), Montoya Moreno & Escobar Gutiérrez (2019) y Giraldo et al. (2020), en cuencas andinas alteradas por agricultura y por ganadería. La familia Chironomidae está principalmente asociada a intervención antrópica por ganadería (Giraldo et al. 2014) y altas concentraciones de materia orgánica. Villada-Bedoya et al. (2017) destacan que las actividades agrícolas impactan negativamente la diversidad de insectos acuáticos y, la pérdida de vegetación ribereña, se asocia a la presencia de las familias Simuliidae y Chironomidae, típicas de zonas perturbadas por su tolerancia a la contaminación y la sedimentación.
El Análisis de Correspondencia Canónica (ACC) mostró que la varianza acumulada de la relación entre la abundancia de macroinvertebrados y las variables ambientales fue explicada por los dos primeros ejes, en un 72,1 %. El primer eje separó los dos muestreos realizados en AA y se asoció con los taxones Tubificidae (Haplataxida), Planariidae (Tricladida), la clase Bivalvia, Elmidae (Coleoptera), Naucoridae (Hemiptera) y Libellulidae (Odonata), que se relacionaron, a su vez, con mayores valores de caudal y de temperatura del agua (Figura 1). Según Zúñiga et al. (2013), los bivalvos son comunes en zonas de predominancia agropecuaria y Chará et al. (2007), registraron que aumentan su abundancia relativa en quebradas sin protección boscosa. Del mismo modo, los oligoquetos, e.g. familia Tubificidae, están íntimamente asociados al fondo fangoso de los cuerpos de agua, donde se concentra mayor cantidad de sedimentos finos, ricos en materia orgánica y detritus (Roldán, 1988) y tienen una alta capacidad de soportar sustancias tóxicas en altas concentraciones (Martins et al. 2008). Por su parte, el segundo eje separó los dos muestreos de BA, que se asociaron con mayor abundancia de los taxones Calamoceratidae (Trichoptera), Veliidae (Hemiptera), Polythoridae (Odonata), Ptilodactylidae (Coleoptera) y con mayores valores de QBR-And (Figura 1) y los dos muestreos en MA, que se asociaron con mayor abundancia de Tipulidae (Diptera), Polycentropodidae (Trichoptera), Odontoceridae (Trichoptera), Ceratopogonidae (Diptera), la subclase Acari, Sialidae (Megaloptera), y Chironomidae (Diptera) (Figura 1). La mayor cantidad de organismos típicos de zonas perturbadas (e.g. Tipulidae y Chironomidae), en la estación MA, indica que factores antrópicos, como la poza artificial y viviendas cercanas, estarían afectando la cantidad y la calidad del agua e impactando negativamente la diversidad del ensamblaje de macroinvertebrados acuáticos.

Figura 1 Análisis de correspondencia canónica basado en la abundancia de macroinvertebrados y variables ambientales en tres estaciones, con diferentes niveles de alteración antrópica (BA: baja alteración; MA: media alteración; AA: alta alteración), de la quebrada El Poleo, cuenca del río Magdalena, Colombia. QBR-And, Calidad de bosque de ribera; BWMP, Índice Biological Monitoring Working Party. Los números representan cada muestreo: 1= junio de 2018 y 2= abril 2019.















