Introducción
El órden Diptera es uno de los órdenes de insectos más ampliamente distribuidos y diversos entre los artrópodos. Incluye desde mosquitos, moscas negras, jejenes y moscas de la fruta, hasta moscas domésticas. Se han descrito alrededor de 160000 especies (Courtney y Cranston, 2015), dentro de las cuales 21000 se encuentran en Norteamérica (Courtney y Cranston, 2015) y se estima que hay alrededor de otras 24075 en el Neotrópico (Souza Amorim et al., 2002). Este amplio margen de distribución se relaciona con la riqueza de especies y los variados mecanismos de locomoción y respiración, así como las diferentes funciones ecológicas que permiten colonizar variedad de hábitats, incluyendo ambientes terrestres y acuáticos como ríos, arroyos, lagos, embalses, brácteas de bromeliáceas y demás plantas que acumulan agua, orificios de troncos viejos y las costas marinas (Roldán y Ramírez, 2008; Merritt et al., 2009; DeWalt et al., 2010). Debido a estas condiciones y a su capacidad de tolerar amplios rangos ambientales (Sarmiento, 2010), estos organismos no solo se convierten en elementos bióticos de gran relevancia en la cadena trófica, sino que también son de gran importancia económica y médica a nivel mundial (Merritt et al., 2009). Familias como Tipulidae, Muscidae, Agromyzidae y Tephritidae son plagas de cultivos, otras como Culicidae, Psychodidae y Simuliidae son vectores de patógenos que afectan el bienestar y la salud humana, y algunas como Chironomidae y Blephariceridae juegan un rol importante como bioindicadores de la calidad del agua (Lizarralde de Grosso, 2009; Merritt et al., 2009).
El análisis de la calidad de los ecosistemas dulceacuícolas no solo se basa en parámetros fisicoquímicos y bacteriológicos sino también en aspectos biológicos y ecológicos, por lo tanto el uso de macroinvertebrados constituye una herramienta viable y fácil de estudiar (Domínguez y Fernández, 2009). No obstante el conocimiento de los ensamblajes de larvas de dípteros acuáticos proviene en gran medida de publicaciones europeas y norteamericanas, que van desde estudios taxonómicos, ecológicos, de bioindicación y estructura de la comunidad dentro de los cuerpos de agua, hasta estudios de carácter médico y veterinario, ya que son vectores de múltiples enfermedades (Roldán y Ramírez, 2008; Courtney et al., 2009; DeWalt et al., 2010).
En Suramérica la información se encuentra en gran medida fragmentada y enfocada a ciertos grupos de dípteros acuáticos. Dicha información está centrada principalmente en aspectos taxonómicos, ecológicos y biológicos, y se resaltan los trabajos de Hamada y Grillet (2001), CoscarónArias (2003), Borkent y Spinelli (2007) y Coscarón y Coscarón-Arias (2007) en los que se hacen descripciones generales de las familias Simuliidae y Ceratopogonidae del Neotrópico y al mismo tiempo se incluyen discusiones sobre bionomía, adaptaciones de las diversas etapas de vida, hábitats, roles ecológicos, técnicas de recolección y preparación, zoogeografía, clasificación y claves de identificación. Otros como Domínguez y Fernández (2009), Paggi (2009) y Trivinho (2011), tratan con claridad aspectos sobre la anatomía, morfología, distribución y ecología del orden Diptera, resaltando familias como Chironomidae y Simuliidae, e incluyen claves de identificación y reseñas para familias y géneros de Suramérica y Brasil.
En Colombia, los trabajos sobre dípteros acuáticos datan de los años 80 y abarcan diferentes aspectos como la caracterización estructural en cuerpos de agua y su relevancia en el campo de la salud pública (Roldán, 1988; Pinilla, 1998; Ruiz Moreno et al., 1999; Pérez, 2007). Dentro de estos, se resalta la descripción de aspectos generales en cuanto a la biología, ecología, taxonomía, distribución y bioindicación de dípteros acuáticos a nivel de familia en el departamento de Antioquia (Bedoya y Roldán, 1984; Roldán, 1988) y las claves taxonómicas de Chironomidae de la sabana de Bogotá (Ruiz Moreno, et al. 1999). Para el Tolima la información existente acerca de este orden se encuentra limitada, ya que se ha estudiado principalmente la taxonomía, diversidad, riqueza y distribución hasta el nivel de subfamilia en el caso de Chironomidae y hasta género en las demás familias, en los ríos Coello, Prado, parte baja de Amoyá, y Opia (Sánchez, 2004; Carranza, 2006; Oviedo, 2011). Entre estos estudios, el de Oviedo (2011) se destaca por determinar por primera vez los organismos de la familia Chironomidae hasta el nivel de género, proporcionando un conocimiento base de gran relevancia para el departamento.
El uso de macroinvertebrados bentónicos como bioindicadores de la calidad del agua ha resultado de gran importancia en los últimos años, sin dejar de lado el uso de los análisis fisicoquímicos y bacteriológicos en los cuerpos de agua. Por consiguiente, la utilización de estas herramientas permiten no solo integrar cambios biológicos, tanto a corto y largo plazo en un rango de variables medioambientales, sino también proporcionar información puntual e indirecta del estado y calidad de las aguas (Jacobsen et al., 2008; Helson y Williams, 2013; Damanik-Ambarita, et al. 2016). Debido a lo expuesto anteriormente y a la importancia del orden díptera en la cuenca del río Alvarado (Tolima, Colombia) el presente estudio determinó la composición y estructura de larvas de dípteros acuáticos durante dos periodos hidrológicos, con el fin de ampliar la línea base de esta fauna béntica en las cuencas hidrográficas del Tolima y proveer información en cuanto a su distribución y relación con algunas variables fisicoquímicas.
Materiales y métodos
Área de estudio. El río Alvarado pertenece a la cuenca del río La China, que a su vez hace parte del sistema del río Totare, cuenca del río Magdalena, en el departamento del Tolima. Presenta un área de 29988,14 hectáreas, un perímetro de 91,66 km y una longitud del cauce de 55,06 km (Cortolima, 2009). De acuerdo con la clasificación de las zonas de vida de Holdridge (Pizano y García, 2014), el río Alvarado se localiza dentro del ecosistema del bosque seco tropical del departamento del Tolima, y, por su ubicación, fertilidad de sus suelos y condiciones ecológicas, se ha visto reemplazado a lo largo del tiempo por grandes zonas de cultivo, pastos para ganadería y urbanización (Cortolima, 2009).
Esta cuenca registra precipitaciones promedio anual de 700 a 2000 mm y temperaturas superiores a los 24 °C. Se caracteriza por poseer una escasa masa forestal protectora, que se reduce en las partes altas de las estribaciones de la cordillera Central; posee bosques en su gran mayoría secundarios y tierras destinadas primordialmente al uso de pasto. El suelo de la cuenca es de carácter francoarcilloso y de erosión severa (Cortolima, 2009). La cuenca presenta una forma alargada y las aguas que circulan por esta no están sometidas a grandes velocidades, ya que presenta pendientes muy bajas, con un carácter moderadamente torrencial (Cortolima, 2009). Los principales afluentes del río Alvarado son Santo Domingo, El Neme, Mercadillo, El Ceboso, La Leona, Acedratas, San Isidro, El Guayabo, La Totuma, Trujillo, Amesitas, El Lazo, El Retiro, Peñonosa, La Babillera, Cachipa, Cocare, La Caima y Del Valle (Cortolima, 2009).
Con relación a las características de la cuenca, esta se encuentra rodeada principalmente por especies vegetales en su mayoría arbóreas, así como helechos, herbáceas como bromelias y musgos, entre otros. También cuenta con la presencia de fauna silvestre como el venado, conejo armadillo, reptiles como el lobo pollero, y serpientes del género Micrurus, así mismo gran cantidad de avifauna (Cortolima, 2009).
Toma de muestras. Durante dos periodos hidrológicos correspondientes a altas y bajas lluvias, entre septiembre y diciembre de 2012, se tomaron muestras en microhábitats de arena (A), hojarasca (H), grava (G) y roca (R) en nueve puntos del río Alvarado y sus tributarios (Figura 1; Tabla 1). Para esto se empleó una red Surber de 250 μm con un área de 0,09 m2, siguiendo la metodología propuesta por Wantzen y Rueda (2009) en tramos impactados y no impactados por la urbanización y la agricultura (Figura 2).
Tabla 1 Estaciones de muestreo en la cuenca del río Alvarado, periodo septiembre y diciembre de 2012.
| Estación | Sigla | Municipio | Coordenadas | Altitud (m s.n.m.) | |
| Quebrada Cocare | QCOC | Ibagué | 04⁰28'37,4" N | 075⁰08'25,4" O | 1057 |
| Quebrada Chembe | QCHE | Ibagué | 04⁰27'34,2" N | 075⁰08'54,7" O | 988 |
| Río Alvarado-Inicio | RAIN | Ibagué | 04⁰27'13,1" N | 075⁰09'23,2" O | 977 |
| Quebrada Chumba | QCHU | Ibagué | 04⁰29'06,2" N | 075⁰05'48,6" O | 973 |
| Quebrada La Manjarrés | QLM | Ibagué | 04⁰28'19,3" N | 075⁰04'26,9" O | 758 |
| Río Alvarado-Chucuni | RACH | Ibagué | 04⁰27'56,7" N | 075⁰03'46,7" O | 697 |
| Río Alvarado-Puente | RAP | Alvarado | 04⁰31'11,3" N | 074⁰59'14,0" O | 521 |
| Quebrada La Caima | QLCA | Alvarado | 04⁰35'45,8" N | 074⁰56'39,6" O | 374 |
| Río Alvarado-Caldas Viejo | RACV | Alvarado | 04⁰36'41,2" N | 074⁰55'46,2" O | 351 |

Figura 2 Registro fotográfico de las diferentes estaciones muestreadas en la cuenca del río Alvarado, periodo septiembre y diciembre de 2012.
Las muestras recolectadas se almacenaron en frascos plásticos de 500 ml y se conservaron en alcohol al 70 %. En el laboratorio se filtraron a través de un tamiz de 50 μm para limpieza, separación e identificación de las larvas de dípteros con ayuda y uso de estereoscopio Olympus szx9 (6,3X-57X). Los organismos se determinaron hasta género, empleando las claves y descripciones de Epler (2001), Borkent y Spinelli (2007), Coscarón y Coscarón-Arias (2007), Domínguez y Fernández (2009) y Trivinho (2011).
Para la adecuada identificación de quironómidos las larvas se aclararon con el fin de hacer más visibles las diferentes estructuras existentes en la cápsula cefálica y a lo largo del cuerpo (Anexo 1). Para ello, se empleó hidróxido de potasio (KOH) al 10 %, posteriormente se realizaron lavados sucesivos con alcohol en diferentes concentraciones (70, 96 y 99,9 %), y finalmente se realizó el montaje y fijación por placas con euparal (Trivinho, 2011) para la visualización en el microscopio.
Una vez las muestras fueron analizadas, los especímenes se ingresaron a la Colección Zoológica de la Universidad del Tolima, en la sección macroinvertebrados acuáticos (CZUT-Ma).
Parámetros fisicoquímicos y bacteriológicos. Se tomaron muestras de agua en los 9 puntos, tanto para análisis bacteriológico como para análisis de 18 parámetros fisicoquímicos. Para esto se utilizaron frascos estériles de vidrio de 300 ml (bacteriológico) y frascos plásticos de 2 L (fisicoquímico). Los análisis se llevaron a cabo en condiciones in situ (medición de temperatura ambiental, temperatura del agua, profundidad, caudal y velocidad) y ex situ en el Laboratorio de Análisis Químico de la Universidad del Tolima (LASEREX) que incluyó los parámetros de pH, turbiedad, oxígeno disuelto, porcentaje de saturación, demanda química de oxígeno (DQO), demanda biológica de oxígeno (DBO5), alcalinidad, cloruros, dureza, sólidos totales, sólidos suspendidos, conductividad eléctrica, fósforo total, fosfatos, nitratos, coliformes totales y fecales, de acuerdo con las recomendaciones propuestas por APHA-AWWA-WEF (American Public Health Association et al., 2005).
Análisis de datos. Para analizar la estructura del orden Diptera se determinó la riqueza y la abundancia relativa a partir de las densidades de cada uno de los géneros para los dos periodos muestreados. También se analizó la diversidad de estos organismos tanto a nivel temporal como espacial y de sustratos mediante el cálculo del índice de riqueza de Margalef (D), dominancia de Simpson (λ) y diversidad de Shannon-Wiener (H’), empleando el programa Past versión 1.98 (Hammer et al., 2001). Con el fin de verificar la normalidad de los datos en las abundancias y los parámetros fisicoquímicos tanto a nivel temporal como espacial (p > 0,05), se llevó a cabo la prueba de Shapiro-Wilk.
Una vez analizada la estructura de dípteros en la cuenca del río Alvarado, se procedió a determinar diferencias significativas a nivel espacial y temporal en los valores medidos para los parámetros fisicoquímicos mediante el test de Kruskal-Wallis, usando el paquete estadístico STATISTICA versión 7.0 (StatSoft, 2007). Por otro lado, se realizó un Análisis de Correspondencia Canónica mediante el programa Canoco versión 4.5 (Ter Braak y Smilauer, 2004), con el propósito de explorar las asociaciones entre las variables fisicoquímicas, la fauna de larvas de dípteros acuáticos y los puntos muestreados en el río Alvarado. Así mismo, se determinaron las variables con mayor influencia en la dinámica fisicoquímica de la cuenca, mediante un Análisis de Componentes Principales utilizando el programa STATISTICA versión 7.0 (StatSoft, 2007).
Resultados
Entre septiembre y diciembre de 2012 en las 9 estaciones del río Alvarado se encontraron 3283 larvas de dípteros pertenecientes a 8 familias, 13 subfamilias y 41 géneros. Se destacan 15 nuevos registros de la familia Chironomidae (Cladotanytarsus, Cryptochironomus, Endotribelos, Microchironomus, Paratanytarsus, Pelomus, Riethia, Saetheria, Cricotopus, Nanocladius, Onconeura, Paracladius, Gr. Thienemannimyia, Labrundinia y Larsia), 4 de la familia Ceratopogonidae (Forcipomyia, Culicoides, Bezzia y Dasyhelea) y un género de Empididae (Clinocera) (Anexo 2).
A nivel general, la familia Chironomidae presentó el mayor porcentaje de individuos en relación al total de larvas colectadas y fue seguida por Ceratopogonidae. A su vez, se destaca la elevada presencia de los géneros Chironomus, Dicrotendipes, Polypedilum, Rheotanytarsus, Cricotopus (Chironomidae), Culicoides (Ceratopogonidae), y Simulium (Simuliidae). En este estudio, las familias menos abundantes fueron Culicidae, Empididae, Psychodidae y Stratiomyidae (Anexo 2).
Distribución temporal. En septiembre se evidenció el mayor registro de riqueza, densidad y abundancia de organismos recolectados en comparación con lo muestreado en el mes de diciembre (Anexo 2). Sin embargo no hubo diferencias significativas (U = 710, n = 41, p = 0,23) entre las densidades y abundancias a nivel temporal. Para el primer periodo las 1941 (59,12%) larvas de dípteros analizadas se distribuyeron en 8 familias, 13 subfamilias y 39 géneros, mientras que en diciembre se registraron 1342 (40,87 %) distribuidas en 6 familias, 11 subfamilias y 32 géneros. En ambos periodos, se destaca la presencia de las subfamilias Chironominae, Orthocladiinae y Tanypodinae, con una abundancia relativa del 43 %, 27 % y 5 %, respectivamente (Anexo 2). Con respecto a la distribución temporal de las larvas por cada punto muestreado, se evidenció una disminución en el número de organismos en todas las estaciones; sin embargo, en RAP y RACV el número de individuos aumentó de septiembre a diciembre (Figura 3). En estas estaciones, se registró una gran abundancia relativa de larvas de la familia Chironomidae, en la cual se destacan los géneros Cladotanytarsus, Cricotopus, Dicrotendipes, Larsia, Onconeura, Polypedilum, Paratanytarsus y Saetheria.

Figura 3 Abundancia relativa de larvas de dípteros acuáticos a nivel espacial en la cuenca del río durante septiembre y diciembre de 2012.
Distribución espacial. En los dos periodos muestreados, la estación RAIN reflejó la mayor abundancia de organismos recolectados (10 % y 9 %); mientras que la estación QCOC presentó la menor abundancia (3 % y 2 %) (Figura 3). No obstante, de septiembre a diciembre en estaciones como QCHU se evidenció una disminución abrupta en el número de larvas recolectadas (13 % y 2 %) (Figura 3), esto puede deberse al aumento de las corrientes como resultado de las intensas lluvias que se presentaron durante los días de muestreo. Con relación a la distribución altitudinal, en los dos periodos se hallaron dípteros en todos los puntos muestreados, desde los 351 m s.n.m hasta los 1057 m s.n.m. Sin embargo, algunos géneros por su baja abundancia presentaron restricciones altitudinales. Dentro de estos se destacan, Chironomus (973-977 m s.n.m.), Fittkavimyia (521 m s.n.m.), Microchironomus (521 m s.n.m.), Paracladius (973 m s.n.m.), Pelomus (973 m s.n.m.), Xestochironomus (758 m s.n.m.), Atrichopogon (977-977 m s.n.m.), Forcipomyia (351 m s.n.m.), Anopheles (374 m s.n.m.), Chelifera (1057 m s.n.m.), Clinocera (1057 m s.n.m.) y Odontomyia (351 m s.n.m.) (Anexo 2).
En lo que respecta a la familia Chironomidae, géneros como Polypedilum, Rheotanytarsus, Cladotanytarsus, Dicrotendipes, Saetheria, Cricotopus, Onconeura, Cardiocladius, Thienemanniella, Lopescladius, Corynoneura, Larsia, Pentaneura, Labrundinia y Paratanytarsus mostraron una amplia distribución altitudinal y en su mayoría se relacionaron con todos los sustratos muestreados (Anexo 2); situación similar se presentó en géneros como Simulium, Hexatoma y Culicoides (Anexo 2). Caso contrario, larvas de Limonia, Pericoma y Dasyhelea estuvieron asociadas a sustratos como hojarasca y roca, y presentaron un rango de distribución altitudinal amplio, estos estuvieron asociados con sustratos como hojarasca y roca (Anexo 2).
Índices ecológicos. Los valores de los índices muestran una gran diversidad y riqueza de géneros para los períodos muestreados. En septiembre, estaciones como QCHU y QCOC evidenciaron valores elevados de riqueza y diversidad, mientras que QLM presentó valores bajos (Figura 4A). Para el periodo de diciembre QLM, RACH y RAP presentaron los índices de riqueza y diversidad más elevados, contrario a la estación RAIN que evidenció valores bajos (Figura 4B). Con respecto al índice de dominancia, para el periodo de septiembre estaciones como RACV, RAIN, QLM, y QCHE mostraron valores elevados, mientras que para diciembre los puntos QCOC, RAIN y QCHU reflejaron índices de dominancia elevados (Figura 4A-B).

Figura 4 Variación espacial del índice de riqueza de Margalef, dominancia de Simpson y Shannon-Wiener de dípteros de la cuenca del río Alvarado septiembre (A) y diciembre (B) de 2012
En cuanto a los sustratos muestreados, durante septiembre y diciembre se evidenciaron valores elevados de riqueza y diversidad, y bajos de dominancia para todos los microhábitats, aunque hojarasca y roca presentaron una dominancia moderadamente elevada en los dos periodos muestreados (Figura 5A-B).

Figura 5 Variación en el índice de riqueza de Margalef, dominancia de Simpson y Shannon-Wiener de dípteros, en los diferentes sustratos muestreados de la cuenca del río Alvarado en septiembre (A) y diciembre (B) de 2012
Finalmente, a pesar de que se encontró una gran diversidad y riqueza de larvas de dípteros tanto para septiembre como diciembre, estaciones como QLM mostraron valores elevados de dominancia en el sustrato de hojarasca, y para diciembre, QCHU presentó índices de dominancia más elevados en los sustratos de hojarasca y roca (Figura 6A-B).

Figura 6 Variación espacial del índice de riqueza de Margalef, dominancia de Simpson y ShannonWiener de Dípteros, en los diferentes sustratos muestreados en las nueve estaciones de la cuenca del río Alvarado en el mes de septiembre (A) y diciembre (B) de 2012.
Variables fisicoquímicas y bacteriológicas. Las variables fisicoquímicas analizadas no evidenciaron diferencias significativas (p > 0,05) a los largo de las nueve estaciones de muestreo, a excepción de la temperatura del agua, conductividad eléctrica y alcalinidad (Tabla 2). Por otra parte, a nivel temporal se reflejaron cambios significativos en los parámetros analizados, lo cual puede ser atribuido a factores externos como las condiciones climáticas y antropogénicas de la región durante los dos periodos de estudio (Tabla 2).
Tabla 2 ANOVA de Kruskal-Wallis para los 19 parámetros fisicoquímicos y bacteriológicos analizados en las nueve estaciones de la cuenca del río Alvarado en septiembre y diciembre de 2012.
| Unidad de medida | Variables fisicoquímicas y bacteriológicas | Estaciones | Muestreo | |||
|---|---|---|---|---|---|---|
| H(8,N=18) | P | H(1,N=18) | P | |||
| C° | Temperatura del agua | 15,9649 | 0,0429 | 0,2359 | 0,6272 | |
| C° | Temperatura ambiente | 12,4271 | 0,1331 | 1,5409 | 0,2145 | |
| µS/cm | Conductividad eléctrica | 16,3859 | 0,0372 | 0,0955 | 0,7573 | |
| Unidades | pH | 5,5934 | 0,6927 | 9,5615 | 0,002 | |
| UNT | Turbiedad | 4,2810 | 0,8309 | 10,2319 | 0,0014 | |
| mg O2/l | Oxígeno disuelto | 7,0877 | 0,5272 | 5,0701 | 0,0243 | |
| % O2 | Porcentaje saturación | 2,1689 | 0,9754 | 12,8026 | 0,0003 | |
| mg/l | Solidos totales | 14,2456 | 0,0756 | 1,0311 | 0,3099 | |
| mg/l | Solidos suspendidos | 2,8362 | 0,9442 | 12,8424 | 0,0003 | |
| mg O2/l | DQO | 5,2966 | 0,7255 | 1,5881 | 0,2076 | |
| mg O2/l | DBO5 | 7,5779 | 0,4757 | 7,7448 | 0,0054 | |
| mg NO3/l | Nitratos | 12,8159 | 0,1183 | 1,5314 | 0,2159 | |
| mg P/l | Fosfatos | 3,1384 | 0,9254 | 11,9892 | 0,0005 | |
| mg P/l | Fosforo total | 3,0507 | 0,9311 | 11,2419 | 0,0008 | |
| mg Cl/l | Cloruros | 14,0219 | 0,0812 | 0,0315 | 0,8591 | |
| mgCaCO3/l | Alcalinidad | 16,8421 | 0,0318 | 0,0175 | 0,8946 | |
| mgCaCO3/l | Dureza | 14,4221 | 0,0714 | 0,2358 | 0,6272 | |
| Colif/100ml | Coliformes fecales | 8,5355 | 0,383 | 4,5475 | 0,033 | |
| Colif/100ml | Coliformes totales | 7,0862 | 0,5274 | 5,0754 | 0,0243 | |
Con respecto al Análisis de Componentes Principales (ACP), los dos primeros factores explican el 60,69 % de la varianza acumulada (Figura 7). El primero de ellos mostró que las variables de mayor contribución y correlación fueron conductividad eléctrica, pH, sólidos totales, alcalinidad y dureza, variables que denotan procesos de mineralización en las aguas (Ramírez y Viña, 1998a). Para el segundo componente, las variables de mayor contribución y correlación fueron turbiedad, fosfatos y coliformes totales. De acuerdo con lo registrado por Ramirez y Viña (1998a), las variables de mayor contribución en el segundo componente denotan procesos asociados a oxido-reducción de materia orgánica y procesos de contaminación o intervención antrópica (Figura 7). Comparando esto con la proyección obtenida de las estaciones, puntos como QLCA, RAP y RACV se disgregan en igual dirección a las variables de mayor contribución en el primer componente, mientras que la estación RAIN cercana a asentamientos urbanos, se disocia hacia las variables de mayor correlación del segundo componente (Figura 8).
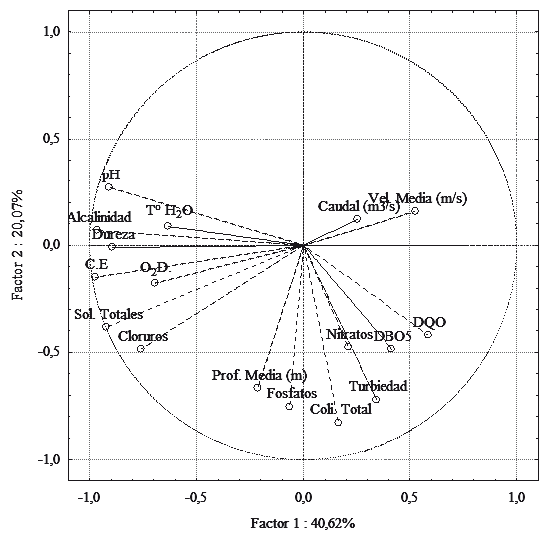
Figura 7 Proyección de las variables fisicoquímicas y bacteriológicas analizadas en la cuenca del río Alvarado de acuerdo con los componentes obtenidos a partir del análisis de componentes principales en septiembre y diciembre de 2012.

Figura 8 Proyección de las estaciones evaluadas en la cuenca del río Alvarado de acuerdo con el análisis de componentes principales de las variables fisicoquímicas y bacteriológicas analizadas en septiembre y diciembre de 2012.
Se evidencia en el Análisis de Correspondencia Canónica (ACC) una fuerte correlación entre las variables coliformes totales y turbiedad con la estación RAIN. La presencia de géneros como Chironomus y Nanocladius estuvo asociada a estos parámetros. A su vez, este tipo de correlación también se muestra en variables como alcalinidad - dureza, conductividad eléctrica - temperatura del agua y oxígeno disuelto - sólidos totales. A estas, se asocian las estaciones QLCA, QCHU y RACV, junto a los géneros Anopheles, Bezzia, Cladotanytarsus, Dasyhelea, Dicrotendipes, Forcipomyia, Limonia, Odontomyia, Paracladius, Paratanytarsus, Pelumos, Pericoma, Riethia y Thienemanniella. Sin embargo, géneros como Xestochironomus, Cardiocladius, Chelifera y Clinocera no se asociaron a las variables fisicoquímicas evaluadas, en las estaciones QCOC y QLM (Figura 9).
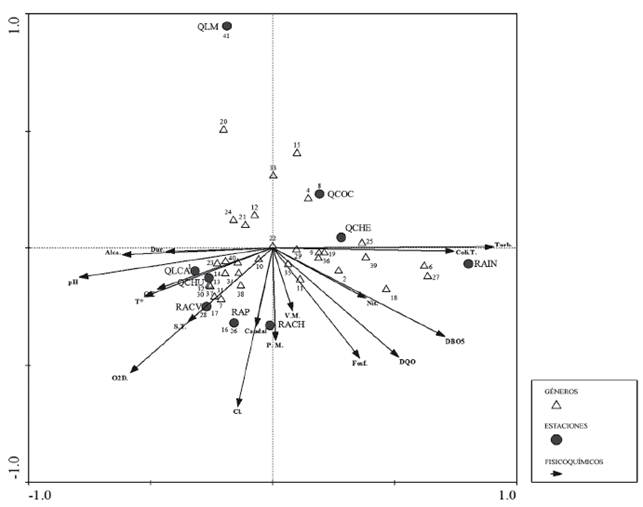
Figura 9 Diagrama de ordenación canónica entre variables fisicoquímicas y la fauna de dípteros acuáticos en las diferentes estaciones muestreadas de la cuenca del río Alvarado en septiembre y diciembre de 2012. Géneros: 1. Anopheles; 2. Atrichopogon; 3. Bezzia; 4. Cardiocladius; 5. Chelifera; 6. Chironomus; 7. Cladotanytarsus; 8. Clinocera; 9. Corynoneura; 10. Cricotopus; 11. Cryptochironomus; 12. Culicoides; 13. Dasyhelea; 14. Dicrotendipes; 15. Endotribeles; 16. Fittkavimyia; 17. Forcipomyia; 18. Gr. Thienemannimyia; 19. Hemerodromia; 20. Hexatoma; 21. Labrundinia; 22. Larsia; 23. Limonia; 24. Lopescladius; 25. Maruina; 26. Microchironomus; 27. Nanocladius; 28. Odontomyia; 29. Onconeura; 30. Paracladius; 31. Paratanytarsus; 32. Pelomus; 33. Pentaneura; 34. Pericoma; 35. Polypedilum; 36. Rheotanytarsus; 37. Riethia; 38. Saetheria; 39. Simulium; 40. Thienemanniella; 41. Xestochironomus. Variables fisicoquímicas: Dureza (Dur.), Alcalinidad (Alca.), pH, conductividad eléctrica (C.E.), Temperatura (T°), solidos totales (S.T.), oxígeno disuelto (O2D), Cloruros (Cl.), Fosfatos (Fosf), Nitratos (Nit), DQO, DBO5, coliformes totales (Coli. T.) y turbiedad (Turb.).
Discusión
La cuenca del río Alvarado por su moderada torrencialidad y cobertura vegetal, bajas velocidades de corrientes y amplias zonas de remansos con sustratos pedregosos y arenosos con material vegetal, constituye un escenario ideal para el establecimiento de una gran diversidad y abundancia de macroinvertebrados acuáticos (Ramírez y Viña, 1998b; Merritt y Wallace, 2009). Muchos de estos organismos son capaces de adaptarse a amplios rangos ambientales y obtener de estas condiciones el alimento necesario (Ramírez y Viña, 1998b; Roldán y Ramírez, 2008). Tal es el caso de los dípteros, que por su amplia distribución, riqueza, diversidad, variedad estructural y hábitos ecológicos, pueden abarcar un sin número de hábitats acuáticos (Merritt et al., 2009).
Aunque los ecosistemas acuáticos tropicales se caracterizan por su amplia diversidad, factores como las precipitaciones y el aumento de las corrientes impiden la consolidación de ambientes acuáticos estables, haciendo que estos se mantengan en constantes procesos de sucesión con proliferación de especies capaces de adaptarse a las condiciones ambientales prevalecientes (Ramírez y Viña, 1998b). Es por esta razón que a nivel temporal las comunidades de macroinvertebrados acuáticos presentan variaciones en su riqueza, estructura, composición y abundancia (Kikuchi y Uieda, 2005; Rosa et al., 2013b). Dicha situación no fue un aspecto atípico para el ensamblaje de dípteros en el río Alvarado, ya que la densidad y riqueza presentaron una leve disminución de un periodo a otro, aunque no hubo diferencias significativas. Es claro que estos mínimos cambios en el ensamblaje de dípteros evidencia la tolerancia y prevalencia de estos organismos a diferentes factores ambientales tales como variabilidad torrencial, heterogeneidad espacial y oferta de hábitats (Roldán, 1988; Kikuchi y Uieda, 2005; Aburaya y Callil, 2007; Rosa et al., 2013b).
Los sistemas dulceacuícolas tropicales, al enfrentar temporadas de sequía y lluvia, facilitan o no la disposición de nutrientes y material orgánico particulado grueso o fino, siendo este último más frecuente en temporada de altas precipitaciones (Merritt y Wallace, 2009; Thorp, 2015). Es así como durante septiembre la presencia de dípteros fragmentadores, recogedores (recolectores) y depredadores como Chironomidae, Ceratopogonidae, Stratiomyidae y Tipulidae presentaron mayor abundancia, ya que son organismos cuya preferencia alimenticia es la materia orgánica particulada gruesa, el detritus y otros organismos (Merritt y Wallace, 2009; Hanson et al., 2010). Caso contrario se presentó en diciembre, en el cual el incremento en las precipitaciones facilitó la presencia y abundancia de organismos filtradores (detritívoros) como Chironomidae y Simuliidae, cuya preferencia alimenticia se limita a materia orgánica particulada fina en descomposición (Merritt y Wallace, 2009; Hanson et al., 2010).
Aunque los periodos de lluvia y sequia proveen variabilidad, también lo hacen la velocidad de las corrientes, la disponibilidad de nutrientes y la complejidad estructural de hábitats en sistemas lóticos, lo cual posibilita que los dípteros por su gran adaptabilidad a amplios rangos ambientales y eurifagia, colonicen multitud de ambientes acuáticos en distintas condiciones ambientales (Kikuchi y Uieda, 2005; Thorp y Rogers, 2011; Courtney y Cranston, 2015; Cañedo-Argüelles et al., 2016). Si bien dicha condición se evidenció dentro de la estructura de dípteros en la cuenca del río Alvarado, aspectos como la física de los cuerpos de agua y la presencia de planos inundables con zonas de remanso y baja velocidad facilitaron aún más el establecimiento de estos organismos a lo largo de los nueve puntos de muestreo para ambos periodos, condiciones que de acuerdo con Ramírez y Viña (1998b) y Roldán y Ramírez (2008) aumentan aún más la capacidad ambiental de los ecosistemas dulceacuícolas tropicales.
Sin embargo, estos patrones no fueron propios y particulares a todos los puntos de muestreo para ambos periodos, ya que bajas abundancias de dípteros se presentaron en las estaciones QCOC y RAP, situación atribuible a la presencia de caudales muy reducidos con grandes extensiones de orillas, escasa vegetación ribereña, disminución de la acumulación de material vegetal sobre el cauce y predominancia de sustrato arenoso y rocoso (guijarro). Dichas condiciones de acuerdo con lo registrado por Kikuchi y Uieda (2005), DeWalt et al. (2010), Rosa et al. (2013b) y Cañedo-Argüelles et al. (2016) propician la aparición de organismos especialistas propios a dichas condiciones ecológicas.
Evidencia de lo anterior es la especificidad espacial que se manifestó a lo largo de la cuenca por parte de algunos organismos del orden Diptera. Larvas de los géneros Chelifera, Clinocera, Fittkauimyia, Saetheria y Microchironomus se encontraron establecidas en las estaciones QCOC y RAP, en remansos o aguas estancadas de poco caudal, cubiertos por vegetación circundante, asociados a sustratos de grava y roca. La ecología de estos organismos se vincula principalmente a sedimentos arenosos de ríos, arroyos y estanques boscosos (Epler, 2001; Carreira, 2002; Kong, 2010; Trivinho, 2011), situación por la cual su distribución altitudinal se vio limitada.
Ninguno de los puntos muestreados presentó alguna ausencia de dípteros, a razón de que en su mayoría fue dada por la alta presencia y dominancia de quironómidos (Kikuchi y Uieda, 2005; Ribeiro y Uieda, 2005). Esta situación concuerda con lo registrado para el Tolima, ya que dentro de este orden dicha familia ha sido la de mayor distribución, abarcando una gran variedad de sustratos (hojas, troncos sumergidos, rocas, arena y lodo) entre los 244 m s.n.m. y los 4000 m s.n.m. en las cuencas de los ríos Lagunilla, Anamichú, Recio, Totare, Coello, Prado y Opia (Villa et al., 2004; Reinoso et al., 2007, 2008a, b; Reinoso et al., 2009).
La amplia diversidad y riqueza de dípteros acuáticos en la cuenca del río Alvarado a nivel espacial, temporal y de sustratos, es evidencia de la gran capacidad que tienen estos organismos de colonizar múltiples hábitats, soportar condiciones ambientales de sequía y lluvia (Kikuchi y Uieda, 2005; Ribeiro y Uieda, 2005) y al amplio gradiente altitudinal que ocupan estos organismos en el Neotrópico (Merritt et al., 2009).
Esta estructura en gran medida está soportada por la ubicuidad de la familia Chironomidae, la cual presentó la mayor riqueza, abundancia y diversidad en todas las estaciones, sustratos y épocas de recolección en la cuenca del río Alvarado. Tal patrón es producto de la amplia capacidad de hábitos alimenticios que tienen las larvas acuáticas de esta familia (Merritt y Wallace, 2009), lo cual le permite obtener el recurso de cualquier medio y por ende ocupar un amplio rango de microhábitats (Kikuchi y Uieda, 2005; Courtney y Merritt, 2009; Paggi, 2009; DeWalt et al., 2010; Rosa et al., 2013a; Rosa et al., 2013b). Por otro lado, la baja riqueza y diversidad en las familias Culicidae y Stratiomyidae dentro de este estudio puede relacionarse con la afinidad de estos organismos a ecosistemas dulceacuícolas lénticos (DeWalt et al., 2010).
Adicionalmente, la morfología y geología de la cuenca constituyen un factor importante en la riqueza y diversidad de larvas acuáticas, ya que su ambiente moderadamente torrencial, además de su ubicación y forma alargada con pocas pendientes, la hacen menos propensa y susceptible a grandes velocidades y crecidas súbitas y violentas (Cortolima, 2009). Es por esto que la cuenca presenta grandes extensiones de sus orillas con remansos donde las partículas orgánicas e inorgánicas en suspensión fácilmente se depositan en el fondo, caracterizado en su mayoría por limo, arena, grava, hojarasca y restos de madera, que son ambientes propicios para la colonización de un variado número de organismos (Merritt y Wallace, 2009). Por esta razón se evidencia una baja dominancia tanto en las estaciones como en los sustratos evaluados.
Si bien las condiciones morfológicas, geológicas e hidrológicas de la cuenca juegan un rol importante en el establecimiento de diversas comunidades bentónicas, las diferentes zonas de vida y sus características como la disponibilidad del sustrato también lo son (Kikuchi y Uieda, 2005; Ribeiro y Uieda, 2005; Merritt y Wallace, 2009), ya que pueden facilitar la aparición de grupos especializados y adaptados a ciertas condiciones ambientales (Roldán, 1999), las cuales pueden dar como resultado elevadas dominancias. Prueba de lo anterior es lo registrado en la estación QLM para el periodo de septiembre y en las estaciones QCHU, RAIN, QCHE y RAP para diciembre. En el caso de la estación QLM, la elevada dominancia en el sustrato hojarasca se debe a la densidad de larvas de Polypedilum, mientras que en la estación QCHU, los sustratos roca, grava y hojarasca fueron hábitat predilecto para las larvas de Cricotopus. Por su parte, los lechos arenosos, de grava y roca de las estaciones RAIN y RAP fueron propicios para los géneros Polypedilum, Maruina, Simulium, Cricotopus, Onconeura, Chironomus, Rheotanytarsus y Dicrotendipes. Los sustratos rocosos de la estación QCHE fueron idóneos para los géneros Simulium y Cardiocladius. Esta situación reafirma la fuerte predominancia de larvas de la familia Chironomidae en diferentes hábitats dentro de la fauna béntica de ríos y a su vez evidencia la gran estabilidad y consistencia que ofrece los ambientes rocosos a esta fauna béntica (Roldán, 1988; Kikuchi y Uieda, 2005; Bernal et al., 2006; Rosa et al., 2013b).
Por su parte, los cambios fisicoquímicos presentados durante los periodos de muestreo son evidencia de la influencia de factores como la naturaleza geológica de la cuenca y el régimen de precipitaciones (Ribeiro y Uieda, 2005; Roldán y Ramírez, 2008). Dicha variabilidad constituyó un factor importante en la estructuración ecológica de los biotopos acuáticos, determinando así la ocurrencia y distribución de los dípteros acuáticos en la cuenca del río Alvarado para ambos periodos (Ramirez y Viña, 1998b; Ribeiro y Uieda, 2005). Lo anterior se sustenta en dos aspectos: el primero se relaciona a los mínimos cambios que hubo con relación a la densidad y riqueza de dípteros entre los periodos de bajas y altas precipitaciones (septiembre y diciembre); y el segundo con las correlaciones existentes en el ACP y ACC, las cuales indicaron que las variables conductividad eléctrica, pH, solidos totales, alcalinidad y dureza tuvieron una influencia importante en la distribución de larvas acuáticas del orden Diptera, específicamente en las estaciones RAP, QLCA, QCHU y RACV, mientras que variables como turbiedad, fosfatos y coliformes totales influyeron en estos organismos en la estación RAIN.
Por consiguiente, las estaciones influenciadas por las variables que denotan mineralización registraron una biota diversa de dípteros dentro de los cuales se destacan los géneros Anopheles, Bezzia, Cladotanytarsus, Dasyhelea, Dicrotendipes, Forcipomyia, Limonia, Odontomyia, Fittkauimiyia, Microchiromus, Paracladius, Paratanytarsus, Pelomus y Riethia. Dichas estaciones presentaron niveles elevados de conductividad eléctrica, pH, sólidos totales, alcalinidad, dureza y oxígeno disuelto en ambos periodos de muestreo. Esto sugiere que las amplias zonas de remanso y las velocidades de corrientes moderadas presentes en estos puntos, constituyen una fuente rica de alimento y por ende un hábitat propicio para la proliferación de una biota diversa, ya que estos aspectos facilitan la sedimentación y el arrastre de material orgánico autóctono y alóctono a lo largo de los cuerpos de agua (Kamp-Nielsen, 2008; Wang y D’Odorico, 2008; Ratnayaka et al., 2009). La mayoría de los organismos presentes en estas estaciones se caracterizan por vivir en ecosistemas dulceacuícolas con grandes cantidades de material vegetal, detrito orgánico y aguas poco ácidas (Roldán, 1988; Trivinho, 2011).
Por otro lado, la presencia de larvas de los géneros Chironomus y Nanocladius en la estación RAIN en donde se evidenciaron elevados valores de coliformes totales y turbiedad, deja entrever la adecuada fisiología que poseen las larvas de la familia Chironomidae para vivir en medios pobres en oxígeno (Epler, 2001; Trivinho, 2011). Adicionalmente, estos parámetros que denotan procesos de óxido-reducción de materia orgánica, influyen de manera importante en el establecimiento de una biota poco diversa, convirtiéndose en una limitante para el desarrollo de diferentes especies (Roldán y Ramírez, 2008; Ratnayaka et al., 2009).
Finalmente, es importante resaltar que géneros como Cardiocladius, Clinocera, Endotribelos, Maruina, Pentaneura y Xestochironomus no estuvieron condicionados a alguna variable evaluada en ambos periodos en las estaciones QLM, QCOC y QCHE. Estos puntos presentaban poca intervención antrópica, amplia cobertura vegetal del cauce, abundante material vegetal sumergido y aguas con poca velocidad. Las larvas de estos géneros por su ecología se encuentran presentes en lugares con presencia de detritus (algas), macrófitas y material vegetal sumergido (troncos y hojas) en aguas estancadas o en movimiento (Epler, 2001; Trivinho, 2011). Este aspecto evidencia la poca especificidad que pueden llegar a tener algunos géneros de dípteros acuáticos a la física y química de los cuerpos de agua lóticos.
Conclusiones
El presente estudio amplía el conocimiento sobre la composición y distribución de larvas acuáticas del orden Diptera en ecosistemas dulceacuícolas lóticos neotropicales de la región Andina en Colombia, y constituye una línea base para futuros estudios sobre distribución, taxonomía y ecología de los géneros registrados. Debido a la gran diversidad de este orden, la determinación taxonómica de la familia Chironomidae se realizó hasta nivel de género, ampliando la información existente a nivel regional y nacional para futuros trabajos en la identificación de este grupo biológico.
Los análisis realizados con respecto a la determinación taxonómica y la caracterización en términos de biodiversidad muestran la amplia riqueza y abundancia de estos organismos en la cuenca del río Alvarado sobre todos los sustratos muestreados. Aunque la estructura del orden Diptera dentro de este ecosistema lótico se mantuvo similar a lo largo de todos los puntos de muestreo, se hizo evidente que el régimen de las precipitaciones, la dinámica y las condiciones fisicoquímicas de la cuenca se convierten en factores limitantes en la distribución de las larvas acuáticas de estos insectos.















