Introducción
La organización grupal es una característica del comportamiento social animal que ha evolucionado sobre las bases de conductas colectivas en las especies (Rubenstein & Alcock, 2018). Se ha demostrado que los animales que presentan este tipo de organización tienen mayor eficiencia en la búsqueda de alimento, cuidado de crías, dominancia de territorios más amplios y en la vigilancia (Alcock, 2001; Santos & Macedo, 2011; Beauchamp, 2015; Wittwer et al., 2017; Boucherie et al., 2019). Sin embargo, las conductas territoriales entre machos para el apareamiento, las disputas por espacios y recursos alimenticios, y la competencia entre hembras por sitios de nidificación, son algunas de las evidencias de los costos de la vida en grupo (Alcock, 2001; Schradin et al., 2010; Rubenstein & Alcock, 2018).
La colonialidad, como un sistema de organización de grupo, está influenciada exclusivamente por factores sociales (Gross & Macmillan, 1981) y ha sido documentada en insectos, peces, reptiles, mamíferos y aves (Alexander, 1974; Rolland et al., 1998). La dinámica de la convivencia bajo un sistema colonial determina la existencia de una estructura jerárquica de dominancia, con individuos ocupando posiciones de privilegio con roles reproductivos, e individuos subordinados con labores de protección y mantenimiento de la colonia (Alcock, 2001; Jungwirth, et al., 2015). Este sistema produce el despliegue de conductas sociales como la defensa colectiva ante depredadores (Robinson, 1997; Beauchamp, 2015; Jungwirth, et al., 2015), o la competencia intraespecífica por recursos y apareamiento (Koening et al., 1995; Price et al., 2006; Duijns & Piersma, 2014; Miles & Fuxjager, 2018; Boucherie et al., 2019), las cuales se transmiten entre individuos dentro de un sistema de comunicación (Bradbury & Vehrencamp, 2011).
En las especies que coexisten bajo este sistema, los individuos usan señales para identificarse entre sí y coordinar tareas (Wittwer et al., 2017); estas señales pueden utilizar los medios visual, químico, táctil o acústico (Marler, 1967; Guilford & Dawkins, 1991; Carazo & Font, 2010; Bradbury & Vehrencamp, 2011). Dentro de los distintos medios de comunicación, el acústico es uno de los más empleados, identificándose diferentes tipos de señales: neonatales, que mantienen la interacción entre la cría y sus progenitores; integrativas de cohesión grupal; señales de competencia, que demarcan territorialidad y jerarquía social; y señales sexuales, que se emiten para el cortejo (Tirado et al., 2004). En las aves, el medio acústico representa el método de comunicación más utilizado dentro del contexto social (Ladich & Winkler, 2017).
Las vocalizaciones en las aves presentan estructuras acústicas variadas y funciones específicas (Catchpole & Slater, 2008). Por ejemplo, algunas aves como la viuda senegalesa (Vidua chalybeata), el zanate caribeño (Quiscalus lugubris), o el cacique lomiamarillo (Cacicus cela), utilizan señales acústicas con propósitos específicos como la alerta grupal, la competencia intraespecífica por territorios y el cortejo (Payne, 1979; Feekes, 1982; Jaramillo & Burke, 1999). Las vocalizaciones emitidas para comunicar una determinada conducta presentan características particulares y, en algunas especies, pueden variar estructural y espectralmente, de acuerdo con el contexto (Vallet et al., 1998; Gil & Gahr, 2002; Catchpole & Slater, 2008). Payne (1979) demostró que V. chalybeata emite cantos de mayor duración en situaciones de persecución entre machos y cantos con modulación de frecuencia para el cortejo; por su parte, Price et al. (2006) encontraron que la oropéndola de Moctezuma (Psarocolius montezuma) modifica los valores mínimos de frecuencia en la que emite sus cantos territoriales para disuadir a su competencia y obtener beneficios reproductivos, lo cual indica que las características de las vocalizaciones pueden variar en función de las interacciones u organización social en las que se desarrollan algunas especies. Cuanto más complejo es el sistema de organización grupal, mayor variedad de señales y funciones dentro de las interacciones sociales presenta su sistema de comunicación asociado (Freeberg et al., 2012; Leighton, 2017; Wittwer et al., 2017; Miles y Fuxjager, 2018).
Diferentes especies del género Cacicus han evidenciado organización colonial; tal es el caso de C. cela (Feekes, 1982; Robinson, 1985a; Trainer, 1987; Thieltges et al., 2014), el cacique lomirrojo (C. haemorrhous; Thieltges et al., 2014) y el cacique de yelmo (C. oseryi; Leak & Robinson, 1989). En C. cela, se ha reportado una organización colonial con nidos densamente agregados a nivel del dosel del bosque (Feekes, 1982; Thieltges et al., 2014), encontrándose desde 10 hasta 100 nidos activos aproximadamente por cada árbol (Robinson, 1986); este mismo patrón de distribución de los nidos también se ha reportado en colonias de C. haemorrhous (Thieltges et al., 2014). Estas especies se caracterizan por tener cantos variados como producto de procesos evolutivos ligados a la selección sexual de los machos, mostrando repertorios amplios y versátiles (Price & Lanyon, 2004). Las vocalizaciones en estas especies varían tanto estructuralmente como en términos espectro-temporales, que abarcan, cambios anuales, cambios entre períodos de reproducción o incluso cambios dentro de una misma temporada reproductiva (Thieltges et al., 2014).
En el presente estudio se describen aspectos del comportamiento colonial y de las vocalizaciones del cacique montano norteño (Cacicus chrysonotus leucoramphus), una especie de hábitos coloniales de la cual existen vacíos de información en lo referente a su comportamiento social y vocal. Para esta especie, se ha documentado que anida en colonias pequeñas, (i.e., de tres a seis nidos en un árbol); en cuanto a sus vocalizaciones se ha reportado que produce al menos tres tipos de llamados, con repeticiones de notas y varios armónicos (Fraga, 2020). En este estudio se evaluó la asociación existente entre las vocalizaciones que emiten los machos y los comportamientos que exhiben dentro de su contexto social. Para conseguir este objetivo, se realizó una descripción de su comportamiento vocal y social exhibido dentro de la colonia y se evaluó estadísticamente la asociación entre tipos de vocalizaciones y conductas observadas.
Materiales y métodos
Área de estudio. El estudio se realizó en la laguna de La Cocha (Nariño, Colombia), un lago tropical de alta montaña que hace parte del humedal de importancia internacional Ramsar Laguna de La Cocha y que está asociado a ecosistemas de bosque montano (López-Martínez y Madroñero-Palacios, 2015). Las colonias de observación se ubicaron en las localidades de El Motilón (1°7’1.42”N, 77°10’29.344”O), El Romerillo (1°5’6.71”N, 77°10’29.347’’O), Santa Rosa (1°7’25.663’’N, 77°7’10.211’’O) y Santa Teresita (1°5’2.749’’N, 77°7’13.634’’O), entre 2800 y 3200 m s.n.m. (Figura 1).

Figura 1 Ubicación geográfica de las cuatro colonias estudiadas de Cacicus chrysonotus leucoramphus en el área del humedal Ramsar Laguna de La Cocha, Nariño, Colombia, mostrando el modelo digital de elevación (MDE).
Especie de estudio. El cacique montano, Cacicus chrysonotus, es una especie de bosque montano húmedo y bosque de niebla, que se distribuye ampliamente a lo largo de la zona andina, desde Venezuela hasta Bolivia, entre 2000 y 3600 m s. n. m. La subespecie, C. chrysonotus leucoramphus presenta principalmente una coloración negra, con las plumas de la espalda baja y las coberteras supracaudales amarillas, y tiene un parche amarillo en las alas. Los machos adultos presentan un mayor tamaño que el de las hembras, y tienen el iris de color azul, que lo diferencia de los individuos juveniles, que tienen el iris de color marrón oscuro. Su período reproductivo abarca desde febrero hasta julio (Fraga, 2020).
Fase de campo. Se realizaron un total de 12 salidas entre septiembre y diciembre de 2018, en las que se monitorearon 11 machos adultos en cuatro colonias de anidación. Cada colonia fue monitoreada durante su fase de actividad durante una jornada continua de 12 horas, desde las 05:00 hasta las 17:00 h, para un total de esfuerzo de muestreo de 144 horas. Durante el monitoreo se realizaron grabaciones acústicas y registros conductuales sobre individuos machos adultos.
Registro conductual y acústico. El método de muestreo fue tipo barrido (scan), evaluando el grupo completo en intervalos de diez minutos, durante los cuales se registró el comportamiento de cada individuo en ese instante, complementado con muestreo de tipo focal en el que se las observaciones se enfocaron en un solo individuo (Martin & Bateson, 2007). Las observaciones realizadas se complementaron con registro fotográfico y de video, utilizando una cámara Nikon D3400 con lente 18-55 mm VR (Vibration Reduction). De igual manera, se realizaron registros acústicos, empleando dos grabadoras portátiles ROLAND R26, con micrófonos condensadores unidireccionales RODE NTG2 a una frecuencia de muestreo de 44.1 kHz, en formato WAV de 32-bits (Budney & Grotke 2013; Price et al., 2004). Las grabaciones fueron limitadas a un intervalo de hasta 5 minutos en paralelo con la toma de datos de las conductas. En total se obtuvieron 221 vocalizaciones de 11 machos adultos. La descripción de las conductas se realizó con base en literatura referente al comportamiento animal (Stutchbury & Morton, 2001; Beauchamp, 2015; Rubenstein & Alcock, 2018) y en investigaciones del comportamiento colonial de C. cela (Feekes, 1982; Robinson, 1985b; Trainer, 1987; Robinson, 1997) y de C. haemorrhous (Thieltges et al., 2013).
Análisis de vocalizaciones. Las grabaciones se examinaron usando el software Raven Pro v1.5 (Bioacoustics Research Program, 2011; ventana: Hann, tamaño de DFT: 1024 puntos, superposición: 90 %). Mediante inspección visual se seleccionaron las grabaciones de mejor calidad y se determinaron tipos de vocalizaciones. Se midieron aquellas vocalizaciones con al menos cuatro notas emitidas de forma continua (i.e., tiempo entre notas no debe ser mayor a 0.3 segundos), con una diferencia de tiempo entre cada vocalización al menos tres veces mayor con respecto a la diferencia de tiempo entre cada nota (Feekes, 1982). Se midieron siete variables temporales y espectrales (Figura 2): (1) número de notas (número de notas que componen cada vocalización medida), (2) duración de la vocalización en segundos (el intervalo entre el inicio de la primera nota y la nota final), (3) frecuencia baja en Hz (la posición de la frecuencia más baja en el espectro), (4) frecuencia alta en Hz (la posición de la frecuencia más alta en el espectro), (5) ancho de banda de frecuencia al 90 % en Hz (la diferencia entre estas mediciones donde se encuentra el 90 % de la potencia de la señal), (6) frecuencia pico en Hz (la frecuencia con mayor potencia en relación con otras frecuencias dentro de la vocalización), y (7) frecuencia pico más baja en Hz (el mínimo valor de frecuencia en donde se encuentra la mayor potencia de la señal); la medición de variaciones en este parámetro ha sido importante en investigaciones de disputas territoriales y atracción de hembras en la oropéndola de, Psarocolius montezuma (Price et al., 2006; Miles & Fuxjager, 2018). Las mediciones de las variables espectrales se hicieron considerando un umbral de 20 decibeles (Figura 2A) del pico de mayor energía de la señal en un espectro de poder; mediante este método, la selección no se basa en una inspección visual del espectrograma que podría estar sesgada ante la presencia de componentes de baja frecuencia, sino que se puede obtener una medida estandarizada (Podos, 1997; Ríos-Chelén et al., 2017).

Figura 2 Representación gráfica de las medidas obtenidas de las vocalizaciones de Cacicus chrysonotus leucopramphus en Nariño, Colombia. A, Estandarización del umbral de medición sobre el espectro de poder; B, Espectrograma. A, Power spectrum, showing the threshold used. B. Spectrogram
Análisis estadístico. Se realizó un análisis descriptivo con el promedio y la desviación estándar de cada variable acústica de las vocalizaciones registradas. Posteriormente, se realizó una prueba de Chi-cuadrado con tablas de contingencia para determinar la asociación que existe entre los tipos de vocalización y las categorías de comportamiento. Esta prueba fue complementada mediante la prueba d de Cohen para el tamaño del efecto (Cohen, 1988), la cual permitió identificar entre qué tipos de vocalizaciones y comportamientos existe la asociación encontrada. Se utilizó α = 0.5. Las pruebas estadísticas fueron realizadas en el software Statgraphics v16 (Statgraphics Centurion, 2009).
Resultados
Generalidades de las colonias de C. chrysonotus leucoramphus. Las colonias se conformaron por tres a cinco nidos construidos en un único árbol. La construcción de los nidos, la alimentación y el cuidado de las crías es llevada a cabo exclusivamente por las hembras, mientras que los machos se mantienen vigilando el área de nidificación, utilizando principalmente los “sitios de preferencia” (i.e., perchas cercanas a los nidos, las cuales son disputadas constantemente por los machos de la colonia).
Descripción de conductas. Se registraron un total de cuatro conductas, que se catalogaron como vigilancia, alerta, defensa territorial y cortejo; las primeras tres se registraron en todas las colonias, mientras que el evento de cortejo se registró una única vez en la colonia de Santa Teresita (Figura 3; individuos en https://youtu.be/B8r0nt4kE0s).

Figura 3 Diagrama representativo de la asociación entre vocalizaciones y conductas de Cacicus chrysonotus leucoramphus, en Nariño, Colombia. Las líneas representan la asociación, y barras más gruesas indican asociaciones mayores al 50 %. Se representan cuatro conductas: vigilancia, alerta, defensa territorial con postura de inclinación total, cortejo, con hembra exhibiendo posición solicitante. Se muestran representaciones espectrales de los siete tipos de vocalizaciones identificadas. Para las vocalizaciones Tipo III y Tipo IV se presentan sus dos variaciones. La vocalización Tipo VIII fue realizada durante el evento de cortejo observado (ejemplo en https://xeno-canto.org/set/5930; https://youtu.be/B8r0nt4kE0s).
Vigilancia. Durante la exhibición de esta conducta se pudo evidenciar que los machos permanecieron en posición vertical con las alas ligeramente hacia adelante, descubriendo el plumaje amarillo de su dorso, mientras observaban a su alrededor. Se registró esta conducta en dos situaciones: (i) sobre los nidos, en eventos de construcción o alimentación de las crías, ejecutados por las hembras. Los machos se ubican en perchas cercanas a los nidos o en los denominados “sitios de preferencia”; (ii) vigilancia de algún determinado sitio de forrajeo apartado de la colonia. Estas labores fueron efectuadas por un miembro “centinela” o entre varios individuos.
Alerta. Esta conducta fue observada ante la presencia de potenciales intrusos (e.g., perros, seres humanos), o depredadores (e.g., garcita del ganado, Bubulcus ibis). Esta conducta estuvo acompañada de vocalizaciones realizadas repetidamente por el individuo “centinela” o por todos los miembros del grupo, los cuales cesaron cuando la amenaza potencial se retiró. No se advirtieron comportamientos de escape aéreo o de escondite ya que no se registraron ataques directos a los nidos (Figura 3).
Defensa territorial. En esta conducta los machos interactuaron para ocupar los lugares de preferencia en el árbol donde se ubica la colonia y para mantener su espacio individual durante la alimentación. Esta conducta se realizó mediante el despliegue horizontal, con un grado de inclinación corporal total o moderado, enervando las plumas de su dorso, cabeza y coberteras supracaudales a la par que realiza aleteos visibles para amenazar al macho rival (Figura 3). Dentro de los episodios de exhibición de esta conducta fue posible registrar un evento de enfrentamiento entre los individuos de la misma colonia en la localidad El Romerillo. Adicionalmente, no se registró ningún evento de defensa territorial ante la presencia de especies como la mirla común (Turdus fuscater) o la pava andina (Penelope montagnii), especies con las cuales comparte sitios de forrajeo.
Cortejo. Se registró un único evento, en una zona alejada de los nidos, utilizando como escenario la parte alta de una vivienda humana. Durante este evento de cortejo, el macho adoptó una posición inclinada hacia adelante, moviendo su plumaje dorsal y realizando leves aleteos, aproximándose a la hembra mediante pequeños saltos acompañados de vocalizaciones. La hembra respondió adoptando una posición solicitante (Figura 3).
Descripción de las vocalizaciones. Las vocalizaciones de C. chrysonotus leucoramphus son variables, con elementos tonales y atonales, formados principalmente por notas fuertes y repetitivas y con varios armónicos. Presentan un número variable de notas (desde 4 hasta más de 15) vocalizadas ininterrumpidamente, incorporando a su exhibición algunos sonidos del ambiente o de otros animales, mediante imitación. Emiten trinos estructuralmente complejos, con notas de rápida modulación de frecuencia (entre 495.4 y 7500 Hz), una duración entre los 0.5 y 5 segundos y, ocasionalmente, con la presencia de chasquidos al final de la vocalización. En total se identificaron siete tipos de vocalizaciones diferentes y una vocalización registrada en el único evento de cortejo observado (Figura 3; ejemplo en https://xeno-canto.org/set/5930). La vocalización Tipo I se propone como la principal, debido a que fue mayormente emitida en proporción al resto de vocalizaciones; los tipos III y IV presentaron dos formas estructurales que se diferenciaron entre sí por la forma y distancia entre notas. Los tipos VI y VII presentaron los valores más bajos con respecto a frecuencia baja y los más altos para frecuencia alta. En las vocalizaciones tipo II y IV se registraron los valores más altos en frecuencia pico más baja (Tabla 1).
Tabla 1 Valores promedio y desviación estándar de las variables acústicas para cada tipo de vocalización de Cacicus chrysonotus leucoramphus en Nariño, Colombia. Los parámetros temporales se presentan en segundos y los espectrales en hercios.

Asociación de vocalizaciones y conductas. Los resultados de la prueba de chi-cuadrado (Tabla 2) demostraron una asociación entre las vocalizaciones y los comportamientos registrados (χ 2 12 = 98.5, n = 224, p < 0.05; Figura 3). Con base en los resultados del análisis para el tamaño del efecto con la prueba d de Cohen (Tabla 3), se estableció que para el tipo I existen diferencias moderadas entre las frecuencias de emisión en vigilancia con respecto a territorialidad y alerta (i.e., asociado a vigilancia). El tipo II obtuvo diferencias altas entre las asociaciones para los tres comportamientos; con base en los resultados de la prueba de chi-cuadrado fue asociado principalmente a alerta (52.95 %) y vigilancia (42.86 %). El tipo III obtuvo el 100 % de sus registros en vigilancia, por lo cual fue asociado únicamente a esta conducta. En el tipo IV se registró una diferencia alta entre defensa territorial y vigilancia, resultando asociado únicamente a vigilancia (85.71 % en la prueba de chi-cuadrado). El tipo V evidenció baja asociación con las conductas (i.e., no superó el 50% de ocurrencias en ninguna conducta), mostrando diferencias irrelevantes según la prueba d de Cohen). El tipo VI obtuvo diferencias altas entre defensa territorial (75 % en la prueba de chi-cuadrado) con alerta y vigilancia; de forma similar ocurrió con el tipo VII, con su frecuencia de emisión en defensa territorial (58.82 %). De esta manera, ambas vocalizaciones (VI y VII) fueron asociados a esta conducta (Figura 3, Tabla A1).
Tabla 2 Chi-cuadrado para las frecuencias de ocurrencia de cada tipo de vocalización frente a tipo de comportamiento de Cacicus chrysonotus leucoramphus en Nariño, Colombia. El primer número de cada celda representa el conteo de vocalizaciones registradas en cada comportamiento, el segundo número de cada celda muestra el porcentaje de frecuencia de cada vocalización relativo al comportamiento en el que aparece.
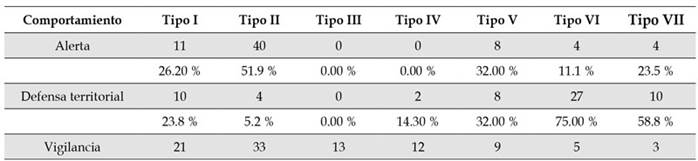
Tabla 3 Tamaño del efecto (d de Cohen) de las frecuencias de las vocalizaciones de Cacicus chrysonotus leucoramphus en Nariño, Colombia, respecto a sus comportamientos. Los valores fueron a aproximados a dos decimales. Para d < 0.2 las diferencias son irrelevantes; si 0.2 ≤ d > 0.5, las diferencias son bajas; si 0.5 ≤ d > 0.8, las diferencias son moderadas; si d ≥ 0.8, las diferencias son altas (Cohen, 1988).

Discusión
Comportamiento colonial de Cacicus chrysonotus leucoramphus. La organización colonial de C. chrysonotus leucoramphus registrada en este estudio se ha reportado en otras especies del género, como C. cela (Feekes, 1982; Robinson, 1985a, b; Trainer, 1989; Thieltges et al., 2014), C. haemorrhous (Thieltges et al., 2014) y C. oseryi (Leak & Robinson, 1989). Esta organización de tipo colonial está basada sobre un conjunto de relaciones de dominancia, donde se presentan despliegues de agresividad entre machos para ocupar los sitios de preferencia. Adicionalmente, los eventos de vigilancia fueron efectuados cooperativamente por varios machos o por un único individuo centinela en cada una de las colonias. Consistentemente con nuestro estudio, Robinson (1997) describió este comportamiento en C. cela, registrando conductas de vigilancia grupal con defensa de los sitios de nidificación, ante la presencia de algún depredador, utilizando vocalizaciones de alerta y ataques dirigidos. Feekes (1982), Robinson (1985b) y Trainer (1987) reportaron que las agresiones intraespecíficas entre machos de C. cela se producen para ocupar los sitios de preferencia y poder realizar las exhibiciones de cortejo dirigidas a las hembras, así como para defender espacios individuales de forrajeo. En este contexto, se producen eventos de lucha cuando la exhibición de la defensa territorial mediante el despliegue horizontal no es suficiente para disuadir al posible competidor (Feekes, 1982). Por otro lado, la construcción de los nidos por parte de las hembras, con los machos al margen del cuidado parental, se ha documentado en especies de los géneros Cacicus, Psarocolius, Sturnella y algunas especies de Icterus (Fraga, 2008). Estas evidencias en el comportamiento de C. chrysonotus leucoramphus y la presencia de una mayor proporción de hembras que machos en cada colonia, sugiere que la especie tiene un sistema de reproducción de poliginia. Hasta el momento, este sistema de apareamiento se ha reportado dentro de la familia Icteridae en todas las especies de oropéndolas (Psarocolius), y en el grupo de los caciques (Cacicus) únicamente para C. cela, C. haemorrhous y C. oseryi (Price et al., 2007; Price & Whalen, 2009; Fraga, 2008). Por esta razón es necesario todavía evaluar los sistemas reproductivos y su papel en el comportamiento social en C. chrysonotus leucoramphus. Esta estructura colonial demuestra la organización jerárquica que se presenta en aquellas especies que viven en grupos, donde cada miembro cumple un rol en específico (Jungwirth et al., 2015; Rubenstein & Alcock, 2018).
Comportamiento vocal de Cacicus chrysonotus leucoramphus. En este estudio, se registraron siete tipos de señales acústicas emitidas por machos de C. chrysonotus leucoramphus las cuales presentaron diferencias estructurales y auditivas entre sí. Trainer (1989) reportó en C. cela de cinco a ocho tipos de cantos compartidos entre colonias, mientras que Wiley (1976) encontró en el zanate común (Quiscalus quiscula) seis tipos de cantos distintos, uno de los cuales era exclusivo de las hembras. Estructuralmente, los tipos III y IV de C. chrysonotus leucoramphus presentan cuatro notas; ocasionalmente los machos pueden emitirlos con cinco notas y también pueden omitir la primera o la última nota. Esta estructura es similar al canto principal, cela song, descrito por Feekes (1982) en C. cela, el cual tiene por lo general cuatro notas y puede ser vocalizado sin la última de ellas; así mismo, hay similitudes estructurales con los cantos cortos descritos por Thieltges et al., (2013) en C. haemorrhous. La capacidad de imitación de sonidos también fue reportada en C. cela (Feekes, 1982).
Asociación de las vocalizaciones de Cacicus chrysonotus leucoramphus en el contexto social Las vocalizaciones tipo I, III, IV, VI y VII están relacionadas específicamente con al menos una de las conductas observadas; sin embargo, la tipo I fue utilizada en variedad de contextos (percha, búsqueda grupal de alimentación). Lo mismo sucede con respecto a la tipo V, a cual evidenció estadísticamente una asociación irrelevante con los comportamientos descritos, pero fue utilizada de forma consistente a lo largo de muestreos en escenarios de desplazamiento aéreo de los individuos, búsqueda de alimentación o percha. De manera adicional, se registró que las hembras pueden emitir este tipo de vocalización ocasionalmente. Esto sugiere la necesidad de asignar categorías más específicas a los comportamientos ya identificados, para poder evaluar a futuro la funcionalidad de estas vocalizaciones. Por su parte, la tipo II demostró tener más de una función, ya que fue asociada a vigilancia y alerta. En C. cela se han reportado al menos tres tipos de vocalizaciones asociadas a interacciones entre machos (Trainer, 1987). Esto puede explicarse por la reducción del costo energético de producción de las señales para transmitir el mensaje, lo cual puede conducir a una mejor comunicación entre los individuos (Partan & Marler, 2005; Bradbury & Vehrencamp, 2011; Webster et al., 2018). En este aspecto, C. chrysonotus leucoramphus podría optimizar su mecanismo de comunicación reutilizando la señal usada durante la vigilancia en situaciones de alerta (e.g., la presencia de un depredador). En este caso, la disminución en la producción de señales acústicas debe traerle beneficios, tanto al emisor como al receptor del mensaje (Searcy & Nowicki, 2005; Webster et al., 2018). Esto estaría indicando una relación secuencial entre estos dos tipos de comportamiento (Trainer, 1988), siendo posible predecir el despliegue de una conducta de alerta posterior al estado en vigilancia, si se detecta la presencia de un organismo intruso, y reanudar la vigilancia sin cambiar el tipo de vocalización, cuando el individuo ajeno se retira, indicando que, si bien el peligro ha pasado, deben mantenerse atentos ante una nueva amenaza.
Las vocalizaciones tipo VI y tipo VII de Cacicus chrysonotus leucoramphus fueron asociadas a defensa territorial. Estas señales acústicas presentan valores altos en ancho de banda y se componen de notas con modulación de frecuencia. Payne (1979) encontró cuatro vocalizaciones distintas asociadas a conductas territoriales en Vidua chalybeata, con características espectrales similares a lo encontrado en C. chrysonotus leucoramphus. Una de estas vocalizaciones presenta fuerte modulación de frecuencia y las otras tres tienen, al menos, un componente de trino con modulación de frecuencia. En V. chalybeata se categorizaron las conductas agresivas en vuelos de persecución entre machos y llegada a la percha de canto después de un evento de persecución; los cuatro tipos de canto resultaron asociados a una de estas dos categorías.
Lo anterior puede sentar un precedente para discriminar de forma más precisa la función de las vocalizaciones tipo VI y VII de C. chrysonotus leucoramphus, categorizando su defensa territorial en conductas más específicas. Por su parte, Feekes (1982) identificó dos grupos de cantos en C. cela, el mencionado cela song, que fue vocalizado principalmente por machos cerca a los sitios de construcción de nidos o después de eventos de escape durante los cuales todos los machos de la colonia vocalizan este tipo de canto. Esto significa que el cela song puede tener funciones de alerta y vigilancia, similar a como ocurre con las vocalizaciones tipo I, II, III y IV en C. chrysonotus leucoramphus. El otro grupo de cantos identificado por Feekes (1982) se denomina harsh song, y fue asociado a conductas agonísticas entre machos y también para el cortejo, vocalizados con la exhibición del despliegue horizontal con tres distintos grados de inclinación corporal, siendo el tercer grado de inclinación el que denota la mayor agresividad. En C. chrysonotus leucoramphus, las vocalizaciones tipo VI y VII, asociadas a defensa territorial, más la única vocalización registrada en el cortejo, fueron emitidas exhibiendo el despliegue horizontal, de igual forma que C. cela.
Las vocalizaciones de C. chrysonotus leucoramphus con estructuras más complejas y en un rango de frecuencias superior con relación al resto de sus vocalizaciones, fueron utilizadas para la defensa territorial. Varios estudios han reportado que las vocalizaciones territoriales tienen implicaciones en el contexto reproductivo (Price et al., 2006; Greig et al., 2013; Miles & Fuxjager, 2018); el canto en los machos ha evolucionado bajo procesos de selección sexual, privilegiando aquellos rasgos capaces de imponerse para disuadir la competencia e incrementar sus posibilidades de apareamiento (Catchpole, 1982; Price & Whalen, 2009). Por esta razón, es necesario investigar sobre el papel de las vocalizaciones de defensa territorial de C. chrysonotus leucoramphus en contextos reproductivos, y prestar atención a la vocalización registrada durante el cortejo, la cual posee elementos complejos y es estructuralmente similar a las señales de amenaza entre machos. Sin embargo, el despliegue de movimientos corporales y gesticulaciones complementan la exhibición vocal, aumentando el éxito dentro de las disputas entre machos y la competencia por el apareamiento (Price et al., 2006; Miles & Fuxjager, 2018). Debido a lo anterior, el despliegue horizontal es otro aspecto importante de la competencia agonística en C. chrysonotus leucoramphus y complementa sus vocalizaciones de defensa territorial.
Conclusión
La evidencia obtenida indica que C. chrysonotus leucoramphus utiliza diferentes tipos de señales acústicas dentro de los diferentes contextos de su comportamiento social. Las vocalizaciones emitidas están asociadas a alguna conducta específica, soportando la idea de que una señal puede ser utilizada en más de un contexto conductual, posiblemente para reducir el costo energético de producción y optimizar su sistema de comunicación. Los resultados obtenidos amplían el conocimiento de la comunicación animal en escenarios sociales complejos, como la organización colonial.
















