Introducción
La familia Cymothoidae constituye un grupo de parásitos obligatorios de peces marinos y dulceacuícolas, que en la actualidad comprende 369 especies válidas, distribuidas en 43 géneros (Boxshall & Hayes, 2019). Generalmente se localizan en el tegumento, las branquias o en la boca de los peces, variando según la especie de parásito o la especie hospedera (Smit et al., 2014; Tavares-Dias et al., 2015), provocando lesiones severas en el sitio de fijación (Tavares-Dias et al., 2014; Carvalho et al., 2004) y cambios en la fisiología del pez hospedero (Östlund-Nilsson et al., 2005).
A nivel mundial, América del Sur presenta la mayor diversidad de cimotoidos, con alrededor de 39 especies y 14 géneros reconocidos (Luque et al., 2013). Sin embargo, es necesario profundizar el conocimiento referente al parasitismo de este grupo en el Neotrópico (Tavares-Dias et al., 2014). En Ecuador, los estudios sobre el parasitismo de isópodos en peces dulceacuícolas son escasos. Hasta la fecha, en varias cuencas hidrográficas de la Amazonía ecuatoriana se han reportado únicamente cuatro especies de isópodos en peces (Leigh-Sharpe, 1937; Anaguano-Yancha & Brito, 2015; Junoy, 2016; Rodríguez-Haro et al., 2017; Anaguano-Yancha, 2017; Plaul et al., 2019).
El género Telotha agrupa tres especies: T. henselii (Von Martens, 1869), T. lunaris Schioedte & Meinert, 1884 y T. silurii Szidat & Schubart, 1959, de las cuales las dos últimas solo han sido registradas en Brasil y son parásitos exclusivos de peces. T. henselii se distribuye en varios países de América del Sur, donde infesta una alta variedad de peces (Thatcher, 2006; Luque et al., 2013) y camarones de río (Wunderlich et al., 2011; Andrade et al., 2020). Sin embargo, esta especie no se ha registrado parasitando peces de la familia Loricariidae en América del Sur. En el presente estudio, reportamos por primera vez el parasitismo de T. henselii sobre dos especies de peces loricáridos y extendemos su área de distribución a la cuenca alta del río Santiago, Amazonía ecuatoriana.
Materiales y métodos
Los ejemplares de Chaetostoma breve Regan, 1904 y C. carrioni (Norman, 1935) se capturaron el 5 de diciembre de 2017 en el cauce principal del Río Quimi (02°06’55” S 78°07’12” O, 750 m s.n.m), parroquia Tundayme, cantón El Pangui, provincia de Zamora Chinchipe (Figura 1). El Río Quimi forma parte de la zona ictiogeográfica Upano-Zamora (Barriga, 2012), y es un afluente de aguas negras del Río Zamora. Tiene 25 m de ancho, una profundidad promedio de 0.8 m y sustrato arenoso. La vegetación circundante corresponde a cultivos y pastizales.

Figura 1 Sitio de recolección de Telotha henselii en la cuenca alta del Río Santiago, Amazonía ecuatoriana.
Para la captura de los peces se empleó una atarraya. Los peces capturados se examinaron a nivel macroscópico en busca de la presencia de isópodos. Los individuos parasitados se sacrificaron, usando solución analgésica de benzocaína, siguiendo las directrices establecidas por Leary et al. (2013). Los peces que no presentaron parásitos fueron liberaron en el mismo sitio de captura. En procura del isópodo, se examinaron ejemplares de Parodon buckleyi Boulenger, 1887 (Characiformes: Paradontidae), Brycon coxeyi Fowler, 1943 (Characiformes: Bryconidae), Astyanax bimaculatus (Linnaeus, 1758), Ceratobranchia elatior Tortonese, 1942, Creagrutus kunturus Vari, Harold & Ortega, 1995, Knodus sp. (Characiformes: Characidae), Pimelodella yuncensis Steindachner, 1902 (Siluriformes; Heptapteridae), Andeancistrus platycephalus (Boulenger, 1898) (Siluriformes; Loricariidae) y Bujurquina zamorensis (Regan, 1905) (Cichliformes: Cichlidae) capturados en el mismo ambiente, con resultados negativos.
Los isópodos hallados se extrajeron y almacenaron en etanol al 70%. Se identificaron como T. henselii, mediante la literatura específica disponible (van Name, 1925; Ringuelet, 1947; Alberto, 2008), y los hospederos, como C. breve y C. carrioni, con base en Lujan et al. (2015). Las medidas de los hospederos y parásitos se tomaron con un calibrador digital Buffalo Tools (± 0.01 mm). Se tomaron fotografías de los isópodos con un microscopio digital Andonstar Adsm301. Las ilustraciones morfológicas se realizaron utilizando el software INKSCAPE 1.1. Los isópodos se encuentran depositados en la colección de Invertebrados del Instituto Nacional de Biodiversidad (INABIO-MA-237-240). Finalmente, la intensidad parasitaria y la prevalencia se determinaron de acuerdo a lo establecido por Bush et al. (1997).
Resultados
Se observó el parasitismo de T. henselii únicamente en dos de las 11 especies de peces capturadas en el Río Quimi. Se examinaron en total 16 individuos de C. breve, que medían, en promedio, 80.15 mm (± 8.53 mm) de longitud estándar (Figura 2A). De este total, solo tres individuos se encontraban parasitados por T. henselii, uno de ellos infestado por un isópodo en fase masculina y otro en fase femenina, el resto de hospederos alojaba una hembra adulta y un macho. Los machos se encontraban fijados en la base de la aleta pélvica izquierda (Figura 2B) y las hembras se hallaban alojadas en la cavidad branquial (Figura 2C). Los machos presentaron una longitud total de 6.67-6.76 mm y un ancho de 3.14-3.26 mm, mientras que las hembras, una longitud total de 11.39-13.71 mm y un ancho de 8.18-8.85 mm. La intensidad parasitaria fue de uno a dos parásitos por hospedero y la prevalencia del 16.6 %. En el caso de C. carrioni, se inspeccionaron ocho individuos, con un promedio de 4.56 mm (± 8.53 mm) de longitud estándar (Figura 2D). Solo en un espécimen se registró (12.5 %) un isópodo en fase masculina, con 6.52 mm de largo total y 3.12 mm de ancho, el cual se encontraba adherido a la piel en la región abdominal (Figura 2E). A nivel macroscópico, se observaron leves lesiones y hemorragia en los arcos branquiales de C. breve, debido a la fijación del isópodo.

Figura 2 Nuevos hospederos y sitios de alojamiento de Telotha henselii sobre loricáridos. A, Chaetostoma breve; B, Telotha henselii en fase masculina, adherida a la base de la aleta ventral izquierda de Chaetostoma breve; C, Telotha henselii en fase femenina, alojada en la cavidabranquial de Chaetostoma breve; D, Chaetostoma carrioni; E, Telota henselli en fase masculina adherida a la piel de la región abdominal de Chaetostoma carrioni.
Telotha henselii (Figura 3A-F) se caracteriza por presentar cinco espinas en el borde interno del propodito en los tres primeros pereiópodos, mientras que el resto de pereiópodos tienen cuatro espinas en el propodito y una en el mero (Alberto, 2008). El carpopodito del VII pereiópodo presenta espinas (Ringuelet, 1947), urópodos ovalados y setosos en los machos (Alberto, 2008, Figura 4). En las hembras no se observan espinas en los pereiópodo, los urópodos son alargados y no tienen setas (van Name, 1925; Alberto, 2008).
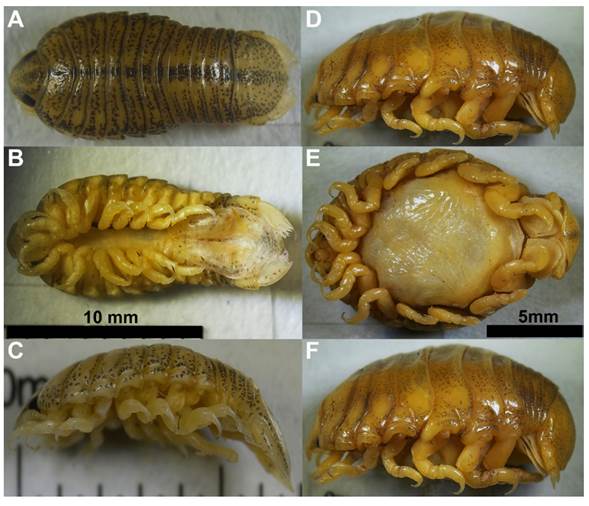
Figura 3 Telotha henselii en fase masculina en vista dorsal (A), ventral (B) y lateral (C). Telotha henselii en fase femenina en vista dorsal (D), ventral (E) y lateral (F).
Discusión
En la cuenca del Río Santiago se ha reportado únicamente el parasitismo de Riggia sp. sobre heptaptéridos (Anaguano-Yancha & Brito, 2015). Por otra parte, Brito et al. (2016) hallaron restos de Artystone trisibia Schioedte, 1866 en el contenido estomacal de una rata cangrejera Ichthyomys stolzmanni Thoma, 1893 (Rodentia: Cricetidae), recolectada en el Río Jurumbuno, afluente del Río Santiago. Los registros de este estudio constituyen los primeros casos de parasitismo de T. henselii sobre loricáridos en América del Sur y establece al Río Quimi como una nueva localidad de registro, lo que amplía en 2250 km la distribución de T. henselii, desde Tundayme, en la Amazonía ecuatoriana, hasta el municipio de Itacoatiara, en la Amazonía brasileña. La prevalencia reportada en este estudio se encuentra dentro del rango (1.08-87.5 %) reportado en estudios previos en peces en América del Sur (Tabla 1).
Tabla 1 Lista de peces hospederos de Telotha henselii reportadas para América del Sur
| Hospederoa | Prevalencia (%) | País | Referencia |
|---|---|---|---|
| CHARACIFORMES | |||
| Erythrinidae | |||
| Hoplias malabaricus (Bloch, 1974) | - | Uruguay | Cordero (1937) |
| - | Brasil | Luque et al. (2013) | |
| SILURIFORMES | |||
| Heptapteridae | |||
| Rhamdia quelen (Quoy & Gaimard, 1824) | 33.3 | Brasil | Alberto (2008) |
| - | Surinam | Trilles (1979) | |
| - | Uruguay | Taberner et al. (2003) | |
| Pimelodidae | |||
| Brachyplatystoma sp. | - | Guayana | Van Namme (1925) |
| - | Brasil | Luque et al. (2013) | |
| Pimelodella australis Eigenmann, 1917 | - | Brasil | Alberto (2008) |
| Pimelodella laticeps Eigenmann, 1917 | - | Uruguay | Taberner et al. (2003) |
| Pimelodus maculatus Lacépède, 1803 | 1.55 | Brasil | Alberto (2008) |
| Mochokidae | |||
| Synodontis schall (Bloch & Schneider 1801) | 87.5 | Uruguay | Taberner et al. (2003) |
| - | Guayana | Van Namme (1925) | |
| Synodontis clarias (Linnaeus, 1758) | - | Brasil | Luque et al. (2013) |
| Loricariidae | |||
| Chaetostoma breve Regan, 1904 | 16.6 | Ecuador | Este estudio |
| Chaetostoma carrioni (Norman, 1935) | 12.5 | Ecuador | Este estudio |
| CICHLIFORMES | |||
| Cichlidae | |||
| Geophagus sp. | - | Brasil | Schiödte & Meinert (1881) |
| Geophagus brasiliensis (Quoy & Gaimard, 1824) | Brasil | Luque et al. (2013) | |
| Gymnogeophagus sp. | - | Uruguay | Taberner (2003) |
| Gymnogeophagus rhabdotus Hensel, 1970 | 1.08 | Brasil | Alberto (2008) |
| Gymnogeophagus gymnogenys (Hensel, 1870) | - | Brasil | Luque et al. (2013) |
| CYPRINODONTIFORMES | |||
| Rivulidae | |||
| Austrolebias prognathus Amato, 1986 | - | Uruguay | Taberner et al. (2003) |
| PERCIFORMES | |||
| Sciaenidae | |||
| Pachyurus bonariensis Steindachner, 1879 | - | Brasil | Alberto et al. (2001) |
*El listado de los peces hospederos sigue el esquema taxonómico propuesto por Fricke et al. (2020).
De acuerdo con Thatcher (2006) y Luque et al. (2013), T. silurii y T. lunaris son parásitos exclusivos de Iheringichthys labrosus (Lütken 1874) (Siluriformes: Pimelodidae) y Apteronotus brasiliensis (Reinhardt 1852) (Gymnotiformes: Apteronotidae) en Brasil. En contraste con las especies antes mencionadas, los registros disponibles en el Sistema Global de Información sobre Biodiversidad-GBIF indican que T. henselii se distribuye ampliamente por América del Sur, parasitando 15 especies de peces (Tabla 1). Adicionalmente, en Argentina y Brasil se ha reportado que cuando T. henselii está en fase masculina parasita ocho especies de camarones (Wunderlich et al., 2011; Andrade et al., 2020). Debido a la gran variabilidad de especies que parasita durante sus fases de vida, T. henselii presenta una baja especificidad en cuanto a hospederos, ya que, aparentemente, posee una gran flexibilidad en cuanto a la tolerancia ecológica. Esto quiere decir que presenta un coacomodamiento (Brooks, 1979), lo que probablemente podría explicar su amplia distribución en América del Sur (Taberner et al., 2003).
Pese a lo antes manifestado, en el Río Quimi, al parecer, en ambas fases de su ciclo de vida, T. henselii muestra una preferencia por parasitar peces del género Chaetostoma Por otra parte, a pesar de que el camarón Macrobrachium brasiliense (Heller, 1862) es abundante en la cuenca alta del Río Santiago (Maldonado & Bravo, 2010; Mena-Olmedo, 2016), no existen reportes que informen del parasitismo de T. henselii sobre esta especie.
Telota henselii es un ectoparásito hematófago, generalmente se encuentra en la cavidad branquial o en la piel de los peces hospederos (Szidat & Schubart, 1960). Dentro de la cavidad branquial se aloja un isópodo adulto, adherido firmemente a los arcos branquiales, causando lesiones y hemorragias producidas por los hábitos alimenticios del parásito (Taberner et al., 2003), lo que concuerda con lo observado en C. breve en este estudio. A pesar del enorme tamaño de las hembras adultas de T. henselii, aparentemente no provocan daños notables a su hospedero, sin contar los daños producidos en el sitio de alojamiento por el parásito. No obstante, Taberner et al. (2003) sugiere que, debido al tamaño y ubicación del isópodo, la funcionalidad de los arcos branquiales podría comprometerse gravemente. Por otra parte, se ha reportado que los isópodos causan pérdida y reducción de los filamentos de las branquias (Morey et al., 2016) o pueden generar la aparición de tumores en sus hospederos (Carvalho et al., 2004). En este estudio no se evidenció daños en las dos especies de loricáridos, relacionados con la fijación de T. henselii en fase masculina. Sin embargo, la infestación de cimotoides causa destrucción de escamas e inflamación severa en la piel de los peces, lo que genera un gran problema para las pisciculturas Amazónicas (Tavares-Dias et al., 2014). También, afecta la fisiología del pez hospedero, incluyendo cambios de comportamiento y disminución de la tasa de crecimiento (Östlund-Nilsson et al., 2005)
















