Introducción
Gmelina arborea es una especie arbórea perenne originaria del sureste asiático que se desarrolla naturalmente en regiones tropicales y subtropicales (Stuhrmann, et al., 1994); se utiliza ampliamente en proyectos de reforestación con fines comerciales debido a su simplicidad de reproducción sexual y vegetativa (Swamy, et al., 2003). La madera se usa comúnmente en embalajes, construcción, fabricación de muebles, y biomasa con fines energéticos, entre otros, por sus excelentes propiedades físicas y mecánicas (Swamy, et al., 2004). En Costa Rica es una de las especies más usadas en los programas de reforestación comercial con fines maderables y cuenta con un mercado de gran demanda, al punto que se ha desarrollado un ambicioso programa de mejoramiento genético para incrementar su productividad y resistencia a patógenos, específicamente a hongos y bacterias (Ávila-Árias, et al., 2015; Murillo-Gamboa, et al., 2016).
Uno de los factores que deben considerarse en los programas de reforestación forestal con G. arborea es el control fitosanitario para evitar el ataque de plagas o patógenos que reduzcan la productividad del cultivo o aumenten la mortalidad de los individuos, lo que afectaría directamente la calidad y viabilidad económica del cultivo (Maniklal & Yogesh, 2010). Entre las plagas que más afectan a G. arborea se encuentra el defoliador Atta cephalotes, hormiga forrajera generalista que forma colonias de gran tamaño y tiene capacidad de defoliar grandes áreas en poco tiempo (Valadares & Nascimento, 2016), lo que incide directamente en la productividad, la supervivencia y la calidad de los individuos afectados. En los estudios de Bhusal, et al. (2019) se ha determinado una disminución del 33 % de la productividad y un aumento del 20 % en la mortalidad en cultivos de Malus domestica debido a la pérdida de área foliar, que genera un estrés fisiológico negativo en el individuo, el cual pierde su capacidad fotosintética obligando a que la energía acumulada por el organismo se dedique a la recuperación, con el consecuente estancamiento del crecimiento y la aparición de condiciones críticas que llevan a la muerte de la planta (Valadares, et al., 2015).
Los estudios sobre el ataque del A. cephalotes en especies arbóreas han aumentado en las últimas décadas; se destaca entre ellos la investigación de Ribeiro & Woessner (1980), quienes analizaron el efecto de defoliación de A. cephalotes en G. arborea y Pinus caribaea var. hondurensis y encontraron una tasa de reducción diaria del 6 % en el índice de área foliar de los árboles. Por su parte Peres Filho, et al. (2002) analizaron en condiciones de invernadero la incidencia y la gravedad del ataque de Atta sexdens en la cobertura foliar de 41 especies tropicales y encontraron variaciones significativas entre especies, con mayor efecto en las especies de lámina foliar amplia. Awotoye, et al. (2016) analizaron en 16 especies arbóreas tropicales la recuperación de la cobertura foliar y establecieron un retardo del crecimiento del 10 al 26 %, en tanto que Arenas & Roces (2016) analizaron los patrones de distribución y ataque de la hormiga en cultivos agrícolas y encontraron nidos con áreas de desarrollo de 2 a 20 m2 y con una capacidad de afectación de 500 m a la redonda. Silva-Junior, et al. (2017), por su parte, evaluaron el tipo de ataque de A. sexdens en cultivos de Zea mays y determinaron una defoliación total en el 36 % del cultivo y un 28 % de afectación parcial con un 29 % de pérdida en la productividad. Por último, Santos-Reis, et al. (2019) analizaron distintos métodos de control de la plaga en una región tropical y determinaron que los métodos químicos tuvieron mayor efectividad para controlar el ataque de la especie en árboles juveniles.
Sin embargo, hasta el momento no se ha reportado ningún estudio enfocado en evaluar el previo, durante y después de un ataque de A. cephalotes desde una perspectiva fisiológica e hidráulica y su impacto en el crecimiento a lo largo del tiempo. Santana-Vieira, et al. (2010) mencionan que en el desarrollo de planes de manejo integral de plagas se deben entender y dimensionar los efectos que tiene la plaga en el desarrollo y la capacidad de recuperación de la plata afectada; con un mayor conocimiento sería posible desarrollar paquetes tecnológicos para mitigar el efecto del patógeno y mejorar la calidad de los individuos. Por ello es fundamental entender el desarrollo fisiológico de las plagas defoliadoras. Amaral & Machado-Santelli (2008) mencionan cómo este tipo de plagas reduce el área foliar y con ello la capacidad de que el organismo desarrolle los procesos de fotosíntesis y generación de azúcares necesarios para su crecimiento, lo que incide en el estrés fisiológico y, por ende, en la generación de enzimas y aminoácidos que generan estancamiento; a ello deben agregarse los factores ambientales como la falta de agua o nutrientes que desencadenan la marchitez permanente y la muerte de la planta.
Valverde & Arias (2018) mencionan que el conocimiento de la fisiología y la hidráulica de las especies arbóreas tropicales es fundamental para el desarrollo de actividades silviculturales que permitan mejorar la calidad y supervivencia de los cultivos y adoptar medidas de mitigación frente a los ataques de patógenos. En este sentido, son necesarias las investigaciones que permitan entender el estrés fisiológico e hidráulico generado por la defoliación, y cuantificar y dimensionar el proceso de recuperación del árbol y la forma en que incide en el crecimiento y calidad del cultivo. En dicho contexto, el objetivo de este trabajo consistió en analizar los efectos de la defoliación generada por A. cephalotes en el crecimiento y desarrollo fisiológico e hidráulico de árboles juveniles de G. arborea en condiciones controladas.
Materiales y métodos
Especie y condiciones del estudio
Se incluyeron 25 árboles de G. arborea con una edad inicial de 11 meses; el material empleado consistió en semillas mejoradas procedentes de un huerto semillero del Centro Agronómico Tropical de Investigación y Enseñanza (CATIE) que se sembraron en macetas de 40 cm de profundidad y 35 cm de diámetro; el sustrato empleado fue un suelo franco arcilloso, con un pH de 6,2, una disponibilidad de nitrógeno de 2,3 cmol kg-1, una de fósforo de 0,16 cmol kg-1y de potasio de 4,3 cmol kg-1, y 5,5 % de material orgánico. Además, se aseguró que el suelo estuviera libre de patógenos, para lo cual se esterilizó previamente, y que fuera homogéneo, lo que se garantizó filtrándolo para eliminar piedras y desechos orgánicos.
Las macetas se colocaron con una separación 50 cm y se ubicaron en un sitio totalmente expuesto a la intemperie, alejadas a 30 m a la redonda del árbol más próximo y con una exposición diaria de 12 horas de luz natural. No se aplicó fertilizante alguno a las plantas durante el experimento y se les suministraron 700 ml/semana de agua según las indicaciones de Valverde (2015) en sus ensayos de estrés hídrico con la misma especie en condiciones controladas; la base de la maceta se forró con aluminio para evitar que en los días de lluvia el agua se filtrara a la maceta.
El sitio de estudio fue un campo de prácticas ubicado en Cartago, Costa Rica (9°84' N; 83°86' O), situado a una altitud de 1.320 m, con una temperatura media anual de 25 °C y una precipitación anual de 2.100 mm concentrada en siete meses de lluvia de mayo a noviembre (Instituto Meteorológico Nacional - IMN, 2018). En el sitio se instalaron tres miniestaciones climáticas automatizadas (iButton, Maxim integrated™), las mediciones se realizaron cada hora durante todo el tiempo del estudio, lo que permitió registrar una temperatura promedio de 27 °C y una humedad relativa del 68 %.
Tiempo de estudio y ataque del Atta cephalotes
El experimento se desarrolló entre diciembre del 2016 y mayo del 2018 (510 días en total) y se inició en época de transición lluviosa a seca; las plantas se adaptaron a las condiciones del estudio durante dos meses antes del inicio del experimento tiempo en el que no se recolectaron datos fisiológicos debido a la gran variabilidad que mostraron los individuos. En febrero del 2017, 16 plantas de G. arborea se expusieron al ataque de hormigas A. cephalotes y a partir de ese momento se evaluó el proceso de recuperación hasta el final del experimento. La colonia de hormigas se ubicó una distancia de 120 m de las plantas y su tamaño aproximado fue de 3,2 m2, con un conteo de bocas de 26,3 por m-2, con un montículo de altura promedio de 1,63 m, un montículo principal de 2,85 m3 y un área de respiradero de 0,62 m2; el ancho de la pinta principal fue de 10,82±5,66 cm, con un número de hormigas obreras de 32,66±12,65 por minuto; todas las evaluaciones del nido se ajustaron a la metodología de Montoya-Lerna, et al. (2006) .
Además de las plantas atacadas, se mantuvieron nueve plantas de control en las mismas condiciones, las cuales se protegieron con agentes químicos (imidaclorid al 0,03 % en dosis de 1.000 ml/ha-1, aplicado dos veces durante el desarrollo del estudio) y físicos (se colocaron láminas metálicas de 20 cm alrededor de las plantas) para evitar su defoliación.
En el experimento se evaluaron el crecimiento diamétrico a nivel de base del individuo y la altura total y las variables fisiológicas e hidráulicas cada 30 días durante los primeros 360 días y luego cada 90 días hasta el final de experimento. En el caso específico del ataque de A. cephalotes el índice de área foliar (IAF) se evaluó diariamente hasta que el árbol se defolió en su totalidad. Las mediciones se hicieron entre las 09:00 y las 11:00 (GMT-6 Central América) con el fin de mantener la homogeneidad en las condiciones de muestreo; se controló la temperatura, la humedad relativa y la luminosidad para que su variabilidad no infiriera en los datos obtenidos.
Pérdida de IAF por el ataque de A. cephalotes
Para determinar la pérdida de IAF se empleó la metodología de Valverde, et al. (2017); las mediciones se tomaron mediante fotografías digitales hemisféricas a la misma hora (GMT-6 Central América) y se les aplicó el mismo procedimiento de análisis empleado para la recuperación foliar.
Variables fisiológicas evaluadas
A cada planta de G. arborea se le seleccionaron tres hojas de edad intermedia según la metodología de Valverde & Arias (2018), caracterizadas por estar libres de defectos, para valorar las siguientes variables: contenido relativo de clorofila (medido con SPAD), conductividad estomática (Gs) y área foliar específica (AFE).
El valor del contenido relativo de clorofila en las hojas se midió con un SPAD-502 (Konica Minolta®), que cuenta con un área efectiva de valoración de 5 mm2.
La conductividad estomática se evaluó mediante el uso de un Leaf Porometer CS-1 (Degacon Devices, Inc®), que cuenta con una cámara de apertura de medición de 6,35 mm de diámetro.
Para el IAFs e consideró el índice de área de la planta (IAP), definido por la sumatoria del área foliar y la parte leñosa aérea de la planta, como parámetro para obtener el IAF indirecto a partir de imágenes fotográficas hemisféricas. Las mediciones se hicieron en marzo de 2016 aplicando la metodología propuesta por Mougin, et al. (2014) y Chianucci, et al. (2014), con clima totalmente nublado y sin presencia de viento.
Para obtener las fotografías digitales hemisféricas se utilizó un teléfono móvil marca ASUS®, modelo Zenfone 5, con una cámara de 8MP (una resolución de 2024 pixeles x 2024 pixeles en formato RGB) y con la aplicación móvil Fisheye Pro, versión 1.2 (R22) para la plataforma Android. Todas las fotografías se tomaron niveladas con la ayuda de un trípode, a una altura de 60 cm sobre el nivel del suelo y con la dirección hacia el norte previamente marcada.
Las fotografías hemisféricas se procesaron con el programa CAN EYE, versión 6.3.13, previamente calibrado siguiendo el método descrito en el manual del fabricante (Weiss, et al., 2004). Se limitó el grado de visión de las imágenes a 60° y con la opción de recorte del programa se eliminaron las copas de los árboles que rodeaban a cada individuo de estudio, con el fin de prevenir las distorsiones y sesgos en el cálculo del IAP; asimismo, se configuró un ángulo zenith (sobre el eje espacial Z ) de 2,5° y un azimut (sobre el eje espacial Y) de 5° (Chianucci, et al., 2014), con un análisis de pixeles del tipo No mixed pixels (2 clases); el algoritmo seleccionado fue el IAF-2000 de 4 anillos debido a que en estudios previos de Chianucci, et al. (2015) demostró tener una mayor precisión en especies tropicales.
Variables hidráulicas evaluadas
Turgencia foliar (Pp). Este parámetro se determinó mediante unidades ZIM-probe (Yara®) de 82 mm2 de cobertura, cuyos valores se generan a partir del principio de la ecuación 1.
donde a y b son constantes, F a es el factor de atenuación específico de la hoja y P clamp es un factor de atenuación del sensor. Las hojas seleccionadas para recolectar datos con el Zimprobe se caracterizaron por no tener presencia de agua superficial ni defectos o decoloraciones atípicas que pudieran producir distorsiones en la medición.
Movimiento del flujo de savia (MFS). El MFS se monitoreó con la técnica de pulso de compensación por calor desarrollada por Gower, et al. (1999). Se utilizaron sensores de MFS de ICT International©, con una profundidad máxima de evaluación de 60 mm y el equipo utilizó un pulso de calor de 1 J h-1; se instalaron aproximadamente a 20 cm por encima de nivel del suelo. Las tasas de flujo de tallo (l h-1) de ambos tratamientos se monitorearon específicamente a las 06:00, 12:00 y 15:00 (GMT-6 Central América); para el ajuste del equipo se utilizaron los datos anatómicos disponibles para la especie (Zimberman, et al., 2008). Las mediciones se realizaron en los mismos puntos de muestreo a lo largo del tiempo, manteniendo constante el protocolo de instalación, con los puntos de medición de los sensores cubiertos con una capa de 5 cm de algodón y tres capas de aluminio, tal como se recomienda en la metodología de Bush, et al. (2010).
Contenido de humedad foliar (CHF). De cada planta se extrajo una hoja compuesta que se pesó y secó a una temperatura de 80 °C durante 48 horas para obtener el peso seco que permitió calcular el contenido de humedad con la ecuación 2:
donde CHF es el contenido de humedad en porcentaje, PS es el peso seco de la hoja compuesta (en gramos) y PV es el peso fresco de la hoja compuesta (en gramos).
Diseño experimental y análisis estadístico
Para la reducción del IAF se utilizó estadística descriptiva y para estimar la pérdida de tiempo, estadística descriptiva. El diseño experimental fue simple aleatorio; con el fin de evaluar el efecto del ataque de A. cephalotes en el crecimiento y la fisiología e hidráulica de los árboles, se aplicaron previamente los supuestos de normalidad y homocedasticidad propios de la estadística paramétrica. Posteriormente se hizo un análisis de varianza de una vía (ANOVA) y a las variables que mostraron diferenciaciones se les aplicó la prueba de Tukey, con un nivel de significación de 0,05. Los análisis se realizaron con el programa STATISTICA 10.3.
Debe mencionarse que los aspectos fitosanitarios no se consideraron debido a que en el momento de recuperación de la planta hubo un monitoreo constante para que no se presentara un ataque de algún otro patógeno controlando la presencia de bacterias, hongos o insectos que afectaran la calidad de las plantas.
Resultados
Pérdida de IAF por el ataque de Atta cephalotes
Antes del ataque de A. cephalotes el IAF de las plantas era de 0,62 m2m-2. En el momento del ataque de la hormiga se observó el mismo patrón de reducción del IAF de la copa de los árboles: en promedio, a las 72 horas de iniciada la defoliación, el árbol perdió la totalidad de la cobertura vegetal de la copa (Tabla 1). El patrón de ataque del insecto consistió en la eliminación de las hojas maduras más cercanas, lo que determinó que a las 48 horas de iniciada la defoliación, la pérdida del IAF fuese de 67,21 %. A las 49 horas, la parte alta de la copa fue atacada por las hormigas y defoliada totalmente en las 72 horas posteriores al inicio del ataque.
Tabla 1 Pérdida del índice del área foliar (IAF), porcentaje de reducción y reducción acumulada en el tiempo en árboles juveniles de G. arborea por el ataque de A. cephalotes en condiciones controladas
| Tiempo de afectación (horas) | IAF (m2m 2) | Reducción del IAF (%) | Reducción acumulada del IAF (%) |
|---|---|---|---|
| 0 | 0,61 (0,15) | 0,00 | 0,00 |
| 24 | 0,45 (0,12) | 26,23 | 26,23 |
| 48 | 0,21 (0,10) | 40,98 | 67,21 |
| 72 | 0 | 32,79 | 100,00 |
| Planta de control (durante 72 horas) | 0,61 (0,19) | - | 0,00 |
Nota: los datos entre paréntesis corresponden a la desviación estándar.
Efecto de la defoliación en el crecimiento
En la figura 1 se presenta el crecimiento diamétrico y en altura de las plantas de G. arborea antes, durante y después del ataque de A. cephalotes. Este se obtuvo a nivel diamétrico (Figura 1a), en el cual no se habían identificado diferencias significativas (p<0,05) en el diámetro de la base de los árboles antes del ataque de la hormiga, siendo, en promedio, de 21,61 mm. Después de la defoliación de los árboles no se encontraron diferencias (p<0,05) en el crecimiento hasta el día 60, en el cual las plantas de control presentaban un diámetro significativamente mayor (p<0,05), de 90,62 mm en promedio, con respecto a las plantas afectadas por A. cephalotes, 62,33 mm, en promedio. Se presentó un patrón de crecimiento menor que el de las plantas de control, el cual llegó a ser de 39 %. En el caso del crecimiento en altura total (Figura 1b), se presentó el mismo patrón: al inicio del experimento no había diferencias (p<0,05) entre las alturas, con un valor promedio de 82,11 cm, pero a los 60 días, comenzó un crecimiento significativamente mayor (p<0,05) en las plantas de control con respecto a las plantas atacadas por A. cephalotes, al punto que a los 360 días el retraso de estas fue del 66,1 %; al finalizar el experimento las plantas de control presentaban una altura de 452,2 cm, en comparación con las defoliadas, que fue de 290,6 cm.
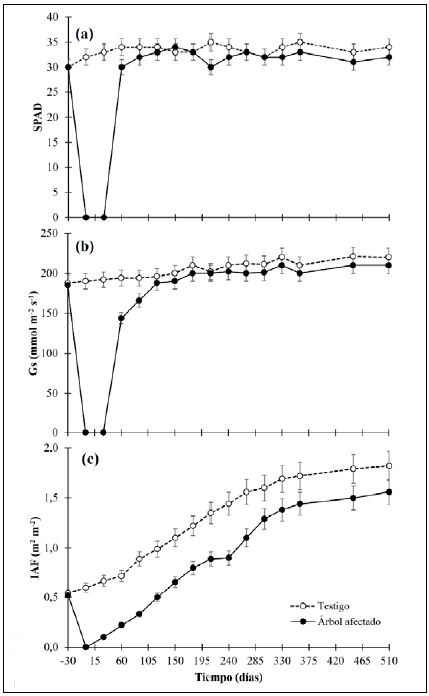
Proceso de recuperación fisiológico
La variación fisiológica de los árboles de control y de los afectados por A. cephalotes se presentan en la figura 2. En general, se determinó que: 1) no existieron diferencias significativas (p<0,05) en los datos del SPAD, la Gs y el IAF antes de la afectación por A. cephalotes entre las plantas de control y las afectadas; 2) después del ataque de A. cephalotes se debió esperar 60 días para disponer de hojas con la madurez fisiológica suficiente para la medición de SPAD y la Gs, por lo que en los primeros 60 días no se contó con información fisiológica; 3) la respuesta de reactivación fisiológica de la planta reflejada en el IAF de las plantas afectadas a los 30 días se debió a que A. cephalotes dejó los brotes de hojas nuevas en las plantas afectadas, lo que permitió que comenzaran a aparecer nuevas láminas foliares; 4) el IAF fue la única variable que no llegó a presentar significación estadística en las plantas de control (p<0,05) después de finalizado el experimento. El contenido relativo de clorofila en las hojas (SPAD) (Figura 2a) antes del ataque de A. cephalotes presentó un valor promedio de 30,11; después de la afectación se requirieron 120 días para que las nuevas láminas foliares presentaran contenidos de SPAD estadísticamente no significativos (p<0,05), en tanto que las hojas mostraron valores de 28 a 44 % menos SPAD. Después de su recuperación, no hubo diferencias significativas (p<0,05) entre ambos grupos.
En cuanto a la conductancia estomática (Gs) (Figura 2b), el comportamiento fue similar: antes de la defoliación las plantas registraban un valor promedio de 189,44 nmolm-2s-1, después de la pérdida de la lámina foliar se requirieron 150 días para que la cobertura foliar presentara datos significativos (p<0,05) en la planta de control y a partir de este momento ninguno de los tratamientos mostró una variación representativa (p<0,05). Por último, el IAF continuó sin mostrar variación con un valor promedio de 0,61 m2 m-2 y después de que A. cephalotes eliminó toda la cobertura foliar, los árboles empezaron a recuperarse. A los 150 días se presentó un IAF inferior a 47,6 % con respecto a las plantas de control y después, las plantas afectadas continuaron incrementando el IAF, pero manteniendo valores significativamente menores (p<0,05), y al final del experimento el déficit era del 26,5 %.
Proceso de recuperación hidráulico
El comportamiento de recuperación hidráulica de los árboles afectados por A. cephalotes (Figura 3) se caracterizó por: 1) una recuperación rápida, pues, en general, se requirieron 75 días para que las plantas afectadas mostraran el mismo comportamiento de las plantas de control; 2) la variable con menor variación fue el MFS debido a que esta se evalúa en el fuste de las plantas y permite determinar el transporte hidráulico en la xilema vascular; 3) la recuperación hidráulica foliar se incrementó con el tiempo y la madurez de la hoja, contrario a las variables fisiológicas. En cuanto a la turgencia foliar (Figura 3a), las plantas mostraron un valor promedio de 165 kPa en el momento del ataque de A. cephalotes; el Pp fue nulo debido a la pérdida de hojas, y a los 45 días de regeneración, las primeras hojas mostraron una recuperación del 56 %; en el día 60 mostraron valores estadísticamente iguales (p<0,05) a las plantas de control.
En el caso del MFS (Figura 3b), la tendencia de las plantas de control fue hacia el aumento a medida que crecían. En el inicio del experimento el movimiento hidráulico promedio fue de 4,61 dm3m-2s-1 y no hubo variación entre los dos tratamientos y su valor se incrementó a los 510 días a 6,98 dm3m-2s-1. Las plantas que presentaron pérdida de cobertura foliar tuvieron una reducción del MFS de 45,7 % en los 30 días posteriores al ataque, cuando los árboles comenzaron a aumentar el MFS, y en el día 60 mostraron valores estadísticamente iguales a las plantas de control (4,89 dm3m-2s-1); a partir de este momento el MFS tendió a aumentar de la misma manera que en las plantas de control. Por último, el CHF (Figura 3c) tuvo un valor homogéneo durante todo el experimento, siendo en promedio de 89 %; las plantas atacadas por A. cephalotes requirieron de 45 días para presentar valores similares a las de control, periodo en el que los valores fueron nulos debido a la ausencia de hojas con algún grado de madurez.
Discusión
El retardo en el crecimiento, específicamente en la altura, se debe a la pérdida de la cobertura foliar, ya que el árbol no puede desarrollar los procesos de transpiración y fotosíntesis necesarios para la generación de azúcares y enzimas que permiten el crecimiento del meristemo apical (Trager, et al., 2013). A nivel diamétrico, por la reducción de azúcares y proteínas el árbol entra en un proceso de estrés fisiológico en el que desarrolla estrategias mecánicas de estancamiento del crecimiento en el lumen, ya que las reservas energéticas se distribuyen en el meristemo apical y en los meristemos secundarios, con el fin de generar nuevas láminas foliares y reactivar la fotosíntesis. Desde la perspectiva química, el árbol inicia la generación de ácido abscísico (ABA), cuya función es generar procesos de dormancia, acumulación de reservas nutritivas y tolerancia a la desecación (Dietrich & Kahmen, 2019), además de producción de proteínas básicas para el desarrollo radicular, esto con el fin de obtener los nutrientes y compuestos necesarios para la supervivencia del árbol y la generación de nuevas hojas, lo cual requiere que el crecimiento se suspenda como medida de reducción energética y, por ende, del movimiento hidráulico, centrando los elementos móviles en los meristemos y produciendo un estrés positivo radicular para la captación de nutrientes (Bhusal, et al., 2019).
El estrés negativo generado por el ataque de A. cephalotes en las condiciones de estudio se puede clasificar de moderado, y si bien hubo un estancamiento en el crecimiento, el proceso de recuperación foliar fue corto, comportamiento similar al reportado por Brunetti, et al. (2019), y las plantas tuvieron una rápida recuperación foliar debido a los movimientos nutricionales rápidos de la raíz a la parte superior del tallo para la activación de los meristemos laterales y apical, de ahí que la recuperación hidráulica se dé antes que la fisiológica. Por su parte Pereyra, et al. (2019) han señalado que en condiciones de estrés, el xilema tiene una función primordial en la reactivación metabólica del organismo, y en el movimiento constante de nutrientes (nitrógeno, potasio y fósforo), carbohidratos (glucosa, sacarosa y maltosa) y proteínas primarias.
La recuperación fisiológica lenta en comparación con la hidráulica se debe, según Evans & Ortega (2019), Fajstavr, et al. (2019) e Iwasaki, et al. (2014), a que la planta requiere movilización nutricional para la formación de nuevas hojas. Generalmente, las primeras hojas se caracterizan por tener un área de lámina menor debido a que el ABA limita el tamaño para evitar pérdida energética y se enfoca en generar cobertura que reactive la fotosíntesis. Después de una defoliación total la planta debe readecuarse y generar una recuperación que le evite entrar en el punto de marchitez permanente (Heraldo, et al., 2019). La regulación de elementos móviles como el nitrógeno, el fósforo y el potasio se debe a que son fundamentales para el proceso de fotosíntesis dentro del ciclo de Calvin; en especial en plantas C3, su reducción incide en la reducción del tamaño de las hojas, la disminución de la turgencia y una gran reactivación de meristemos secundarios en aras de la supervivencia. Estos aspectos provocan que la transpiración y los valores de SPAD sean menores a los de las hojas de control. A medida que el individuo empieza a tener un IAF mayor, las hojas empiezan a generar azúcares, proteínas y aminoácidos y a disminuir las concentraciones de ABA. Trifilò, et al. (2019) encontró en tres especies arbóreas de Trichilia spp. una disminución química de sacarosa del 20 % y de aminoácidos esenciales de 15 % producto del incremento de la concentración de ABA de 5 % como consecuencia del aumento de 2 °C en la temperatura, lo que inhibe directamente la capacidad estomática generando un aumento en el cierre de estomas. La reducción en la concentración del ABA en plantas recuperadas puede variar según las condiciones ambientales de temperatura, humedad relativa y precipitación.
La recuperación de los árboles afectados por el defoliador es vital desde las perspectivas hidráulica y fisiológica, pero su impacto en el crecimiento y la productividad es significativo. Dada la pérdida energética por la ausencia de procesos fotosintéticos, la recuperación gradual del árbol depende del aumento del IAF, aspecto que Wang, et al. (2019) consideraron fundamental para mejorar las condiciones de la planta, ya que cuanto mayor sea el aumento de láminas foliares, la estabilización fisiológica e hidráulica será mayor y, con ello, la reactivación de crecimiento será menor, de ahí que el uso de técnicas como la inyección nutricional en el fuste o la aplicación de nutrimientos en el suelo ricos en nitrógeno, fósforo y potasio puede mejorar la capacidad de recuperación de los árboles. Munitz, et al. (2019) determinaron en especies arbustivas una disminución del 33 % en el tiempo de recuperación de arbustos podados a los que se les aplicó fertilizante en el suelo, debido a que obtuvieron mayor cantidad de elementos nutricionales movilizados a la copa y con la capacidad de sintetizar carbohidratos y proteínas que permitieran la formación de nuevas hojas.
Conclusiones
Atta cephalotes generó un retraso en el crecimiento de los árboles de 39,0 % en el diámetro y de 64,3 % en la altura. A nivel fisiológico, se requirieron 120 días para la recuperación de los SPAD y 150 días para que la conductancia estomática y el IAF fueran similares a los de las plantas de control. Para las variables hidráulicas el periodo fue menor: la turgencia foliar se recuperó en 45 días y el MFS y el CHF en 60 días. Este comportamiento se debió a que, en respuesta al estrés de la defoliación, el árbol debe reiniciar la recomposición foliar, lo que requiere el movimiento de azúcares, nutrientes y agua; para ello el movimiento hidráulico es primordial en el proceso de recuperación y para incremento del IAF y la estabilización de crecimiento.