Introducción
Los canales de calcio son un grupo amplio de proteínas integrales de membrana que se caracterizan por tener un poro acuoso que atraviesa la totalidad de la bicapa lipídica. Estas proteínas proporcionan una vía para que los iones Ca2+ ingresen al interior celular y puedan activar rutas de señalización intracelular 1. Los canales se caracterizan por ser altamente selectivos 2-5, y por fluctuar entre un estado abierto, cerrado e inactivo 3. Se abren sólo en respuesta a un estímulo específico, que puede ser un cambio de voltaje a través de la membrana, la unión de un ligando específico o incluso estímulos físicos, como pH o variaciones en la temperatura 6-8. Un sistema de clasificación general de estos canales los agrupa en tres clases diferentes: canales de Ca2+ operados por receptor o ROCC (por sus siglas en inglés Receptor Operated Calcium Channel), canales activados por parámetros físicos o TRP (por sus siglas en inglés Transient Receptor Potencial) y canales de calcio dependientes de voltaje o VDCCs (por sus siglas en inglés Voltage-gated Calcium Channels) 8-12 (ver Figura 1).

Fuente: Elaborado por Lozano y Sánchez.
Figura 1 Clasificación de los canales de calcio de acuerdo a su mecanismo de acción.
La estructura de estos canales los hacen importantes blancos terapéuticos, por esta razón entender los diferentes componentes moleculares que participan en la regulación de su actividad y su relación con las vías de señalización celular permitirá proponer nuevos potenciales puntos de acción farmacológica.
Canales de Ca 2 + operados por receptor
Los canales iónicos operados por la interacción receptor-ligando constituyen una familia de proteínas que permiten el paso de los iones después de que un ligando se ha unido al receptor 13. Los principales receptores operados por la interacción receptor-ligando son el receptor nicotínico, el receptor GABA A (ácido γ-aminobutírico), receptor glicina y receptor NMDA (N-metil-D-aspartato). De este conjunto el mejor ejemplo de un canal de Ca2+ operado por receptor es NMDA 13,14. Este canal se encuentra constituido por 4 subunidades (α, β, y, δ) que se ensamblan en la membrana celular como una estructura pentamérica (ver Figura 2), en la que una o varias subunidades pueden estar repetidas. Estructuralmente, el canal consiste de cuatro segmentos transmembrana (M1-M4) de los cuales el segmento M2 forma la pared del canal 13,15.
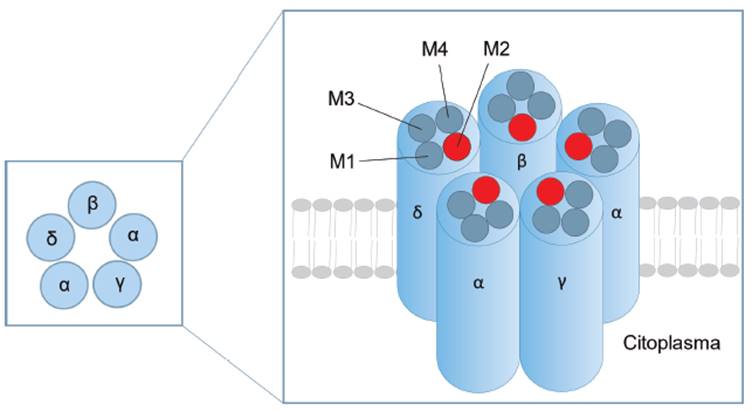
Fuente: Elaborado por Lozano y Sánchez.
Figura 2 Característica estructural de los receptores operados por la interacción receptor ligando. Las subunidades se encuentran constituidas de 4 segmentos transmembrana (M1-M4).
El receptor NMDA es activado selectivamente por el N-metil-D-aspartato y por un co-agonista, el aminoácido glicina. Se caracteriza porque permite el flujo de Na+, K+ y Ca2+16,17. Este receptor comparte características funcionales con otros canales regulados por la interacción receptor-ligando y con canales dependientes de voltaje debido a que cuando el potencial de membrana está próximo al valor de reposo, el canal se encuentra bloqueado por el ion Mg2+18. El bloqueo es eliminado transitoriamente cuando la membrana se despolariza 19,20.
Otro receptor con selectividad al ion calcio es el receptor nicotínico. La activación del receptor provoca la apertura del canal y el aumento de la permeabilidad iónica para cationes monovalentes Na+, K+ y en menor proporción cationes divalentes como Ca2+ y Mg2+, inducido por la unión de dos moléculas de acetilcolina en los extremo de la subunidades α 21,22.
Otros canales pertenecientes a esta categoría son los receptores de inositol 1, 4, 5 trifosfato (IP3) y el receptor rianodina (RYR), ambos localizados en la membrana del retículo endoplásmico. Su activación se inicia con una señal extracelular que activa a los receptores acoplados a proteína G, lo que lleva a la activación de la enzima fosfolipasa C (PLC) para generar 1,2 diacilglicerol (DAG) e inositol 1,4,5 trifosfato (IP3). Este último se une a los receptores de IP3 produciendo la apertura del canal y la salida de Ca2+ desde el retículo al citosol celular (ver Figura 3) 23-25.

Fuente: Elaborado por Lozano y Sánchez.
Figura 3 Activación de los canales de Ca2+ del tipo operados por ligando. En este ejemplo se muestra la activación de los canales del tipo receptor IP3.
El vaciamiento de los depósitos intracelulares de calcio genera la apertura de los canales TRPs (Transient Receptor Potencial), lo que restablece el llenado de los depósitos de Ca2+ intracelular (ver Figura 3) 25.
Canales TRPs
Los miembros de la superfamilia de canales TRPs se caracterizan porque permiten el ingreso de Ca2+ y Na+ al interior celular; se subdividen en 7 subfamilias: TRPC ('Canonical'), TRPV ('Vanilloid'), TRPM ('Melastatin'), TRPP ('Polycystin'), TRPML('Mucolipin'), TRPA ('Ankyrin') y TRPN ('NOMP') 26. Todos presentan una estructura común constituida de 6 dominios transmembrana, que se ensamblan en tetrámeros para formar el poro selectivo a cationes. Son ampliamente conservados y se encuentran expresados en diferentes células encontrando ejemplos de estas proteínas en prácticamente todos los tejidos 27,28. La mayoría de los canales TRP tienen la habilidad de responder a una gran variedad de estímulos de origen muy diverso, tanto físicos (cambios en la temperatura, distensión de la membrana) como químicos (pH, hormonas, concentraciones iónicas), estos canales se han visto implicados en procesos de proliferación y diferenciación celular 29-32.
Canales de calcio dependientes de voltaje
Se trata de una familia de proteínas bastante amplia que tiene en común la selectividad para Ca2+ y un mecanismo de activación dependiente de la despolarización de la membrana (potenciales mayores a -60 mV) 33.
Su actividad también se encuentra regulada por diversas proteínas que operan sobre la porción intracelular del canal.
Los VDCCs presentan estructura oligomérica constituida por 4 subunidades (α1, β, α2 y, δ) (ver Figura 4).

Fuente: Elaborado por Lozano y Sánchez.
Figura 4 Diagrama estructural de los canales de Ca2+ tipo VDCCs.
La subunidad central α1 es una glicoproteína con una masa molecular de 212 kilodalton (kDa); consta de 4 dominios homólogos (I-IV), cada uno con 6 segmentos transmembrana (S1-S6) 34. Es la subunidad que forma el poro del canal para el paso de los iones Ca2+35 y su segmento S4 actúa como un sensor de voltaje para responder a un estímulo despolarizante. Presenta diez isoformas, cuya distribución es dependiente del tejido (ver Tabla 1), convirtiéndola en una unidad importante en los procesos de regulación de la concentración de calcio intracelular.
Tabla 1 Clasificación de los canales de calcio dependientes de voltaje.

Fuente: Elaborado por Lozano y Sánchez.
La subunidad β, por su parte, es una proteína de naturaleza hidrofílica con una masa molecular de 54 kDa. En cuanto a su función, participa en el tráfico de la subunidad α1 a la membrana plasmática y regula las propiedades cinéticas (activación e inactivación). Sin embargo, se desconocen los mecanismos por los cuales la subunidad β es capaz de regular la actividad de la subunidad α1 (ver Figura 4) 36.
La subunidad α2δ es una glicoproteína constituida por la subunidad α2 de 143 kDa y δ de 27 kDa, unidas por puentes disulfuro. Se ha descrito que puede ser importante en la apertura del canal de Ca2+37 y además se sugiere que presenta una alta afinidad por el fármaco anticonvulsionante gabapentina (ver Figura 4) 38,39.
La subunidad γ es una glicoproteína de 30 kDa que posee 4 segmentos transmembrana. Se sugiere que podría jugar un papel importante en el acoplamiento excitación-contracción (ver Figura 4) 37.
Los VDCCs se clasifican de acuerdo con sus propiedades biofísicas, según sea el potencial requerido para activarse (alto o bajo) 40. Los canales tipo L (Long Lasting Current), se inactivan lentamente y requieren un alto potencial para su activación; los de tipo T (Transient Current) se caracterizan porque requieren un bajo potencial para su activación y su inactivación es rápida. Los canales tipo N (Neither T Nor L) poseen unas características electrofisiológicas intermedias entre los canales tipo T y L 33.
Los VDCCs también se clasifican de acuerdo con sus propiedades farmacológicas, es decir, de acuerdo con la respuesta que presentan frente a ciertos fármacos. Así, los de tipo L son sensibles a dihidropiridina (DHP), mientras que los del de tipo P/Q, N y R no responden a DHP, sino a otras moléculas (ver Tabla 1) 41.
Como ya se mencionó, los VDCCs se activan por un estímulo despolarizante. El sensor de voltaje ubicado en el segmento S4 de la subunidad α1 detecta el cambio de potencial de la membrana, provocando un cambio conformacional que abre el canal y permite el ingreso de iones Ca2+ a la célula 25. Otro mecanismo de regulación de la activación de los VDCCs está dado indirectamente por los receptores β1, β2 adrenérgicos. El acoplamiento de éstos a la proteína heterotrimérica acoplada del tipo Gαs, lleva al aumento de la concentración de AMP cíclico (AMPc); el que, a su vez, activa la proteíncinasa C, con la consecuente fosforilación de los residuos serina y/o treonina de una o más subunidades del canal 42 (ver Figura 5).
Calcio en un contexto fisiológico
El calcio es uno de los principales mensajeros celulares. Está implicado en numerosas vías de señalización que regulan procesos tan importantes como secreción, contracción, proliferación y apoptosis celular 43. Sus implicaciones fisiológicas son, por lo tanto, diversas y de gran interés investigativo.
En condiciones fisiológicas, la concentración de Ca2+ dentro del citoplasma se mantiene en niveles muy bajos, alrededor de 100 nM. En contraste, la concentración de este ion en el espacio extracelular y en ciertos organelos citoplasmáticos internos, como el retículo endoplasmático o la mitocondria es 10.000-20.000 veces mayor 44. Este gradiente de Ca2+ se mantiene en parte por la acción de bombas de calcio que existen en la membrana plasmática y en la membrana del retículo endoplasmático, las cuales mueven Ca2+ por un mecanismo de transporte activo hacia el exterior de la célula o hacia el interior del reservorio intracelular, respectivamente, en contra del gradiente electroquímico 45. Un sistema adicional de transporte lo constituye el intercambiador Na+/Ca2+ que utiliza tres iones de Na+ para impulsar la salida de un ion Ca2+25.
Por acción de señales extracelulares como hormonas y neurotransmisores se genera un rápido aumento en la concentración de Ca2+ en el citosol celular 46,47, que proviene de la apertura de canales de Ca2+46,48,49. El incremento de Ca2+ intracelular modula la actividad de diversas proteínas como calmodulina, troponina C, calpainas y otras proteínas de unión a Ca2+ (calbindina, calreticulina, calsecuestrina) 44, las cuales activan diferentes efectores desencadenando cambios en la actividad celular.
Ca2+ en la contracción muscular
El ion Ca2+ es un regulador fisiológico clave para la contracción muscular. En el músculo esquelético y cardiaco el proceso se inicia con la llegada de un impulso nervioso que lleva a la activación de los VDCCs. El consiguiente flujo de iones Ca2+ hacia el citoplasma incrementa la concentración de Ca2+ citosólico lo suficiente para influir en la interacción de las proteínas contráctiles actina, miosina, tropomiosina (TM) y troponina (Tn) 50 (ver Figura 6A). El movimiento de la miosina a lo largo del filamento de actina se encuentra regulado por el complejo TN -TM, siendo TN la unidad fijadora Ca2+ que regula la posición de TM (ver Figura 6b). El aumento de Ca2+ intracelular permite la fijación de iones a TN generando un cambio conformacional que permite el movimiento de TM; por lo tanto, se anula el efecto inhibidor del complejo TN-TM, permitiendo que la miosina se pueda fijar al filamento delgado de actina con la consecuente contracción muscular (ver Figura 6B) 51-53.

Fuente: Elaborado por Lozano y Sánchez.
Figura 6 Ca2+ en la contracción muscular. A. Contracción actina-miosina en músculo. B. Regulación de la contracción muscular.
A nivel del músculo liso la contracción se origina por la presencia de diversos estímulos contráctiles que contribuyen al aumento en la concentración de calcio intracelular. Este Ca2+ citosólico se une a la proteína calmodulina formando un complejo calcio-calmodulina, (Ca2+-CM), que activa la quinasa de cadena ligera de la miosina (MLCK) (ver Figura 7A), la que a su vez fosforila la cadena ligera de la miosina (LC) facilitando su interacción con la actina y la contracción muscular (ver Figura 7B). La relajación muscular se produce cuando disminuyen los niveles de Ca2+ intracelular, lo que reduce la actividad de la MLCK y hace que predomine la actividad de la fosfatasa de la cadena ligera de la miosina (MLCP) que defosforila e inactiva la LC 25.
Calcio en la neurotransmisión
La liberación de neurotransmisores por el proceso de exocitosis es un proceso dependiente de Ca2+ en el cual intervienen diversas proteínas. El proceso se inicia cuando llega un potencial de acción a la terminal presináptica, se activan los canales de Na+ regulados por voltaje, ingresando Na+ a favor de un gradiente de concentración. El flujo de cargas positivas despolariza la membrana plasmática lo que conduce a la apertura de los VDCCs y el respectivo ingreso del ion Ca2+ a la neurona 54. A nivel citoplasmático se activa la calmodulina por la unión de Ca2+, formándose un complejo Ca2+-calmodulina que activa una cascada de señalización conducente a la liberación de neurotransmisores por la fusión de las vesículas cargadas con neurotransmisores con la membrana plasmática, de acuerdo al modelo conocido como la hipótesis SNARE 55. Se ha propuesto que la sinaptotagmina, proteína presente en el complejo SNARE (ver Figura 8), evita la fusión de la vesícula con la membrana plasmática. Con el aumento de Ca2+ intracelular se presenta un cambio conformacional en esta proteína, siendo desplazada del complejo, permitiendo que otras proteínas se unan y se inicie el proceso de fusión 56,57.
Calcio en la secreción de hormonas
La secreción de hormonas es también un proceso dependiente de calcio. Análogo a lo recién descrito para la secreción de neurotransmisores, las vesículas conteniendo hormonas se unen con la membrana plasmática por el mismo mecanismo de fusión. La Figura 9 ejemplifica el proceso de secreción de insulina que ocurre en el páncreas. Después del ingreso de glucosa a las células beta del páncreas, aumenta la concentración de ATP en el citoplasma. Este ATP se fija e inhibe los canales de K+ sensibles a ATP, provocando una reducción de la salida de iones K+ lo que genera una despolarización de la membrana plasmática y activación de los VDCCs. El ingreso de Ca2+ activa la fusión de las vesículas secretoras que contienen insulina (58-60) (ver Figura 9).
Calcio en los potenciales de acción cardiacos
El impulso cardíaco nace en el nodo sinoauricular (SA), se propaga a las aurículas, atraviesa el nodo auriculoventricular (AV) y mediante el sistema especializado de conducción His-Purkinje, invade ambos ventrículos que responden a la onda de propagación contrayéndose de forma sincrónica 54 (ver Figura 10A).

Fuente: Elaborado por Lozano y Sánchez.
Figura 10 Calcio en los potenciales de acción cardiacos. A. Esquema de las partes del corazón implicadas en el potencial de acción. B. Fases del potencial de acción.
El ciclo cardiaco se encuentra controlado por variaciones en la concentración citosólica de Ca2+, que incrementa durante la sístole y disminuye durante la diástole. El Ca2+ contribuye a la génesis del potencial de acción (ver Figura 10B). Cuando la célula cardiaca se despolariza produce una respuesta eléctrica denominada potencial de acción cardíaco; potenciales de acción rápidos o dependientes de Na+ (en miocardio auricular, ventricular y sistema His-Purkinje) o lentos dependientes de Ca2+ (se presenta en el Nodo SA y Nodo AV) (ver figura Figura 10C). En ambos tipos de potencial la respuesta eléctrica depende del ingreso de Ca2+ a la célula.; En el primero de ellos, Ca2+ es importante para la fase 2 del potencial, y en el segundo caso, lo es para la fase 0 (ver figura Figura 10C).
Otros papeles fisiológicos del Ca 2 + intracelular
El Ca2+ no sólo participa en los procesos fisiológicos anteriormente discutidos, que son efectos a corto plazo. También produce efectos a largo plazo que implican regulación de la expresión génica 61,62. Se conoce que el aumento de Ca2+ intracelular lleva a la activación de factores de transcripción. Un ejemplo de ello es la proteína NFAT (Nuclear Factor of Activated T Cells) que pertenece a una familia de factores de transcripción que regulan la expresión de genes implicados en la respuesta inmune 63. Otro factor de transcripción regulado por Ca2+ es CREB (proteína de unión al elemento de respuesta a AMP cíclico) que regula la expresión de genes implicados en respuesta a diferentes estímulos 64.
Todo lo anterior resalta la importancia de Ca2+ en múltiples procesos fisiológicos importantes.
Canales de Ca2+ y su interés farmacológico
Los canales de calcio son el blanco de acción de diferentes fármacos empleados en la actualidad. El manejo farmacológico relacionado con estos canales está orientado mayoritariamente al sistema cardiovascular, especialmente para el tratamiento de arritmias, hipertensión, anginas y otros (ver Tabla 2).
Tabla 2 Principales patologías asociadas a canales de calcio como blanco farmacológico.

Fuente: Elaborado por Lozano y Sánchez.
Todos los fármacos empleados actúan como bloqueadores de canales de calcio, y se clasifican en 1,4-dihidropiridinas (DHPs), benzotiazepinas y fenilalquilaminas (Tabla 3) 54.
Tabla 3 Principales fármacos usados en sistema cardiovascular.

Fuente: Elaborado por Lozano y Sánchez.
Estos fármacos afectan principalmente canales VDCCs de tipo-L y, en mucho menor grado, tienen efecto a nivel del sistema nervioso central. α, β, y, δ
En cuanto al mecanismo de acción, estos fármacos se unen directamente a determinados segmentos transmembrana de la subunidad α1 del canal. El grupo de las DHPs se une al segmento S6 de los dominios II y IV; los benzotiazepínicos (diltiazem) se unen al dominio III, IV entre el S5-S6, y los fenilalquilamínicos se unen al dominio IV S6 65.
Los bloqueadores de canales de Ca2+ se unen más rápidamente a células que presentan potenciales de membrana más despolarizados, lo que explica su mayor afinidad por las células musculares vasculares y por las células nodales que tienen potenciales de membrana alrededor de -60 mV comparadas con las células musculares auriculares, ventriculares y las fibras de Purkinje en las que su potencial es de -90 mV 15. Estos fármacos reducen la frecuencia de apertura de los canales de calcio en respuesta a la despolarización, teniendo como resultado una notable disminución en la corriente de calcio en el músculo liso y en el músculo cardiaco 54, generando una disminución en la contractilidad (Tabla 4) 66.
Tabla 4 Efectos cardiovasculares de fármacos usados en el sistema cardiovascular.

Fuente: Elaborado por Lozano y Sánchez.
Sistema cardiovascular
En los vasos de resistencia periférica el calcio genera contracción en las células musculares lisas (ver Figura 6), los canales que permiten el ingreso de Ca2+ son las dianas específicas del verapamilo, diltiazem y nifedipino, precipitando la caída de Ca2+ citosólico generando en músculo cardiaco disminución de la conducción auriculoventricular y sinoauricular y en músculo liso vasodilatación. En las arritmias cardiacas los bloqueadores de canales de calcio disminuyen la frecuencia cardiaca y la velocidad de conducción a nivel nodal 63. En hipertensión los bloqueantes de los canales de Ca2+ producen relajación arteriolar y, por lo tanto, reducción en la resistencia vascular periférica. En angina de pecho disminuye la demanda de oxígeno reduciendo el trabajo cardiaco y permiten atenuar el vasoespasmo, mejorando el aporte de oxígeno al miocardio al aumentar el flujo sanguíneo coronario 54,66.
Sistema nervioso central
La entrada de calcio en la terminación pre-sináptica facilita la liberación de neurotransmisores y da lugar a la despolarización y propagación de la descarga (ver Figura 7). En la epilepsia, se busca impedir la propagación de la descarga a estructuras vecinas siendo los canales tipo T implicados en la propagación del impulso nervioso. Por otro lado, los bloqueadores de canales de Ca2+ actúan a nivel de las arterias cerebrales permitiendo la atenuación del vasoespasmos 54,66.
Efectos sistémicos de los bloqueadores de canales de Ca 2+
En el músculo liso se presenta una relajación. Al parecer el músculo liso vascular es el más sensible, pero puede verse relajación en el músculo liso bronquial, gastrointestinal y uterino. En el músculo esquelético no se deprimen las concentraciones de Ca2+ intracelular debido al gran tamaño del retículo endoplásmico. En vasoespasmo cerebral la nimodipina posee una gran afinidad por los vasos sanguíneos cerebrales, permitiendo la atenuación de este efecto.
Proyecciones
Recientes descubrimientos sobre las bases moleculares de la inactivación de los canales de Ca2+ en el proceso de excitación-contracción en células cardiacas y vasculares ha permitido dilucidar detalles estructurales de los canales de Ca2+, como la interacción de proteínas necesarias para la activación y finalización de las corrientes de Ca2+67, lo cual puede ayudar al desarrollo de nuevos agentes terapéuticos basados en los nuevos principios estructurales.
La terapéutica actual se ha direccionado al bloqueo de los canales de Ca2+ ubicados en la membrana plasmática. Sin embargo, los canales ubicados en el retículo endoplasmático (IP3 y RYR), son un potencial blanco terapéutico para el control de la función celular. Xantinas, adenosinas y algunos policationes, se han encontrado que son específicos para el receptor RyR. Esta información ayudará al desarrollo de agentes permeables de membrana de bajo peso molecular que presenten selectividad y, por lo tanto, pueden servir como agentes terapéuticos para controlar la liberación de Ca2+ intracelular desde el retículo endoplasmático 68.
Otro aspecto interesante es el papel de Ca2+ en tejido adiposo. El incremento de calcio intracelular parece que ejerce un papel regulador bifásico en la diferenciación del adipocito: en estadios tempranos, bloquea la diferenciación, y en estadios tardíos la estimula 25,69,70. Recientemente se ha descrito que los canales TRPV1 estarían implicados en inhibición de la adipogénesis de preadipocitos 3T3-L1 71.
Muchas investigaciones actuales están encaminadas a comprender los mecanismos moleculares implicados en la regulación de la actividad de estos canales y su relación con las vías de señalización 72-73. El conocimiento de estos mecanismos creará nuevos potenciales puntos de acción farmacológica.


















