I. Introducción
A acelerada pérdida de diversidad biológica que se vive en la actualidad se debe en gran medida al efecto de las acciones antropogénicas como la introducción de especies exóticas, destrucción y fragmentación del hábitat, entre otras [1], [2]. Las cuencas hidrográficas no son la excepción pues estas sufren alteraciones con los diferentes usos del suelo (agricultura, ganadería, industria, asentamientos humanos, deforestación, entre otros) determinando así la calidad fisicoquímica del agua y la biota acuática [3]- [6]. La cuenca del caño Quenane-Quenanito soporta acciones antrópicas pues en la parte alta y media prevalecen el turismo, los asentamientos humanos, la explotación de hidrocarburos, la agricultura, y en la zona baja actividades agropecuarias y de ganadería extensiva [7]. Estas actividades podrían alterar el funcionamiento del ecosistema y las comunidades que en ella habitan, como los macroinvertebrados acuáticos y particularmente los coleópteros.
Coleoptera es uno de los órdenes más diversos dentro de la clase Insecta; cuenta con más de 400.000 especies a nivel mundial de las cuales alrededor de 18.000 son acuáticas [8]. La gran diversidad de este grupo se debe al amplio espectro que tiene en cuanto al hábitat en sistemas lóticos y lénticos [9], por lo cual se esperaría encontrar un gran número de familias, géneros y especies, en una región como los Llanos Orientales, con gran diversidad de ecosistemas acuáticos [10]. Los coleópteros en general tienen la capacidad de tolerar amplias variaciones en los niveles de oxígeno por lo cual no son buenos indicadores de calidad del agua [11], aunque la familia Elmidae ha sido utilizada ampliamente porque la mayoría de sus especies se encuentran en aguas bien oxigenadas y son poco tolerantes a la contaminación orgánica [12], [13]. De tal forma que se planteó la siguiente pregunta de investigación: ¿Cómo cambia el ensamblaje de coleópteros a lo largo del caño Quenane-Quenanito, en dos periodos hidrológicos contrastantes? Y como hipótesis se planteó: los coleópteros responden espacialmente a cambios físicos y químicos del agua a lo largo del caño, pues el ensamblaje responde a las acciones antrópicas asociadas y a la variación del régimen de lluvias, que conlleva a un aumento o disminución del caudal.
II. Metodologia
A. Área de estudio
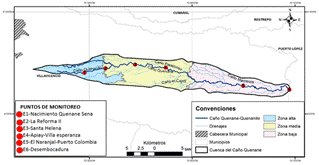
La cuenca hidrográfica del caño Quenane-Quenanito se encuentra ubicada en el departamento del Meta y se extiende desde el municipio de Villavicencio, nace en la base aérea de Apiay a 375 msnm, y termina en el municipio de Puerto López confluyendo al río Negro en la vereda Pachaquairo, a 200 msnm; la temperatura mínima promedio es de 19.6°C y la temperatura máxima promedio es de 33.5°C [14]. El 99,7% de la cuenca está ubicada en el municipio de Villavicencio y un 0,3% en el municipio de Puerto López y recorre un total de 12 veredas [7].
B. Estructura del muestreo
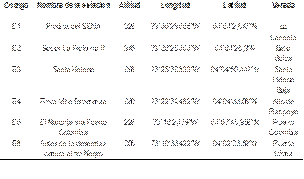
Con el fin de obtener representatividad de dos periodos del ciclo hidrológico, el muestreo se realizó en transición a aguas bajas (TAB) (19 al 21 de noviembre de 2014) y aguas bajas (AB) (24 al 26 de febrero de 2015). Se establecieron 6 estaciones a lo largo del caño cada una con diferentes actividades antrópicas asociadas (Tabla 1), con una franja de 100 metros de longitud que representaba los tipos de hábitats más frecuentes en el curso de agua [15]. El muestreo fue realizado por el Instituto de Ciencias Ambientales de la Orinoquia Colombiana (ICAOC) en el desarrollo del Convenio Marco de Cooperación 5211592 suscrito entre la Universidad de los Llanos y Ecopetrol.
C. Colecta de especímenes
En las seis estaciones se estableció una franja de 100 metros de longitud la cual representó los tipos de hábitats más frecuentes en la corriente [16]. Para la colecta de los especímenes se empleó una red Surber (250 µm, 900 cm2) la cual se estableció parcialmente sumergida a contracorriente [16] con remoción del sustrato durante 3 minutos. Se tomaron un total de 7 muestras por estación, las cuales se integraron en una sola en recipientes plásticos rotulados y fijadas con alcohol (70%). Posteriormente, los organismos fueron separados del material inorgánico con ayuda de un estereoscopio OlympusSZ61 en los laboratorios del Instituto de Ciencias Ambientales de la Orinoquia Colombiana (ICAOC). Posteriormente fueron almacenados en tubos de plástico con alcohol (70%) y etiquetados. La identificación de los especímenes se realizó con base en las claves taxonómicas de [17][18].
D. Variables fisicoquímicas
En cada una de las estaciones se midieron in situ: pH (unidades de pH), oxígeno disuelto (ppm), porcentaje de saturación de oxígeno (%Sat.O2), temperatura (°C), conductividad eléctrica (μS/cm), caudal (m3/s) turbidez (AquaFluor 8000-010). También se tomaron muestras de agua para la medición de 14 variables ex situ analizadas por el laboratorio ANALQUIM certificado por el instituto de Hidrología, Meteorología y Estudios Ambientales (IDEAM): bicarbonatos (mg/L CaCO3), cromo (mg/L Cr), DQO (mg/L O2), DBO (mg/L O2), fósforo total (mg/L PO43-), hierro (mg/L Fe), nitrógeno total (mg/L N), sólidos totales disueltos (ppm STD), sulfatos (mg/L SO42-), tensoactivos (mg/L), zinc (mg/L Zn), Clorofila a (µg/l), Clorofila alfa y coliformes totales (variable bacteriológica).
E. Análisis de datos
Para determinar la variación en la diversidad alfa entre las estaciones y periodos hidrológicos se emplearon tres medidas de diversidad: Diversidad de orden cero (q=0; 0D) o riqueza, que hace referencia al número de géneros, por lo que es insensible a la abundancia relativa de estos en cada una de las estaciones. Diversidad de orden uno (q=1; 1D) o de Shannon-Wiener, que se basa en la abundancia relativa de los géneros, incluye tanto los comunes como los dominantes e incluso los raros; y por último la diversidad de orden dos (q=2; 2D) o de Dominancia de Simpson, que les da peso a las especies abundantes [19], [20]. Estas tres medidas de diversidad se complementan entre sí y permiten una mejor interpretación, así como determinar en qué proporción la diversidad aumenta o disminuye a nivel espacial o temporal [20].
Para la diversidad beta se analizó el recambio y anidamiento [21] , a partir del índice Bray-Curtis. Esto permitió medir la variación de la composición de géneros de Coleóptera entre las estaciones y los periodos hidrológicos, ya que este índice permite determinar si la disimilitud en la composición de géneros es idéntica (valores iguales o cercanos a 0) o diferente (valores iguales o cercanos a 1) [22].
Para explorar la relación entre las variables fisicoquímicas y bacteriológicas con el ensamblaje de coleópteros se realizó un análisis de redundancia con el cual se determinó qué variables fisicoquímicas fueron responsables de la ausencia o presencia de géneros de Coleóptera a lo largo del caño Quenane-Quenanito en los dos periodos hidrológicos. Lo anterior, se realizó con previo análisis de la longitud del gradiente al ejecutar un análisis de correspondencia sin tendencia y determinar si la respuesta era lineal o unimodal [23]. Todos estos análisis se realizaron empleando el software Rstudio (RStudio Team, 2015), y los paquetes iNEXT [24], betapart [25] y vegan [26].
III. Resultados
Se registraron 983 individuos distribuidos en 5 familias y 13 géneros. La familia Elmidae fue la de mayor representatividad con el 89% (876 individuos) seguida de Psephenidae 10.5% (103 individuos); las menos abundantes fueron Dryopidae (0,2%) e Hydrophilidae (0.1%). El género Macrelmis fue el más representativo 36.5% (360 individuos), seguido por Microcylloepus 30.6% (302 individuos), mientras que los menos abundantes fueron Neocylloepus (0,3%) y Berosus (0,1%).
Durante el periodo de aguas bajas (AB) se registró la mayor abundancia (68.4%) de organismos y la menor riqueza (11 géneros); mientras que en el periodo transición aguas bajas (TAB) se evidenció la menor abundancia (31.6%) y mayor riqueza (13 géneros) registrándose todos los géneros en este periodo hidrológico.
La abundancia de coleópteros a nivel espacial varió en los dos periodos hidrológicos. El periodo de TAB presentó unas abundancias similares a lo largo de todo el estudio; las estaciones E5 y E2 fueron las que presentaron mayor abundancia (89 y 78 organismos, respectivamente) mientras que la estación E1 fue la que presentó la más baja (13 organismos). En el periodo de AB las abundancias a lo largo del estudio mostraron un cambio drástico en las estaciones E5 y E6, en donde el número de individuos fue mucho más alto que en cualquiera de las otras en cualquier periodo, y esto se debió al elevado número de individuos de Macrelmis.
En cuanto a la riqueza a nivel espacial de familias de coleópteros, en el periodo TAB se registraron todas las familias recolectadas en el estudio, aunque hubo menor abundancia de individuos con respecto al otro periodo hidrológico. En cuanto a géneros, todos se registraron en TAB; en la estación E3 (13 géneros) se registró la mayor riqueza genérica en contraste con la estación E1 (2 géneros). (Fig. 2A). Por otro lado, en el periodo AB las abundancias de los géneros recolectados fue menor, aunque en este periodo Macrelmis y Microcylloepus presentaron abundancias muy altas en E5 (226 individuos) y E6 (196 individuos), respectivamente (Fig. 2B). La estación E1 fue la que tuvo menor riqueza de géneros (4), mientras que las de mayor riqueza fueron E5 (8) y E2 (7), aunque en esta última las abundancias no superaron los 3 individuos por género. El género Austrolimnius no se registró en este periodo hidrológico (Fig. 2B).

Fig. 2 Número de individuos de géneros de Coleóptera por cada estación muestreada en dos periodos hidrológicos (A) TAB y (B) AB, en el caño Quenane-Quenanito.
A. Diversidad Alfa
En el periodo de transición aguas bajas (TAB) la diversidad de orden q0, mostró a E3 y E2 con la mayor riqueza (13 y 11 géneros efectivos respectivamente), seguidas por E6 y E5 (8 y 7 géneros efectivos); mientras que E4 y E1 registraron la menor riqueza (4 y 2 géneros efectivos). En cuanto a la diversidad de orden q1 las estaciones E3 y E2 presentaron la mayor diversidad (10.46 y 8.02 géneros efectivos) mientras que E4 y E1 presentaron la menor diversidad (3.50 y 1.64 géneros efectivos). La diversidad de orden q2, al igual que en las diversidades de orden 0 y 1, registró a E3 y E2 con la mayor dominancia (9.10 y 6.27), mientras que E4 y E1 presentaron la menor dominancia (3.09 y 1.47).
En el periodo de aguas bajas (AB) la diversidad de orden q0 fue menor que en el periodo de transición aguas bajas (TAB). La estación E5 presentó la mayor riqueza con 8 géneros efectivos; las estaciones E2, E3, E4 y E6 (7,6,6 y 5 géneros efectivos respectivamente) presentaron una riqueza similar y la E1 presentó la menor riqueza (4 géneros efectivos). En cuanto a diversidad de orden q1 la E2 registró la mayor diversidad (6.2 géneros efectivos), seguida por E4, E3 y E1 (4.6, 3.9, 3.3); además E5 y E6 presentaron la diversidad más baja (2.33 y 2.08 géneros efectivos). En lo que respecta a la diversidad de orden q2 la E2 presentó la mayor dominancia (5.7 géneros efectivos) mientras que E6 y E5 presentaron la dominancia más baja (1.7 y 1.6 géneros efectivos, respectivamente).
B. Diversidad Beta
Para el periodo de transición aguas bajas (TAB) la diversidad beta total fue de 0.71 y estuvo determinada principalmente por la variación balanceada con 0.50 aportando un 70.4% de la diversidad beta total; mientras que por gradiente de abundancia (0.2125) aportó 29.5% de la diversidad beta total. El dendrograma de disimilitud de Bray-Curtis de la variación balanceada de la abundancia reveló la conformación de dos grupos: el primero conformado por las estaciones E3, E1 y E2 con una disimilitud total de 13,16%; y el segundo por las estaciones E4, E5 y E6 con una disimilitud total de 46,15%.
En el periodo AB la diversidad beta total fue de 0.88 y estuvo determinada principalmente por la variación balanceada con 0.63 aportando 72.2%; y por gradiente de abundancia con 0.2529, que corresponde a 28.7% de la diversidad beta total. El dendrograma de disimilitud de Bray-Curtis de la variación balanceada de la abundancia mostró a E1 con una disimilitud del 72.22% separada de todas las demás estaciones, a E2 con una disimilitud del 50% y E6 con 35%; y un grupo conformado por las estaciones E5, E3 y E4 con una disimilitud del 10.52%.
La diversidad beta total entre los dos periodos hidrológicos fue baja (0.56) y estuvo determinada principalmente por la variación balanceada de la abundancia (0.3006; 53.6%); aunque la variación por gradiente de abundancia (0.2608; 46.5%) también contribuyó a la explicación de la diversidad beta total.
C. Análisis NDMS y ANOSIM
El análisis de NMDS mostró dos agrupamientos diferentes entre los dos periodos TAB (azul) y AB (rojo) indicando diferencias en el ensamblaje de coleópteros entre los periodos hidrológicos (NDMS stress: 0.08702584, ANOSIM: R=0,017 y P=0,375); igualmente se evidenció que la composición de Coleóptera en las estaciones es diferente dependiendo del periodo hidrológico, aunque se pudo observar un pequeño solapamiento en E1AB (Fig. 3).
D. Análisis multivariado
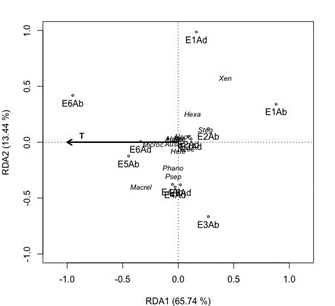
El RDA arrojó que la proporción acumulada de los dos primeros ejes fue de 79.18%. La temperatura (T) fue la única variable con importancia significativa; la estación E6AB se evidenció positivamente relacionada con la temperatura a diferencia de la estación E1AB que se relacionó negativamente. Los géneros Phanoceroides y Psephenus se asociaron con las estaciones E4TAB, E4AB y E5TAB; los demás géneros y estaciones no presentaron ninguna relación con la variable temperatura (Fig. 4).
IV. Discusion
De las 28 familias reportadas para Colombia [27] en este estudio se reportaron cuatro (Elmidae, Psephenidae, Dryopidae, e Hydrophilidae) que representan el 14.2% del total registrado para el país. La familia Elmidae fue la más abundante (89%) y la que presentó mayor riqueza (11 géneros), tal como lo han registrado otros investigadores en distintas regiones del país [9], [28]-[32]. Psephenidae fue la segunda familia más abundante con solo un género (Psephenus), resultados que coinciden con lo reportado en corrientes del Pacífico [33]. En cuanto a riqueza genérica en este estudio se reportaron 13 géneros: Austrolimnius, Berosus, Heterelmis, Hexacylloepus, Huleechius, Macrelmis, Microcylloepus, Neocylloepus, Neoelmis, Phanoceroides, Psephenus, Stegoelmis y Xenelmis, que representan el 8.4% del total (154) registrado para el país, según lo reportado por [27].
La familia Elmidae fue la más abundante a lo largo del estudio en ambos periodos hidrológicos (TAB y AB). Estos organismos se caracterizan por vivir en aguas corrientes y con niveles altos de oxígeno [17]; también se asocian a diferentes sustratos como hojarasca, raíces de plantas acuáticas, vegetación riparia, troncos, ramas, piedras y arena [9], todos estos presentes a lo largo del caño Quenane-Quenanito lo que seguramente influyó en la marcada riqueza y abundancia de esta familia. Macrelmis fue el género con mayor abundancia a lo largo de todo el estudio, similar al trabajo de [33], [34], donde fue uno de los más abundantes. Seguido por Microcylloepus, coincidiendo con el estudio de [9] y [34], en los cuales también fue el segundo más abundante. Estos dos géneros toleran cierto grado de contaminación del agua (Calidad regular), a diferencia de otros que solo se encuentran exclusivamente en aguas con calidad de agua buena a excelente como por ejemplo Stegoelmis (con abundancia baja) [34], grado de tolerancia que explicaría la abundancia de estos géneros en las estaciones, como es el caso de Macrelmis el cual no se registró en E1TAB, E1AB y E2AB, Microcylloepus el cual no se registró en E1TAB y Stegoelmis que se registró en las estaciones E2,E3,E5,E6 (TAB) y E1,E2 (AB).
Cabe resaltar que Macrelmis y Microcylloepus presentaron sus mayores abundancias en el periodo AB en las estaciones E5 y E6, que están en la parte baja del caño Quenane-Quenanito; en esta zona hay presencia de viviendas, ganadería y actividades agrícolas como cultivos de arroz, cítricos, palma aceitera y maíz [35], todo esto generando pérdida de la cobertura vegetal ribereña e inclusión de pastos en las orillas lo que influye en la corriente haciéndola lenta [6]. Todo esto en el periodo AB, pudo haber influido en la abundancia tan elevada de estos géneros pues en el periodo TAB no se evidenció esa marcada abundancia, indicando que las aguas bajas son más propicias para abundancias elevadas de algunos élmidos pues no se ven afectados ya que el microhábitat es más estable. Además, que este hecho permite el establecimiento de macrófitas las cuales crean un ambiente propicio para el desarrollo de estos organismos bentónicos [36].
La familia Psephenidae (Psephenus) tuvo presencia en casi todas las estaciones muestreadas en ambos periodos, solo en la estación E1 (TAB y AB) no se registró. Por lo general esta familia es común en corrientes de tamaños mayores con sustratos pedregosos [36], y la baja disponibilidad de oxígeno; esto posiblemente explicaría su ausencia en la estación de la zona alta del caño Quenane-Quenanito.
Para la diversidad alfa en el periodo el periodo TAB la estación E3 reflejó la mayor diversidad de orden q=0, mientras que la estación E1 registró la menor. La estación E3 ofrece gran variedad de sustratos y aguas con buena oxigenación lo que favorece el establecimiento de las larvas de Elmidae y Psephenidae, posiblemente por la facilidad que tienen estos coleópteros de colonizar gran variedad de hábitats acuáticos debido a las características morfológicas y fisiológicas de sus larvas [9]. Por otro lado, la estación E1 presentó vertimientos de desechos domésticos, y está ubicada en la parte alta de la cuenca donde hay bajas concentraciones de oxígeno [34], condiciones que no favorecen las larvas de coleópteros, lo que está muy relacionado con la diversidad y abundancia de la familia Elmidae [37], la cual fue la más abundante y diversa a lo largo del caño Quenane-Quenanito.
Por otra parte, en el periodo AB la estación E5 presentó la mayor riqueza (8 géneros) y la estación E1 la menor (4 géneros). La estación E5 se encuentra en la zona baja de la cuenca, y a ella están asociadas a mayor escala actividades antrópicas de vertimientos difusos de cultivos de arroz y cítricos [35], lo que pudiese aumentar los nutrientes que de cierta manera beneficiaría la riqueza de las larvas. También se pueden observar diferentes tipos de sustratos que ayudan al establecimiento de las larvas de coleópteros ya que hay presencia de piedras, macrófitas y vegetación riparia, tal como lo señalan [9]. En el periodo AB la estación E1, ubicada en la parte alta del caño Quenane-Quenanito, registró el nivel más bajo de oxígeno disuelto, lo que es indispensable para la presencia de las larvas de las familias Elmidae y Psephenidae; además no se evidenciaron diferentes tipos de sustratos, que ayuden a establecer las larvas de coleópteros en esta estación. Los cuatro géneros registrados aquí fueron Hexacylloepus, Microcylloepus, Stegoelmis y Xenelmis, que han mostrado ciertos niveles de tolerancia a niveles bajos de oxígeno [34].
La diversidad beta en el periodo TAB, estuvo determinada por la variación balanceada quien aportó 70.4 % de la diversidad beta total; tuvo 2 grupos, el primero formado por las estaciones E3, E1 y E2 y el segundo por las estaciones E4, E5 y E6, con una disimilitud del 13.16% y del 46.15%, respectivamente. El primer grupo corresponde a las estaciones de la parte alta y media del caño Quenane-Quenanito, estas estaciones comparten actividades antrópicas similares (asentamientos humanos y actividades turísticas) [35]; en cuanto a la vegetación riparia la perturbación es muy poca, en la primera estación el tipo de corriente es un poco lenta (agua estancada) lo que hace que los niveles de oxígeno disuelto no sean altos, y esto condiciona las larvas que podrían encontrarse en estas estaciones.
En el periodo hidrológico AB la diversidad estuvo determinada por la variación balanceada aportando un 72.2% para la diversidad beta total. A diferencia del periodo, descrito previamente, aquí solo se formó un grupo con las estaciones E5, E3 y E4 con una disimilitud del 10.52 % y los géneros más abundantes compartidos fueron Macrelmis, Microcylloepus y Psephenus; el oxígeno disuelto fue muy similar en estas estaciones, además de tener sustratos como piedras, hojarasca, macrófitas y troncos que ayudan al establecimiento de las larvas tanto de Elmidae como de Psephenidae [9] y que la vegetación riparia no ha estado tan afectada por las actividades antrópicas (turismo, construcciones y presencia de cultivos). En estas estaciones se evidencia el rol de esta vegetación, al contribuir a la generación de ambientes propicios para el desarrollo de las larvas [36].
El análisis de redundancia (RDA) mostró que la temperatura fue una variable determinante en la composición de la fauna Coleóptera en el caño Quenane-Quenanito a diferencia del estudio de [34] en el cual la temperatura fue una variable con poca significancia estadística. Sin embargo, ningún género se correlacionó de manera específica con esta variable. Así, sólo la estación E6AB (estación con mayor temperatura registrada) se relacionó positivamente con esta variable, mientras que E1AB se correlacionó negativamente, pues aquí se registró la temperatura más baja (23.7°). También se evidenció que los géneros Phanoceroides y Psephenus se asociaron con las estaciones E4TAB, E5TAB y E4AB, las cuales se caracterizaron por tener una temperatura similar (26-27ºC) y tener influencia de actividades antrópicas como el vertimiento de desechos domésticos y los cultivos de arroz y cítricos [35]. En cuanto a los demás géneros y estaciones no se evidenció ninguna relación con la variable temperatura ya que muchas de estas larvas soportan amplios rangos de temperatura [34].
El análisis NDMS reflejó diferencias significativas del ensamblaje de coleópteros entre los dos periodos hidrológicos (TAB y AB), pues tuvieron un agrupamiento por separado lo que permite inferir que la precipitación influye en el establecimiento del ensamblaje de coleópteros, ya que al haber una mayor corriente en el periodo TAB hay mayor disponibilidad de oxígeno lo cual es propicio para el desarrollo de las larvas de coleópteros ya que prefieren aguas bien oxigenadas [17], [9].
V. Conclusiones
La familia Elmidae fue la más representativa de todo el estudio, siendo Macrelmis el género con mayor abundancia en ambos periodos hidrológicos, como se ha reportado en diferentes estudios sobre coleópteros, convirtiéndose así en parte importante del ensamblaje de coleópteros en el caño Quenane-Quenanito.
Se evidenció que la precipitación juega un papel importante en la riqueza de coleópteros a lo largo del caño Quenane-Quenanito, pues este tipo de factor influye positivamente en las concentraciones altas de oxígeno disuelto lo que permite el desarrollo de las larvas de coleópteros.
De las variables fisicoquímicas evaluadas sólo la temperatura fue significativamente importante para el ensamblaje de coleópteros en el caño Quenane-Quenanito, y solo la estación E6AB se correlacionó positivamente con esta variable. Sin embargo, los géneros registrados en este estudio no se correlacionaron de forma clara con esta variable.
De las perturbaciones antrópicas registradas en el caño Quenane-Quenanito se pudo establecer que ninguna afectó significativamente el ensamblaje de coleópteros. Sólo en la estación E1 hubo pocos registros de larvas, lo que posiblemente se debe a los bajos niveles de oxígeno allí registrados. En la parte media y baja del caño Quenane-Quenanito la actividad doméstica, turística y agrícola no influyó drásticamente en la riqueza y abundancia de coleópteros, pues se pudieron establecer a lo largo de todas las estaciones muestreadas, beneficiándose de los buenos niveles de oxígeno disuelto del agua y la oferta de distintos tipos de sustratos (piedras, hojarasca, macrófitas y trocos) que son propicios para el desarrollo de las larvas de coleópteros.