Introducción
El cáncer de ovario es una de las principales causas de muerte por cáncer a nivel mundial; es el séptimo diagnóstico de cáncer más común en mujeres, con 313.959 casos nuevos diagnosticados en 2020 y 207.252 muertes en el mismo año, siendo el tumor maligno más letal del tracto genital femenino 1,2. En Colombia, en el año 2020 se diagnosticaron 2.391 casos y murieron 1.485 mujeres por esta condición 3.
El cáncer de ovario se diagnostica principalmente en estadios avanzados, con un 70 % de los casos debutando en estadios IIIC/IV según la Fédération Internationale de Gynécologie et d’Obstétrique (FIGO, por sus siglas en francés) 4,5. La supervivencia depende de la carga tumoral residual al final de la cirugía y de la respuesta a la quimioterapia; las tasas de supervivencia global a cinco años varían entre el 8-39 % para pacientes con citorreducción subóptima y óptima 6.
La cirugía citorreductora es el estándar de tratamiento y dentro de las maniobras quirúrgicas se incluyen la inspección minuciosa de todos los órganos intraabdominales y superficies peritoneales, haciendo énfasis en el hígado, el diafragma, el epiplón y el peritoneo parietal; también es esencial realizar un lavado peritoneal con toma de muestra de líquido para citología y biopsia de implantes peritoneales si se identifican 7. El objetivo es lograr una citorreducción óptima 8,9, por lo que es posible que se utilicen procedimientos quirúrgico más extensos como resección diafragmática, esplenectomía, pancreatectomía distal, resecciones hepáticas y otros procedimientos que aumentan la complejidad quirúrgica, como la resección intestinal o la creación de ostomías, con aumento del riesgo perioperatorio y la morbimortalidad 10,11.
El procedimiento extenso más frecuentemente realizado es la resección colorrectal, incluso después de la quimioterapia neoadyuvante (NACT, por sus siglas en inglés) 12, con el riesgo de fuga de la anastomosis y aumento de la mortalidad 13. Para evitar este desenlace se ha propuesto el uso de la ileostomía de protección o de la ileostomía fantasma. El objetivo de esta revisión narrativa fue presentar las principales indicaciones y desenlaces del uso de la ileostomía derivativa en pacientes con cáncer de ovario llevadas a cirugía.
Métodos
Se realizó una revisión narrativa a partir de la base de datos PubMed vía Medline, utilizando los términos MeSH: “ileostomy”, “ovarian neoplasms”, “surgical anastomosis” y “diverting ileostomy”. Se revisaron todos los títulos en inglés, sin importar el rango de fecha, y se incluyeron los estudios que evaluaran el uso de la ileostomía derivativa en pacientes con cáncer de ovario. Se obtuvieron 16 resultados, de los cuales se seleccionaron 12 estudios para la revisión de la literatura. Se realizó un resumen narrativo de los hallazgos.
Discusión
La ileostomía de derivación es un procedimiento de protección que busca disminuir los efectos adversos de una probable fuga anastomótica en pacientes con cáncer de ovario llevadas a cirugía citorreductora con resección de recto o exenteración pélvica posterior, seguida de una anastomosis colorrectal termino-terminal 14,15.
La principal preocupación después de realizar una anastomosis colorrectal sigue siendo la aparición de una fuga anastomótica. Esta complicación se ha reportado en pacientes con cáncer de ovario con una incidencia del 1,2 - 9 % 16,17, y después de una resección anterior de recto puede ser hasta del 2,6 - 26,2 % según otras series 18,19. La presencia de una dehiscencia o fuga de la anastomosis colorrectal se ha asociado con aumento de la morbimortalidad y desenlaces adversos, como aumento en el tiempo de la hospitalización y retraso en el inicio de la quimioterapia 20.
No se encontró información concluyente sobre los factores de riesgo de la fuga anastomótica en citorreducción en cáncer de ovario 14,18,21. Lago V, et al. 22 describieron en un análisis multivariado que la edad en el momento de la cirugía, el nivel de albúmina sérica, una o más resecciones adicionales del intestino delgado, la anastomosis suturada a mano y la distancia de la anastomosis desde el borde anal se asociaron de forma independiente con la fuga anastomótica en pacientes con cáncer de ovario después de exenteración pélvica posterior o resección colorrectal; estos factores de riesgo también se han documentado en otros estudios 14,18.
La ileostomía derivativa ha sido estudiada como un recurso protector para reducir la incidencia y las consecuencias de la dehiscencia y fuga de la anastomosis 23. Se prefiere la ileostomía temporal en asa sobre la colostomía porque es más fácil de manejar y es menos probable que se prolapse 24, sin embargo, este procedimiento se relaciona con una tasa importante de morbilidad como deshidratación, desnutrición e insuficiencia renal por alto gasto, complicaciones relacionadas con prolapso y estenosis. La reversión de la ostomía también se relaciona con complicaciones tales como infección de la herida, prolapso o eventración 25,26. La ileostomía de derivación puede impactar en la autoimagen y se ha asociado con efectos psicológicos significativos y una reducción en la calidad de vida 27. Existe evidencia limitada con respecto al uso de la ileostomía de derivación en el tratamiento del cáncer de ovario avanzado, y su uso óptimo aún no se ha establecido por completo.
En la cirugía citorreductora de cáncer de ovario no existe una recomendación definitiva con respecto a qué pacientes se beneficiarían de una ileostomía de derivación y esta decisión se basa en la preferencia de los grupos multidisciplinarios y en los centros de tratamiento integral del cáncer de ovario 28. En pacientes que se sometieron a cirugía citorreductora por cáncer de ovario, la ileostomía mostró una baja incidencia de morbilidad asociada con altas tasas de reversión sin comprometer los resultados oncológicos 16,28, no obstante, no existen estudios prospectivos ni ensayos clínicos que establezcan una indicación sólida en este grupo de pacientes.
Se han descrito tres enfoques posibles después de realizar una anastomosis colorrectal:
• Ileostomía de derivación en asa.
• Ileostomía fantasma.
• Manejo conservador.
Ileostomía en asa
Durante el procedimiento quirúrgico se debe elegir un asa de íleon, asegurándose de que no habrá tensión en la anastomosis o en la propia asa. El área distal se marca con una sutura y se abre una ventana avascular en el mesenterio en el vértice del asa. El sitio del estoma se selecciona cuidadosamente, preferiblemente sobre cualquiera de los montículos del recto infraumbilical, y se extirpa un disco de piel y grasa subcutánea. Se realiza una incisión cruzada en la vaina del recto anterior, se secciona longitudinalmente el músculo recto y se abre el peritoneo. Se retira el asa a través de su incisión, se pasa la varilla a través de la ventana mesentérica y con suturas no absorbibles se fija por ambos lados a la vaina del recto.
Una vez que la herida principal de la laparotomía ha sido cerrada y sellada, el borde anti mesentérico distal se divide, cerca del borde de la piel, alrededor de dos tercios de su circunferencia. El pico se forma evertiendo el extremo proximal sobre un par de pinzas de tejido. Se insertan suturas finas en la unión mucocutánea, que permiten mantener su forma asemejándose a una ileostomía terminal una vez construido el pico 29 (Figura 1).
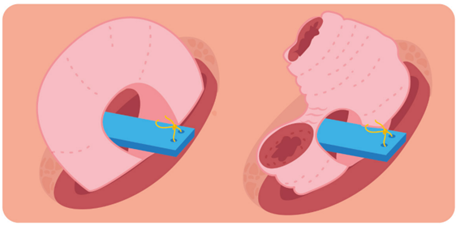
Figura 1. Técnica de construcción de una ileostomía en asa utilizando un puente absorbible subcutáneo que se pasa a través de la ventana mesentérica y se sutura a ambos lados de la vaina del recto.
Tseng JH, et al. 16 evaluaron el uso y los desenlaces de la ileostomía de derivación en pacientes con cáncer de ovario en estadios avanzados, llevadas a citorreducción con realización de resecciones intestinales, encontrando que el 13 % de estas pacientes requirió una ileostomía en asa y la tasa de dehiscencia de la anastomosis fue del 6 %. Al comparar entre las pacientes que recibieron o no ileostomía de derivación no hubo diferencias significativas en complicaciones mayores (30 % vs. 23 %; p=0,41), tasa de fuga anastomótica (5 % vs. 7 %; p=0,60), duración de la estancia hospitalaria (10 vs. 9 días; p=0,25), tasa de readmisión (23 % vs. 17 %; p=0,33) o intervalo hasta el inicio de la quimioterapia adyuvante (41 vs. 40 días, p=0,20). En conclusión, en este estudio, la ileostomía de protección no parece comprometer los resultados posoperatorios.
Ileostomía fantasma
La ileostomía fantasma se realiza con el objetivo de evitar la morbilidad asociada con la creación de un estoma y minimizar el impacto clínico de una ileostomía real 30. La técnica quirúrgica descrita por Lago V, et al. 31 se realiza después de la anastomosis colorrectal; se identifica una porción de íleon terminal a 20 cm de distancia de la válvula ileocecal y se realiza un pequeño orificio en el borde mesentérico para pasar un asa vascular. La porción aferente del íleon terminal se marca con una puntada larga y la eferente con una corta. El asa se coloca a modo de drenaje quirúrgico percutáneo en el teórico sitio del estoma, marcado el día anterior (Figura 2).
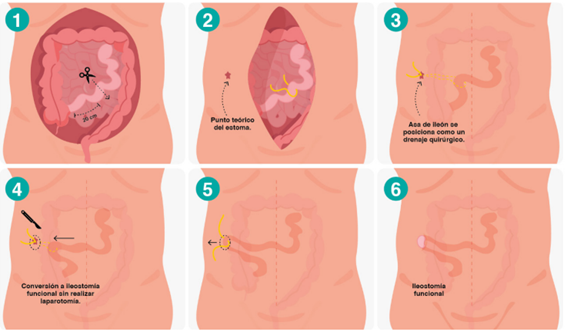
Figura 2. Ileostomía fantasma. (1) Se identifica una porción de íleon terminal (20 cm) distante de la válvula ileocecal. (2) Se diseca un pequeño orificio en el borde mesentérico para pasar un asa vascular. (3) El asa se coloca como un drenaje quirúrgico percutáneo en el punto del estoma teórico. (4) En caso de sospecha clínica de fuga, la ileostomía fantasma se convierte en una ileostomía derivativa. (5) En caso de hallazgos de fuga en la rectoscopia, se exterioriza el asa intestinal. (6) Se realiza una ileostomía de derivación sin relaparotomía.
Algunos autores informan que el control postoperatorio estricto mediante la titulación de proteína C reactiva (PCR), procalcitonina y la rectoscopia, permiten un diagnóstico temprano y subclínico de fugas anastomótica en pacientes con ileostomía fantasma 32, caso en el que se puede convertir esta ileostomía fantasma en una de derivación, ya que solo se requiere la extracción del asa. Los niveles séricos de PCR y de procalcitonina se deben medir al primer y tercer día postoperatorio, y en caso de aumento en sus valores, la ileostomía fantasma se debe convierte en una ileostomía disfuncional.
Otra forma de obtener el diagnóstico de una fuga anastomótica subclínica consiste en realizar una rectoscopia postoperatoria secuencial con baja presión, entre el tercer y séptimo día postoperatorio, para verificar el estado de la anastomosis; si se encuentra una fuga anastomótica durante la rectoscopia, con o sin confirmación en una tomografía computarizada, la ileostomía fantasma debe ser convertida en una ileostomía de derivación. Si en la rectoscopia no se encuentra fuga, se puede iniciar la vía oral y dos semanas después del egreso y de forma ambulatoria el asa se libera de la pared abdominal 23,31.
La ileostomía fantasma evita las desventajas asociadas con la ileostomía como son la deshidratación, la desnutrición, la insuficiencia renal, el prolapso o la estenosis. Además, parece ser una técnica reproducible, segura y de bajo costo 33. Esta técnica también evitaría el impacto en la autoimagen y la calidad de vida asociada con el estoma.
Manejo conservador
Esta conducta poco descrita en la literatura y denominada en inglés “wait and see” (espera y verás), consiste en colocar un drenaje en la pelvis después de la anastomosis colorrectal, seguido del cierre de la pared abdominal, sin creación de estoma. El diagnóstico de fuga anastomótica se realiza con base en la presencia de síntomas como fiebre, salida de material por el dren, la herida o flujo vaginal, y los resultados de los análisis de sangre, con elevación de la PCR, procalcitonina o leucocitosis, asociada con cualquier defecto en la integridad de la anastomosis colorrectal 34.
En un estudio se comparó el uso de manejo conservador, ileostomía derivativa e ileostomía fantasma en pacientes con cáncer de ovario avanzado (estadios II-IV) llevadas a manejo quirúrgico con resección colorrectal y anastomosis, sin encontrar diferencias con respecto a los factores relacionados con la fuga de la anastomosis o la tasa de fuga anastomótica entre los tres grupos, que ocurrió en un 5,6 % de las pacientes con manejo conservador, un 5,3 % en el grupo de ileostomía de derivación y 4,8 % en el grupo de ileostomía fantasma (p=0,98). Dos pacientes murieron debido a la fuga anastomótica en el grupo con manejo conservador y no hubo muertes los otros dos grupos 34.
Complicaciones
La morbilidad intraoperatoria que resulta de la formación de una ileostomía es baja, sin embargo, las complicaciones posoperatorias que ocurren por los cambios fisiológicos dados por la menor absorción de agua y el tiempo de tránsito intestinal más corto son relativamente frecuentes 26,35.
La mayoría de los estudios de complicaciones del uso de ileostomía derivativa de protección en resecciones intestinales provienen de servicios de cirugía colorrectal. Messaris E, et al. 35 encontraron que la tasa de readmisión a los 60 días, en pacientes llevados a ileostomías de derivación en asa después de resecciones colorrectales fue del 16,9 %, siendo la principal causa la deshidratación (43,1 %). Otras causas de readmisión incluyeron infección (25,5 %), obstrucción intestinal (20,6 %) y sangrado (2,9 %). Paquette IM, et al. 36 evaluaron la tasa de readmisión por deshidratación o falla renal en pacientes que se sometieron a ileostomías de protección después de una resección intestinal, el porcentaje de readmisión fue del 17 % y el factor más frecuentemente asociado fue la edad (mayor de 50 años).
Estudios más recientes comparan diferentes formas de ostomías para proteger resecciones intestinales. Yang YW, et al. 37 evaluaron las complicaciones presentadas con la ileostomía y la colostomía en pacientes llevados a resecciones bajas de recto, encontrando que la ileostomía de protección tuvo mayor producción del estoma en comparación con la colostomía de protección (11,1 % vs. 0 %, p<0,001). Así mismo, la colostomía de protección resultó en una mayor retracción del estoma que la ileostomía protectora (21,6 % frente a 9,4 %, p=0,001).
La frecuencia de readmisión hospitalaria después de realizar una ileostomía de protección es un marcador importante de la calidad quirúrgica y, además, permite evaluar las causas de las complicaciones más importantes de la realización de ostomías 38,39. Glasgow MA, et al. 25 evaluaron la tasa y los motivos de reingreso hospitalario dentro de los 30 días posteriores a la creación de la ileostomía en pacientes con cáncer ginecológico; en este estudio retrospectivo de un solo centro la mayoría de las pacientes tenían cáncer de ovario (86,5 %). Las indicaciones para la ileostomía incluyeron obstrucción intestinal (45,3 %), citorreducción primaria (18,9 %) y tratamiento de una fuga anastomótica (15,1 %). La tasa de reingreso a los 30 días fue del 34 % y las causas más frecuentes de reingreso fueron deshidratación (38,9 %) e insuficiencia renal aguda (33,3 %). Las pacientes readmitidas tenían una tendencia hacia una supervivencia global más corta (0,41 años frente a 1,67 años, p=0,061).
En el trabajo de Lago V, et al. 22, que comparó tres enfoques de manejo, se encontró un mayor porcentaje de complicaciones en el grupo de paciente tratadas con ileostomía de derivación (78,9 %) en comparación con el grupo de ileostomía fantasma (7,1 %; p<0,01). Cuatro pacientes (21,1 %) desarrollaron deshidratación debido a un estoma de alto gasto (más de 1500 ml/día), que provocó un desequilibrio electrolítico en el grupo de ileostomía de derivación y en una paciente (2,4 %) en el grupo de ileostomía fantasma (p=0,03). La tasa de reversión del estoma fue del 73,7 % para el grupo de ileostomía de derivación y del 100 % para el grupo de ileostomía fantasma.
Desenlaces oncológicos
La prevención de una fuga anastomótica en paciente con cáncer de ovario llevadas a cirugía citorreductora tiene un impacto en la supervivencia global (SG). Koscielny A, et al. 40 analizaron de forma retrospectiva la fuga anastomótica y las tasas de supervivencia de pacientes con cáncer de ovario en estadios avanzados llevadas a cirugía citorreductora y en quienes se realizaron resecciones intestinales; el 13,9 % de las pacientes presentó dehiscencia de la anastomosis y la mortalidad a los 30 días del posoperatorios fue del 0,7 %. De forma interesante, las pacientes con ileostomía derivativa de protección no presentaron fuga de la anastomosis, aunque esto no fue estadísticamente significativo. La tasa de fuga anastomótica fue significativamente diferente en pacientes sin ileostomía en asa de protección según la administración de bevacizumab (13,5 % no recibieron bevacizumab vs. 50,0 % que sí, p=0,007). Los márgenes de resección positivos para el tumor en los segmentos intestinales fueron un factor pronóstico independiente (RR = 6,3; IC95% 3,1-12,9).
Tseng JH, et al. 16 no encontraron diferencias en la mediana de supervivencia libre de progresión (17,9 vs. 18,6 meses; p=0,88) y la supervivencia global (48,7 vs. 63,8 meses; p=0,25) entre los grupos de pacientes con cáncer de ovario en estadios avanzados llevadas o no a ileostomía derivativa después de anastomosis intestinales.
Conclusiones
La ileostomía en asa de derivación es un procedimiento quirúrgico que se puede utilizar para el tratamiento de las neoplasias malignas ginecológicas, en especial, para el tratamiento del cáncer de ovario. Las principales indicaciones de esta técnica son proteger una anastomosis distal tras una resección intestinal, en caso de fuga anastomótica si no se ha realizado una ostomía previa, o en pacientes con obstrucción intestinal por compresión o infiltración tumoral. Los ginecólogos oncólogos y los cirujanos generales oncólogos deben estar familiarizados con esta técnica quirúrgica, conocer las complicaciones y también la reversión de la ileostomía.















