Introducción
Más del 90% de los pacientes con tumor germinal testicular seminomatoso (TGTS) avanzado tienen res puesta completa o parcial a la quimioterapia (QT) (1. En presencia de masa residual retroperitoneal post-QT es frecuente encontrar fibrosis y necrosis en hasta el 85% de los casos, por lo que es imprescindible seleccionar adecuadamente los pacientes que se beneficiarán de la intervención quirúrgica, dada la alta morbilidad del procedimiento1. El tamaño de la masa residual es un factor determinante, dado que puede predecir la pre sencia de tumor viable, presente en el 15-20% de los casos2,3. En general, se observan las masas residuales retroperitoneales en TGTS cuando son menores de 3 cm; sin embargo, cuando son de 3 cm o mayores deben recibir tratamiento activo como radioterapia o manejo quirúrgico con linfadenectomía retroperitoneal (LRP) (2. Hasta el momento la única indicación por la guía europea de urología para realizar PET/CT-FDG (tomografía por emisión de positrones/tomografía computarizada con fluorodesoxiglucosa) en masas testiculares es en paciente con seminoma y masa residual post-QT mayor a 3 cm, para evaluar la presencia de tumor viable con un valor predictivo negativo (VPN) y positivo (VPP) del 96 y 100% respectivamente4,5. Nuestro objetivo es describir las características clínicas y patológicas de los pacientes con TGTS con masa residual post-QT con marcadores tumorales negativos llevados a LRP en nuestra institución.
Método
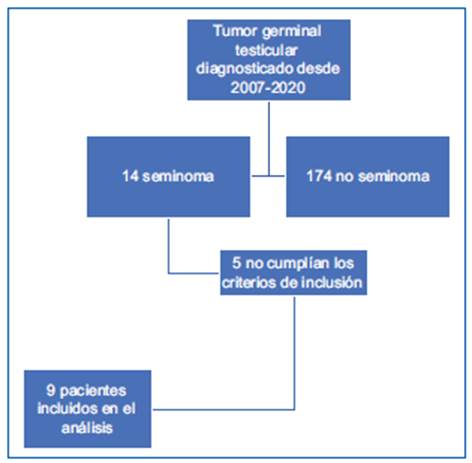
Se realizó una búsqueda de las historias clínicas de los pacientes con tumor germinal testicular y con masa residual post-QT en el periodo 2007-2021. Se identifi caron un total de 188 pacientes con tumor testicular germinal con masa residual post-QT. Se excluyeron los pacientes con tumor germinal tipo no seminoma, iden tificando 14 pacientes con seminoma puro. Se incluye ron pacientes con tumor germinal seminomatoso estadio II o III, con masa residual post-QT mayor de 3 cm y marcadores post-QT negativos. Nueve pacien tes cumplieron con los criterios de inclusión y se inclu yeron en el análisis de datos (Fig. 1).
Resultados
Nueve pacientes cumplieron con los criterios de inclusión. Según la estadificación TNM, seis pacientes eran pT1, mientras que tres pacientes (33,3%) eran N2 y N3, respectivamente. La mayoría de los pacien tes, cinco en total, tenían un estadio clínico IIC, y todos los pacientes se clasificaron como riesgo bueno según la clasificación del International Germ Cell Cancer Collaborative Group (IGCCCG) (Tabla 1).
Tabla 1 Características demográficas
| Características demográficas | n = 9 |
|---|---|
| Variable | Valor |
| Edad, mediana (IQR) | 27 (23-30) |
| Seguimiento, mediana (IQR) | 27,5 (18,7-55,5) |
| pT, n (%) | |
| Pt1 | 6 (66,6%) |
| pT2 | 2 (22,2%) |
| cN, n (%) | |
| Nx | 1 (11,1%) |
| N1 | 1 (11,1%) |
| N2 | 3 (33,3%) |
| N3 | 3 (33,3%) |
| cM, n (%) | |
| Mx | 2 (22,2%) |
| M0 | 7 (77,8%) |
| Estadio S, n (%) | |
| Sx | 2 (22,3%) |
| S0 | 4 (44,4%) |
| S1 | 3 (33,3%) |
| Estadio clínico, n (%) | |
| IIB | 4 (44,4%) |
| IIC | 5 (55,5%) |
| Riesgo IGCCCG, n (%) | |
| Bueno | 9 (100%) |
| Tamaño masa pre-QT, mediana (IQR) | 54 (36-66) |
| QT primaria, n (%) | |
| BEP | 8 (88,8%) |
| EP | 1 (11,1%) |
| Tamaño masa post-QT, mediana (IQR) | 30 (14-71,5) |
BEP: bleomicina, cisplatino, etoposido; EP: etoposido y cisplatino;
IGCCCG: International Germ Cell Cancer Collaborative Group;
IQR: rango intercuartílico; QT: quimioterapia.
La mediana del tamaño de la masa residual post-QT era de 30 mm. Tres pacientes se sometieron a LRP, cinco pacientes fueron observados y solo uno recibió QT. Solo en dos pacientes llevados a LRP se logró una resección completa de la masa y se encontró tumor viable en el 66,6% de los pacientes llevados a LRP (Tabla 2).
Tabla 2 Características tratamiento masa residual
| Variable | Valor |
|---|---|
| Tratamiento, n (%) Observación LRP Quimio | 5 (55,5%) 3 (33,3%) 1 (11,1) |
| Resección n, (%) Completa Incompleta | 2 (66,6%) 1 (33,4%) |
| Resultado patología, n (%) Seminoma+teratoma Fibrosis | 2 (66,6%) 1 (33,3%) |
LRP: linfadenectomía retroperitoneal.
En total fueron 188 pacientes intervenidos quirúrgi camente, de los cuales 14 tenían seminoma en la pato logía. De ellos, cinco pacientes no cumplieron los criterios de inclusión, por ausencia de historia clínica completa y no continuación del tratamiento, por lo que solo nueve pacientes se incluyeron en el estudio.
En nuestra serie de casos, el 88,9% de los pacientes estaban libres de enfermedad durante el seguimiento, un paciente falleció debido a que no fue posible extir par la masa retroperitoneal por completo, con reporte en la patología de tumor viable (Tabla 3).
Tabla 3 Desenlace
| Variable | Valor |
|---|---|
| Progresión, n (%) No Sí | 8 (88,9%) 1 (11,1%) |
| Muerte, n (%) No Sí | 8 (88,9%) 1 (11,1%) |
De los pacientes incluidos en el análisis, cinco fueron estadificados con PET-FDG, con una mediana de 150 días desde la evidencia de recaída a la realización del estudio. Dos pacientes tuvieron un resultado de PET-FDG positivo, de estos, un paciente recibió QT y el otro fue llevado a LRP, donde el resultado de la patología fue fibrosis.
Discusión
Aproximadamente el 60-80% de los pacientes con TGTS estadios II y III tendrán masa residual posterior al tratamiento con QT6. El tratamiento de estos pacien tes es controversial, y a la vez un tema de interés público, debido al aumento de su incidencia en varios países y los efectos adversos relacionados con sus tratamientos7-9.
Los TGTS tienen mayor desmoplasia, especialmente posterior a la QT en comparación con los tumores ger minales no seminomatosos. Las masas residuales en TGTS están íntimamente relacionadas con grandes vasos, y muchas veces no hay plano de clivaje para realizar una disección adecuada, por lo que represen tan un gran reto quirúrgico, requiriendo cirugías adicio nales en el 40% de los casos6,10,11.
Her et al. (12 realizaron un estudio de 55 pacientes candi datos a cirugía con masa residual en seminoma avanzado. El 58% de los pacientes fueron llevados a LRP y el 42% a biopsia de la masa. De los pacientes incluidos, 27 tenían una masa mayor o igual a 3 cm, donde encontraron que el 30% de estos pacientes tenían tumor residual (6 pacientes seminoma y 2 pacientes teratoma), mientras que en los pacientes con masas menores de 3 cm el 100% tenían necrosis en el resul tado de la patología12. En nuestro estudio más de la mitad de los pacientes (66,6%) con masas mayores o iguales a 3 cm tenían tumor viable, encontrando tanto teratoma como seminoma en la patología.
En un estudio realizado por Motzer et al. (2, donde incluyeron a 23 pacientes con seminoma y masa resi dual post-QT, 19 pacientes fueron llevados a biopsia o LRP, encontrando que el 42% de los pacientes tenían tumor viable2. En este estudio solo un paciente con seminoma progresó, comparable con nuestra serie de casos, donde un paciente con seminoma y teratoma en la masa residual progresó.
En aproximadamente el 80% de los casos se encon trará fibrosis en la masa residual y solo el 20% de los pacientes tendrán masa residual con tumor viable6, en los últimos años se ha evaluado la posibilidad de caracterizar mediante otros medios diagnósticos qué pacientes con masa residual se benefician de interven ción quirúrgica.
Recientemente las guías europeas de urología incor poraron la indicación de realizar PET-FDG en pacien tes con TGTS y masa residual mayor a 3 cm, ya que tiene un alto VPN y positivo VPP, permitiendo seleccio nar adecuadamente a los pacientes candidatos a LRP y así evitar la morbimortalidad asociada al procedi miento en los casos que se pueden favorecer de observación4,5.
El estudio SEMPET describió la importancia del uso de la PET-FDG en 51 pacientes con TGTS metastásicos puros con masa residual documentadas en tomografía computarizada; 19 tenían lesiones residuales mayores de 3 cm y 35 (95%) tenían una masa residual menor o igual a 3 cm. Documentaron una especificidad (E) y sensibilidad (S) del 100 y 80%, respectivamente; con un VPP y VPN del 100 y 96%, respectivamente. Comparado con la tomografía computarizada, la cual tiene E del 74%, S del 70%, VPP del 37% y VPN del 92%, respectivamente. De Santis et al. concluyeron con el estudio que la PET-FDG es el mejor predictor de tumores residuales viables en pacientes con TGTS que han recibido tratamiento con QT10.
Cathomas et al. (4 analizaron los patrones de trata miento y desenlaces de los pacientes con PET-FDG y masa residual en seminoma, incluyendo 90 pacientes en total. El 29% de los pacientes recibieron interven ción quirúrgica, encontrando en el 81 y 17% necrosis y seminoma respectivamente, con un valor predictivo positivo del 23%4. En nuestro estudio solo cinco pacientes fueron analizados con PET-FDG, donde uno de ellos tuvo resultado positivo en la PET y fue intervenido quirúrgicamente con LRP, con evidencia de necrosis en el resultado de la patología.
Desde entonces, varios investigadores han evaluado el uso de la PET-FDG como herramienta guía para la elección de tratamiento en dichos pacientes. Sin embargo, consideramos que la investigación y aplica ción de este método diagnóstico tiene ciertas limitacio nes en el mundo real, dada la pobre disponibilidad, que limita la aplicabilidad en entornos de bajos recursos6,7,11. Será necesario realizar estudios multicéntricos prospectivos, con el fin de aumentar el número de casos y evaluar el pronóstico a largo plazo.
Este estudio presenta múltiples limitaciones. En pri mer lugar, su naturaleza retrospectiva; en segundo lugar, la cantidad de pacientes evaluados, y por último hay que tener en cuenta la disponibilidad del recurso de la PET-FDG en países en vías de desarrollo como Colombia es limitado, por lo que puede retrasar el ini cio de un tratamiento oportuno.
Conclusión
Los pacientes con TGTS con masa residual tumoral post-QT mayor o igual a 3 cm deberían recibir algún tipo de tratamiento activo. La presencia de tumor viable en la masa residual es predictora de peor pronóstico y desenlaces fatales. En nuestra experiencia la LRP es viable en este tipo de pacientes, logrando la resección completa en la mayoría de los casos, en caso de no lograr una resección completa es imprescindible ofrecer tratamientos adicionales. La PET-FDG es una herra mienta diagnóstica que se debe realizar a los pacientes con seminoma y masa residual, ya que tiene un alto valor predictivo negativo, ayudando a seleccionar ade cuadamente los pacientes candidatos a LRP y así evitar la morbimortalidad asociada al procedimiento en los casos que se pueden favorecer de observación.