Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Colombiana de Ciencias Químico - Farmacéuticas
Print version ISSN 0034-7418
Rev. colomb. cienc. quim. farm. vol.45 no.1 Bogotá Jan./Apr. 2016
https://doi.org/10.15446/rcciquifa.v45n1.58026
DOI: http://dx.doi.org/10.15446/rcciquifa.v45n1.58026
Nanopartículas lipídicas a base de propóleos como transportadores de activos de interés cosmético: Desarrollo, caracterización y evaluación de seguridad
Propolis based lipid nanoparticles as carriers of cosmetic actives: Development, characterization and safety evaluation
Yuly X. Correa González1, Daniela Paillié Jiménez1, Alba L. Valenzuela Correa2, Maritza A. Rojas Cardozo3, Claudia E. Mora Huertas1*
1 Universidad Nacional de Colombia, Sede Bogotá, Facultad de Ciencias, Departamento de Farmacia, Grupo de investigación en Desarrollo y Calidad de Productos Farmacéuticos y Cosméticos, Ciudad Universitaria, Carrera 30 N. o 45-03, edificio 450, código postal 111321, Bogotá D.C., Colombia.
2 Centro de Innovación y Desarrollo Tecnológico de Belcorp, Tocancipá, Colombia.
3 Universidad Nacional de Colombia, Sede Bogotá, Facultad de Ciencias, Departamento de Farmacia, Grupo de Investigación en Fitoquímica y Farmacognosia UN (GIFFUN), Ciudad Universitaria, Carrera 30 N. o 45-03, edificio 450, código postal 111321, Bogotá D. C., Colombia.
* Correo electrónico: cemorah@unal.edu.co, tel.: +5713165000 ext.14625; fax: +5713165060
Recibido para evaluación: 21 de diciembre de 2015. Aceptado para publicación: 24 de febrero de 2016.
Resumen
En el ámbito cosmético, la tecnología a escala nanométrica resulta atractiva para el diseño de productos novedosos y funcionales. Así, para el caso de las nanopartículas lipídicas, se ha demostrado su capacidad para incrementar la estabilidad de moléculas activas y modificar su liberación. Como un aporte en la búsqueda de alternativas innovadoras para la preparación de este tipo de transportadores (carriers), el presente trabajo propone el aprovechamiento de las ceras provenientes de propóleos para la preparación de partículas lipídicas conteniendo extracto del árbol de té. Las partículas obtenidas presentan tamaños cercanos a 200 nm con polidispersidades inferiores a 0,1. Los valores de potencial zeta cercanos a cero sugieren un mecanismo de estabilización del sistema particulado vía efecto estérico. De otro lado, la incorporación del activo dentro de la estructura de las partículas es confirmada por DSC. En conjunto, los resultados evidencian la posibilidad de generar valor agregado a un producto de la colmena reconocido y valorado por sus propiedades biológicas. Además, ofrecen un material de partida que constituye una alternativa interesante para el desarrollo de productos cosméticos novedosos en los que podrían incorporarse moléculas activas.
Palabras claves: Emulsificación-difusión, nanopartículas sólidas lipídicas, propóleos, aceite del árbol de té.
Summary
In the cosmetic field, the technology at the nanometric scale is attractive for designing novel and functional products. In the case of lipid nanoparticles, the ability of these carriers for increasing the stability of active molecules and modifying their release has been demonstrated. As a contribution in the research of innovative alternatives for preparing these particles, this work proposes the use of the propolis waxes as starting material. In this way, lipid nanoparticles containing tea tree oil were prepared having particle sizes close to 200 nm with polydispersity indexes less than 0.1. The zeta potential values near to zero suggest the stabilization of the lipid nanoparticles via steric mechanisms. The incorporation of the active into the nanoparticle structure is confirmed by DSC. As a whole, the results are appealing in order to give added value to beehive product, recognized in Latin America for its biological properties. Furthermore, these results offer a new alternative of lipid material which is interesting for developing pioneering cosmetic products containing active molecules.
Keywords: Emulsification-diffusion, Solid lipid nanoparticles, Propolis, Tea tree oil.
Introducción
En el ámbito cosmético, la nanotecnología se ha convertido en uno de los ejes de innovación gracias al diseño de materiales a escala nanométrica que aprovechan desde modificaciones físicas, que permiten lograr efectos de color, hasta modificaciones químicas que mejoran la solubilidad de algunos compuestos o disminuyen su reactividad [1, 2]. Dentro de dichos materiales se encuentran las partículas lipídicas, objeto de estudio en la presente investigación, debido a su potencial para la encapsulación de sustancias susceptibles de degradación [3], la liberación controlada de moléculas [4] y la ventaja que ofrecen respecto a la penetración de compuestos activos en el estrato córneo de la piel [5]. Además, por sus propiedades oclusivas contribuyen a la hidratación de la piel [6], y por su tamaño y estructura, podrían emplearse como sistema alternativo de protección UV [7].
Las partículas lipídicas son derivadas de las emulsiones. No obstante, las gotas lipídicas son sólidas a temperatura corporal y, según los materiales de partida, pueden clasificarse como nanopartículas sólidas lipídicas (SLN, por sus siglas en inglés) o como transportadores lipídicos nanoestructurados (NLC, por sus siglas en inglés). Para su preparación se emplean técnicas como la emulsificación–difusión [8] utilizando lípidos sólidos y líquidos, tensioactivos y solventes [9]. Sobre esta base, el presente trabajo busca el aprovechamiento de estos componentes en la preparación de partículas lipídicas considerando que el propóleos contiene sustancias lipídicas (e.g., ceras) y que es catalogado como de uso alimentario y GRAS (Generally Recognized as Safe) [10]. Así, se pretende proponer un nuevo material para ser usado en formulaciones cosméticas y plantear una alternativa novedosa de utilización del propóleos, que genere valor agregado a las ceras que contiene y que son catalogadas como contaminantes que afectan desfavorablemente su calidad.
Metodología
Materiales
El propóleos empleado en la presente investigación fue gentilmente donado por el Jardín Botánico de Medellín, siendo recolectado entre noviembre de 2014 y febrero de 2015 en la ciudad de Medellín (Antioquia, Colombia; 6° 13ʹ 55" 098N, 75° 34ʹ 05" 752W, altitud 1486 m.s.n.m.), en colmenas de abejas sin aguijón de la especie nativa Tetragonisca angustula. También fueron utilizados triglicéridos cáprico/caprílico (CCT, Labrafac Lipophile WL 1349, obsequiado por Gattefossé), aceite del árbol de té (TTO, Melaleuca alternifolia, Lipovol® Tea Tree, obsequiado por Lipo® Colombia Ltda), aceite de ajonjolí calidad farmacéutica, poloxamer 188 (PLX, Kolliphor® P188, Basf; obsequiado por Handler Colombia), alcohol polivinílico (PVA) 31-51 kDa y 87-89% de hidrólisis, adquirido en Sigma-Aldrich, acetato de etilo (AcOEt)(R.A. Tedia®), n-hexano (R.A. J.T. Baker), medio Eagle modificado por Dulbecco (Sigma Aldrich), suero fetal bovino (Eurobia) y penicilina y estreptomicina (Life Sciences). El agua destilada usada en todos los experimentos se obtuvo a partir del sistema Milli-Q.
Métodos
Control de calidad del propóleos, extracción y caracterización del material lipídico extraído
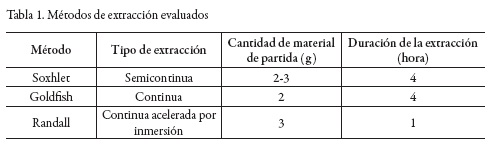
Teniendo en cuenta que en Colombia no se dispone de una normativa para el control de calidad del propóleos, en el presente estudio se estructuró una ficha de control de calidad a partir de las legislaciones argentina [11] y brasilera [12, 13] para establecer los valores de especificación. Los métodos utilizados fueron los oficiales de la Association of Analytical Communities (AOAC, 2012), la farmacopea americana [14] y Standard Methods [15]; así como aquellos reportados en la literatura [16-20]. Para la extracción del material lipídico se investigaron los métodos Soxhlet, Goldfish y Randall (Unidad Extractora de Solventes Ser 148 VelpScientifica); para los dos primeros se usó como disolvente n-hexano, mientras que para la extracción por el método Randall se utilizaron n-hexano y AcOEt (ver tabla 1).El material lipídico extraído fue caracterizado por cromatografía en capa delgada (TLC), espectroscopía infrarroja (IR, IRAffinity-1 FT-IR Shimadzu), calorimetría diferencial de barrido (DSC, DSC 1 STARe System-Mettler Toledo) y difracción de rayos X(XRD, X'PertPRO PANalytical).
Preparación y caracterización de partículas lipídicas empleando material lipídico del propóleos
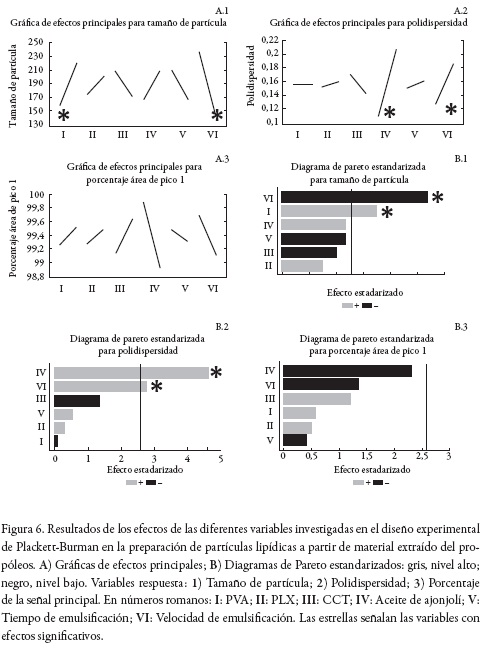
Para la preparación de las partículas lipídicas se utilizó el método de emulsificación-difusión propuesto por Quintanar et al. con algunas modificaciones [8]. En síntesis, se dispersaron 100 mg del material lipídico extraído del propóleos en 10 mL de solvente orgánico (AcOEt) previamente saturado con agua (Ika® C-Mag HS 7; 500 rpm, temperatura ambiente). Dicha dispersión, denominada fase orgánica, se filtró a través de papel de filtro Whatman N. o 3, se adicionó al agente estabilizante previamente disuelto en 40 mL de agua saturada con AcOEt (fase acuosa) y se emulsificó (Ultraturrax® T18 IKA®; 11200 rpm, 5 min). La emulsión obtenida se adicionó bajo agitación (Ika® C-Mag HS 7, 500 rpm) a 250 mL de agua destilada. Las partículas lipídicas se formaron inmediatamente. Finalmente, el AcOEt y parte del agua fueron retirados por evaporación a presión reducida (Heidolph Hei-VAP Precision; 130 rpm, 40º C). Las condiciones más adecuadas para lograr el menor tamaño de partícula, la menor polidispersidad y el mayor porcentaje de área de la señal principal, fueron deducidas por medio de un diseño experimental del tipo Plackett-Burman para 12 experimentos (Statgraphics Centurion V17.1.02), donde se investigaron los efectos a dos niveles del agente estabilizante (PVA o PLX), de otros lípidos adicionados (CCT o aceite de ajonjolí), y del tiempo y la velocidad de emulsificación (ver tabla 2).
Finalmente, las partículas lipídicas obtenidas a partir de las condiciones más adecuadas fueron caracterizadas respecto a su tamaño e índice de polidispersidad por el método de dispersión de luz dinámica (Zetasizer Nano ZS, Malvern®, 5 mediciones por muestra, 5 barridos por medición, con una duración de 10 s por barrido a una temperatura de 25 ºC y un ángulo de 173°). El potencial zeta fue determinado mediante velocimetría Doppler de láser empleando el mismo equipo. Para tal fin, se preparó una dispersión diluida de partículas en NaCl 1 mM, realizando 5 mediciones por muestra, 10 barridos por medición, con una duración de 10 s por barrido, a una temperatura de 25 ºC.
Igualmente, se evaluó la estabilidad a temperatura ambiente (18 ºC ± 3 ºC) y en estufa a 40 ºC ± 1 ºC (Jouan IG150), de la dispersión acuosa de las nanopartículas durante 45 días, haciendo lecturas de tamaño y potencial zeta cada 15 días ± 1 día. Adicionalmente, a través de una metodología modificada a partir del trabajo de Avgoustakis et al. [21], se evalúo la estabilidad coloidal de las partículas lipídicas frente a la presencia de electrolitos. Para este ensayo de agregación inducida con sulfato de sodio, se tomaron 250 μL de dispersión de partículas y se adicionaron sobre 2,5 mL de soluciones de sulfato de sodio de concentraciones diferentes desde 0 M a 1 M, incubadas a 37 ºC en un baño maría bajo agitación constante (100 rpm; plancha de calentamiento Ika® C-Mag HS, 2102). Transcurridos 10 min se determinó visualmente la concentración crítica de coagulación.
Para lograr una aproximación a la composición química de las partículas se identificaron los principales grupos funcionales utilizando TLC y espectroscopía infrarrojo (IR, IRAffinity-1 FT-IR Shimadzu).
Evaluación de la citotoxicidad in vitro de las partículas lipídicas
La citotoxicidad de las dispersiones de partículas preparadas a partir del material extraído del propóleos fue evaluada a través de ensayos in vitro en líneas celulares de fibroblastos y queratinocitos.
Citotoxicidad en fibroblastos 3T3/Balb-c medida a través de la captación del colorante rojo neutro
Se utilizaron células en fase exponencial de crecimiento, cultivadas en el laboratorio y sembradas en placas de 96 pozos en una densidad de 1,5x104 células/pozo, con medio de cultivo suplementado (DMEM, medio Eagle modificado por Dulbecco + 5 % suero fetal bovino y 1 % antibiótico penicilina/estreptomicina). Las células se adhirieron durante 20 h ± 4 h y se reemplazó su medio de cultivo. Posteriormente, se adicionaron los tratamientos de forma directa sobre las células en concentraciones de 2000 ppm a 50 ppm y se incubaron en condiciones estándar de cultivo (37 ºC, 65 % de humedad relativa, 5 % de CO2). Tras 24 h ± 2 h de incubación, las células se observaron por microscopía invertida para evaluar los posibles daños o cambios en la morfología celular. Se retiraron los tratamientos y se adicionó colorante rojo neutro (NR). Las células fueron incubadas nuevamente durante 3 h ± 0,5 h bajo las condiciones previamente expuestas y al cabo de ese tiempo se lavaron, se extrajo el NR de las células tratadas y se cuantificó espectrofotométricamente a 550 nm.
A partir de las absorbancias obtenidas se calculó el porcentaje de supervivencia celular de las células tratadas versus el control de crecimiento (blanco sin tratamiento). Para obtener los valores de las concentraciones efectivas EC90 (relacionada con la potencia de actividad) y EC50 (que define el grado de actividad sobre el sistema celular en estudio) se realizó un análisis de regresión no lineal del porcentaje de supervivencia versus el logaritmo de la concentración en estudio. El grado de irritación se asignó según los criterios presentados en la tabla 3. La máxima dosis tolerada (HTD) es un parámetro determinado a través de observación microscópica, que representa la concentración que causa solamente los mínimos cambios morfológicos comparados con los cultivos control [22–24].
Citotoxicidad en líneas celulares establecidas de queratinocitos epidermales modificados humanos (HaCaT) usando MTT (bromuro de 3 -(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol)
Se emplearon células en fase exponencial de crecimiento, obtenidas de los cultivos cotidianos del laboratorio y sembradas en placas de 96 pozos con una densidad de 5x103 células/pozo, con medio de cultivo suplementado (DMEM, medio Eagle modificado por Dulbecco + 10 % suero fetal bovino y 1 % antibiótico penicilina/estreptomicina). Los tratamientos fueron adicionados directamente sobre las células en concentraciones de 2000 ppm a 50 ppm y se incubaron en condiciones estándar de cultivo. Después de 24 h ± 2 h de incubación los cultivos celulares se observaron por microscopía invertida para evaluar los posibles daños o cambios en la morfología celular. Los tratamientos fueron retirados, se adicionó colorante MTT y las células se incubaron durante 2 h ± 0,5 h, bajo las condiciones previamente expuestas. Se realizó la extracción de los cristales de formazán producidos en isopropanol, y se cuantificaron por espectrofotometría a 575 nm. Para obtener los valores EC90 y EC50, las absorbancias obtenidas se relacionaron con los controles de crecimiento mediante análisis de regresión no lineal en una curva de supervivencia celular en porcentaje versus concentración.
Incorporación de aceite del árbol de té (TTO) en partículas lipídicas a base de material lipídico extraído de propóleos
Utilizando la formulación definida previamente para la preparación de las partículas lipídicas, se investigó su capacidad para incorporar TTO. Para tal fin, se evaluaron diferentes concentraciones de este activo, que se adicionó en la fase orgánica. Las partículas obtenidas fueron caracterizadas como se ha descrito y la presencia de activo fue detectada por TLC usando como fase estacionaria cromatofolios TLC Silica Gel 60 F 254 (Merck Millipore) y confirmada por IR.
Resultados y discusión
Control de calidad del propóleos
El propóleos es una sustancia resinosa natural que las abejas fabrican principalmente a partir de los exudados de plantas, ceras y sustancias propias de su metabolismo con el fin de utilizarlo para construir y proteger la colmena [25–27]. Físicamente, se describe como un material lipofílico y duro que al ser calentado se hace suave, flexible y pegajoso. Tiene un olor característico y su color varía según su origen y antigüedad, desde amarillo o verde, hasta rojo o marrón [28].
Como se observa en la tabla 4, el propóleos empleado en la presente investigación no satisface todos los estándares de calidad definidos por las normativas de referencia. Esto puede ser atribuido a su composición química, que depende de factores como el método de extracción, la época de recolección, la iluminación, la altitud, la especie de abejas, la diversidad vegetal circundante y las actividades paralelas de las zonas vecinas a la colmena [27]. En efecto, las legislaciones en este tema están basadas en el propóleos de cada región y muchos son obtenidos de colmenas de abejas de mayor difusión comercial, como es el caso de Apis mellifera L. [29].
No obstante, para este estudio son de particular interés los resultados obtenidos en los ensayos de componentes solubles en etanol y ceras. Los componentes solubles en etanol corresponden a la cantidad de resinas que recolectan las abejas de varias especies vegetales y que llevan a la colmena para elaborar el propóleos [33]. Así, a mayor contenido de resinas mayor actividad biológica, lo que a la vez guarda relación directa con los ensayos de cantidad de fenoles totales, contenido de flavonoides e índice de oxidación. De acuerdo con esto, al tener componentes solubles en etanol por debajo de la especificación, el propóleos utilizado en esta investigación es limitado respecto al contenido de sustancias activas.
De otro lado, respecto a las ceras, se espera una baja proporción debido a la ausencia de moléculas activas en ellas [20]. En efecto, un elevado contenido de ceras en el propóleos (> 40 %) se considera un criterio para su clasificación como material de baja calidad, lo cual es un inconveniente para la preparación soluciones concentradas de propóleos [34, 35]. Como se observa en la tabla 4, el contenido de tales componentes en el propóleos bajo estudio es bastante elevado. Sin embargo, la presente investigación busca aprovechar esta aparente desventaja para darle un valor agregado y convertirlo en materia prima para la preparación de partículas lipídicas con aplicación en el campo cosmético.
Extracción y caracterización del material lipídico a partir del propóleos
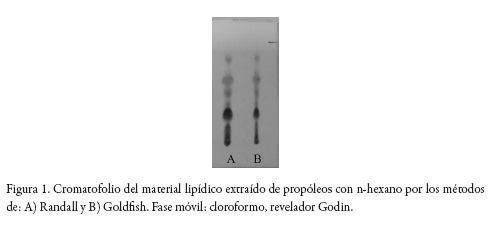
Inicialmente, se investigó la extracción del material lipídico del propóleos empleando diferentes métodos y solventes (n-hexano y AcOEt). Como se observa en la tabla 1, se evaluaron tres métodos de extracción. Sin embargo, el método Soxhlet presentó inconvenientes de orden práctico debido a que el material lipídico se deposita en el brazo del sifón, dificultando la extracción, razón por la cual no fue posible alcanzar un valor confiable en la determinación y se descarta este método para la continuidad del trabajo. De los dos métodos continuos, el de Randall fue seleccionado porque si bien la eficiencia de extracción es algo menor (ver tabla 5), el tiempo de calentamiento del material es inferior al requerido por la técnica de Goldfish, lo que preserva la integridad del extracto. Al caracterizar por TLC los lípidos extraídos (ver figura 1) se detecta la presencia de compuestos de carácter terpénico o fenilpropanoide [36], los que según reportes previos pueden corresponder a monoterpenos que le dan el olor característico [37] y a derivados de los ácidos cinámico, benzoico y fenilpropanoico [38].
Teniendo en cuenta que el método de preparación de las partículas lipídicas usualmente emplea AcOEt como solvente orgánico, se investigó la eficiencia de extracción utilizando este solvente y el método de Randall. Los resultados indican un 63,5 % ± 1,6% de eficiencia de extracción, mayor a la obtenida con n-hexano, donde además de los lípidos, el AcOEt podría extraer una mayor diversidad de componentes del propóleos (ver figura 2).
El material lipídico extraído a partir del propóleos, tanto con n-hexano como con AcOEt, se caracterizó por diferentes técnicas. La figura 3 presenta los resultados del análisis por DSC, observándose durante el calentamiento una señal endotérmica correspondiente a la fusión y durante el enfriamiento la señal exotérmica propia de la cristalización del material. Los rangos de fusión y de cristalización son amplios (ver tabla 6), lo que sugiere una mezcla de sustancias.
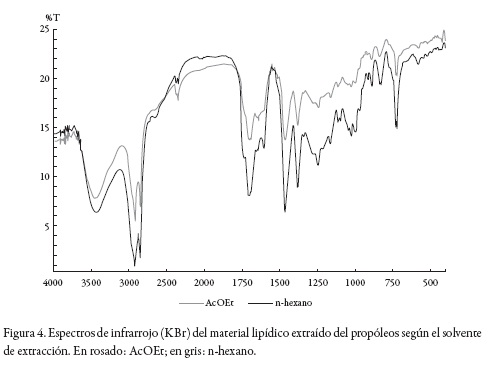
Los resultados de espectroscopía IR (KBr) (ver figura 4) presentan las señales características de la cera de abejas según como lo reportan Birshtein y Tul'chinskii [39]. Así, por ejemplo, existe una señal intensa alrededor de 1710 cm¯1 atribuida a grupos carboxilo no ionizados. La banda ancha entre 3200 cm¯1 y 3450 cm¯1 corresponde a la vibración de estiramiento de los grupos hidroxilo de los alcoholes, y las bandas a 2851 cm¯1 y 2916 cm¯1 se presentan por las vibraciones de estiramiento de enlaces CH, complementado por la señal en 1462 cm¯1 de vibraciones de deformación CH, y en 721 cm¯1 de deformaciones esqueléticas no planares de cadenas largas hidrocarbonadas, tal como se esperaba debido a la presencia de alcanos.
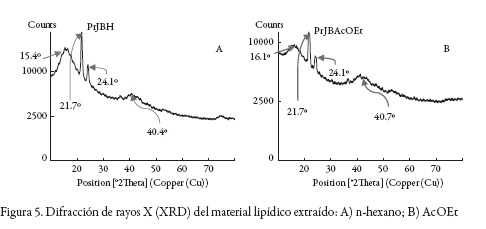
De otro lado, de acuerdo con los resultados de XRD (ver figura 5), el material lipídico extraído del propóleos tiene zonas cristalinas que son similares independientemente del solvente utilizado para la extracción.
Preparación y caracterización de partículas lipídicas a partir del material extraído del propóleos
Utilizando como método de preparación la técnica de emulsificación-difusión se investigaron la formulación y las condiciones de operación más adecuadas para la obtención de partículas lipídicas, a partir del material extraído del propóleos. Con el propósito de favorecer la incorporación de componentes activos, se prefirió la preparación de transportadores lipídicos nanoestructurados (NLC, Nanostructured Lipid Carriers), lo que requiere la inclusión de un lípido líquido en la formulación.
En la figura 6 se presentan los resultados del diseño estadístico de Plackett-Burman a partir de los que se deduce que la velocidad de emulsificación y el agente estabilizante PVA influencian el tamaño de partícula; el aceite de ajonjolí y la velocidad de emulsificación gobiernan la polidispersidad, y ningún factor tiene efecto significativo en la no formación de agregados. La interpretación en conjunto de los resultados obtenidos, en los que se busca el menor tamaño de partícula, la más baja polidispersidad y la menor posibilidad de formación de agregados, sustenta la formulación prototipo y las condiciones de trabajo a utilizar.
En síntesis, las partículas se pueden preparar a partir de 100 mg de material extraído del propóleos, 10 mg de CCT, 10 mL de AcOEt previamente saturado con agua y 40 mL de una fase acuosa previamente saturada en AcOEt que contiene como agentes estabilizantes PLX (0,5 g) y PVA (0,5 g). Como condiciones de emulsificación se prefiere una velocidad de 11200 rpm durante 5 min. Las partículas resultantes tienen un tamaño aproximado de 226 nm ± 7 nm y un índice de polidispersidad inferior a 0,09 ± 0,02. La señal principal de tamaño de partícula corresponde al 100% de la respuesta.
De otro lado, el potencial zeta de las partículas lipídicas preparadas a partir del material extraído de propóleos es menor a ± 2 mV y no es afectado por el pH del medio en el que se realiza la lectura (ver figura 7A). Esto sugiere un mecanismo de estabilización del sistema particulado en el que predomina el efecto estérico. De hecho, se ha reportado que el PLX se adsorbe en la superficie de la partícula considerando la posible afinidad de su bloque central de polioxipropileno con los lípidos. Los bloques hidrofílicos de polioxietileno permanecen en la fase acuosa estabilizando el sistema por repulsión estérica [40]. Por otro lado, considerando el pequeño tamaño de la unidad monomérica del PVA, este podría interactuar con los lípidos ubicándose tanto en la superficie como al interior de las partículas, ejerciendo igualmente un efecto estérico [41]. Para verificar lo anterior, se realizó un ensayo de agregación inducida de las partículas obteniendo una concentración crítica de agregación de 0,7 M de Na2SO4. Una vez agregadas las partículas es imposible su redispersión (ver figura 7B).
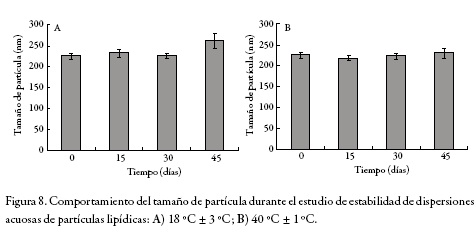
Para verificar que aún con un bajo potencial zeta se garantiza un mínimo de estabilidad de los sistemas lipídicos preparados, las dispersiones de partículas obtenidas, según las condiciones anteriores y utilizando material extraído tanto con AcOEt como con n-hexano, fueron evaluadas respecto a su estabilidad a temperatura de laboratorio y a 40 °C. Como se observa en la figura 8, las variaciones del diámetro hidrodinámico de las partículas en función del tiempo no superan los 30 nm, lo que en la práctica del trabajo con sistemas nanoparticulados no se considera significativo.
Evaluación de las partículas lipídicas respecto a su potencial citotóxico in vitro
La toxicidad de los sistemas nanoparticulados es relevante teniendo en cuenta su potencial aplicación en los campos farmacéutico y cosmético. La mayoría de estudios de viabilidad celular de los nanotransportadores (e.g. NLC) se han desarrollado por el ensayo de MTT [42]. Sin embargo, la técnica que usa NR también es útil, porque se fundamenta en que este colorante penetra con rapidez la membrana celular por difusión no iónica, acumulándose especialmente dentro de los lisosomas. Los cambios celulares ocasionados por los tratamientos hacen que las células pierdan su capacidad de incorporar y unir las moléculas de rojo neutro [43].
En esta investigación se llevaron a cabo pruebas en las líneas celulares de fibroblastos murinos 3T3/Balc-c y queratinocitos epidermales modificados humanos, debido a que son modelos biológicos alternativos válidos para la evaluación de seguridad de productos cosméticos. Los resultados presentados en la tabla 7 evidencian que la muestra evaluada no tiene efecto citotóxico en ninguna de las dos líneas celulares, lo que indica un buen margen preliminar de seguridad para uso en la formulación de productos destinados a aplicación tópica.
Incorporación de aceite del árbol de té en NLC preparados a base de material extraído del propóleos
Con el propósito de verificar la posible aplicación de las partículas lipídicas, obtenidas a partir del propóleos como transportadores de activos de interés cosmético, se investigó la incorporación del TTO, un reconocido agente antifúngico y antibacterial [44]. La encapsulación de este activo se evaluó preliminarmente por TLC (ver figura 9). Los resultados de la observación al ultravioleta, y al revelar con anisaldehído-ácido sulfúrico, detectan la presencia de terpenoides y de propilpropanoides [36], tanto en la composición del propóleos como del TTO. Como se observa, los cromatogramas de las partículas que incorporan aceite son notablemente diferentes a aquellos de las partículas blanco. Sin embargo, por medio de esta técnica no fue posible confirmar la incorporación de TTO debido, posiblemente, a la baja concentración adicionada (máximo 5 mg) y a la similitud en la polaridad de los componentes del aceite y del material lipídico empleado para la preparación de las partículas.
Además, para complementar lo anterior, se llevaron a cabo análisis por espectroscopía de IR a partir de los que se evidencia el atrapamiento del TTO. Como se observa en la figura 10, en el espectro de las partículas se incrementa la intensidad de la señal en 2345 cm¯1, la que es característica del espectro del aceite esencial.
Conclusiones
El material lipídico y otros extractables en AcOEt o n-hexano, presentes en el propóleos, pueden ser utilizados exitosamente en la preparación de NLC y brindan una novedosa alternativa para diseñar sistemas a escala nanométrica de posible aplicación como portadores de ingredientes activos, tales como el TTO. Esto ofrece un impacto positivo tanto para el campo apícola como para el cosmético, al darle valor agregado a este producto de la colmena y al abrir nuevas posibilidades de investigación conducentes al desarrollo de productos cosméticos innovadores.
Agradecimientos
El presente trabajo de investigación fue financiado por la Vicerrectoría de Investigación, Programa Nacional de Semilleros de Investigación, Creación e Innovación de la Universidad Nacional de Colombia 2013–2015, proyecto: Ceras de propóleos como material de partida para la preparación de partículas sólidas lipídicas de interés para las industrias farmacéutica y cosmética. Código 28405. Agradecimientos especiales al Jardín Botánico de Medellín "Joaquín Antonio Uribe" y al Programa Estímulos a la Investigación "Thomas van der Hammen" del Jardín Botánico de Bogotá "José Celestino Mutis".
Conflicto de intereses
Parte de este trabajo fue presentado en el XXII Congreso Latinoamericano de Químicos Cosméticos (COLAMIQC 2015) en la ciudad de Punta del Este (Uruguay), y fue reconocido con el premio "José Joaquín Pérez Villalba", otorgado por la FELASCC al mejor trabajo sobre materias primas naturales de origen latinoamericano de interés en cosméticos.
Referencias
1. M.C. Roco, C.A. Mirkin, M.C. Hersam, Nanotechnology research directions for societal needs in 2020: Summary of international study, J. Nanoparticle Res., 13, 897 (2011). [ Links ]
2. S. Raj, Sh. Jose, U.S. Sumod, M. Sabitha, Nanotechnology in cosmetics: Opportunities and challenges, J. Pharm. Bioallied Sci., 4, 186(2012). [ Links ]
3. D.F. Cortés-Rojas, C.R.F. Souza, W.P. Oliveira, Encapsulation of eugenol rich clove extract in solid lipid carriers, J. Food Eng., 127, 34 (2014). [ Links ]
4. M. Gaumet, A. Vargas, R. Gurny, F. Delie, Nanoparticles for drug delivery: The need for precision in reporting particle size parameters, Eur. J. Pharm. Biopharm., 69, 1 (2008). [ Links ]
5. S. Bose, Y. Du, P. Takhistov, B. Michniak-Kohn, Formulation optimization and topical delivery of quercetin from solid lipid based nanosystems, Int. J. Pharm.,441, 56 (2013). [ Links ]
6. S. Golmohammadzadeh, M. Mokhtari, M.R. Jaafari, Preparation, characterization and evaluation of moisturizing and UV protecting effects of topical solid lipid nanoparticles, Braz. J. Pharm. Sci., 48, 683 (2012). [ Links ]
7. D. Nesseem, Formulation of sunscreens with enhancement sun protection factor response based on solid lipid nanoparticles, Int. J. Cosmet. Sci., 33, 70 (2011). [ Links ]
8. D. Quintanar-Guerrero, D. Tamayo-Esquivel, A. Ganem-Quintanar, E. Allémann, E. Doelker, Adaptation and optimization of the emulsification-diffusion technique to prepare lipidic nanospheres, Eur. J. Pharm. Sci., 26, 211 (2005). [ Links ]
9. R.H. Müller, M. Radtke, S.A. Wissing, Solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC) in cosmetic and dermatological preparations, Adv. Drug Deliv. Rev., 54 Suppl. 1, S131 (2002). [ Links ]
10. G.A. Burdock, Review of the biological properties and toxicity of bee propolis (propolis), Food Chem. Toxicol., 36, 347 (1998). [ Links ]
11. Secretaría de Políticas, Regulación e Institutos (SPReI) y Secretaría de Agricultura, Ganadería y Pesca (SAGPyA), Resolución Conjunta 94/2008 y 357/2008. (SENASA, 2008). URL: http://www.senasa.gov.ar/contenido.php?to=n&in=1197&io=7859, consultado en agosto de 2014. [ Links ]
12. Ministério da Agricultura, Pecuária e Abastecimento (MAPA). Instrução Normativa No 3, de 19 de Janeiro de 2001, Regulamentos técnicos de identidade e qualidade de apitoxina, cera de abelha, geléia real, geléia real liofilizada, pólen apícola, própolis e extrato de própolis, Anexo VI, Anexo VII (Ministério da Agricultura e do Abastecimento. Secretaria de Defesa Agropecuária, Departamento de Inspeção de Produtos de Origem Animal (DIPOA), 2001). URL: http://www.sfdk.com.br/imagens/lei/MA-InstNorm.htm#AnexoVI, consultado en agosto de 2014. [ Links ]
13. CATEF, Nota técnica sobre o registro de produtos contendo própolis, Agência Nacional de Vigilância Sanitária (ANVISA), Câmara Técnica de Medicamentos Fitoterápicos -CATEF, 2005. URL: http://www.anvisa.gov.br/medicamentos/catef/propolis.htm#req, consultado en agosto de 2014. [ Links ]
14. US Pharmacopeia, USP 38-NF 33. The United States Pharmacopeia-The National Formulary, The United States Pharmacopeial Convention, Rockville, MD, 2014, pp. 195-197. [ Links ]
15. E.W. Rice, R.B. Baird, A.D. Eaton, L.S. Clesceri (editores), "Standard Methods Examination of water and wastewater", 22nd ed., American Public Health Association, American Water Works Association, Water Environment Federation, 2012, pp. 40-46. [ Links ]
16. E. Bedascarrasbure, L. Maldonado, W. Fierro Morales, A. Álvarez (editores), "Propóleos: caracterización y normalización de propóleos argentinos. Revisión y actualización de composición y propiedades", INTA, Ediciones Magna, Tucumán, 2006, pp. 137-170. [ Links ]
17. S. Kumazawa, T. Hamasaka, T. Nakayama, Antioxidant activity of propolis of various geographic origins, Food Chem., 84, 329 (2004). [ Links ]
18. V.L. Singleton, J.A. Rossi, Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents, Am. J. Enol. Vitic., 3, 144 (1965). [ Links ]
19. K. Slinkard, V. Singleton, Total phenol analysis: Automation and comparison with manual methods, Am. J. Enol. Vitic., 28, 49 (1977). [ Links ]
20. C.S. Funari, V.O. Ferro, Análise de própolis, Ciênc. Tecnol. Aliment. Campinas,26, 171 (2006). [ Links ]
21. K. Avgoustakis, A. Beletsi, Z. Panagi, P. Klepetsanis, E. Livaniou, G. Evangelatos, D.S. Ithakissios, Effect of copolymer composition on the physicochemical characteristics, in vitro stability, and biodistribution of PLGA-mPEG nanoparticles, Int. J. Pharm., 259, 115 (2003). [ Links ]
22. ECVAM, The neutral red cytotoxicity assay Invittox N. ° 64: Eye irritation, 1992. [ Links ]
23. ECVAM, 3T3 NRU Phototoxicity Assay Invittox No. 78: Phototoxicity, 2002. [ Links ]
24. Belcorp, "In vitro Safety screening to predict ocular irritation of cosmetic formulations", Protocol #3: Neutral red uptake cytotoxicity assay in mammalian cells (fibroblast), 2012. [ Links ]
25. M.C. Marcucci, Propolis: Chemical composition, biological properties and therapeutic activity, Apidologie, 26, 83 (1995). [ Links ]
26. V.S. Bankova, S.L. de Castro, M.C. Marcucci, Propolis: Recent advances in chemistry and plant origin, Apidologie, 31, 3 (2000). [ Links ]
27. A.C. de Groot, Propolis: A review of properties, applications, chemical composition, contact allergy, and other adverse effects, Dermatitis, 24, 263 (2013). [ Links ]
28. B.M. Hausen, E. Wollenweber, H. Senff, B. Post, Propolis allergy (I). Origin, properties, usage and literature review, Contact Dermatitis, 17, 163 (1987). [ Links ]
29. A. dos S. Pereira, B. Bicalho, F.R. de Aquino Neto, Comparison of propolis from Apis mellifera and Tetragonisca angustula, Apidologie, 34, 291 (2003). [ Links ]
30. ANVISA, Agência Nacional de Vigilância Sanitária,"Farmacopéia Brasileira", 2010, pp. 192-193. [ Links ]
31. AOAC International, "Official Methods of AOAC International", Editado por G.W. Latimer, AOAC International, Gaithersburg, 2012, Method 930.15. [ Links ]
32. AOAC International, "Official Methods of AOAC International", Editado por G.W. Latimer, AOAC International, Gaithersburg, 2012, Method 923.03. [ Links ]
33. M. Simone-Finstrom, M. Spivak, Propolis and bee health: The natural history and significance of resin use by honey bees, Apidologie, 41, 295 (2010). [ Links ]
34. L.E. Rodríguez-Rodríguez, W. Góngora-Amores, A. Escalona-Arias, M.B. Miranda-Bazán, S. Batista-Suárez, Y. Bermúdez-Cisnero, Optimización de la extracción alcohólica para la obtención de soluciones concentradas de propóleos, Rev. Colomb. Cienc. Quím. Farm., 44, 47 (2015). [ Links ]
35. L.E. Rodríguez-Rodríguez, W. Góngora-Amores, A. Escalona-Arias, D. Cobos-Valdés, S. Batista-Suárez, C. Loustanau-Cárdenas, A.F. González-González, Resultados del proceso productivo de la solución concentrada de propóleos 2010-2013. Impacto de la innovación tecnológica, Rev. Colomb. Cienc. Quím. Farm., 44, 139 (2015). [ Links ]
36. H. Wagner, S. Bladt, "Plant drug analysis. A Thin Layer Chromatography atlas", Springer, Berlin, Heidelberg, 2001, pp. 151-152, 196-197, 364. [ Links ]
37. Ö.G. Çelemli, Chemical properties of propolis collected by stingless bees. En: "Pot-Honey: A legacy of stingless bees", Editado por P. Vit, S.R.M. Pedro, D.W. Roubik, Springer, New York (NY), 2013, pp. 525-537. [ Links ]
38. É.W. Teixeira, D. Message, G. Negri, A. Salatino, P.C. Stringheta, Seasonal variation, chemical composition and antioxidant activity of Brazilian propolis samples, Evid.-Based Complement. Alternat. Med., 7, 307 (2010). [ Links ]
39. V.Y. Birshtein, V.M. Tul'chinskii, Determination of beeswax and some impurities by IR spectroscopy, Chem. Nat. Compd., 13, 232 (1977). [ Links ]
40. M. Musoke, P.F. Luckham, Interaction forces between polyethylene oxide-polypropylene oxide ABA copolymers adsorbed to hydrophobic surfaces, J. Colloid Interface Sci., 277, 62 (2004). [ Links ]
41. K.M. Rosenblatt, H. Bunjes, Poly(vinyl alcohol) as emulsifier stabilizes solid triglyceride drug carrier nanoparticles in the alfa-modification, Mol. Pharm., 6, 105 (2009). [ Links ]
42. S. Doktorovova, E.B. Souto, A.M. Silva, Nanotoxicology applied to solid lipid nanoparticles and nanostructured lipid carriers -A systematic review of in vitro data, Eur. J. Pharm. Biopharm., 87, 1 (2014). [ Links ]
43. G. Repetto, A. del Peso, J.L. Zurita, Neutral red uptake assay for the estimation of cell viability/cytotoxicity, Nat. Protoc., 3, 1125 (2008). [ Links ]
44. C.F. Carson, K.A. Hammer, T.V. Riley, Melaleuca alternifolia (Tea Tree) oil: A review of antimicrobial and other medicinal properties, Clin. Microbiol. Rev., 19, 50 (2006). [ Links ]