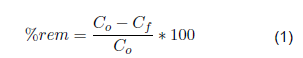Introducción
Los antibióticos son productos de uso generalizado tanto en humanos como en animales. No se absorben completamente por el organismo, por lo que son liberados al ambiente a través de las excretas. De este modo, en el agua residual se pueden detectar diversos antibióticos como la amoxicilina, penicilina, cefalexina, cefixima, entre otros [1]. Un estudio realizado por Jiménez Bambague et al. [1], en las aguas residuales de Cali revela la presencia de contaminantes emergentes y una amplia variedad de productos farmacéuticos en el agua. Además, se destaca que las plantas de tratamiento con sistemas convencionales no logran eliminar eficazmente estas sustancias. La presencia de antibióticos en el agua representa un riesgo significativo para la seguridad humana. Las pequeñas dosis de medicamentos pueden generar resistencia microbiana a los fármacos, lo que implica la posible aparición de cepas resistentes con graves consecuencias para la salud humana, ya que los medicamentos no podrían combatir eficazmente las enfermedades infecciosas [2,3]. Dado que los sistemas comúnmente utilizados no eliminan eficientemente estos contaminantes, se ha vuelto imperativo explorar nuevas técnicas que permitan degradar los antibióticos presentes en el agua. Entre los antibióticos frecuentemente identificados en aguas residuales, se destaca la cefalexina (CFX), un antibiótico de uso extendido para tratar diversas infecciones debido a su potente efecto antimicrobiano y alta solubilidad en soluciones acuosas [3]. La CFX, perteneciente a la familia de las cefalosporinas, se utiliza para abordar infecciones bacterianas en humanos y animales, mostrando eficacia en el tratamiento de diversas afecciones del tracto respiratorio, tracto urinario, piel y tejidos blandos [4]. No obstante, este antibiótico ocasiona la destrucción de microorganismos benéficos en los sistemas de tratamiento de aguas residuales y puede inducir resistencia en agentes microbianos patógenos [3]. Estudios científicos que han explorado los efectos adversos de la CFX en el medio ambiente indican que este compuesto puede dar lugar a ecotoxicidad, resistencia bacteriana, alteración del equilibrio microbiológico y acumulación en sedimentos y tejidos biológicos [5]. Estos hallazgos resaltan la importancia de investigar métodos o técnicas destinadas a eliminar este compuesto del agua, dada su significativa repercusión ambiental.
En la tarea de encontrar alternativas que degraden antibióticos, se han explorado diversas técnicas de tratamiento terciario, como la electrodiálisis [6], la osmosis inversa [7], la adsorción [8], la electrocoagulación [9], y variedad de combinaciones de procesos de oxidación avanzada (POA) [10]. Los POA se fundamenta en la generación de radicales OH* para lograr la disminución de concentración de contaminantes recalcitrantes. Entre los sistemas de oxidación avanzada, se destacan la fotólisis UV [11], ozonización [12], oxidación con H2O2 [13], así como combinaciones de estas técnicas y procesos fotocatalíticos, entre otras técnicas. Variedad de estudios se han enfocado en la fotocatálisis, destacando el trabajo de He et al. [14] quienes emplearon nanopartículas de ZnO y lograron resultados destacados en la degradación. Estos resultados se atribuyen en parte a la influencia del pH del agua, ajustado para favorecer la producción y la vida de los radicales OH*. Bansal y Verma [3] exploraron la fotocatálisis con foto-Fenton en reactores en cascada a una escala de 5 L, logrando una mineralización superior al 63 %. Resaltan la ventaja del uso de estos catalizadores debido a su capacidad de reutilización, que puede superar los 70 ciclos de uso. Finalmente, cabe mencionar el estudio de Almasi et al. [15], quienes llevaron a cabo pruebas separadas de fotocatálisis y foto-Fenton con 1 L de agua y 100 mg/L de CFX. Obtuvieron degradaciones del 100 % y una mineralización superior al 85 % para cada proceso. Dado el éxito previo de la fotocatálisis, este estudio se desarrolló para observar la respuesta del sistema ante fuentes comerciales de LED UV (390 nm) de uso doméstico y determinar la capacidad de degradación de la molécula de CFX.
Materiales y métodos
Para la preparación de las soluciones acuosas, se utilizó agua ultrapura en la que se disolvieron 15 mg/L de CFX con un 99 % de pureza, suministrada por una empresa farmacéutica local, sin ningún otro tratamiento o manipulación. El ajuste del pH inicial de cada solución se realizó con NaOH 0,1 N y HCl 0,1 N de la marca Titripur de Merck; el catalizador utilizado fue TiO2 (anatasa) con una dosis constante de 100 mg/L para todos los experimentos [16]. Como fuente de radiación se emplearon cintas de lámparas UV-LED comerciales con certificación IP-68, emitiendo luz con una radiación de onda de 395 nm y una potencia de 5 W por lámpara. Se hizo uso de un diseño experimental central compuesto con dos factores en dos niveles para cada factor y cinco réplicas del punto central, para un total de 13 experimentos. Las variables analizadas fueron el pH inicial de la solución y el número de lámparas UV-LED, mientras que las variables de respuesta incluyeron el porcentaje de disminución de la concentración de CFX y el porcentaje de disminución de la concentración de carbono orgánico total (COT). El proceso fotocatalítico tuvo una duración de 90 min por experimento. Todos los ensayos se llevaron a cabo a temperatura ambiente, oscilando entre 18 °C y 20 °C. Se realizaron en un recipiente de acrílico de 4L de capacidad (0,1 m de ancho, 0,2 m de largo y 0,2 m de alto). Las lámparas UV-LED se colocaron en un costado dentro del recipiente para irradiar las soluciones acuosas. Para mantener homogéneo el sistema durante el periodo de reacción, las soluciones fueron agitadas con una plancha de agitación magnética ajustada a 250 rpm. El reactor se aisló en un lugar oscuro para eliminar la interferencia de la luz solar en el proceso.
Tras concluir cada ensayo, se tomó una muestra de 100 mL, que se centrifugó a 500 rpm durante 5 min y luego se filtró. Posteriormente, se realizaron análisis de pH, conductividad, concentración de CFX y COT. Los análisis de pH y conductividad se llevaron a cabo según los procedimientos establecidos en los métodos estándar para el análisis de agua potable y residual [17]. El análisis de CFX se realizó por espectrofotometría a 258 nm, y la determinación de COT se llevó a cabo en un TOC-L de SHIMADZU, un analizador de carbono orgánico total.
El porcentaje de disminución de concentración o remoción de cada variable de respuesta fue calculado con la ecuación (1).
Donde C0 y C f son la concentración inicial y Anal respectivamente de CFX y COT. A través del análisis de varianza de los resultados obtenidos, se determinó estadísticamente si los factores analizados influyeron en las variables de respuesta seleccionadas. Utilizando la metodología de superficie de respuesta (SDR), se identificaron las condiciones que permiten alcanzar los mayores valores para cada una de las variables de respuesta, es decir, las mayores remociones de CFX y COT. Finalmente, una vez establecidas las condiciones experimentales más favorables para la remoción de CFX, se llevaron a cabo ensayos bajo estas condiciones, tanto en ausencia de radiación UV-LED como con y sin catalizador, con el objetivo de determinar el aporte a la remoción de contaminantes por fotólisis directa y adsorción sobre la superficie del catalizador.
Resultados y discusión
En la Tabla 1 se presentan los resultados del porcentaje de disminución en la concentración (remoción) de CFX alcanzados en los ensayos realizados para los distintos niveles de pH y número de lámparas.
Tabla 1 Resultados experimentales de los ensayos realizados.
| pH inicial de la solución | Número de lámparas | % de remoción de CFX |
|---|---|---|
| 7,00 | 22 | 6,11 |
| 8,00 | 20 | 1,07 |
| 6,00 | 20 | 3,18 |
| 7,00 | 15 | 9,50 |
| 7,00 | 15 | 9,67 |
| 7,00 | 15 | 9,60 |
| 7,00 | 15 | 9,35 |
| 7,00 | 15 | 9,55 |
| 5,58 | 15 | 0,35 |
| 8,41 | 15 | 22,19 |
| 6,00 | 10 | 0,57 |
| 8,00 | 10 | 33,42 |
| 7,00 | 8 | 8,52 |
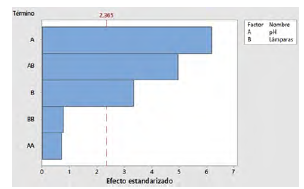
Se empleó el análisis de Pareto (Figura 1) a fin de determinar la influencia de las variables en el proceso estudiado.
El análisis del diagrama de Pareto revela que el pH constituye la variable con mayor impacto en la reducción de la concentración de CFX, seguido de la interacción entre el pH y el número de lámparas. La distribución de estas últimas en el sistema de fotocatálisis UV se posiciona como un factor crucial en el proceso de eliminación de cefalexina. en la concentración de COT, ya que estos fueron nulos en todos los ensayos realizados. Por consiguiente, se concluye que el proceso analizado logra transformar la molécula de CFX, aunque no alcanza una mineralización completa, corroborando resultados previos de estudios realizados por Bansal et al. [3]. El análisis de varianza (presentado en la Tabla 2) indica que las variables y factores de proceso seleccionados ejercen una influencia directa sobre la variable de respuesta, incluyendo la interacción entre ellas. En resumen, cualquier modificación en los valores iniciales de pH y en el número de lámparas impacta la disminución de la concentración de CFX.
Tabla 2 Análisis de varianza para los resultados experimentales.
| Fuente | Suma de cuadrados | Grados de libertad | Cuadrados medios | Valor f | Prob > F |
|---|---|---|---|---|---|
| Modelo | 917,628 | 3 | 305,876 | 26,844 | < 0,0001 |
| A (pH) | 474,727 | 1 | 474,727 | 41,662 | 0,0001 |
| B (número de lámparas) | 137,351 | 1 | 137,351 | 12,054 | 0,0070 |
| AB (pH*número de lámparas) | 305,550 | 1 | 305,550 | 26,815 | 0,0006 |
| Residuo | 102,552 | 9 | 11,395 | ||
| Falta de ajuste | 102,494 | 5 | 20,499 | 1410,787 | < 0,0001 |
| Error puro | 0,058 | 4 | 0,015 | ||
| Total | 1020,180 | 12 |
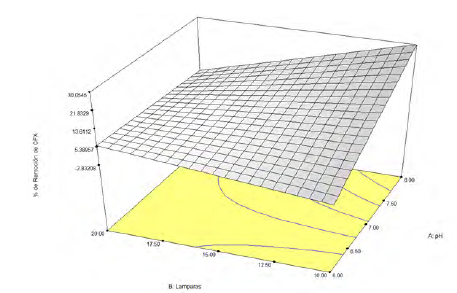
La Figura 2 muestra la superficie de respuesta derivada de los resultados experimentales. En ella, se identifican las condiciones experimentales que favorecen el proceso de degradación de CFX. Las condiciones que condujeron a la mayor remoción de CFX fueron un pH de 8 con 10 lámparas LED UV, resultados que son comparables con los hallazgos de Bansal et al. [3].
Influencia del pH
Es prudente señalar que el pH del medio de reacción juega un papel crucial en la remoción de CFX por fotocatálisis UV. Hay estudios que han demostrado que el pH del sistema de tratamiento influye en la velocidad de degradación de la CFX, debido a los cambios en la carga superficial del catalizador y los contaminantes, así como a la concentración de especies reactivas de oxígeno [18]. Para mayor comprensión del fenómeno, cuando el pH del medio es menor que el pHpzc de la superficie del material (pH< pHpzc), esta se encuentra cargada positivamente, y cuando (pH>pHpzc) la superficie del material se encuentra cargada negativamente [4]. Para el Degussa P25 el pHpzc es de 6, 6,3 y 6,5. Mientras que la CFX contiene un grupo amino (pKa=2,56) y un grupo carboxilo (pKa=6,88) estos grupos se encuentran en forma aniónica a pH cercano a 6 y en forma catiónica a pH<2.56, para pH entre 2,56 y 6,88 la CFX se encuentra en forma molecular o libre de carga [5]. En aquellos casos en los cuales el pH de la solución es mayor que el punto de carga cero del catalizador (pHpzc), la fuerza de repulsión entre la forma aniónica de la cefalexina y la superficie del catalizador cargada negativamente puede limitar la degradación fotocatalítica. En el presente estudio los resultados son distintos, lo cual sugiere que la interacción electrostática tiene poco efecto sobre la efectividad del proceso analizado. El estudio realizado por El Mragui et al. [19] señala que el pH de la solución puede afectar la generación de radicales. Se indica que, a pH alcalinos, los radicales OH* son los principales agentes oxidantes en la solución y su producción se ve intensificada toda vez que a pH alcalino se incrementa la concentración de aniones OH, es decir, el incremento de la producción de radicales OH* a pH alcalino, contribuye a incrementar la degradación de la CFX [14]. El uso de un pH alcalino fue el más eficiente para la remoción de la CFX debido a que puede mejorar la eficiencia y la actividad fotocatalítica del TiO2 [20], hecho que puede aumentar la generación de radicales hidroxilos (OH*), que son altamente reactivos y responsables de la degradación de contaminantes [21] toda vez que mejora la capacidad de adsorción y la interacción del TiO2 [22]. Lo anterior justifica los altos valores de remoción a pH alcalino y por otro lado el uso de un pH ácido en la fotocatálisis UV puede tener efectos negativos en la eficiencia y estabilidad del proceso [23]. Para pH ácido puede presentarse la disminución en la actividad fotocatalítica, puesto que puede inhibir la generación de especies activas de oxígeno y restringir la disponibilidad de electrones y huecos necesarios para las reacciones de oxidación y reducción [24].
Influencia de la radiación UV
Se utilizó TiO2 Degussa P25, con una proporción de 80:20 en masa de anatasa a rutilo, y es el más empleado debido a que ha demostrado excelente desempeño en aplicaciones fotocatalíticas gracias a su apreciable área superficial específica (50 m2/g) con tamaño de partícula que oscila en el rango entre 20 nm y 30 nm [25]. Cuando el TiO2 es excitado con luz UV (λ < 380 nm para anatasa forma más común del catalizador, y λ < 400 nm para rutilo) un electrón es promovido de la banda vB a la banda cB del TiO2 generando un hoyo (h+) en la banda vB y un electrón (e-) en la banca cB [25]. En resumidas cuentas, la radiación UV promueve la generación de radicales OH* en el medio. Se logra apreciar una disminución del porcentaje de degradación para los mayores números de lámparas, la cual se atribuye a un posible exceso de radicales generados dadas las condiciones favorables para su formación mencionadas previamente, debido a que los radicales OH* tienen la capacidad de recombinarse, ocasionando una pérdida de los mismos y con esto la degradación de CFX por la pérdida del agente oxidante. La transformación de CFX por fotocatálisis UV ocurren en varias etapas químicas, en primer lugar, las especies reactivas generadas (radicales hidroxilos) en la superficie del catalizador por efecto de la irradiación UV reaccionan con la CFX, posteriormente los radicales oxidan los grupos funcionales tales como amino y carboxilo, estas reacciones pueden romper enlaces químicos y formar productos degradados y menos tóxicos. Además, los huecos de electrones generados en la superficie del fotocatalizador pueden reaccionar con la CFX, produciendo radicales y especies oxidantes que también contribuyen a la degradación del compuesto [26].
Adsorción del TiO2
Una vez realizados los ensayos correspondientes al diseño experimental y determinadas las condiciones de pH y número de lámparas para las cuales se alcanzó la mayor disminución de concentración de CFX, se llevaron a cabo ensayos solamente con TiO2 sin radiación LED-UV con su respectivo ajuste de pH; además se realizaron ensayos solamente con lámparas LED UV en ausencia de catalizador.
Los resultados de estos ensayos presentaron remociones poco significativas, menores del 1 %, de manera que no ocurre adsorción del contaminante sobre la superficie del catalizador y tampoco fotólisis directa por efecto de las lámparas. El catalizador solo actúa como agente de transferencia de electrones.
Recomendaciones
La cantidad y disposición de las lámparas deben ser meticulosamente optimizadas para asegurar una exposición uniforme del catalizador a la radiación UV y maximizar la eficiencia del proceso. La utilización de múltiples lámparas con una distribución adecuada en el reactor puede potenciar la eficacia de la fotocatálisis UV y disminuir los gradientes de radiación, reduciendo así la formación de zonas muertas donde la radiación resulta insuficiente y la actividad fotocatalítica es baja.
Conclusiones
El uso de lámparas UV-LED comerciales con certificación IP-68 permitió lograr una disminución del 33,42 % en la concentración de cefalexina en 1,5 h, con un pH de 8,01, una dosis de catalizador de 0,1 g/L y utilizando 10 bombillas LED-UV, las cuales tienen un consumo de 2 W.
Los ensayos de fotólisis directa sin catalizador no arrojaron porcentajes significativos de degradación. Además, los ensayos exclusivamente con catalizador indican que la cefalexina no se adsorbe en la superficie del catalizador. Por lo tanto, la eficacia del proceso se debe únicamente al efecto catalítico del TiO2 activado por la radiación UV.
A lo largo de los experimentos, no se observó una reducción en el consumo de carbono orgánico total, indicando que el proceso no logró mineralizar la cefalexina.
Cuando el pH inicial de la solución acuosa es ácido, el número de lámparas no incide significativamente en la degradación de la cefalexina. Por otro lado, el efecto del número de lámparas es relevante en un entorno alcalino, donde se observa que la reducción del número de lámparas conlleva a un aumento en la remoción de CFX. Este fenómeno podría explicarse por la posible abundancia y recombinación de radicales, lo que impide contar con ellos para la degradación del contaminante objeto de estudio.